È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una nuovo portatile In Vitro l'esposizione Cassette per il campionamento di Aerosol
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per eseguire le esposizioni portatile cellulare aerosol e misurare la risposta cellulare. Il metodo utilizza cellule, coltivate all'interfaccia aria-liquido, che imita in vivo fisiologia. Risposta cellulare agli aerosol di rame delle nanoparticelle è stato osservato come lo stress ossidativo attraverso la generazione di specie reattive dell'ossigeno e citotossicità come rilascio del lattato deidrogenasi.
Abstract
Questo protocollo introduce un nuovo in vitro l'esposizione sistema, capace di essere indossati, compresa la caratterizzazione e la performance. Sistemi di esposizione in vitro interfaccia aria-liquido (ALI) sono spesso grandi e ingombranti, rendendo il trasporto al campo e funzionamento alla sorgente di emissione o all'interno della zona di respirazione difficile. Attraverso la miniaturizzazione di questi sistemi, il laboratorio può essere portato al campo, accelerando il tempo di elaborazione e che forniscono un metodo più appropriato di esposizione che non altera l'aerosol prima di contattare le cellule. Il portatile In vitro l'esposizione Cassette (PIVEC) si adatta una cassetta filtro 37mm per consentire per la tossicità in vitro test di fuori di un ambiente di laboratorio tradizionale. Il PIVEC è stato caratterizzato utilizzando tre dimensioni delle nanoparticelle rame per determinare l'efficienza di deposizione basata su gravimetrico e numero analisi della concentrazione delle particelle. Citotossicità iniziali esperimenti sono stati eseguiti con cellule del polmone esposte per determinare la capacità del sistema di depositare particelle mantenendo attuabilità delle cellule. Il PIVEC fornisce un'efficienza di deposizione simile o maggiore quando si confrontano dispositivi di flusso perpendicolare disponibile in vitro l'esposizione. Nonostante il basso rendimento del campione, le piccole dimensioni dà alcuni vantaggi per la corrente in vitro ALI sistemi di esposizione. Questi includono la capacità di essere indossati per il monitoraggio personale, mobilità dal laboratorio per la fonte di emissione e la possibilità di set-up più sistemi per risoluzione spaziale mantenendo un utente più basso costano. Il PIVEC è un sistema in grado di raccogliere aerosol nel campo e all'interno della zona di respirazione su un modello di aria-interfacciato, in vitro .
Introduzione
Campionamento personale utilizzando tecniche in vitro potrebbe fornire informazioni complete per quanto riguarda gli effetti biologici degli aerosol sul posto di lavoro. 1 esposizioni agli agenti inquinanti nell'aria comprendono esposizioni alla sostanza chimica stessa, per i campioni di aria raccolti, sommerso in condizioni dove il gas viene introdotto alla sospensione di cellule, le esposizioni intermittenti usando un dispositivo come un rocker, o diretto esposizioni all'interfaccia aria-liquido (ALI). 2 molte di queste tecniche vengono eseguite con le cellule che crescono in sospensione o il prelievo di campioni prima dell'esposizione, ognuno dei quali può influenzare lo studio tossicologico a causa di potenziali cambiamenti l'aerosol. 3 per evitare questi cambiamenti, il laboratorio può essere portato al campo utilizzando diversi in vitro sistemi di esposizione di cultura ALI che sono utilizzati nella letteratura,4,5,6,7, 8,9,10,11,12,13 tuttavia, pochi sono disponibili in commercio. 8 , 9 , 12 questi sistemi sono spesso ingombranti, soprattutto quando compresi gli strumenti per regolare la temperatura e l'umidità dell'ambiente cellulare e la portata dell'aerosol del campione. Utilizzando il PIVEC, esposizioni di aerosol possono essere eseguite di fuori di un ambiente di laboratorio tradizionale o all'interno della zona di respirazione mentre che imita condizioni di inalazione.
La determinazione di aerosol deposizione in vitro è importante per l'indagine degli effetti sulla salute a causa di inalazione. La zona di respirazione, l'area all'interno di 30 cm dalla bocca e dal naso,14 è fondamentale per comprendere l'esposizione alle nanoparticelle e collegamento agli effetti biologici nei polmoni. 2 spesso, la deposizione sulle cellule è definita come un efficienza di deposizione, le particelle depositate sul e preso dalle cellule divise per le particelle somministrate al sistema6,15 o su una base di massa degli importi stessi. 4 , 16 i metodi correnti per aerosol nella zona di respirazione di misurazione sono filtro basato, catturando particelle su un periodo di campionamento specificato e utilizzando i filtri di condurre ulteriori test. 17 monitoraggio personale richiede un piccolo sistema che viene fornito con il compromesso di meno campioni.
Ci sono molti approcci per determinare gli effetti sulla salute da esposizione ad un aerosol. Il modello di ALI consente per l'aerosol deve essere somministrato direttamente alle cellule attraverso l'aria come in uno scenario di esposizione reale, ma è più conveniente e meno tempo intensivo che in vivo studi mentre che imita le barriere di aria-liquido ad esempio gli occhi, pelle e polmoni. Le cellule del polmone cresciute presso le ALI hanno la capacità di generare un strato di sbarramento polarizzato,18,19 che produce tratti fisiologici che assomigliano in vivo epitelio polmonare, compresa la produzione di muco e di agente tensioattivo in specifici linee cellulari bronchiali o alveolare, ciglia battendo,19 giunzioni strette, polarizzazione delle cellule e20 19,. 18 cambiamenti come questi possono influenzare la risposta cellulare misurata negli studi di tossicità. 21 inoltre, ALI in vitro modello risultati sono spesso più sensibile di cellule esposti via sospensione modelli22 e sono in grado di tossicità da inalazione acuta in vivo modello. 23 , 24 di conseguenza, un sistema di esposizione di ALI che è in grado di eseguire misure all'interno della zona di respirazione è un passaggio naturale.
Esponendo le cellule ad aerosol direttamente alla sorgente di emissione, indagine degli effetti di tutti i gas, composti semi-volatili e particelle coinvolte nella miscela si verifica. Quando la miscela viene raccolto su un filtro, i gas e composti volatili non vengono acquisiti e la miscela intera non può essere studiata. Inoltre, la ricostituzione delle particelle in una polvere o una sospensione liquida può portare all'aggregazione o interazioni particella-fluido, come dissoluzione, in sospensione liquida. 25 , 26 quando le particelle dell'aerosol sono aggiunto al liquido, c'è un maggiore potenziale per agglomerazione,25,27 formazione di una corona di proteina,28 o interazione con i composti nel liquido, che può influenzare la deposizione e influenzare la risposta biologica. 29 , 30
Esposizione presso le ALI si basa su tre principali aerosol profili, nube sedimentazione, parallelo flusso e flusso perpendicolare. Cloud di sedimentazione, utilizzato da aria-liquido Interfaccia cella esposizione (ALICE),4 è un sistema batch dove depositare i particelle attraverso gravitazionale e diffusionale stabilirsi come l'aerosol viene trattato come una singola unità. Flusso parallelo, utilizzato dagli Aerosol elettrostatica in vitro Exposure System (gronda)5 e multicultura esposizione camera (MEC) II,6 consente di deposizione mediante l'aggiunta del moto browniano attraverso il profilo di flusso. Flusso perpendicolare, utilizzato da un microsprayer,7 camera del nebulizzatore Nano per tossicità In Vitro (NACIVT),11 e commerciale ALI sistemi8,9,10,12, aggiunge il compressione di particelle all'interno della regione di deposizione. Molti di questi sistemi di esposizione sono grandi e ingombranti, che richiedono sistemi in eccesso per aerosol pre-condizionamento, pompe per il flusso, o persino il riscaldamento alloggiamenti per l'incubazione delle cellule. Questa grande dimensione diminuisce la portabilità del sistema. Invece di campionamento direttamente alla sorgente di emissione, questi sistemi hanno spesso portati agli aerosol lab o modello generato per analisi di campioni. La complessità dell'aerosol emesso può essere perso nella traduzione dal campo al laboratorio. Il PIVEC è più piccolo rispetto ai sistemi attuali, con una superficie esterna di circa 460 cm2 e pesa solo 60 grammi, con controllo termico e umidità incorporato nel sistema consentendo un dispositivo altamente portatile. La dimensione ridotta e il peso consentono al sistema di essere indossati o adottate per la fonte di esposizione, permettendo il campionamento diretto.
Le grandi dimensioni degli attuali sistemi di esposizione diminuisce anche la capacità di eseguire il campionamento per studiare gradienti spaziale delle concentrazioni. Questa risoluzione è chiave effetti tossicologici di molte potenzialità ambientali e rischi professionali come scarico veicolare particolato materia o sul posto di lavoro attività per determinare dove si verifica la nebulizzazione. Immediatamente post-emissione, là si trasforma in una variazione spaziale nella concentrazione di particelle. Questo cresce con il tempo come le particelle disperdono in tutta l'atmosfera e questi effetti possono modificare sulla base delle condizioni ambientali, quali temperatura, pressione, vento e sole. Le particelle possono cominciare a età e ossidare pure una volta emesso31,32 e tassi di dispersione sono influenzati dalla topografia; concentrazioni più elevate si trovano nel Canyon e tunnel, dove gli effetti di dispersione sono rallentati, e concentrazioni più basse possono essere trovate dove c'è una grande area per dispersione. 33 questi cambiamenti nei tassi di dispersione possono avere effetti significativi sulla salute umana e possono essere visto quando confronta il numero di asmatici adulti che vivono in urbano contro in ambienti rurali. 34 mentre molti sistemi di esposizione forniscono campioni multipli in una sola volta, sistemi multipli sono necessari con un'abbondanza di grandi apparecchiature per eseguire la risoluzione spaziale.
Portando il laboratorio al campo, al momento dell'analisi può essere ridotta utilizzando l'intera cellula come un sensore. Seguendo gli endpoint e i meccanismi biologici noti può aiutare nella determinazione della composizione di aerosol e dimensione. A causa dei metodi di liquidazione lento, tra cui la clearance mucociliare, fagocitosi e traslocazione, queste particelle sono spesso interagendo con le cellule per circa giorni a settimane3 generazione di stress ossidativo, infiammazione e anche la morte delle cellule. Questi endpoint biologici possono essere i punti di partenza per le vie di risultato avverso per malattia cardiovascolare o malattia polmonare ostruttiva cronica. Inoltre, Wiemenn et al. eseguite una serie di saggi in vitro da confrontare con i valori della letteratura per la tossicità a breve termine in vivo per via inalatoria. 35 Risposta in vivo è stato previsto con due dei quattro risultati positivi dai test di citotossicità tramite rilascio di lattato deidrogenasi, stress ossidativo dalla formazione di perossido di idrogeno e riduzione di glutatione e rilascio e infiammazione potenziale da gene dell'alfa di fattore di necrosi tumorale. Fuori dieci ossidi metallici di dimensioni nanometriche testati, sei testato come attivo (ossido di titanio, ossido di zinco e ossido di cerio diversi quattro) con esposizioni in vitro con conferma in vivo.
Al fine di studiare gli effetti degli aerosol in un ambiente professionale, il nostro laboratorio ha sviluppato il PIVEC per le esposizioni nel campo. Inoltre, il PIVEC può essere indossato per campionamento personale monitorare e studiare l'esposizione di inalazione come il 37 mm filtro cassetta36 o più sistemi possono essere utilizzati per ottenere una risoluzione spaziale all'interno di una determinata area. In questo protocollo, la caratterizzazione e l'uso del PIVEC è discusso. Dopo l'esposizione, gli effetti biologici sono osservati mediante saggi di citotossicità.
Protocollo
Gli operatori devono indossare dispositivi di protezione individuale (camice, guanti, occhiali) quando eseguire passaggi 1, 2, 3, 5 e 6.
1. preparazione dei materiali
-
Preparare i materiali per l'assemblaggio del sistema e l'esposizione assicurare la ripetibilità.
- Assicurati di uso nuovo o etanolo al 70% pulito ¼" diametro interno conduttivo della tubazione e ¼" diametro esterno connettori per l'assembly di sistema.
- Archivio test materiali inclusi filtri, componenti PIVEC, pinzette e polveri delle particelle in un ambiente ben controllato, per quanto riguarda la temperatura e l'umidità, per almeno 24 h prima dell'esperimento.
Nota: La temperatura deve essere a temperatura ambiente, circa 20 ° C, con umidità relativa inferiore al 35%. Questo è molto importante per raggiungere ripetibilità tra esperimenti. - Preparare i contatori di particelle utilizzando isopropanolo per pulire parti e consentire il riscaldamento del sistema secondo le raccomandazioni del produttore, tra cui la scansione mobilità particella sizer (SMPS) e la sizer ottici di particelle (OPS) per la misurazione.
2. generazione di Aerosol secco
Nota: Gli operatori dovrebbero eseguire la generazione di aerosol in una cappa aspirante.
-
Assemblare un sistema per generare aerosol secco
Nota: La sospensione di particelle di gas o liquido deve essere appropriata per la cultura delle cellule e applicazione modellata. Il metodo seguente può essere eseguito utilizzando un aerosol a base liquida. Il design del sistema aerosol secco è da Tiwari et al. 37 un disegno schematico del sistema asciutto dispersione è illustrato nella Figura 1.- Collegare la valvola a sfera a ciascuna estremità del tubo di dimensioni filettati 4" 1/8, questo servirà come la tramoggia della particella. Collegare 2" 1/8 dimensioni tubo una valvola.
- Pesare le nanoparticelle di rame, in questo studio la concentrazione di massa per ogni dimensione delle particelle è stata mantenuta costante durante la determinazione dell'efficienza di deposizione. Utilizzare circa 7,5 mg di 40 nm rame nanoparticelle, 7 mg di 100 nm rame nanoparticelle e 13 mg di 800 nm rame nanoparticelle per l'esposizione. Posizionare le nanoparticelle di rame nella tramoggia della particella attraverso l'estremità aperta.
Nota: La quantità di nanoparticelle rame pesate servirà come base la massa amministrata concentrazione. - Posizionare un 3" pezzo di tubo di diametro esterno (OD) del ½" intorno al tubo da 2" e posto un HEPA filtro all'interno di questo tubo breve tale che la direzione del flusso attraverso la valvola a sfera.
- Collegare il generatore di vuoto ad altre valvola a sfera con filettatura. Collegare generatore di vuoto ad aria serbatoio inserendo una tubazione OD 5/16" nella connessione push-to-lock. Utilizzare tubazione OD di ¼" per collegare l'uscita del generatore di vuoto con il set-up sperimentale mettendo il tubo sopra l'uscita del generatore di vuoto.
-
Uso del sistema di secchi di aerosol per generare aerosol secco
- Aprire il serbatoio dell'aria ruotando la valvola principale e consentire il flusso d'aria del sistema. Aprire la valvola del regolatore di flusso sul serbatoio dell'aria e impostato in modo che il flusso attraverso il sistema è equivalente alle impostazioni desiderate sulla pompa del vuoto.
- Aprire la valvola a sfera più vicina al filtro HEPA quindi la valvola a sfera più vicina al generatore di vuoto. Questi tenere aperto per circa 3 s per consentire le particelle essere tirato nel flusso d'aria.
- Chiudere la valvola a sfera più vicina al generatore di vuoto quindi chiudere la valvola a sfera più vicina al filtro HEPA. Consentire l'aria dal serbatoio a scorrere per tutta la durata dell'esperimento come necessario.
- Chiudere le valvole principali e regolatore sul serbatoio di aria per fermare il flusso. Valvole a sfera pulite e generatore di vuoto con etanolo al 70%. Tubi metallici di autoclave per la sterilizzazione.
3. deposizione efficienza misura utilizzando PIVEC
Nota: Gli operatori devono eseguire le esposizioni dell'aerosol in una cappa aspirante.
- Misurare la deposizione raccogliendo il rame nanoparticella aerosol generato nel passaggio 2.2 su un filtro pre-pesato. Utilizzare la dose depositata, misurata utilizzando la massa raccolta sul filtro e la dose somministrata, misurata con la quantità di particelle di rame pesate, per determinare l'efficienza di deposizione.
- Tenere 1,00 µm filtri di fibra di vetro di poro in condizioni di bassa umidità, descritto al punto 1.1.2, per almeno 24 h prima del pre-esposizione misure. Pesare un filtro inutilizzato tre volte e registrare i pesi dei filtri. Inserire il filtro inutilizzato in una coltura cellulare inserire.
- Selezionare cella appropriata cultura inserto adattatore (ben 6 o 24 bene) per PIVEC supportare l'inserto di cultura delle cellule con il filtro. Luogo la coltura cellulare inserire pezzo adattatore sulla parte superiore della base di PIVEC, l'impostazione in posizione tale che la base del pezzo adattatore è più larga della parte superiore.
- Uso delle pinzette per posizionare il filtro caricato coltura cellulare inserire all'interno del raccordo. Posizionare il pezzo superiore sopra pezzo adattatore, stabilendosi in posizione tale che la base della parte superiore è più larga della parte superiore. Avvolgere PIVEC con un singolo strato di nastro adesivo.
- Collegare pezzi cassetta 37 mm sulla parte superiore e inferiore della PIVEC spingendo in luogo. Inserire schede di ¼" spinato cassetta ingresso ed uscita.
- Avvolgere il riscaldatore resistivo intorno PIVEC tale che i fili sono alla base. Nastro per garantire la.
- Avvolgere PIVEC con ~ 8 giri di carta stagnola per isolamento. Fissarla con nastro adesivo.
- Collegare 2" lungo pezzo di 1/2" diametro esterno tubo flessibile alla scheda in cima PIVEC. Rimuovere tubo poroso da acqua sterile e posto all'interno della tubazione in cima PIVEC.
- PIVEC posto all'interno del morsetto sul cavalletto anello e sicuro. Completo set-up con la pompa del vuoto, contatori di particelle e set-up dell'aerosol.
Nota: La dose depositata basati su numero può essere determinata solo se i contatori di particelle vengono inseriti prima del PIVEC e dopo il PIVEC su cicli separati. - Esporre i filtri utilizzando passo 2.2 del protocollo e tempo e flusso tassi di esposizione desiderata, in questo studio che è stato utilizzato un tempo di esposizione di 10 min a 0,5 l/min. Rimuovere PIVEC dal set-up. Prendere l'inserto di cultura cellulare e inserire il filtro esposto nel portafiltro in condizioni di bassa umidità per almeno 24 h prima della misurazione.
- PIVEC pulito con etanolo al 70%. Sterilizzare con luce ultravioletta per almeno 30 min prima dell'esperimento successivo.
- Pesare il filtro esposto tre volte e registrare i pesi dei filtri. Inserire il filtro esposto in un portafiltro con etichetta per deposito.
4. calcolo della Dose depositato ed efficienza di deposizione
Nota: La conoscenza della deposizione è importante per l'amministrazione dell'aerosol e interpretazione della risposta cellulare.
-
Calcolare la deposizione da misure basate su massa
- Calcolare la massa depositata sui filtri come la differenza tra il peso medio pre-esposizione e peso medio post-esposizione. Questo valore è la dose depositata basato sulla massa per l'esperimento.
- Uso amministrato massa, madmin, e basato sulla massa depositata dose determinata in 4.1.1, mdep, per calcolare l'efficienza di deposizione basato sulla massa, ηm, per l'esperimento.
- Valori medi da 4.1.1 e 4.1.2 per almeno 3 esperimenti determinare la deposizione e l'efficienza di deposizione per PIVEC per dimensione delle particelle.
-
Calcolare la deposizione da misure basate su numero
- Garantire che le misure con contatori di particelle sono state eseguite con contatori dopo la PIVEC e per determinare la concentrazione di particelle prima il PIVEC. Integrare la concentrazione delle particelle nel tempo per il contatore di particelle poi integrare sul diametro della particella per determinare il totale particelle misurate.
- Calcolare il numero di particelle depositate come la differenza tra le particelle amministrate e il post-PIVEC di particelle misurate. Questo valore è la dose depositata basato su numeri per l'esperimento.
- Particelle di uso amministrato, nadmin, basati su numero depositate dose, ndep, portata volumetrica, V e dal tempo, t, per calcolare l'efficienza di deposizione basata su numero, ηn, per l'esperimento.
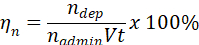
- Valori medi da 4.2.2 e 4.2.3 per almeno 3 esperimenti determinare la deposizione e l'efficienza di deposizione per PIVEC per dimensione delle particelle.
5. aerosol l'esposizione delle cellule
Nota: Per la cella viene definito cultura all'interfaccia aria-liquido il lettore in bianco et al. 38 gli operatori dovrebbero eseguire cultura inserto di cella di carico (misure 5.1.2-5.1.4) all'interno di una cappa di biosicurezza. Gli operatori dovrebbero eseguire esposizioni di aerosol in una cappa.
-
Cellule di cultura all'interfaccia aria-liquido
- Sollevare le cellule A549 da matraccio di cultura con l'aggiunta di tripsina-EDTA, 3ml per un pallone da T75 o 1 mL per una boccetta di T25 e incubare per 5 min a 37 ° C. Aggiungere 7 mL di supporto completo per una boccetta di T75 o 4 mL di terreno completo per un T25 boccetta a boccetta e parete di boccetta di risciacquo con sospensione cellulare massimizzare il numero di cellulare recuperati. Trasferimento la sospensione cellulare in una provetta conica sterile 15 mL poi Centrifugare le cellule a 800 x g per 3 min.
- Rimuovere il surnatante contenente tripsina-EDTA e risospendere il pellet cellulare in 10 mL di multimediale completo. Rimuovere 10 µ l di sospensione cellulare e aggiungere l'emocitometro. Contare le celle utilizzando un emocitometro per determinare la concentrazione e il numero totale di cellule.
- Posto 0,5 mL di terreno completo per ciascun pozzetto all'interno di un piatto ben 24. Posizionare inserti di cultura cellulare inutilizzato a wells. Coltura cellulare di seme si inserisce sul lato apicale con una densità di cella vicino a 1 x 105 cellule/cm2 per i tipi di cellule che crescono ad un tasso vicino raddoppio al giorno. Seed A549 celle all'interno di un 24 ben inserire, inserire celle di seme ad una densità di 1 x 105 cellule/cm2 aggiungendo 35.000 cellule alla coltura delle cellule.
Nota: Le cellule con un tasso di crescita più lento possono essere seminate ad una densità aumentata delle cellule. - Aggiungi media completi al lato apicale della cellula cultura inserto per raggiungere il volume finale (per 24 volume finale ben piatto è 0,25 mL).
- Cultura per 7 giorni in condizioni sommerse, sostituzione media ogni 1-2 giorni. Dopo 7 giorni, rimuovere i supporti apicali e la cultura per almeno 1 giorno in condizioni di ALI, sostituendo solo i media basolaterale.
-
Assemblare PIVEC
- Consentire alle cellule di equilibrare all'interfaccia aria-liquido per almeno 24 h prima dell'esposizione.
- Selezionare cella appropriata cultura inserto adattatore per PIVEC supportare l'inserto di cultura delle cellule con il filtro. Coltura cellulare posto inserire pezzo adattatore in cima PIVEC base, impostazione in posizione tale che la base del pezzo adattatore è più larga della parte superiore. Aggiungere 4 mL di terreno di coltura delle cellule della base della PIVEC.
- Uso delle pinzette per posizionare la coltura delle cellule ad inserire adattatore pezzo posizionato al punto 5.2.3. Posizionare il pezzo superiore sopra pezzo adattatore, stabilendosi in posizione tale che la base della parte superiore è più larga della parte superiore. Avvolgere attentamente, PIVEC con un singolo strato di nastro adesivo.
- Collegare pezzi cassetta 37 mm sulla parte superiore e inferiore della PIVEC, spingendo in luogo. Inserire schede di ¼" spinato cassetta ingresso ed uscita.
- Avvolgere il riscaldatore resistivo intorno PIVEC tale che i fili sono alla base. Nastro per garantire la.
- Avvolgere PIVEC con ~ 8 giri di carta stagnola per isolamento. Fissarla con nastro adesivo.
- Collegare all'adattatore sulla cima PIVEC breve pezzo di tubo flessibile di diametro esterno 1/2". Rimuovere tubo poroso da acqua sterile e posto all'interno della tubazione in cima PIVEC.
- PIVEC posto all'interno del morsetto sul cavalletto anello e sicuro. Completare il set-up con la pompa a vuoto e set-up dell'aerosol.
-
Esporre le cellule alle ALI utilizzando il PIVEC
- Utilizzare l'efficienza di deposizione determinata nel passaggio 2 per calcolare la massa di particelle per essere aerosolized. Pesare massa adeguata e aggiungere al sistema aerosol istituito a seguito del passaggio 2 all'interno della cappa.
- Esporre le cellule seguendo passo 2.2, in questo studio di endpoint biologici le cellule sono state esposte a circa 3,5 mg di rame nanoparticelle con una portata di 0,5 l/min e una durata di esposizione di 10 min. studi di controllo effettuati utilizzata aria umidificata per determinare l'influenza dell'aria da solo. Rimuovere PIVEC dal set-up. Prendere l'inserto di cultura cellulare, inserire nella piastra ben sterile e tornare l'incubatrice di CO2 (37 ° C, 5% CO2, 90% RH).
- Aspirare la media da PIVEC. Se eseguendo ulteriori esperimenti, fondo di risciacquo di PIVEC con fosfato tampone soluzione quindi ripetere il punto 5.1 e 5.2.
- PIVEC pulito con etanolo al 70% al termine. Sterilizzare con luce ultravioletta per almeno 30 min prima dell'esperimento successivo.
-
Procedure di saggio biologico
Nota: Analisi eseguite in questo studio erano generazione di stress ossidativo attraverso l'analisi di DCFH-DA e citotossicità attraverso il rilascio di lattato deidrogenasi (LDH).- Sciogliere 24,4 mg di DCFH-DA in 50 mL di metanolo per fare 1 mM DCFH-DA soluzione. Questa soluzione può essere conservata a-20 ° C fino a 4 mesi. Diluire 1 mM DCFH-DA soluzione mescolando 0,1 mL di 1 mM DCFH-DA soluzione con 9,9 mL HBSS per rendere 10 mL di 10 µM DCFH-DA.
- Rimuovere la cella di terreni di coltura e lavaggio inserto di cultura di cella con circa 1 mL di PBS. Aggiungere 0,5 mL di soluzione di DCFH-DA 10 µM in ciascun pozzetto, sostituendo inserti quando finito. Coprire la piastra con un foglio di alluminio per evitare fotoattivazione del colorante e tornare all'incubatore 37° C per 1 h.
- Rimuovere le cellule dall'incubatrice ed aspirare la soluzione di lavoro di DCFH-dai pozzi. Aggiungere 0,5 mL HBSS pozzetti e sostituire inserti di cultura cellulare.
- Caricare la piastra ben in fluorescenza lettore e misura piastra basale utilizzando lunghezze d'onda di eccitazione/emissione di 485/530 nm. Rimuovere la piastra da inserto reader e carico piastra in PIVEC per l'esposizione.
- Esporre le cellule per la durata di esposizione desiderata. Rimuovere l'inserto da PIVEC e tornare alla piastra ben. Rimuovere 50 µ l di liquido basolateral da ben piatto e posto nella piastra ben bianco 96. Misurare la fluorescenza del DCF utilizzando lunghezze d'onda di eccitazione/emissione di 485/530 nm ogni 30 min post-esposizione per 2 h.
- Lasciate che basolateral fluido stabilizzare a temperatura ambiente per 20-30 min. aggiungere 50 µ l di soluzione dosaggio LDH, misto seguente protocollo di produttore, basolaterale fluido dalla piastra bene e lasciare reagire per 10 min. aggiungere 25 µ l di soluzione bloccante a bene. Leggere la fluorescenza di Resorufina prodotto utilizzando lunghezze d'onda di eccitazione/emissione di 560/590 nm.
- Rimuovere il liquido ulteriori basolaterale e ripetere il passaggio 5.4.6 alle 4h e post-esposizione di 24 ore.
6 metodi statistici
- Analisi dei dati di analisi biologica
- Rapporto produzione di ROS come l'aumento di intensità di fluorescenza delle cellule trattate rispetto a misurazioni di base. Relazione attività LDH come l'aumento di intensità di fluorescenza delle cellule trattate rispetto a cellule non trattate.
- Eseguire il singolo fattore ANOVA per determinare le differenze statistiche fra i set di dati. Se del caso, eseguire student t-test ad un valore di significatività di 0,05. Report dati come media ± deviazione standard di almeno tre misurazioni dell'esposizione.
Risultati
Tossicologia occupazionale in vitro coinvolge mantenere vitalità cellulare durante l'esecuzione di esposizione di aerosol. Il sistema di PIVEC è mostrato in Figura 2, tra cui la temperatura e controllo dell'umidità e la PIVEC consumato. La temperatura è stata mantenuta utilizzando un riscaldatore resistivo alimentati a batteria e l'aerosol umidificato utilizzando aumentato umidificazione naturale attraverso un tubo poroso, a contatto col prodotto...
Discussione
Cartucce filtro forniscono un metodo semplice, poco costoso di raccolta aerosol nella zona di respirazione; Tuttavia, campioni di aerosol estratti dai filtri non rappresentano l'intero aerosol (cioè gas, sostanze volatili e polveri) e di conseguenza limitare la valutazione degli effetti biologici correlati. Usando il disegno iniziale della cassetta filtro 37 mm, il PIVEC è progettato per mantenere la portabilità e imitare la deposizione in vivo delle particelle da inalazione. Il PIVEC è significativamente in...
Divulgazioni
L'affiliazione degli autori è come indicato nel frontespizio. Gli autori sono supportati finanziariamente da Virginia Commonwealth University, dove il lavoro è stato completato a Richmond, in Virginia. Gli autori hanno la responsabilità esclusiva per la scrittura e il contenuto di questa carta. Gli autori dichiarano che non esistono nessun interessi concorrenti.
Riconoscimenti
Gli autori vorrei ringraziare Boris Solomonov e la Virginia Commonwealth innovazione macchina negozio per aiutare con la prototipazione rapida del dispositivo. Gli autori inoltre ringraziare Cristian Romero-Fuentes del gruppo Lewinski, Dr. Vitaliy Avrutin, Dr. Dmitry Pestov e la Virginia Commonwealth nanomateriali Core caratterizzazione Facility per il loro aiuto con caratterizzazione delle particelle. Questo lavoro è stato sostenuto dai fondi di avvio forniti al Dr. Lewinski da College of Engineering presso la Virginia Commonwealth University.
Materiali
| Name | Company | Catalog Number | Comments |
| Scanning mobility particle sizer (SMPS) | TSI, Inc. | 3910 | NanoSMPS |
| Optical particle sizer (OPS) | TSI, Inc. | 3330 | |
| Stainless Steel Pipe, 4" Long | McMaster-Carr | 4830K116 | Standard-Wall 304/304L, Threaded on Both Ends, 1/8 Pipe Size |
| Brass Ball Valve with Lever Handle | McMaster-Carr | 4112T12 | Compact High-Pressure Rating, 1/8 NPT Female |
| Steel Pipe, 2" Long | McMaster-Carr | 7753K121 | Standard Wall, Threaded on One End, 1/8 Pipe Size |
| HEPA filter | GE Healthcare | 09-744-12 | HEPA-Cap Disposable Air Filtration Capsule |
| Vacuum Generator | PISCO USA | VCH10-018C | |
| PIVEC | VCU | For design please contact authors | |
| Resistive heater | |||
| 1/4" barbed connectors | Zefon International, Inc. | 459743 | |
| Porous tubing | Scientific Commodities, Inc. | BB2062-1814A | Hydrophilic 10 um pores |
| Battery power bank | |||
| Cell culture insert | Fisherbrand | 353095 | 24 well plate insert |
| Filter Forceps | Fisherbrand | 09-753-50 | |
| Transfer Pipette | ThermoScientific | 13-711-27 | |
| Glass Fiber Filters | SKC | 225-7 | Binder-Free Type AE Filter 37 MM 1.00 um pore |
| Ultra Micro Balance | A&D | BM-22 | Housed in environmental chamber |
| 37 mm filter cassette | SKC | 225-3250 | Filter Cassette Blank, 37 mm, Clear Styrene |
| Variable flow vacuum pump | SKC | 220-5000TC | AirChek TOUCH, 5 to 5000 mL/min |
| Copper Particles | U.S. Research Materials, Inc. | US1090 | 40 nm |
| Copper Particles | U.S. Research Materials, Inc. | US1088 | 100 nm |
| Copper Particles | U.S. Research Materials, Inc. | US1117M | 800 nm |
Riferimenti
- Lewinski, N. A., Secondo, L. E., Ferri, J. K. Enabling Real-Time Hazard Assessment at the Workplace Enabling Real-Time Hazard Assessment at the Workplace. 14th Global Congress on Process Safety. , 1-9 (2018).
- Bakand, S., Winder, C., Khalil, C., Hayes, A. Toxicity assessment of industrial chemicals and airborne contaminants: transition from in vivo to in vitro test methods: a review. Inhalation Toxicology. 17, 775-787 (2005).
- Bakand, S., Hayes, A. Troubleshooting methods for toxicity testing of airborne chemicals in vitro. Journal of Pharmacological and Toxicological Methods. 61 (2), 76-85 (2010).
- Lenz, A. G., et al. A dose-controlled system for air-liquid interface cell exposure and application to zinc oxide nanoparticles. Particle and Fibre Toxicology. 6, 32 (2009).
- de Bruijne, K., et al. Design and testing of Electrostatic Aerosol in Vitro Exposure System (EAVES): an alternative exposure system for particles. Inhalation Toxicology. 21, 91-101 (2009).
- Asimakopoulou, A., Daskalos, E., Lewinski, N., Riediker, M., Papaioannou, E., Konstandopoulos, A. G. Development of a dose-controlled multiculture cell exposure chamber for efficient delivery of airborne and engineered nanoparticles. Journal of Physics: Conference. 429, 1-10 (2013).
- Grigg, J., et al. DNA damage of macrophages at an air-tissue interface induced by metal nanoparticles Macrophage. Nanotoxicology. 3 (4), 348-354 (2009).
- Aufderheide, M., Knebel, J. W., Ritter, D. An improved in vitro model for testing the pulmonary toxicity of complex mixtures such as cigarette smoke. Experimental and Toxicologic Pathology. 55, 51-57 (2003).
- Aufderheide, M., Halter, B., Möhle, N., Hochrainer, D. The CULTEX RFS: A comprehensive technical approach for the in vitro exposure of airway epithelial cells to the particulate matter at the air-liquid interface. BioMed Research International. 2013 (1), 1-15 (2013).
- Tippe, A., Heinzmann, U., Roth, C. Deposition of fine and ultrafine aerosol particles during exposure at the air/cell interface. Journal of Aerosol Science. 33, 207-218 (2002).
- Savi, M., et al. A novel exposure system for the efficient and controlled deposition of aerosol particles onto cell cultures. Environmental Science and Technology. 42, 5667-5674 (2008).
- Fröhlich, E., et al. Comparison of two in vitro systems to assess cellular effects of nanoparticles-containing aerosols. Toxicology in Vitro. 27, 409-417 (2013).
- Frijns, E., et al. A Novel Exposure System Termed NAVETTA for in Vitro Laminar Flow Electrodeposition of Nanoaerosol and Evaluation of Immune Effects in Human Lung Reporter Cells. Environmental Science and Technology. 51 (9), 5259-5269 (2017).
- Vincent, J. H. . Aerosol Science for Industrial Hygienists. , (1995).
- Fujitani, Y., Sugaya, Y., Hashiguchi, M., Furuyama, A., Hirano, S., Takami, A. Particle deposition efficiency at air-liquid interface of a cell exposure chamber. Journal of Aerosol Science. 81, 90-99 (2015).
- Elihn, K., Cronholm, P., Karlsson, H. L., Midander, K., Odnevall Wallinder, I., Möller, L. Cellular Dose of Partly Soluble Cu Particle Aerosols at the Air-Liquid Interface Using an. In Vitro Lung Cell Exposure System. Journal of Aerosol Medicine and Pulmonary Drug Delivery. 26 (2), 84-93 (2013).
- . . Aerosols Handbook Measurement, Dosimetry, and Health Effects. , (2005).
- de Souza Carvalho, C., Daum, N., Lehr, C. M. Carrier interactions with the biological barriers of the lung: Advanced in vitro models and challenges for pulmonary drug delivery. Advanced Drug Delivery Reviews. 75, 129-140 (2014).
- Fattal, E., Grabowski, N., Mura, S., Vergnaud, J., Tsapis, N., Hillaireau, H. Lung Toxicity of Biodegradable Nanoparticles. Journal of Biomedical Nanotechnology. 10 (10), 2852-2864 (2014).
- Klein, S. G., Serchi, T., Hoffmann, L., Blömeke, B., Gutleb, A. C. An improved 3D tetraculture system mimicking the cellular organisation at the alveolar barrier to study the potential toxic effects of particles on the lung. Particle and Fibre Toxicology. 10, 31 (2013).
- Oberdörster, G., et al. Principles for characterizing the potential human health effects from exposure to nanomaterials: elements of a screening strategy. Particle and Fibre Toxicology. 2, 8 (2005).
- Secondo, L. E., Liu, N. J., Lewinski, N. A. Methodological considerations when conducting in vitro, air-liquid interface exposures to engineered nanoparticle aerosols. Critical Reviews in Toxicology. , 1-32 (2016).
- Sayes, C. M., Reed, K. L., Warheit, D. B. Assessing toxicology of fine and nanoparticles: Comparing in vitro measurements to in vivo pulmonary toxicity profiles. Toxicological Sciences. 97 (1), 163-180 (2007).
- Maier, K. L., et al. Health effects of ambient particulate matter--biological mechanisms and inflammatory responses to in vitro and in vivo particle exposures. Inhalation Toxicology. 20 (May 2007), 319-337 (2008).
- Cohen, J. M., Teeguarden, J. G., Demokritou, P. An integrated approach for the in vitro dosimetry of engineered nanomaterials. Particle and Fibre Toxicology. 11 (1), 20 (2014).
- Deloid, G., et al. Estimating the effective density of engineered nanomaterials for in vitro dosimetry. Nature Communications. 5, 3514 (2014).
- Pal, A. K., Bello, D., Cohen, J., Demokritou, P. Implications of in vitro dosimetry on toxicological ranking of low aspect ratio engineered nanomaterials. Nanotoxicology. , 1-15 (2015).
- Walkey, C., et al. Protein corona fingerprinting predicts the cellular interaction of gold and silver nanoparticles. ACS Nano. 8 (3), 2439-2455 (2014).
- Raemy, D. O., et al. Effects of flame made zinc oxide particles in human lung cells - a comparison of aerosol and suspension exposures. Particle and Fibre Toxicology. 9 (1), 33 (2012).
- Holder, A. L., Lucas, D., Goth-goldstein, R., Koshland, C. P. Cellular response to diesel exhaust particles strongly depends on the exposure method. Toxicological Sciences. 103 (1), 108-115 (2008).
- Sanderson, P., et al. Characterisation of iron-rich atmospheric submicrometre particles in the roadside environment. Atmospheric Environment. 140. , 167-175 (2016).
- Burtscher, H. Physical characterization of particulate emissions from diesel engines: A review. Journal of Aerosol Science. 36 (7), 896-932 (2005).
- Ris, C. U.S. EPA health assessment for diesel engine exhaust: a review. Inhalation Toxicology. 19 (Suppl. 1), 229-239 (2007).
- Jie, Y., Isa, Z. M., Jie, X., Ju, Z. L., Ismail, N. H. Urban vs. Rural Factors That Affect Adult Asthma. Reviews of Environmental Contamination and Toxicology. 226, (2013).
- Wiemann, M., Vennemann, A., Sauer, U. G., Wiench, K., Ma-Hock, L., Landsiedel, R. An in vitro alveolar macrophage assay for predicting the short-term inhalation toxicity of nanomaterials. Journal of Nanobiotechnology. 14 (1), 16 (2016).
- Kenny, L. C., et al. A collaborative european study of personal inhalable aerosol sampler performance. Annals of Occupational Hygiene. 41 (2), 135-153 (1997).
- Tiwari, A. J., Fields, C. G., Marr, L. C. A Cost-Effective Method of Aerosolizing Dry Powdered Nanoparticles. Aerosol Science and Technology. 47 (11), 1267-1275 (2013).
- Blank, F., Rothen-Rutishauser, B. M., Schurch, S., Gehr, P. An Optimized In Vitro Model of the Respiratory Tract Wall to Study Particle Cell Interactions. Journal of Aerosol Medicine. 19 (3), 392-405 (2006).
- Laboratory, N. C. . NCL Method GTA-2 HEP G2 Hepatocarcinoma Cytotoxicity Assay. (November), 1-9 (2015).
- Kim, J. S., Peters, T. M., O'Shaughnessy, P. T., Adamcakova-Dodd, A., Thorne, P. S. Validation of an in vitro exposure system for toxicity assessment of air-delivered nanomaterials. Toxicology in Vitro. 27 (1), 164-173 (2013).
- Mertes, P., et al. A compact and portable deposition chamber to study nanoparticles in air-exposed tissue. Journal of aerosol medicine and pulmonary drug delivery. 26, 228-235 (2013).
- Panas, A., et al. Silica nanoparticles are less toxic to human lung cells when deposited at the air-liquid interface compared to conventional submerged exposure. Beilstein Journal of Nanotechnology. 5, 1590-1602 (2014).
- Zavala, J., et al. Regulating temperature and relative humidity in air-liquid interface in vitro systems eliminates cytotoxicity resulting from control air exposures. Toxicology Research. 6, 448-459 (2017).
- Jing, X., Park, J. H., Peters, T. M., Thorne, P. S. Toxicity of copper oxide nanoparticles in lung epithelial cells exposed at the air - liquid interface compared with in vivo assessment. TOXICOLOGY IN VITRO. 29 (3), 502-511 (2015).
- Bitterle, E., et al. Dose-controlled exposure of A549 epithelial cells at the air-liquid interface to airborne ultrafine carbonaceous particles. Chemosphere. 65, 1784-1790 (2006).
- Steinritz, D., et al. Use of the Cultex Radial Flow System as an in vitro exposure method to assess acute pulmonary toxicity of fine dusts and nanoparticles with special focus on the intra- and inter-laboratory reproducibility. Chemico-Biological Interactions. 206 (3), 479-490 (2013).
- Cronholm, P., et al. Intracellular uptake and toxicity of Ag and CuO nanoparticles: A comparison between nanoparticles and their corresponding metal ions. Small. 9 (7), 970-982 (2013).
- Cronholm, P., Midander, K., Karlsson, H. L., Elihn, K., Wallinder, I. O., Möller, L. Effect of sonication and serum proteins on copper release from copper nanoparticles and the toxicity towards lung epithelial cells. Nanotoxicology. 5 (2), 269-281 (2011).
- Midander, K., et al. Surface characteristics, copper release, and toxicity of nano- and micrometer-sized copper and copper(ll) oxide particles: A cross-disciplinary study. Small. 5 (3), 389-399 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon