Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Caracterización macro-reológica del moco rastrillo branquial en la carpa plateada, Hypophthalmichthys molitrix
En este artículo
Resumen
Este protocolo presenta un método para realizar la caracterización reológica del moco que reside en los rastrillos branquiales (GUR) de la carpa plateada. Las características viscoelásticas del MOG-GR, obtenidas midiendo la viscosidad, el almacenamiento y los módulos de pérdida, se evalúan para el estrés de rendimiento aparente para comprender el mecanismo de alimentación del filtro en los RR.
Resumen
La carpa plateada, Hypophthalmichthys molitrix,es un pez alimentador de filtro planctívoro invasor que infestó las vías fluviales naturales de la cuenca superior del río Mississippi debido a su mecanismo de alimentación por filtro altamente eficiente. Los órganos característicos llamados rastrillos branquiales (RDA), que se encuentran en muchos de estos alimentadores de filtro, facilitan la filtración eficiente de partículas de alimentos como el fitoplancton que son de unas pocas micras de tamaño.
La motivación para investigar la reología del moco GR proviene de nuestro deseo de comprender su papel en la ayuda al proceso de alimentación por filtro en la carpa plateada. El líquido rico en moco, en un estado "espeso y pegajoso" puede facilitar la adhesión de las partículas de los alimentos. La permeación y el transporte a través de la membrana GR se ven facilitados por la acción de fuerzas de cizallamiento externas que inducen diferentes tasas de deformación por cizallamiento. Por lo tanto, la reología del moco puede proporcionar una pista vital sobre la tremenda naturaleza de la carpa plateada dentro del grupo de peces que se alimentan por filtro. Sobre la base de esto, se postuló que el moco GR puede proporcionar una función adhesiva a las partículas de alimentos y actuar como un vehículo de transporte para ayudar en el proceso de alimentación del filtro.
El objetivo principal del protocolo es determinar la tensión de rendimiento del moco, atribuida a la tensión de cizallamiento mínima requerida para iniciar el flujo en el que se observa por primera vez una deformación plástica irreversible a través de un material viscoelástico estructurado. En consecuencia, las propiedades reológicas del moco GR, es decir, la viscosidad, el almacenamiento y los módulos de pérdida, se investigaron por su naturaleza no newtoniana, adelgazamiento por cizallamiento utilizando un reómetro rotacional.
Un protocolo presentado aquí se emplea para analizar las propiedades reológicas del moco extraído de los rastrillos branquiales de una carpa plateada, pescado en la ubicación de Hart Creek del río Missouri. El protocolo tiene como objetivo desarrollar una estrategia efectiva para las pruebas reológicas y la caracterización de materiales de moco que se supone que es un material viscoelástico estructurado.
Introducción
La carpa plateada, Hypophthalmichthys molitrix,es un alimentador de filtro planctívoro y una especie invasora que se ha infiltrado en varias vías fluviales naturales en los Estados Unidos. Esta especie se introdujo inicialmente en la cuenca alta del río Mississippi para controlar las floraciones de algas1,2,3. La carpa plateada es un alimentador extremadamente eficiente. Por lo general, sus tamaños de partículas de alimentos consumibles varían de 4 a 20 μm a zooplancton más grande que son alrededor de 80 μm3,4,5. Esta especie ha superado a otros peces nativos y potencialmente puede causar enormes daños a las vías fluviales nativas al limitar los recursos disponibles1,2,6. Por lo tanto, los peces que se alimentan por filtro como la carpa plateada y la carpa cabe cabeza grande representan una gran amenaza para los Grandes Lagos1,2,6,7,8.
Los peces que se alimentan por filtro poseen órganos especiales llamados rastrillos branquiales (RDA) con una capa delgada de moco que reside en su superficie. Estos órganos mejoran la eficiencia de filtración y agregación de pequeñas partículas del fluido entrante. El objetivo del protocolo presentado en este documento es caracterizar la propiedad no newtoniana del material de adelgazamiento por cizallamiento y la tensión de rendimiento del moco GR adquirido de la superficie interna de los rastrillos branquiales en la carpa plateada. El valor de la tensión de rendimiento del GR-moco, determinado mediante un reómetro rotacional, es de interés en este estudio. La tensión de rendimiento medida, también llamada "tensión de rendimiento aparente", depende de los métodos de prueba, como la velocidad de cizallada constante o la deformación oscilatoria dinámica tipo9,10. El adelgazamiento por cizallamiento, 'fluido de estrés de rendimiento', experimenta una transición de un comportamiento sólido a un comportamiento líquido en una tensión crítica aplicada9,11. La tensión de rendimiento aparente es la tensión de cizallamiento mínima requerida para iniciar el flujo o aquella en la que se observa por primera vez una deformación plástica irreversible cuando el moco pasa de un material similar a un gel a un material similar a un fluido. Este comportamiento se puede observar en materiales viscoelásticos estructurados. La transición del comportamiento similar a un gel a un comportamiento fluido del moco GR implica dos funciones, es decir, un papel adhesivo para recolectar partículas de alimentos y un papel de vehículo de transporte para ayudar en el proceso de entrega y filtración de partículas. La función extendida del moco incluye la creación de barreras de difusión en la resistencia a las enfermedades y la respiración, proporcionando una liberación controlada de factores nutricionales, componentes tóxicos y excreción, creando vías metabólicas para la alimentación y la anidación, ayudando en la protección de los depredadores y produciendo modificaciones de la capa límite que mejoran la locomoción y la eficiencia propulsiva12,13,14.
A diferencia de los fluidos simples, los fluidos complejos como el moco poseen propiedades que varían con las condiciones de flujo y requieren parámetros de medición adicionales para definir su comportamiento físico a gran escala. Para controlar la viscosidad y el estrés por rendimiento del moco GR, las mediciones reológicas se realizan utilizando un reómetro rotacional. El reómetro rotacional aplica una tensión o tensión de cizallamiento constante u oscilatoria por medio de un disco giratorio en contacto con la muestra de fluido y mide su respuesta. La razón detrás del uso de este instrumento y técnica es que el reómetro puede proporcionar un conjunto de mediciones para describir las propiedades materiales del moco GR de la carpa plateada, que no se pueden definir solo por la viscosidad.
El moco es un material viscoelástico y su respuesta mecánica a una deformación impuesta es entre la de un sólido puro (regido por la ley de elasticidad de Hooke) y el de un líquido puro (regido por la ley de viscosidad de Newton)15,16. La compleja red macromolecular contenida dentro del moco puede estirarse y reorientarse en respuesta a fuerzas externas o deformación. Un reómetro rotacional se compone de una geometría de cono y una placa de Peltier como se muestra en la Figura 1 y la Figura 2 (consulte la Tabla 1 para las especificaciones de instrumentación). El objetivo de este estudio fue desarrollar un protocolo para determinar las propiedades reológicas del moco GR. Una ventaja del reómetro rotacional sobre un viscosímetro es su capacidad para realizar mediciones dinámicas utilizando pequeños volúmenes de muestra. El volumen de la muestra de moco GR en este estudio fue de aproximadamente 1,4 ml. El viscosímetro, por otro lado, está limitado a velocidades de cizallamiento constantes y requiere grandes volúmenes de muestra.
Se espera que las propiedades reológicas del moco varíen mucho dentro de la anatomía de la carpa plateada. Por ejemplo, las propiedades del moco que reside en las superficies GR pueden ser diferentes del órgano epibranquial. Para tener en cuenta la variabilidad potencial de las propiedades del moco en diferentes regiones del pez, la muestra de moco GR adquirida se diluyó y se crearon y probaron soluciones de tres concentraciones utilizando el reómetro rotacional. Los datos y resultados relativos a la reología del moco informados tras la ejecución del protocolo demostraron la eficacia de la técnica de medición. Los datos ilustrativos presentados en este documento no están destinados a generalizarse en toda la población de carpa plateada. El protocolo presentado en este documento se puede extender para investigar la reología del moco en conjuntos de muestras más grandes para probar otras hipótesis.
El propósito de este estudio es demostrar la variación de las propiedades reológicas de la reología del moco GR con tres concentraciones diferentes de moco (400 mg/mL, 200 mg/mL y 100 mg/mL). La concentración de 400 mg/ml representa la muestra de moco crudo cosechada de los GRs de pescado. Se utilizó agua desionizada (DI) para diluir la muestra de moco crudo en concentraciones de 200 mg/mL y 100 mg/mL. La dilución de las muestras de moco permitió la evaluación del grado de adelgazamiento por cizallamiento y la tensión aparente del rendimiento en función de la concentración y la determinación de la concentración a la que el moco GR pasa a un comportamiento no newtoniano. Se utilizó un agitador para descomponer cualquier grupo grande de moco en las muestras para mitigar los errores en los datos reológicos debido a la no homogéneidad.
En la mayoría de los vertebrados, incluidos los peces, las macromoléculas formadoras de moco predominantes son las glicoproteínas (mucinas) que tienden a hincharse en el agua por enredos o reticulaciones químicas y crean un material similar a un gel12,13,17,18,19,20. Las macromoléculas formadoras de gel de alto peso molecular y el alto contenido de agua reflejan el deslizamiento en el moco13. Un alto grado de interacciones inter-macromoleculares conduce a la formación de gel, mientras que los niveles más bajos de interacciones inter-macromoleculares o enlaces rotos dan como resultado fluidos de alta viscosidad21.
Los procesos de filtración de partículas de alimentos en peces que se alimentan por filtro son ayudados por propiedades relacionadas con el moco GR, como la cohesión y la viscosidad, que determinan su potencial de adhesión yadherencia 22. La fuerza de la adhesión basada en moco depende de interacciones intermoleculares, electrostáticas o hidrofóbicas específicas23. Sanderson et al.24 realizaron un estudio de alimentación en suspensión en peces negros en el que encontraron la evidencia de adhesión basada en moco. Afirmaron que la adhesión de partículas de alimentos en suspensión con una superficie mucosa es seguida por el transporte de grupos agregados de partículas unidas con el moco por el flujo de agua dirigido que actúa sobre él24. El moco expuesto a las tasas de tensión de cizalla generadas por el flujo de agua facilita la entrega de partículas de alimentos a los órganos digestivos. Se utilizaron técnicas endoscópicas para observar partículas filtradas24.
La literatura sobre el rango de las tasas de cizallamiento y los límites prácticos en las pruebas reológicas del moco GR es escasa. Por lo tanto, se buscó orientación de estudios reológicos sobre moco gástrico, nasal, cervical y pulmonar, moco de piel de salmón, limo de pez bruja y lubricante de superficie de articulación ósea en los que se estudió la caracterización reológica y los atributos no newtonianos11,12, 25,26, 27,28,29,30,31. Más recientemente, el efecto del moco de la piel de los peces en la locomoción y la eficiencia propulsiva se ha estudiado utilizando viscometría de velocidad de cizallamiento constante. Los estudios de reología del moco cutánico (sin ninguna dilución u homogeneización) relacionados con la dorada, la lubina y la exigua demostraron un comportamiento no newtoniano a tasas de cizallamiento típicamente bajas14. En otro estudio relacionado, se encontró que las muestras de moco cutángeo crudo de los lados dorsal y ventral del lenguado senegalés exhiben un comportamiento no newtoniano, lo que indica una mayor viscosidad del moco ventral a todas las tasas de cizallamiento consideradas32. Otros protocolos reológicos relacionados con el desarrollo del andamio de hidrogel y para suspensiones altamente concentradas utilizando un viscosímetro de velocidad de cizallamiento constante también han sido reportados en la literatura33,34.
En este estudio, las propiedades del moco GR se investigaron utilizando un reómetro rotacional controlado por la velocidad de deformación que ha sido ampliamente utilizado en experimentos de reología en fluidos biológicos complejos25. Para los fluidos newtonianos, la viscosidad aparente permanece constante, es independiente de la velocidad de cizallamiento y las tensiones de cizallamiento varían linealmente con las tasas de deformación de cizallamiento(Figura 3A,B). Para fluidos no newtonianos (como los fluidos de adelgazamiento por cizallamiento) la viscosidad depende de la velocidad de cizallamiento o de la historia de la deformación(Figura 3A,B). El módulo de pérdida (G") representa la medida en que el material resiste la tendencia a fluir y es representativo de la viscosidad del fluido(Figura 4). El módulo de almacenamiento (G') representa la tendencia del material a recuperar su forma original después de la deformación inducida por tensión y es equivalente a la elasticidad (Figura 4). El ángulo de fase (δ) o valor tangente de pérdida, se calcula a partir de la tangente inversa de G"/G'. Representa el equilibrio entre la pérdida de energía y el almacenamiento y también es un parámetro común para caracterizar materiales viscoelásticos (δ = 0° para un sólido hookeo; δ = 90° para un líquido viscoso; δ < 45° para un sólido viscoelástico y δ > 45° para un líquido viscoelástico) (Figura 4)25. La tensión de rendimiento aparente (σy) en fluidos estructurados representa un cambio de estado que se puede observar en los datos reológicos de barrido en estado estacionario y barridos dinámicos de tensión-deformación10. Si la tensión externa aplicada es menor que la tensión de rendimiento aparente, el material se deformará elásticamente. Cuando la tensión excede la tensión de rendimiento aparente (marcada como "tensión promedio" en la Figura 3B),el material pasará de la deformación elástica a la plástica y comenzará a fluir en su estado líquido35. La medición del módulo de almacenamiento (G') y el módulo de pérdida (G") en la muestra de moco en condiciones de tensión oscilatoria (o deformación) cuantifica el cambio en el estado del material de un comportamiento similar al gel al viscoelástico similar al líquido.
Los tipos de pruebas de reómetro realizadas para monitorear datos relacionados con el módulo de almacenamiento (G'), el módulo de pérdida (G") y la viscosidad aparente (η) se describen aquí. Las pruebas de oscilación dinámica (barridos de deformación y barridos de frecuencia) monitorearon G' y G" bajo oscilación controlada de la geometría del cono. Las pruebas de barrido de deformación dinámica determinaron la región viscoelástica lineal (LVR) del moco mediante el monitoreo de la respuesta intrínseca del material(Figura 4). Se utilizaron barridos de deformación para determinar el comportamiento de rendimiento a una frecuencia y temperatura de oscilación constantes. Las pruebas de barrido de frecuencia dinámica monitorearon la respuesta del material al aumento de la frecuencia (tasa de deformación) a una amplitud y temperatura constantes (tensión o tensión). La deformación se mantuvo en la región viscoelástica lineal (LVR) para las pruebas de barrido de frecuencia dinámica. Las pruebas de velocidad de cizallado en estado estacionario monitorearon la viscosidad aparente (η) bajo rotación constante de la geometría del cono. El moco GR se sometió a pasos de tensión incrementales y la viscosidad aparente (η, Pa.s) se monitoreó para variar la velocidad de cizallamiento (ý, 1/s).
El protocolo presentado en este trabajo trata el moco GR como un material estructurado complejo de viscoelasticidad desconocida con un cierto rango de respuesta viscoelástica lineal. El moco de pescado fue extraído de los RR de la carpa plateada durante una expedición de pesca en la ubicación de Hart Creek en el río Missouri por la profesora L. Patricia Hernández (Departamento de Ciencias Biológicas, The George Washington University) 1,2,36. Una matriz de RDA dentro de la boca de una carpa plateada se muestra en la Figura 5A y un dibujo esquemático se presenta en la Figura 5B. Un GR extirpado se muestra en la Figura 5C. La extracción de moco de los ER de la carpa plateada se presenta como ejemplo en los dibujos esquemáticos, Figura 5D,E. Todas las pruebas del reómetro se realizaron bajo una temperatura constante y controlada de 22 ± 0.002 ° C, la temperatura registrada en el sitio de pesca1,2,36. Cada muestra de moco se probó tres veces con el reómetro, y los resultados promediados se presentan junto con las barras de error estadístico.
Protocolo
1. Preparación de las soluciones de moco de diversas concentraciones
NOTA: Tres concentraciones de la solución de moco (400 mg/mL, 200 mg/mL y 100 mg/mL con volúmenes aproximados, 1 mL, 1 mL y 2 mL, respectivamente) están preparadas para este experimento.
- Para calcular la masa del moco, mida la masa media de los viales con (Mcon moco ; mg) y sin moco (M viales ; mg). Luego reste la masa de los viales con moco con la que no tiene moco (Mmoco = M conmoco - Mviales ; mg).
- Diluya el moco en tres concentraciones (400, 200, 100, mg/ml) con agua desionizada (DI).
- Prepare la primera concentración de la solución de moco, 400 mg / ml agregando 0.6 ml de agua DI al moco usando una micropipeta.
NOTA: Dado que el volumen aproximado del moco extraído fue de 1,4 ml, la solución de 400 mg/ml tendrá un volumen total de ~ 2 ml. - Coloque el vial de solución de moco de 400 mg/ml en un agitador para asegurarse de que la solución de moco esté adecuadamente homogeneizada y se mitigue cualquier aglomeración de partículas de moco.
- Prepare la segunda concentración de la solución de moco, 200 mg/ml, extrayendo la mitad del volumen de la solución de moco de primera concentración en un nuevo vial utilizando una micropipeta y añadiendo 1 ml de agua DI en el nuevo vial.
- Repita el paso 1.2.2 para el primer y segundo vial con soluciones de moco.
- Preparar la tercera concentración de la solución de moco, 100 mg/ml, extrayendo la mitad del volumen (1 ml) de la solución de 200 mg/ml en un nuevo vial utilizando una micropipeta y añadiendo agua DI en el nuevo vial.
- Repita el paso 1.2.2 para las tres concentraciones de soluciones de moco en sus respectivos viales (véase la figura complementaria 1).
- Guarde los viales de solución de moco en un refrigerador hasta que se realice la calibración y las pruebas del reómetro.
- Prepare la primera concentración de la solución de moco, 400 mg / ml agregando 0.6 ml de agua DI al moco usando una micropipeta.
2. Mediciones y adquisición de datos utilizando un reómetro
NOTA: El software utilizado en este protocolo para el control de instrumentos y la adquisición de datos con reómetro se indican en la Tabla de Materiales. Este software se denominará «software de control de instrumentos de reómetro».
- Configure y calibre el instrumento del reómetro.
- Encienda el suministro de aire comprimido al reómetro y asegúrese de que la mesa neumática y el reómetro estén nivelados con un medidor de burbujas. Gire la tapa protectora en el eje del reómetro y mantenga el eje quieto mientras se desenrosca.
- Encienda los interruptores principales del reómetro para activar los rodamientos magnéticos del reómetro.
- Encienda la computadora de control del reómetro con el software de control del instrumento del reómetro instalado en ella e inicie el software de control del instrumento del reómetro (consulte la Figura suplementaria 2).
- Realice la calibración del instrumento seleccionando las pestañas'Calibración | Instrumento' desde la ventana del software. Elija la opción'Instrumento'. Haga clic en'Calibrar'en'Inercia'. Registre el valor de calibración de inercia del instrumento en μN.m.s2 y repita la calibración al menos 3 veces para garantizar que los valores de calibración estén dentro del 10% entre sí (consulte la Figura suplementaria 3).
- Instale la geometría del reómetro en el eje del reómetro.
- Haga clic en la pestaña 'Geometrías' en el software de control del instrumento del reómetro.
- Limpie el cono con la geometría deseada (40 mm de diámetro, 1◦ 0' 11'' cono) y la placa peltier con isopropanol (ver Tabla 1, Tabla de Materiales, Figura 1y Figura 2).
NOTA: La placa Peltier viene instalada en el reómetro; se puede limpiar con isopropanol mientras se fija directamente al reómetro. - Asegúrese de que el accesorio de la placa Peltier esté libre de polvo visible y limpie, si es necesario, con isopropanol. Instale la placa Peltier si no está preinstalada en el reómetro y conecte las conexiones del disipador de calor.
- Pulse elbotón 'Bloquear'en el reómetro del eje de bloqueo que está conectado a la geometría del cono. Esto detiene la posición del eje, pero puede girar libremente en la posición.
- Haga clic en 'Smart Swap | Habilitado' en la pestaña del software de control del instrumento del reómetro para permitir la detección automática de la geometría (consulte la Figura suplementaria 4).
- Gire el eje en la parte superior del reómetro para atornillar la geometría. El software detectará la geometría del ángulo del cono de 40 mm de diámetro, 1◦ 0' 11'' en esta etapa (ver Tabla 1 y Tabla de Materiales).
- Repita los pasos 2.2.5 – 2.2.6 para asegurarse de que se detecta la geometría.
- Seleccione'Gap'en el 'Panel decontrol'del software de control del instrumento del reómetro, haga clic en el icono'Opciones'y elija la opción'Fuerza axial'. Establecer la fuerza axial en '1 Newton'; esto es para garantizar que la geometría del cono toque la placa de Peltier para la inicialización de espacio cero (consulte la Figura suplementaria 5).
- Realice la calibración de la geometría del reómetro.
- Seleccione la pestaña 'Geometría' en la ventana del software. Haga clic en'Calibrar'en'Inercia'. Registre el valor de calibración de inercia de geometría en μN.m.s2 y repita esto 2-3 veces para garantizar que los valores de calibración estén dentro del 10% entre sí.
- Haga clic en'Calibrar'en'Fricción'en la ventana del software. Registre el valor de calibración de fricción de la geometría en μN.m/(rad/s) y repita esto 2-3 veces para asegurarse de que los valores de calibración estén dentro del 10% entre sí (ver Figura suplementaria 6).
- Realizar la inicialización de brecha cero
NOTA: Dado que la geometría no se puede elevar con precisión por encima de la placa de Peltier para realizar mediciones sin una posición de referencia "cero", se realiza la inicialización de espacio cero. Para los fines de medición, la geometría tiene un espacio de geometría incorporado de 24 μm y un espacio de recorte de 28 μm. El espacio de recorte está configurado para limpiar eficazmente el exceso de líquido que puede derramarse fuera del área de superficie de la geometría. Estas brechas son imperativas para medir con precisión los datos utilizando la muestra y el reómetro. El paso 2.4.1 es absolutamente necesario para asegurarse de que la geometría se establece en cero espacio para lograr la geometría y recortar los huecos de 24 μm y 28 μm, respectivamente.- Haga clic en el icono'Cero espacio'en la pestaña'Espacio'en el'Panel de control'en la ventana del software. La inicialización se completa cuando la fuerza axial experimentada por la geometría es mayor o igual a 1 N, ya que toca la placa de Peltier. Asegúrese de que el espacio del reómetro esté a cero para que su posición de referencia sea precisa (véase la Figura suplementaria 7 y la Figura suplementaria 8).
- Pulse los controles de laflecha arriba y abajoen el instrumento del reómetro o los iconos de"subir y bajar" de la geometríabajo la pestaña"Gap"en el software de control del instrumento del reómetro para elevar la geometría a cualquier altura arbitraria. La pantalla de control en el instrumento del reómetro y el panel de control del software de control del instrumento del reómetro mostrarán la (misma) altura del espacio.
- Configure el procedimiento experimental en el software de control del instrumento del reómetro. Realizar la caracterización de las propiedades reológicas mediante el uso de una geometría de placa de cono sobre Peltier a 22 °C.
NOTA: El sitio web del Servicio Geológico de los Estados Unidos se utilizó para determinar la temperatura del agua del río el 20 de septiembre de 2018, cuando se pescó la carpa plateada utilizada para los experimentos de moco GR en la ubicación de Hart Creek36. La temperatura del moco puede afectar las propiedades reológicas. La importancia de ajustar los valores a la temperatura del río es que coincida aproximadamente con la temperatura bajo la cual se pueden estimar de manera realista las propiedades del moco.- Seleccione la pestaña'Experimentos'en el software de control del instrumento reómetro y complete la información relevante como 'Nombre', 'Operador', 'Proyecto', etc. (véase la figura complementaria 9)
- Seleccione la pestaña 'Geometría' y asegúrese de que la información esté de acuerdo con los pasos 2.2.5. - 2.2.7. (véase la figura complementaria 10).
- Seleccione la ficha 'Procedimiento', y utilice las teclas de flecha configuradas en '1: Amplitud de oscilación' procedimiento. (véase la figura complementaria 11).
- Inicialice la configuración de 'Control ambiental' como sigue: 'Temperatura = 22 °C'; 'Tiempo de remojo = 120 s' y marque la casilla 'Esperar la temperatura' (ver Figura suplementaria 11).
- Inicialice la configuración de 'Parámetrosde prueba ' de la siguiente manera: 'Frecuencia = 1 Hz'; establecer 'Barrido logarítmico'; «Par = 10 a 10000 μN.m»; «Puntos por década = 5» (véase la figura complementaria 11).
- Configure el experimento para determinar el rango viscoelástico lineal (LVR) del moco de concentración conocida (100 mg / ml)
- Utilizando una micropipeta apropiada y una punta de pipeta extraiga aproximadamente 0,3 ml de solución de moco de pescado de concentración 100 mg/ml (consulte el Paso 1.2, Tabla de materiales).
- Introduzca la solución de moco en la placa de Peltier utilizando la micropipeta (ver Figura 2).
- Pulse el botón 'Trim Gap' en el reómetro para bajar la geometría a la placa Peltier. Alternativamente, haga clic en el icono'Recortar hueco'en la pestaña'Hueco'en la opción'Panel de control'en el software de control del instrumento del reómetro (consulte la Figura suplementaria 12).
- Use la micropipeta con la punta de la pipeta para eliminar cualquier exceso de solución de moco y asegúrese de que el fluido esté debajo de la geometría sin derramarse cerca de la periferia de la geometría.
NOTA: La carga incorrecta del fluido dará lugar a errores en las mediciones. La muestra rellena bajará la distribución del par y la muestra sobrellenó conducirá a distribuciones de tensión erróneas debido al derrame a lo largo de los bordes. - Seleccione las pestañas 'Motor' y 'Velocidad' a 5 rad/s y 0 rad/s alternativamente, hasta que haya una inercia y velocidad mínimas en la muestra debajo de la geometría. La pantalla de control en el instrumento del reómetro y el panel de control del software de control del instrumento del reómetro mostrarán la velocidad (ver Figura suplementaria 13).
- Presione el botón 'Geometry Gap' en el reómetro para bajar la geometría al espacio adecuado preestablecido por geometría específica. Alternativamente, haga clic en el icono'Geometry Gap'en la pestaña'Gap'en la opción 'Panel de control' en el software de control del instrumento del reómetro (consulte la Figura suplementaria 14).
- Ejecute el experimento para determinar el rango viscoelástico lineal (LVR) del moco de la concentración conocida (100 mg / ml).
- Haga clic en el icono'Inicio'en el software de control del instrumento del reómetro (consulte la Figura complementaria 15).
NOTA: El reómetro realiza mediciones automáticas; una vez pulsado el botón 'Inicio', el reómetro tardará aproximadamente 20 minutos en completar la prueba. La configuración "Puntos por década" en el paso 2.5.5 determina cuánto tiempo necesitará el reómetro para completar las mediciones. - Ejecute el experimento haciendo clic en 'Sí' en el cuadro emergente que aparece y sugiere que el espacio de geometría se reduzca a la distancia correcta para iniciar el experimento, si aún no se ha bajado.
- Observe la gráfica en tiempo real generada por el reómetro que informa los módulos de almacenamiento (G') y pérdida (G'').
NOTA: La G' y la G" son los módulos de almacenamiento y pérdida, respectivamente. El módulo de almacenamiento representa la tendencia del material a recuperar su forma original después de la deformación inducida por la tensión y es equivalente a la elasticidad. El módulo de pérdida representa la medida en que el material resiste la tendencia a fluir y es representativo de la viscosidad del fluido (ver Figura 4). - Establezca el eje X de la gráfica en 'Porcentaje de deformación de oscilación'. Para ello, haga clic con el botón derecho en el gráfico presentado y elija lapestaña 'Variables del gráfico' (consulte la Figura complementaria 16).
- Registre el rango de porcentaje de deformación de oscilación de la gráfica antes de que el material entre en el rango viscoelástico no lineal, una vez que se complete la prueba.
- Pulse los controles de laflecha arriba y abajoen el instrumento del reómetro o los iconos de"subir y bajar" de geometríadebajo de la pestaña"Gap"en el software de control del instrumento del reómetro para elevar la geometría a cualquier altura arbitraria por encima de la placa de Peltier.
- Guarde el archivo que contiene tanto el procedimiento experimental como los resultados en el formato de archivo nativo del software de control del instrumento reómetro para determinar la región viscoelástica lineal (LVR) de la muestra de moco.
NOTA: Esto se puede hacer configurando el eje X de la gráfica para que la amplitud de deformación (%) y/o la tensión de oscilación antes de que los datos entren en la región viscoelástica no lineal (NLVR) (consulte la Figura suplementaria 16).
antes de que los datos entren en la región viscoelástica no lineal (NLVR) (consulte la Figura suplementaria 16).
- Haga clic en el icono'Inicio'en el software de control del instrumento del reómetro (consulte la Figura complementaria 15).
- Ejecute los barridos dinámicos y los experimentos de prueba de flujo de velocidad de cizallamiento en estado estacionario en el rango viscoelástico lineal (LVR) para el moco de concentración conocida 100, mg / ml para generar resultados de tres muestras de moco independientes de 100 mg / ml. Realice estos pasos en las muestras de concentración de moco disponibles individualmente.
- Repita los pasos 2.5.1 – 2.5.4.
- Inicialice la configuración de 'Parámetrosde prueba ' de la siguiente manera: 'Frecuencia = 1 Hz'; establecer 'Barrido logarítmico'; «Cepa % = 100 a 10000 %; 'Puntos por década = 10'.
- Seleccione la pestaña'Procedimiento'y utilice las teclas de flecha configuradas en el procedimiento '2: Frecuencia de oscilación'.
- Inicialice la configuración de 'Control ambiental' como sigue: 'Temperatura = 22 °C'; 'Tiempo de remojo = 0.0 s'.
- Inicialice la configuración de 'Parámetrosde prueba ' de la siguiente manera: 'Strain % = 1 %'; establecer 'Barrido logarítmico'; «Frecuencia = 20 a 1 Hz»; 'Puntos por década = 10'.
- Seleccione la pestaña'Procedimiento'y utilice las teclas de flecha configuradas en el procedimiento '3: Flow Sweep'.
- Inicialice la configuración de 'Control ambiental' como sigue: 'Temperatura = 22 °C'; 'Tiempo de remojo = 0.0 s'.
- Inicialice la configuración de 'Parámetrosde prueba ' como sigue: 'Velocidad de cizalla = 1 a 10000 1/s'; 'Puntos por década = 10'; casilla de verificación 'Detección de estado estacionario'.
- Repita los pasos 2.7.1 – 2.7.2 y espere hasta que se complete el experimento, aproximadamente 45 minutos.
- Presione los controles de laflecha hacia arriba y hacia abajoen el instrumento del reómetro o los iconos de "geometría de subir y bajar" en la pestaña "Brecha" en el software de control del instrumento del reómetro para elevar la geometría a cualquier altura arbitraria.
- Use toallitas y guantes desechables para eliminar y limpiar el moco en la placa Peltier con solución de isopropanol (ver Tabla de Materiales).
- Guarde el archivo que contiene tanto el procedimiento experimental como los resultados en el formato de archivo nativo del software de control del instrumento del reómetro.
3. Repita el protocolo para otras concentraciones de soluciones de moco de 200 mg/ml y 400 mg/ml.
- Realice los pasos 2.5 – 2.8 incluyendo todos los sub-pasos enumerados en el mismo para las dos concentraciones restantes de soluciones de moco, 200 mg / ml y 400 mg / ml.
4. Representación gráfica y análisis de datos
NOTA: El código proporcionado en el archivo de código suplementario realiza el promedio de datos y genera errores de repetibilidad, superpone los datos de todos los experimentos. Las funciones de cálculo de desviación estándar no están disponibles en el software de control del instrumento del reómetro. El código está escrito en un lenguaje de programación para el análisis de datos, el posprocesamiento y la representación gráfica (consulte la Tabla de materiales para obtener más detalles).
- Exporte los datos generados a partir del paso 2.8 relacionados con la concentración de moco GR de 100 mg / ml y el paso 3.1 relacionado con las concentraciones de moco GR de 200 mg / ml y 400 mg / ml gr en formato de hoja de cálculo haciendo clic en la pestaña'Archivo | exportación | Excel' en el software de control de instrumentos del reómetro (ver Figura suplementaria 17).
- Ejecute códigos suplementarios para generar gráficos de viscosidad aparente (η) para variar las tasas de deformación por cizallamiento (
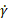 ) y el módulo de pérdida (G"), el módulo de almacenamiento (G') y el ángulo de fase (δ) para variar la tensión de oscilación ( ) y generar
) y el módulo de pérdida (G"), el módulo de almacenamiento (G') y el ángulo de fase (δ) para variar la tensión de oscilación ( ) y generar  resultados representativos.
resultados representativos.
Resultados
En esta sección, presentamos los resultados de los experimentos sobre moco GR utilizando un reómetro rotacional con una geometría de cono (40 mm de diámetro, 1° 0' 11'') y una placa de Peltier. Los experimentos ayudaron a caracterizar el comportamiento no newtoniano, de adelgazamiento por cizallamiento del moco GR y el estrés aparente del rendimiento que representa la transición del moco de un material similar a un gel a un material similar a un fluido. Los resultados representativos implican descripciones cuantit...
Discusión
Uno de los principales objetivos del desarrollo de este protocolo es establecer que es adecuado para la caracterización reológica del moco GR cuando se dispone de volúmenes de muestra muy pequeños. Reconocemos que se necesitan más muestras de una escuela de carpa plateada para caracterizar completamente las propiedades reológicas del moco GR y los datos presentados aquí no son una generalización en toda la población de carpa plateada. Nuestra técnica se justifica por su eficacia con la caracterización reológi...
Divulgaciones
No se declaran conflictos de intereses.
Agradecimientos
Los autores reconocen el apoyo y la financiación del GW Center for Biomimetics and Bioinspired Engineering. Agradecemos a la profesora L. Patricia Hernández del Departamento de Ciencias Biológicas de la Universidad George Washington por inspirar la investigación y la colaboración continua, proporcionar experiencia biológica en la fisiología de la carpa plateada y proporcionar las muestras de moco. Agradecemos a los estudiantes, el Sr. David Palumbo, la Sra. Carly Cohen, el Sr. Isaac Finberg, el Sr. Dominick Petrosino, el Sr. Alexis Renderos, la Sra. Priscilla Varghese, el Sr. Carter Tegen y el Sr. Raghav Pajjur por su ayuda en el laboratorio y al Sr. Thomas Evans y el Sr. James Thomas de TA Instruments, New Castle, DE por su apoyo con la capacitación y el mantenimiento del reómetro. Las imágenes para las Figuras 5A, C fueron tomadas durante una disección realizada por la profesora L. Patricia Hernández del Departamento de Ciencias Biológicas de la Universidad George Washington.
Materiales
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Kim Wipes | VWR | 470224-038 | To clean Sample from plate |
| Gloves | VWR | 89428-750 | To prevent contamination of sample |
| Pipette | VWR | 89079-974 | To transport sample from vial to rheometer |
| Pipette Tips | Thermo Scientific | 72830-042 | To transport sample from vial to rheometer |
| Shaker | VWR | 89032-094 | To homogenously mix sample of mucus |
| Vials | VWR | 66008-710 | Contains measured sample volumes |
| Weigh Scale | Ohaus | Scout –SPX Balances | To weigh mass of mucus samples |
| Chemical Reagents | |||
| De-Ionized Water (H20) | - | - | Liquid |
| Sterile 70% Isopropanol (C3H8O) | VWR | 89108-162 | Liquid |
| GR Mucus | |||
| 100 mg/mL concentration, 2mL | - | - | Viscoelastic Material |
| 400 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| 200 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| Software | |||
| MATLAB | Mathworks | R2017a | Data analysis, post-processing and graphical representation |
| Trios | TA Instruments | v4.5.042498 | Rheometer instrument control and analysis software |
Referencias
- Cohen, K. E., Hernandez, L. P. The complex trophic anatomy of silver carp, Hypophthalmichthys molitrix, highlighting a novel type of epibranchial organ. Journal of Morphology. 279, 1615-1628 (2018).
- Cohen, K. E., Hernandez, L. P. Making a master filterer: Ontogeny of specialized filtering plates in silver carp (Hypophthalmichthys molitrix). Journal of Morphology. 279, 925-935 (2018).
- Cremer, M., Smitherman, R. Food habits and growth of silver and bighead carp in cages and ponds. Aquaculture. 20 (1), 57-64 (1980).
- Battonyai, I., et al. Relationship between gill raker morphology and feeding habits of hybrid bigheaded carps (Hypophthalmichthys spp.). Knowledge and Management of Aquatic Ecosystems. 416, 36 (2015).
- Zhou, Q., Xie, P., Xu, J., Ke, Z., Guo, L. Growth and food availability of silver and bighead carps: Evidence from stable isotope and gut content analysis. Aquaculture Research. 40 (14), 1616-1625 (2009).
- Freedman, J. A., Butler, S. E., Wahl, D. H. . Impacts of invasive Asian carps on native food webs (Final Report). , (2012).
- Nico, L., Fuller, P., Li, J. . Silver carp (Hypophthalmichthys molitrix)-FactSheet. , (2017).
- Walleser, L., Howard, D., Sandheinrich, M., Gaikowski, M., Amberg, J. Confocal microscopy as a useful approach to describe gill rakers of Asian species of carp and native filter-feeding fishes of the upper Mississippi River system. Journal of Fish Biology. 85 (5), 1777-1784 (2014).
- Nelson, A. Z., Ewoldt, R. H. Design of yield-stress fluids: a rheology-to-structure inverse problem. Soft Matter. 13, 7578-7594 (2017).
- Chen, T. Rheological Techniques for Yield Stress Analysis. TA Instruments Applications Note, RH025. , (2020).
- Ewoldt, R. H., Johnston, M. T., Caretta, L. M., Spagnolie, S. Experimental challenges of shear rheology: how to avoid bad data. Complex Fluids in Biological Systems. , (2015).
- Thornton, D. J., Sheehan, J. K. From Mucins to Mucus: Toward a more coherent understanding of this essential barrier. Proceedings of the American Thoracic Society. 1, 54-61 (2004).
- Shepard, K. L. Functions for fish mucus. Reviews in Fish Biology and Fisheries. 4, 401-429 (1994).
- Fernández-Alacid, L., et al. Skin mucus metabolites in response to physiological challenges: A valuable non-invasive method to study teleost marine species. Science of the Total Environment. 644, 1323-1335 (2018).
- Wagner, C. E., Wheeler, K. M., Ribbeck, K. Mucins and Their Role in Shaping the Functions of Mucus Barriers. Annual Reviews in Cell and Developmental Biology. 34, 189-215 (2018).
- Bird, R. B., Armstrong, R. C., Hassager, O. . Dynamics of Polymeric Liquids, Volume 1: Fluid Mechanics. , 1255-1284 (1987).
- Mantle, M., Allen, A. Isolation and characterisation of the native glycoprotein from pig small intestinal mucus. Biochemical Journal. 195, 267-275 (1981).
- Allen, A., Hutton, D. A., Pearson, J. P., Sellers, L. A., Nugent, J., O'Conner, M. Mucus glycoprotein structure, gel formation and gastrointestinal mucus function. Mucus and Mucosa (Ciba Foundation Symposium). , 137-156 (1984).
- Asakawa, M. Histochemical studies of the mucus on the epidermis of eel, Anguillajaponica. Bulletin of Japanese Society of Scientific Fisheries. 36, 83-87 (1970).
- Fletcher, T. C., Jones, R., Reid, L. Identification of glycoproteins in goblet cells of epidermis and gill of plaice (Pleuroneces platessa L.), flounder (Platichthys flesus (L.)) and rainbow trout (Salmo gairdneri Richardson). Histochemical Journal. 8, 597-608 (1976).
- Silberberg, A. Mucus glycoprotein, its biophysical and gel forming properties. Symposia of the Society for Experimental Biology. 43, 43-64 (1989).
- Hills, B. . The Biology of Surfactants. , 408 (1988).
- Aubert, H., Brook, A. J., Shephard, K. L. Measurement of the adhesion of a desmid to a substrate. British Phycology Journal. 24, 293-295 (1989).
- Sanderson, S. L., Cech, J. J., Patterson, M. R. Fluid dynamics in suspension feeding black fish. Science. 251, 1346-1348 (1991).
- Lai, S. K., Wang, Y. Y., Wirtz, D., Hanes, J. Micro- and macrorheology of mucus. Advanced Drug Delivery Reviews. 61 (2), 86-100 (2009).
- Chaudhary, G., Ewoldt, R. H., Thiffeault, J. L. Unravelling hagfish slime. Journal of Royal Society Interface. 16 (150), 20180710 (2019).
- Downing, S., Salo, W., Spitzer, R., Koch, E. The hagfish slime gland: a model system for studying the biology of mucus. Science. 214, 1143-1145 (1981).
- Hwang, S. H., Litt, M., Forsman, W. C. Rheological properties of mucus. Rheologica Acta. 8, 438-448 (1969).
- Litt, M. Mucus rheology. Archives of Internal Medicine. 126, 417-423 (1970).
- Quarishi, M. S., Jones, N. S., Mason, J. The rheology of nasal mucus: a review. Clinical Otolaryngology. 23, 403-413 (1998).
- Nordgård, C. T., Draget, K. I., Seternes, T. Rheology of salmon skin mucus. Annual Transactions - The Nordic Rheology Society. 23, 175-179 (2015).
- Fernández-Alacid, L., et al. Comparison between properties of dorsal and ventral skin mucus in Senegalese sole: Response to an acute stress. Aquaculture. 513, 734410 (2019).
- Yüce, C., Willenbacher, N. Challenges in Rheological Characterization of Highly Concentrated Suspensions - Case Study for Screen-printing Silver Pastes. Journal of Visualized Experiments. (122), e55377 (2017).
- Sultan, S., Mathew, A. P. 3D Printed Porous Cellulose Nanocomposite Hydrogel Scaffolds. J. Vis. Exp. (146), (2019).
- Barnes, H. A., Hutton, J. F., Walters, K. . An Introduction to Rheology. , (1989).
- USGS Current Conditions for USGS 06910450 Missouri River at Jefferson City, MO. U.S. Geological Survey Available from: https://nwis.waterdata.usgs.gov/usa/nwis/uv/?cb_00010=on&cb_00060=on&cb_00065=on&format=gif_default&site_no=0691045&p09-19&end_date=2018-09-21 (2020)
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados