A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطوير قطاع كروماتوغرافي للتدفق الجانبي للكشف السريع والكمي عن مركبات الجزيئات الصغيرة
* These authors contributed equally
In This Article
Abstract
تعد الشرائط المناعية للتدفق الجانبي القائمة على الأغشية (ICSs) أدوات مفيدة للتشخيص الذاتي منخفض التكلفة وتم تطبيقها بكفاءة على السموم والمؤشر الفسيولوجي والكشف عن العلامات الحيوية السريرية. في هذا البروتوكول، نقدم وصفا مفصلا للخطوات اللازمة لتطوير مناعة التدفق الجانبي السريع والحساسة والكمية (باستخدام AuNPs كعلامة و mAbs كمسبار). يصف الإجراء إعداد وتوصيف الذهب الغرواني ، وتركيب اقتران AuNP-mAb ، وتجميع الشريط المناعي ، والتحقيق المنهجي للمقايسة. وأظهرت النتائج أنه يمكن مواصلة استخدام الشرائط النهائية للتشخيص الذاتي السريع والمريح لجزيء صغير، مما قد يوفر أداة بديلة في التحليل السريع والدقيق للمؤشرات الفسيولوجية والبيولوجية.
Introduction
تعد شرائط التدفق المناعي الجانبي القائمة على الأغشية (ICSs) أدوات مفيدة للكشف المنخفض التكلفة والسريع. غشاء النيتروسليلوز كالناقل والذهب الغرواني كعلامات للكواشف التشخيصية السريعة الكروماتوغرافيا المناعية هي الطريقة الأكثر استخداما POCT (اختبار نقطة الرعاية) ، ونطاق اختبار المشروع أوسع. من تطبيقها الأصلي في رصد أثناء الحمل، وقد تم تمديد استخدامها لرصد حالةتخثرالدم 1،2، إصابة عضلة القلب3، الطب البيطري4، بقايا المبيداتالحشرية 5، الأمراض المعدية6 وتركيزات المخدرات. يمكن تقييم أنواع أكثر من العينات، بما في ذلك البول واللعاب والدم كله والمصل وسوائل الجسم الأخرى7و8و9.
في السنوات الأخيرة، تم تطوير العديد من المقايسات الجديدة للكشف عن المؤشرات الحيوية في تشخيص الاضطرابات، بما في ذلك HPLC، UPLC، LC-MS و ELISA، والتي هي حساسة ودقيقة وموثوقة ومحددة. ومع ذلك ، تتطلب هذه الأساليب أجهزة متطورة ومعالجة مسبقة معقدة وعلاجات تستغرق وقتا طويلا9. وبالتالي ، فإن تطوير استراتيجية تشخيصية أكثر سرعة وملاءمة في نقطة الرعاية للكشف الذاتي والحقيقي عن المركبات الطبية النشطة أمر عاجل10،11.
شعبية ICSs ، وخاصة بالنسبة للاختبارات الشائعة ، مدفوعة بسهولة استخدامها ، لأنها لا تتطلب محترفين أو إعداد مفيد مفصل12. وبعبارة أخرى، يمكن للأشخاص الذين ليس لديهم تدريب خاص تشغيل شرائط أو الاختبارات الذاتية13. يمكن الحصول على نتائج الاختبار في 5 دقائق، مما يعني أنه يمكن استخدامه لعمليات التفتيش الموقع14. وعلاوة على ذلك، وفقا لحساباتنا، يمكن أن تكون تكلفة شرائط أقل من 1 يوان15،مما يعني أن الاختبارات غير مكلفة لتعزيز16. وبالتالي ، فإن ICS هو جهاز دقيق نسبيا وبسيط وغير مكلف يمكن التخلص منه. ICSs على أساس الذهب الغرواني17،18 كما يتم تطبيقها في الكشف السريع COVID - 19.
يمكن تقسيم مبدأ ICS إلى ساندويتش ICS وICS تنافسية. الشكل 1A هو مخطط تخطيطي للساندويتش ICS ، والذي يستخدم بشكل رئيسي للكشف عن المواد الجزيئية الكلية مثل البروتينات ، بما في ذلك علامات الورم ، والعوامل الالتهابية ، وغدد الغدد الغذائية المشيمية البشرية (HCG ، مستضد الحمل المبكر). في هذه الطريقة ، يتم استخدام الأجسام المضادة المقترنة التي تستهدف epitopes مختلفة من المستضد ، ويتم تجفيف الجسم المضاد التقاط على غشاء NC كخط اختبار. يتم تجفيف الأجسام المضادة المسماة على اللوحة المصاحبة ، ويستخدم الجسم المضاد الثانوي كخط تحكم.
الشكل 1B هو مخطط تخطيطي لICS التنافسية، والذي يستخدم أساسا للكشف عن المواد جزيء صغير (MWCO < 2000 دا). يتم إصلاح مستضد الطلاء على غشاء NC كخط اختبار ، ويتم تجفيف الجسم المضاد المسمى على اللوحة المصاحبة. أثناء الكشف ، تتدفق العينة والأجسام المضادة المسماة عبر خط الكشف تحت إجراء الشعرية ، ويربط المستضد المغلف بشكل تنافسي مستضد مجاني في العينة ويطور لونا أحمر على خط الكشف.
في الآونة الأخيرة ، وصفنا إجراء توليد الأجسام المضادة أحادية النسيلة ضد المنتجاتالطبيعية 19. في هذا العمل، قمنا بتطوير اختبار مناعي تدفق الجانبية رواية على أساس أعدت المضادة SSD MA20 للكشف السريع، في الموقع. وتشير النتائج إلى أن فحص الكروماتوغرافيا المناعية أداة لا غنى عنها ومريحة للكشف عن المركبات الطبيعية المشتقة من المنتجات.
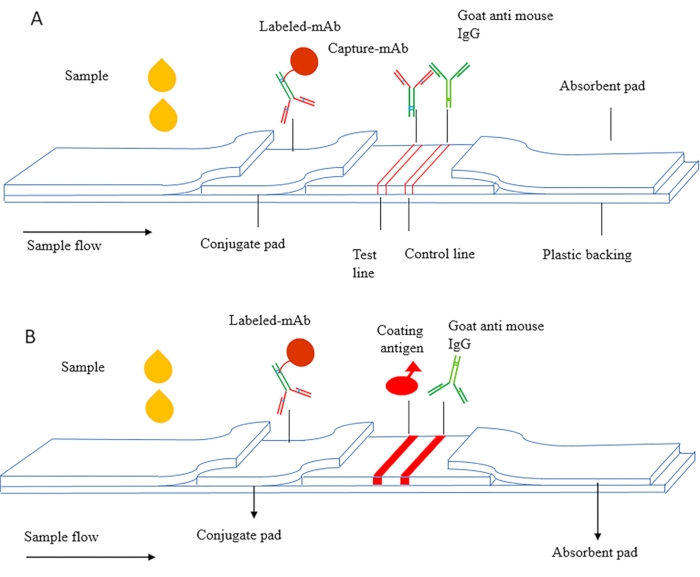
الشكل 1 الرسم التخطيطي للمقايسة immunochromatography (أ) ساندويتش شرائط اختبار immunochromatographic. (ب) شرائط اختبار كروماتوغرافية المناعة التنافسية غير المباشرة. تم تعديل هذا الرقم من تشانغ وآخرون., 201821. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تمت الموافقة على جميع الإجراءات التي أجريت في هذه الدراسة من قبل لجنة مراجعة الأخلاقيات في جامعة بكين للطب الصيني (رقم الموافقة 2017BZYYL00120).
1. إعداد وتوصيف الذهب الغرواني
ملاحظة: بالنسبة لتركيب الذهب الغرواني ، حيث يتم امتصاص الذهب الغرواني بسهولة على الجدار الداخلي للوعاء وعرضة لهطول الأمطار بسبب الشوائب ، يجب تنظيف وعاء تخليق وتخزين الذهب الغرواني بدقة ونقعه في الحمض (40 مل من الماء المقطر ، و 360 مل من حمض الكبريتيك المركز ، أو 20 جراما من ثنائي كرومات البوتاسيوم) أو التعرض لعلاج التمريض السطحي. تم استخدام طريقة للحد من حمض الستريك لتجميع الذهب الغرواني.
- بدوره على stirrer المغناطيسي ووضع قارورة (250 مل) على خلاط.
- إعداد 4٪ محلول حمض كلوريد الذهب و 1٪ محلول سيترات الصوديوم، على التوالي.
- أضف 120 مل من الماء المقطر إلى قارورة قاع مستديرة وسخنيها حتى تغلي على ستيرر المغناطيسي الحراري.
- استمر في الغليان، وأضف بسرعة 0.5 مل من حمض الكلورواريك بنسبة 4٪ و5 مل من سترات الصوديوم بنسبة 1٪.
- مراقبة لون الحل. حل حمض الكلورواريك الأصفر الشاحب يحول النبيذ الأحمر في غضون بضع دقائق.
- استمر في التدفئة لمدة 10 دقائق، حتى يتغير الحل من اللون إلى الأحمر الشفاف.
- إيقاف تشغيل قوة خلاط المغناطيسي الحرارة، بارد لدرجة حرارة الغرفة، ونقل الخليط إلى زجاجة نظيفة. تخزينه عند 4 °C.
- تحديد حجم ومورفولوجيا من AuNPs عن طريق التحليل الطيفي فوق البنفسجي والتصوير TEM.
ملاحظة: يمكن الحصول على أحجام مختلفة من جزيئات الذهب الغروانية لمختلف التطبيقات عن طريق تغيير نسبة سيترات الصوديوم وحمض الكلورواريك.
2. توليف أونبس-ماب مترافق
ملاحظة: منذ الأجسام المضادة ربط الذهب الغرواني عن طريق الامتزاز الكهروستاتيكي, التهم على سطح البروتينات والذهب الغرواني تؤثر تأثيرا مباشرا على كثافة الربط; لذلك، قيمة رقم الحموضة المخزن المؤقت عامل هام يؤثر على استقرار الذهب الأجسام المضادة الغروية اقتران. SSD و mAbs مكافحة SSD تستخدم كأمثلة في هذا البروتوكول.
- تقييم اقتران pH
- إضافة 100 ميكرولتر من محلول NaCl (10٪ م / v) في ثمانية أنابيب.
- ضبط حلول AuNP عند درجة الحموضة 5 و6 و7 و8 و9 و10 و11 و12 مع 0.1 M K2CO3.
- إضافة 100 ميكرولتر من محلول الذهب الغرواني (درجة الحموضة المعدلة 5-12) إلى ثمانية أنابيب تحتوي على NaCl.
- السماح للحلول بالوقوف لعدة دقائق بعد المزج. مراقبة تغيير لون كل حل أنبوب، وتسجيل الأنبوب الذي لا يزال أحمر.
- اختر قيمة درجة الحموضة مع أقل إضافة من K2CO3 ولون الحل مستقرة كقيمة درجة الحموضة الأمثل لإعداد الاتحاد الافريقي-mAb المصاحبة.
ملاحظة: لا تستخدم مقياس pH لأن probe قد يتم إتلاف بواسطة AuNPs.
- تقييم كمية الأجسام المضادة
- أضف 100 ميكرولتر من محلول NaCl (10٪ م/v) إلى ثمانية أنابيب.
- إضافة 100 ميكرولتر من محلول الذهب الغرواني مع درجة الحموضة الأمثل لكل أنبوب.
- إضافة حلول الأجسام المضادة أحادية النسيلة (تركيز البروتين 0.1 ملغم/مل-3.2 ملغم/مل) إلى الأنابيب الثمانية المذكورة أعلاه.
- السماح للحلول بالوقوف لعدة دقائق بعد المزج. مراقبة تغيير لون كل حل أنبوب، وتسجيل الأنبوب الذي لا يزال أحمر.
- اختيار كمية الأجسام المضادة مع أدنى تركيز من mAb ولون الحل مستقرة كما كمية mAb الأمثل لإعداد الاتحاد الافريقي-mAb المصاحبة.
- إعداد المخزن المؤقت لإعادة الإنفاق: إضافة 1 M Tris-HCl (pH 8.8) و 1٪ (ث/v) BSA و 0.5٪ (v/v) توين 20 و 1٪ (v/v) PEG 20000 ومزج جيدا.
- توليف AuNP-mAb اقتران
- خذ 10 مل من محلول الذهب الغرواني واستخدم 0.1 M K2CO3 لضبط الحل إلى القيمة المثلى ل درجة الحموضة.
- أضف ببطء سعات SSD بتركيزات مناسبة وهز في درجة حرارة الغرفة لمدة 30 دقيقة.
- طارد مركزي الخليط في 83 × ز (1000 دورة في الدقيقة) لمدة 10 دقائق في 4 درجة مئوية. إزالة الراسب، الذي يحتوي على الشوائب أو الذهب الغرواني عجلت.
- طاردة مركزية الخليط في 8,330 x g (10,000 دورة في الدقيقة) لمدة 30 دقيقة في 4 °C. تجاهل supernatant، والراسب هو الذهب الغروانية-mAb المصاحبة.
- إضافة المخزن المؤقت لإعادة الإنفاق إلى فصل هطول الأمطار.
3. جمعية القطاع
ملاحظة: بالنسبة للاختبارات المناعية للتدفق اللاحق ، سيؤثر اختيار المواد الغشائية وال معالجتها مسبقا بشكل مباشر على الاختبار ، والذي يجب التحقيق فيه. يتكون الشريط المناعي من لوحة عينة، ولوحة مترافقة، وغشاء نيتروسيلولوس (NC)، ولوحة ماصة ولوح PVC(الشكل 1). يجب فحص المواد الغشائية وتقييمها عن طريق التجسم للقضاء على التجانس.
- لصق غشاء NC على لوحة PVC 2 سم وبصرف النظر عن حافة نهاية شفط المجلس.
- إضافة SSD-BSA (2 ملغم/مل) بشكل إسقاطي إلى غشاء NC (2 سم بصرف النظر عن الحافة العليا) كخط اختبار (بعرض 1 مم)، وإضافة IgG مضاد للماوس من الماعز (1.5 ملغم/مل) بشكل إسقاطي على غشاء NC (2 سم بعيدا عن الحافة السفلية) كخط تحكم (بعرض 1 مم). السيطرة على كمية البروتين المضافة.
- إرفاق لوحة ماصة إلى ورقة PVC فوق غشاء NC وتداخلها مع غشاء NC من قبل 2 مم.
- غمر غشاء الألياف الزجاجية في محلول AuNPs-mAb المصاحب. جفف الغشاء الرطب في حاضنة عند 37 درجة مئوية.
- تقليم غشاء الألياف الزجاجية إلى 5 سم طويلة و 2 سم واسعة واستخدامه كوسادة مترافقة.
- الصق لوحة اقتران المعالجة مسبقا تحت غشاء NC. يجب أن يكون طول التداخل مع غشاء NC 0.1 سم.
ملاحظة: غشاء الألياف الزجاجية لديه قدرة قوية على ربط وإطلاق البروتينات. - تقليم الانصهار 3 غشاء إلى 1.8 سم طويلة و3.5 سم واسعة واستخدامه كوسادة العينة.
- لصق لوحة عينة على لوحة PVC وتداخلها مع لوحة اقتران من قبل 2 ملم.
- اقطع لوحة الورق المجمعة إلى شرائح بعرض 3.5 مم باستخدام آلة قطع وضغطها باستخدام نظام صفح دفعي.
- وأخيرا، ضع شرائط الاختبار في القشرة، وختمها في كيس رقائق الألومنيوم التي تحتوي على المجففة، وتخزينها بعيدا عن الضوء. يتم تجميع ICSs الآن.
ملاحظة: ما ورد أعلاه هو الإجراء المختبري. في الإنتاج، وتستخدم معدات رش الذهب والأدوات عبر الأغشية لرش الذهب وجعل خطوط T و C.
4. الكشف الكمي
- إسقاط 50 ميكرولتر من محلول العينة على ثقب العينة لمراقبة عملية الكروماتوغرافيا.
ملاحظة: نتيجة للعمل الشعرية مدفوعة لوحة ماصة، حل عينة يهاجر إلى الطرف الآخر من الشريط. عندما يصل حل العينة إلى اللوحة المقترنة، يتفاعل SSD (مستضد) في العينة مع AuNPs-mAb المحمل مسبقا على اللوحة. عندما يهاجر الحل ويصل إلى خط T ، يمكن التقاط AuNPs-mAb بدون SSD بشكل انتقائي من قبل SSD-BSA (اقتران البروتين الناقل للمضاد) ، ويظهر كلون أحمر على الخط T. ثم ينتقل الحل إلى خط C، حيث يتم التقاط AuNPs-mAb بواسطة IgG المضادة للفأرة من الماعز في المنطقة، وبالتالي تظهر كلون أحمر على خط C. - تحليل الشرائط مع قارئ الشريط المحمولة. يمكن للجهاز توفير نسبة خط الاختبار إلى خط التحكم (T/C).
- تقييم خصوصية وحساسية وتكرار واستقرار اختبار ICS.
ملاحظة: ضمن الكشف النوعي، يشير خط أحمر واحد إلى نتيجة إيجابية (خط التحكم). يشير خطان أحمران إلى نتيجة سالبة (خطوط الاختبار والتحكم). إذا لم يكن خط التحكم موجودا، يعتبر الاختبار غير صالح.
النتائج
توصيف الذهب الغرواني
وكانت الحلول الذهبية الغروية المعدة كلاريت الأحمر. واستخدمت تحليلات TEM لتحديد مورفولوجيا وشكل الملوثات المضادة للنواة(الشكل 2A-D). الشكل 2A والشكل 2B تكشف عن أن الجسيمات متعددة الهدنة في الشكل وتوزيعها...
Discussion
في هذا العمل، نقدم بروتوكولا لإعداد mAbs ضد الجزيئات الصغيرة المشتقة من المنتجات الطبيعية. وقد تم تحديد الخطوات الأساسية والمسائل التي تحتاج إلى اهتمام في الإجراء، وقد أظهرنا فائدة هذا البروتوكول باستخدام جزيء صغير SSD كمثال. وترد في البيانات التمثيلية أطياف المثال وصور TEM والنتائج الكمية و...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد دعم هذا العمل الصندوق الخاص لصناديق البحوث الأساسية التابع لمؤسسات التعليم العالي المنتسبة إلى الإدارات المركزية. ونحن نقدر دعم الكلاسيكية وصفة طبية فريق البحوث الأساسية من جامعة بكين للطب الصيني.
Materials
| Name | Company | Catalog Number | Comments |
| Chloroauric acid solution (HAuCl4) | Tianjin Fu Chen Chemical Reagents Factory | JY-SJ102 | |
| bovine serum albumin | AMRESCO | 332 | |
| centrifuge tube 15 mL | Corning | 430645 | |
| centrifuge tube 50 mL | Corning | 430828 | |
| ELISA plates, 96 well | NUNC | 655101 | |
| Filter paper | Sinopharm | H5072 | |
| Glass fibre membranes | Jieyi | XQ-Y6 | |
| goat-anti-mouse IgG antibody | applygen | C1308 | |
| Nitrocellulose membranes | Millipore | millipore 180 | |
| ovalbumin | Beijing BIODEE | 5008-25g | |
| PEG20000 | Sigma Aldrich | RNBC6325 | |
| Pipette 10mL | COSTAR | 4488 | |
| Pipette 25mL | FALCON | 357525 | |
| semi-rigid PVC sheets | Jieyi | JY-C104 | |
| Sodium citrate | Beijing Chemical Works | C1034 | |
| sodium periodate | Sinopharm Chemical | BW-G0008 | |
| Sulfo-GMBS | Perbio Science Germany | 22324 | |
| TipOne Tips 1,000 µL | Starlab | S1111-2021 | |
| Tris-HCl | Solarbio | 77-86-1 | |
| TWEEN 20 | Solarbio | 9005-64-5 |
References
- Huang, X., et al. Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection: A review. Biosensors and Bioelectronics. 75, 166-180 (2016).
- Chang, H. -. F., Wang, J. -. Q., Wang, B., Deng, A. -. P. An immune chromatographic assay for rapid and simultaneous detection of levonorgestrel and methylprednisolone in water samples. Chinese Chemical Letters. 24 (10), 937-940 (2013).
- Lai, J. J., Stayton, P. S. Improving lateral-flow immunoassay (LFIA) diagnostics via biomarker enrichment for mHealth. Methods in Molecular Biology. 1256, 71-84 (2015).
- Zhang, M. Z., et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Analytical & Bioanalytical Chemistry. 395 (8), 2591-2599 (2009).
- Kranthi, K. R., et al. Development of a colloidal-gold based lateral-flow immunoassay kit for 'quality-control' assessment of pyrethroid and endosulfan formulations in a novel single strip format. Crop Protection. 28 (5), 428-434 (2009).
- Qian, K., et al. Development and evaluation of an immunochromatographic strip for rapid detection of capsid protein antigen p27 of avian leukosis virus. Journal of Virological Methods. (221), 115-118 (2015).
- Guo, H., et al. Lateral flow immunoassay devices for testing saliva and other liquid samples and methods of use of same. US Patent. , (2003).
- Miočević, O., et al. Quantitative Lateral Flow Assays for Salivary Biomarker Assessment: A Review. Frontiers in Public Health. 5, 1-13 (2017).
- Lisa, M., et al. Gold nanoparticles based dipstick immunoassay for the rapid detection of dichlorodiphenyltrichloroethane: an organochlorine pesticide. Biosensors and Bioelectronics. 25 (1), 224-227 (2009).
- Zhang, Z., et al. Monoclonal Antibody-Europium Conjugate-Based Lateral Flow Time-Resolved Fluoroimmunoassay for Quantitative Determination of T-2 Toxin in Cereals and Feed. Analytical Methods. 7 (6), 2822-2829 (2015).
- Shen, H., et al. Facile synthesis of high-quality CuInZnxS2+x core/shell nanocrystals and their application for detection of C-reactive protein. Journal of Materials Chemistry. 22 (35), 18623-18630 (2012).
- Xiang, T., et al. A novel double antibody sandwich-lateral flow immunoassay for the rapid and simple detection of hepatitis C virus. International Journal of Molecular Medicine. 30 (5), 1041-1047 (2012).
- Yang, Q., et al. Quantum dot-based immunochromatography test strip for rapid, quantitative and sensitive detection of alpha fetoprotein. Biosensors & Bioelectronics. 30 (1), 145 (2011).
- Song, L. W., et al. Rapid fluorescent lateral-flow immunoassay for hepatitis B virus genotyping. Analytical Chemistry. 87, 5173-5180 (2015).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of GsRerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Li, Z., et al. Development and Clinical Application of a Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. Journal of Medical Virology. 92 (9), (2020).
- Xiaomei, L., Jing, W., Ya, Z. The clinical application value analysis of the 2019-coronary virus disease was analyzed by the whole blood Sars-COV 2 specific antibody detection. Natural Science Edition. 42, (2020).
- Zhang, Y., et al. Generation of Monoclonal Antibodies Against Natural Products. Journal of Visualized Experiments. , e57116 (2019).
- Sai, J., et al. Development of an Enzyme-Linked Immunosorbent Assay and Immunoaffinity Column Chromatography for Saikosaponin d Using an Anti-Saikosaponin d Monoclonal Antibody. Planta Medica. 82, 432-439 (2016).
- Yue, Z., et al. A Highly Sensitive Immunochromatographic Strip Test for Rapid and Quantitative Detection of Saikosaponin d. Molecules. 23 (2), 338 (2018).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of Puerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved