このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
バイオサーファクタントの組み合わせを使用したオイル回収の強化
要約
我々は、バイオサーファクタント産生微生物のスクリーニングおよび同定に関与する方法を例示する。バイオサーファクタントのクロマトグラフィー特性評価および化学的同定のための方法、残留油回収の増強におけるバイオサーファクタントの産業的利用可能性の決定も提示される。
要約
バイオサーファクタントは、極性の異なる2つの相間の表面張力を低下させることができる界面活性化合物である。バイオサーファクタントは、毒性が低く、生分解性が高く、環境適合性があり、極端な環境条件に対する耐性があるため、化学界面活性剤の有望な代替品として浮上しています。ここでは、バイオサーファクタントを産生し得る微生物のスクリーニングに用いられる方法を例示する。バイオサーファクタント産生微生物を、ドロップ崩壊、油拡散、およびエマルジョンインデックスアッセイを用いて同定した。バイオサーファクタント産生は、微生物メンバーの増殖による培地の表面張力の低下を決定することによって検証した。また、バイオサーファクタントの特性評価および同定に関与する方法についても説明します。抽出されたバイオサーファクタントの薄層クロマトグラフィー、続いてプレートの示差染色を行い、バイオサーファクタントの性質を決定した。LCMS、 1HNMR、およびFT-IRを用いて、バイオサーファクタントを化学的に同定した。我々はさらに、シミュレートされたサンドパックカラムにおける残留油回収率を高めるための産生されたバイオサーファクタントの組み合わせの適用を評価するための方法を例示する。
概要
バイオサーファクタントは、微生物によって産生される両親媒性界面活性分子であり、2つの相間の表面および界面張力を低下させる能力を有する1。典型的なバイオサーファクタントは、通常、糖部分またはペプチド鎖または親水性アミノ酸から構成される親水性部分と、飽和または不飽和脂肪酸鎖2から構成される疎水性部分とを含む。その両親媒性の性質のために、バイオサーファクタントは2つの相の間の界面で集合し、境界における界面張力を低下させ、1つの相の他方の相への分散を促進する1,3。これまでに報告されている様々なタイプのバイオサーファクタントには、炭水化物がエステル結合を介して長鎖脂肪族またはヒドロキシ脂肪族酸に連結された糖脂質(例えば、ラムノリピッド、トレハロ脂質およびソホロリピッド)、脂質がポリペプチド鎖に結合しているリポペプチド(例えば、サーファクチンおよびリケニシン)、および通常、多糖−タンパク質複合体(例えば、 エムルサン、リポサン、アラサンおよびリポマンナン)4。微生物によって産生される他のタイプのバイオサーファクタントには、脂肪酸、リン脂質、中性脂質、および粒子状のバイオサーファクタント5が含まれる。バイオサーファクタントの最も研究されたクラスは糖脂質であり、その中でほとんどの研究はラムノリピッド6について報告されている。ラムノ脂質は、1分子または2分子の長鎖脂肪酸(通常はヒドロキシデカン酸)に連結されたラムノース(親水性部分を形成する)の1つまたは2つの分子を含有する。ラムノ脂質は、緑膿菌7から最初に報告された一次糖脂質である。
バイオサーファクタントは、それらが提供する様々なユニークで独特の特性のために、化学的対応物と比較してますます注目を集めています8.これらには、より高い特異性、より低い毒性、より大きな多様性、調製の容易さ、より高い生分解性、より良い発泡性、環境適合性および極端な条件下での活性が含まれる9。バイオサーファクタントの構造的多様性(図S1)は、それらに化学的対応物10に対する優位性を与える別の利点である。それらの臨界ミセル濃度(CMC)は通常、化学界面活性剤11よりも数倍低いので、それらは一般に、より低い濃度でより効果的かつ効率的である。それらは非常に耐熱性(最大100°C)であり、より高いpH(最大9)および高い塩濃度(最大50g / L)に耐えることができると報告されており12 、それによって極端な条件への曝露を必要とする工業プロセスにおいていくつかの利点を提供する13。生分解性と毒性が低いため、バイオレメディエーションなどの環境用途に適しています。彼らが提供する利点のために、彼らは食品、農業、洗剤、化粧品、石油産業のような様々な産業でますます注目を集めています11。バイオサーファクタントはまた、石油汚染物質および有毒汚染物質を除去するための油修復において多くの注目を集めている14。
ここでは、 Rhodococcus sp. IITD102、 Lysinibacillus sp. IITD104、およびPaenibacillus sp. IITD108によって産生されたバイオ サーファクタ ントの産生、特性評価、および適用を報告する。強化された油回収のためのバイオサーファクタントの組み合わせのスクリーニング、特性評価、および適用に関連するステップを 図1に概説する。
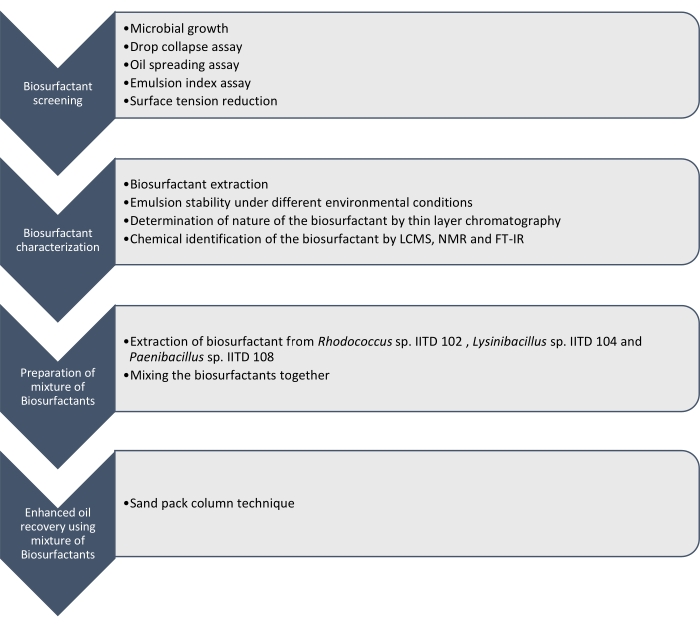
図1:バイオサーファクタントの組み合わせを使用した油回収率を高める方法。 ステップワイズなワークフローが表示されます。作業は4段階で行った。まず、微生物株を培養し、ドロップ崩壊アッセイ、油拡散アッセイ、エマルジョンインデックスアッセイ、および表面張力測定を含む様々なアッセイによってバイオサーファクタントの産生についてスクリーニングした。次いで、バイオサーファクタントを無細胞ブロスから抽出し、その性質を薄層クロマトグラフィーを用いて同定し、LCMS、NMR、およびFT-IRを用いてさらに同定した。次のステップでは、抽出されたバイオサーファクタントを一緒に混合し、得られた混合物の油回収率を高める可能性をサンドパックカラム技術を用いて決定した。 この図の拡大版を表示するには、ここをクリックしてください。
バイオサーファクタントを産生するこれらの微生物株のスクリーニングは、微生物の増殖による無細胞培地の表面張力の低下のドロップ崩壊、油拡散、エマルジョンインデックスアッセイおよび決定によって行われた。バイオサーファクタントを抽出し、特徴付け、LCMS、 1HNMR、およびFT-IRによって化学的に同定した。最後に、これらの微生物によって産生されるバイオサーファクタントの混合物を調製し、シミュレートされた砂パックカラムで残留油を回収するために使用した。
本研究は、残留油回収率を高めるためのバイオサーファクタント組合せのスクリーニング、同定、構造特性評価、および適用に関与する方法のみを示している。微生物株15、16によって産生されるバイオサーファクタントの詳細な機能的特徴付けを提供していない。任意のバイオサーファクタントの詳細な機能特性評価のために、臨界ミセル決定、熱重量分析、表面濡れ性、および生分解性などの様々な実験が行われる。しかし、この論文は方法論文であるため、残留油回収を促進するためのバイオサーファクタントの組み合わせのスクリーニング、同定、構造特性評価、および適用に焦点を当てています。これらの実験はこの研究には含まれていない。
プロトコル
1. 微生物株の増殖
- ルリアブロス粉末2gの重量を量り、250mL円錐フラスコに50mLの蒸留水を加える。粉末が完全に溶解するまで内容物を混合し、蒸留水を使用して体積を100mLにする。
- 同様に、100mLのルリアブロスのフラスコをさらに2つ準備し、フラスコの首に綿のプラグを置きます。
- 綿のプラグをアルミホイルで覆い、フラスコを121°Cおよび15psiで15分間オートクレーブして媒体を滅菌する。
- オートクレーブ処理後、メディアを室温まで冷却します。
- 菌株の初代培養物の調製のために、接種ループを用いてLAプレートから単一のコロニーを選び、5mLの滅菌ルリアブロスを含む試験管に接種する。
- 試験管を180rpmで30°Cで一晩インキュベートする。
- 100mLのオートクレーブ処理されたルリアブロスを含むフラスコに、一晩成長させた種子培養物1mLを層流キャビネット内のフラスコに加えることによって接種する。
- フラスコをロータリーインキュベーター中で30°Cおよび180rpmで7日間インキュベートする。
- インキュベーション期間の終了後、フラスコを回収し、培養液を遠沈管に移す。培養物を4,500 x g で4°Cの冷蔵遠心分離機で20分間遠心分離する。
- 無細胞上清を新鮮なビーカーに穏やかに注ぎ、バイオサーファクタント産生のスクリーニングアッセイに使用します。
2. バイオサーファクタント生産のためのスクリーニングアッセイ
注:以下のセクションでは、市販の界面活性剤(サポニン)を陽性対照として使用し、水および非接種培地を陰性対照として使用した。
- ドロップコラプスアッセイ
- 清潔なスライドガラスを取り、スライドの表面を200μLの油でコーティングします。
- 20μLの無細胞上清を油の中心に加え、2〜3分間邪魔されずに放置する。
注:滴が崩壊した場合は、上清をバイオサーファクタントの存在について陽性と評価してください。
- 油拡散アッセイ
- ペトリプレート(直径75mm)に20mLの二重蒸留水をとり、水面に200μLの原油を加える。
- 20 μLの無細胞上清を油の中心に加え、1分間邪魔されずに放置する。
注:油の変位のためにクリアリングゾーンが形成された場合は、バイオサーファクタントの存在について上清を陽性と評価します。
- エマルジョンインデックスアッセイ(E24 アッセイ)
- ガソリン(ガソリン)と無細胞の上澄み液をそれぞれ4mLを清潔なガラス試験管に加える。
- 混合物を3分間激しく渦巻き、次の24時間邪魔しないでおきます。
- 24時間後、液カラム全体の高さ(cm)に対する乳化層の高さ(cm)の割合としてE24 指数を求める。
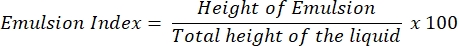
注:24時間後にエマルジョン(水中の油分または油中の水)が観察された場合、上清にはバイオサーファクタントが含まれている可能性があります。
- 表面張力測定
注:表面張力は、デュノイリング法17を用いて測定した。この実験で使用した機器( 材料表を参照)は非常に敏感なので、ガラス容器とプローブを適切に洗浄してください。- システムの電源を入れ、関連するソフトウェアをダブルクリックして開きます。
- 表面張力が決定される液体でガラス容器をきれいにしなさい。
- 液体(40mL)を容器に加え、容器ホルダーに容器を取り付ける。
- プローブホルダーのロックを解除し、プローブを取り付けます。次に、手動コントローラのロックボタンを押してプローブホルダーを ロック します。
- 手動コントローラーを使用して、プローブが液体の表面から約 2 ~ 3 mm 離れるようにプラットフォームの高さを調整します。
- 次に、ソフトウェアを使用して表面張力を測定します。画面の左上のパネルにある [ファイル ]をクリックします。「 ワークスペースを開く」をクリックします。ポップアップウィンドウが表示されます。
- 下にスクロールし、 K100をダブルクリックします:表面と界面張力 アイコン。
- 次に、画面の左上隅にある [ファイル ]アイコンをクリックします。[ 新しいデータベース]をクリックします。データを保存する名前を入力し、[ OK]をクリックします。
- もう一度、[ ファイル>新しい測定>SFT>リング]をクリックします。測定の名前を入力します。構成テンプレートに SFT リングが表示されていることを確認します。
- 「測定 構成」 ウィンドウに詳細を入力するには、測定に使用するプローブと容器を選択します。また、液相と気相の詳細を記入してください。
注:液相は水で、気相は空気です。液相の密度は、無細胞上清の密度である。これは、液体の50mLの重量を取り、密度をKg/m3として計算することによって決定することができる。 - 次に、[ 手順] タブをクリックして、次の詳細を入力します:検出速度:6 mm/分、検出感度:0.005 g、検索速度:6 mm/分、検索感度:0.005 g、測定速度:3 mm /分、測定感度:0.001 g、浸漬深度:3 mm、戻り距離:10%、補正: Harkins & Jordan、最大値: 5。 [OK]をクリックします。
- ポップアップウィンドウで、データを保存するデータベースを選択し、[ OK]をクリックします。
注:ここで新しいデータベースを作成することも、既存のデータに新しい測定値を追加することもできます。 - 次に、画面上部中央にある [再生 ]ボタンをクリックします。システムがスクリプトの実行を開始します。システムが安定すると、表面が検出されます。プローブを液体に浸し、プローブを前後に動かして、形成されたラメラの張力を検出します。
- 結果を取得するには、画面の中央左側にある 測定 アイコンをクリックします。[ データ ]をクリックし、決定された表面張力を書き留めます。
- 測定が完了したら、プラットフォームの高さを下げ、プローブと容器を装置からロック解除して取り外します。
注:バイオサーファクタント産生による表面張力の低下を決定するには、未接種LBを対照として使用するべきである。
3. バイオサーファクタント抽出
- 2 N HClを使用して無細胞上清のpHを2に調整し、混合物を4°Cで一晩保存する。
- 等量のクロロホルム - メタノール混合物(2:1)を上清に加え、20分間激しく混合する。
- 相分離が起こるように混合物を邪魔しないでおきます。
- 水とメタノールを含む上相を除去し、バイオサーファクタントを含む下相をヒュームフード内で蒸発させる。
- 有機相を蒸発させた後、蜂蜜色の粗バイオサーファクタントを3mLのクロロホルムに再溶解し、この混合物を使用してバイオサーファクタントのさらなる同定および特性評価を行う。
4. 乳化安定性試験
-
異なる温度での乳化安定性
- 5 mL の無細胞上清を異なる試験管に取ります。
- 各試験管に5mLのガソリンを加え、3分間ボルテックスで激しく混合する。
- 試験管を異なる温度(30°C、40°C、50°C、60°C、および70°C)の異なる水浴中で一晩インキュベートする。
- 24時間後、前述のようにエマルジョン指数を推定します。
-
異なるpH値での乳化安定性
- 5 mLの無細胞上清を清潔な試験管に取ります。
- 1 N HClおよび1 N NaOHを使用して、無細胞上清(2、4、6、8、および10)のpHを調整する。
- 試験管に等量のガソリンを加え、3分間ボルテックスで激しく混合する。
- 試験管を室温で24時間邪魔されずに放置する。
- 前述のようにエマルジョン指数を推定します。
-
異なる塩濃度での乳化安定性
- 5 mLの無細胞上清を清潔な試験管に取ります。
- 上清に異なる量の塩(NaCl)を加える(0 g/L、5 g/L、10 g/L、20 g/L、60 g/L、80 g/L)。
- 3分間ボルテックス処理することによって細胞遊離上清中の塩を溶解する。
- 試験管に等量のガソリンを加え、3分間ボルテックスで激しく混合する。
- 試験管を室温で24時間邪魔されずに放置する。
- 24時間後のエマルジョン指数を推定する。
5. バイオサーファクタントの性質を決定する
-
抽出したバイオサーファクタントのTLC
- TLCプレート上のバイオサーファクタントの20 μLをスポットします。一度に2 μLをスポットします。
- バイオサーファクタントを3つの異なるTLCプレート上に配置します。
- クロロホルム:メタノール(2:1)を含む溶離液の100mL混合物を調製し、溶離液をTLCチャンバーに加える。チャンバーの蓋を閉じ、20分間飽和させます。
- プレートを乾燥させた後、クロロホルムメタノール混合物で飽和させたチャンバー内にTLCプレートを置き、TLCを流す。
- 溶離液がTLCプレートの上部(上部から1cm離れた場所)に達したら、プレートを取り出し、風乾させます。
-
脂質検出のための染色
- きれいなTLCチャンバーを取り、ヨウ素のいくつかの(5-10)顆粒を新鮮なチャンバーに加え、チャンバーを5〜10分間飽和させます。
- TLCプレートをチャンバー内に置き、黄色の斑点の発生を観察します。斑点が現れたら、バイオサーファクタントを脂質成分の存在について陽性とスコア付けする。
-
ペプチドまたはアミノ酸検出のための染色
- 0.4gのニンヒドリンを20mLのブタノールに溶解してニンヒドリン溶液を調製する。混合物に0.6mLの100%氷酢酸を加える。
- TLCプレートにニンヒドリン溶液をスプレーし、2分間空気乾燥させます。プレートを110°Cで加熱し、色の発色を観察した。
注:青い斑点が現れた場合は、バイオサーファクタントをペプチド鎖またはアミノ酸の存在について陽性と評価してください。
-
炭水化物検出のための染色
- 1mLのH2SO4を含む48mLの氷酢酸に2mLのp-アニスアルデヒドを加えてp-アニスアルデヒドの溶液を調製する。混合物に0.6mLの酢酸を加える。
- 混合物をTLCプレート上に均等にスプレーし、2分間風乾させる。
- プレートを110°Cでインキュベートし、スポットの発生をモニターする。
注:緑色または茶色の斑点が現れた場合は、バイオサーファクタントを炭水化物の存在について陽性と評価してください。
6. バイオサーファクタントの化学的同定
- バイオサーファクタントのLCMS
- 抽出したバイオサーファクタント25mgをクロロホルム1mLに溶解する。
- C18列を使用してLCMS(基準スキャン周波数10秒のロックスプレー構成)を実行します。
- 移動相としてクロロホルム:メタノール(1:1)を使用し、0.1 mL/minの流速で2 μLのサンプルをカラムに注入します。
- 実験パラメータを、極性:ES正、キャピラリー電圧:3kV、ソース温度:80°C、脱溶媒温度:300°C、脱溶媒ガス流量:7,000L/h、トラップガス流量:0.40mL/minに設定しました。
- 20分の検出時間中に100~1,200Daの範囲をスキャンし、正のESモードでイオンを調査する。
- 任意の質量分析ソフトウェアを使用してm / z値を定量的に分析します。
- 分析するには、ソフトウェアにログインします。
- バッチ検索をクリックし、得られた質量のリストを入力します。結果を正電荷モードで調査し、付加物としてM+HおよびM+Naを使用する。精度を 10 PPM に維持し、表示構造にチェックマークを付けます。
- [検索]をクリックし、化合物のリストから、PPMレベルが最も低い化合物を選択します。
- 1バイオサーファクタントのH NMR
注:バイオサーファクタントの 1HNMRは、400MHz NMR分光計を用いて行った( 材料表を参照のこと)。- 5mgのバイオサーファクタントを1mLの重水素化クロロホルム(CdCl3)に溶解する。
- 混合物をNMRチューブに移す。チューブを適切にキャップし、チューブをスパナに挿入します。アジャスターチューブを使用してチューブの高さを調整します。
- チューブをスパナとともにNMRマシンに置き、以下の手順に従ってNMRスペクトルを取得します。
- サンプル管タイプを選択するには:sxN、ここでNは、関連するソフトウェアにおいて、チューブが置かれた位置(例えば、sx 13、チューブが13番目の 位置に置かれた場合)である。
- edc と入力し 、Enter キーを押して、データを保存できる新しいフォルダーを作成します。
- ポップアップが表示されます。リスト内のCdCl 3 をクリックして溶媒を選択し、サンプルの名前を入力します。
- プロトコルを開始するには、"getprosol" と入力します。溶剤をロックするには、「CD cl3 をロック」と入力します。
- "topshim" と入力してサンプルをシムし、最後に "rga;zgefp" と入力してデータを取得します。これにより、プロトコルが開始されます。
- スペクトルが得られたら、「apk;abs n」と入力し、Enter キーを押して位相とベースラインの補正を行います。
- プライマリピークを選択するには、「pp」と入力して Enter キーを押し ます。強烈なピークのみを選択するには、「mi」と入力し、ピークを選択する強度を入力します。デフォルト値は 0.2 です。
- ピークを統合するには、「 統合」(Integrate ) をクリックし、統合するピークの左側にカーソルを置き、カーソルを押しながらカーソルをクリックしてピークの周りをドラッグします。
- 左上隅の [ファイル ]をクリックしてデータを保存し、[ 保存]をクリックします。
- サンプルは、「sx ej」と入力することでマシンから取り出すことができます。
- ピークを分析し、H原子の環境を決定します。
- バイオサーファクタントのフーリエ変換赤外分光法
注:抽出されたバイオサーファクタントのFT−IRは、ATRモードで市販の分光光度計を用いて行った( 材料表を参照)。- 分光光度計をオンにし、パージ、乾燥剤、検出器を確認します。
- スペクトルを収集するには、まずサンプルを配置せずにバックグラウンドスペクトルを収集します。
- 抽出したバイオサーファクタントを取り、完全に乾燥させます。乾燥したバイオサーファクタントをダイヤモンドクリスタルの上に直接置き、圧力をかけてATRタッチポイントを押します。
- ソフトウェアで、スキャン回数(30と入力)を選択し、400 cm-1 ~ 4,000 cm-1 のスペクトルをスキャンします。
- [ OK] をクリックして、サンプルスペクトルをスペクトルウィンドウに追加します。
- [ ファイル]>[名前を付けて保存]>クリック し、ファイル名に続いて拡張子.spaを入力して[ OK]をクリックします。
7.バイオサーファクタントの適用(強化された油回収)
注:この実験では、二重蒸留水を陰性対照として用い、10%SDS、10%Tween 80、および10%市販のサポニンを陽性対照として用いた。
- ガラスを取り、底の出口をグラスウールとガラスビーズで密封します。
- 土壌の上部に液体を加え、流れを下部に集めることができるように、砂質土壌でカラムを充填します。ホルダーに柱を取り付け、土の上にガラスビーズを加えます。
- カラムに 50 mL のブライン溶液をフラッディングし、流れを集めて細孔容積を決定します。
細孔容積=上部に加えられた塩水の量 - 回収されたフロースルーの体積。 - カラムの上部から添加した後、原油を強制的に通過させてカラムからブラインを除去します。カラムから出てくるブラインとオイルの量を集めて、初期オイル飽和量を決定します。カラムから放出されるブラインの量は、初期オイル飽和量または元のオイルになります。
- カラムを 24 時間邪魔しないでおきます。
- 24 時間後、カラムに 10 細孔容のブラインを溢れさせ、カラムから出てくるオイルを収集して、二次オイル回収率を推定します。二次油回収後にカラムに残された油分が残油に相当する。
- 抽出したバイオサーファクタント(工程3.5後に抽出)をガラスビーカーに等量加えることにより、バイオサーファクタントの混合物を調製する。バイオサーファクタントをカラムの上部に追加し、カラムを24時間インキュベートします。
- 24時間後、油と水の量を測定して、油の追加または増強された油回収率を決定します。カラムから放出される油の量は、回収された残留油に対応する。
- 次の式で強化されたオイル回収率を推定します。
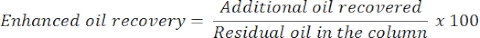
結果
3つの細菌株(Rhodococcus sp. IITD102、Lysinibacillus sp. IITD104、およびPaenibacillus sp. IITD108)を、ドロップ崩壊アッセイ、油置換アッセイ、エマルジョンインデックスアッセイ、および表面張力低下を含む様々なアッセイによってバイオサーファクタントの産生についてスクリーニングした。3つの細菌株すべておよび化学界面活性剤の溶液の無細胞上清は、滴下崩壊をもたらし、した?...
ディスカッション
バイオサーファクタントは、化学界面活性剤の魅力的な代替品になりつつある生物学的に活性な成分の最も汎用性の高いグループの1つです。洗剤、塗料、化粧品、食品、医薬品、農業、石油、水処理など、濡れ性の向上、CMCの低下、構造の多様化、環境への優しさなど、幅広い用途があります18。これは、バイオサーファクタント産生が可能なより多くの微生物株を発見す?...
開示事項
著者らは利益相反がないと宣言しています。
謝辞
著者らは、インド政府バイオテクノロジー省の財政支援に感謝したい。
資料
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
参考文献
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved