Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Recuperación mejorada de petróleo utilizando una combinación de biosurfactantes
En este artículo
Resumen
Ilustramos los métodos involucrados en el cribado y la identificación de los microbios productores de biosurfactantes. También se presentan métodos para la caracterización cromatográfica y la identificación química de los biosurfactantes, determinando la aplicabilidad industrial del biosurfactante en la mejora de la recuperación de aceite residual.
Resumen
Los biosurfactantes son compuestos tensoactivos capaces de reducir la tensión superficial entre dos fases de diferentes polaridades. Los biosurfactantes han surgido como alternativas prometedoras a los tensioactivos químicos debido a la menor toxicidad, la alta biodegradabilidad, la compatibilidad ambiental y la tolerancia a condiciones ambientales extremas. Aquí, ilustramos los métodos utilizados para la detección de microbios capaces de producir biosurfactantes. Los microbios productores de biosurfactantes se identificaron mediante el colapso de gotas, la propagación del aceite y los ensayos de índice de emulsión. La producción de biosurfactantes se validó determinando la reducción de la tensión superficial del medio debido al crecimiento de los miembros microbianos. También describimos los métodos involucrados en la caracterización e identificación de biosurfactantes. Se realizó cromatografía en capa delgada del biosurfactante extraído seguido de tinción diferencial de las placas para determinar la naturaleza del biosurfactante. LCMS, 1H NMR y FT-IR se utilizaron para identificar químicamente el biosurfactante. Ilustramos además los métodos para evaluar la aplicación de la combinación de biosurfactantes producidos para mejorar la recuperación de aceite residual en una columna de paquete de arena simulada.
Introducción
Los biosurfactantes son las moléculas anfipáticas tensoactivas producidas por microorganismos que tienen la capacidad de reducir la superficie y la tensión interfacial entre dos fases1. Un biosurfactante típico contiene una parte hidrofílica que generalmente se compone de una fracción de azúcar o una cadena peptídica o aminoácido hidrófilo y una parte hidrofóbica que se compone de una cadena de ácidos grasos saturados o insaturados2. Debido a su naturaleza anfipática, los biosurfactantes se ensamblan en la interfaz entre las dos fases y reducen la tensión interfacial en el límite, lo que facilita la dispersión de una fase en la otra 1,3. Varios tipos de biosurfactantes que se han reportado hasta ahora incluyen glicolípidos en los que los carbohidratos están vinculados a ácidos alifáticos o hidroxi-alifáticos de cadena larga a través de enlaces éster (por ejemplo, ramnolípidos, trehalolipípidos y soforolipídicos), lipopéptidos en los que los lípidos se unen a cadenas polipeptídicas (por ejemplo, surfactina y liquenina) y biosurfactantes poliméricos que generalmente se componen de complejos polisacáridos-proteínas (por ejemplo, emulsano, liposan, alasan y lipomanano)4. Otros tipos de biosurfactantes producidos por los microorganismos incluyen ácidos grasos, fosfolípidos, lípidos neutros y biosurfactantes de partículas5. La clase de biosurfactantes más estudiada son los glicolípidos y entre ellos la mayoría de los estudios se han reportado sobre ramnolípidos6. Los ramnolípidos contienen una o dos moléculas de ramnosa (que forman la parte hidrofílica) unidas a una o dos moléculas de ácido graso de cadena larga (generalmente ácido hidroxi-decanoico). Los ramnolípidos son glicolípidos primarios reportados primero a partir de Pseudomonas aeruginosa7.
Los biosurfactantes han ido ganando cada vez más atención en comparación con sus contrapartes químicas debido a varias propiedades únicas y distintivas que ofrecen8. Estos incluyen mayor especificidad, menor toxicidad, mayor diversidad, facilidad de preparación, mayor biodegradabilidad, mejor formación de espuma, compatibilidad ambiental y actividad en condiciones extremas9. La diversidad estructural de los biosurfactantes (Figura S1) es otra ventaja que les da una ventaja sobre las contrapartes químicas10. Generalmente son más efectivos y eficientes a concentraciones más bajas, ya que su concentración crítica de micelas (CMC) suele ser varias veces menor que los tensioactivos químicos11. Se ha informado que son altamente termoestables (hasta 100 °C) y pueden tolerar un pH más alto (hasta 9) y altas concentraciones de sal (hasta 50 g/L)12 , por lo que ofrecen varias ventajas en los procesos industriales, que requieren exposición a condiciones extremas13. La biodegradabilidad y la menor toxicidad los hacen adecuados para aplicaciones ambientales como la biorremediación. Debido a las ventajas que ofrecen, han estado recibiendo una mayor atención en diversas industrias como la industria alimentaria, agrícola, detergente, cosmética y petrolera11. Los biosurfactantes también han ganado mucha atención en la remediación de petróleo para la eliminación de contaminantes del petróleo y contaminantes tóxicos14.
Aquí informamos la producción, caracterización y aplicación de biosurfactantes producidos por Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 y Paenibacillus sp. IITD108. Los pasos involucrados en la detección, caracterización y aplicación de una combinación de biosurfactantes para mejorar la recuperación de petróleo se describen en la Figura 1.
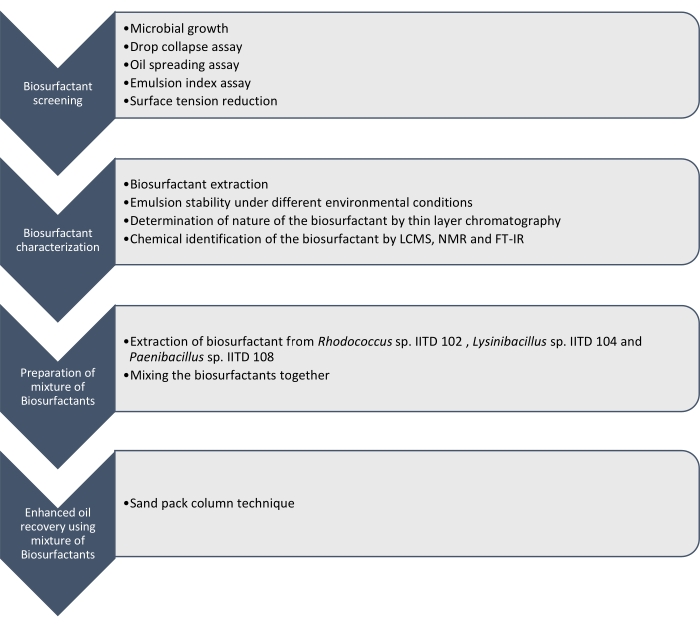
Figura 1: Un método para mejorar la recuperación de petróleo utilizando una combinación de biosurfactantes. Se muestra el flujo de trabajo paso a paso. El trabajo se llevó a cabo en cuatro pasos. Primero, las cepas microbianas fueron cultivadas y examinadas para la producción de biosurfactante mediante varios ensayos, que incluyeron el ensayo de colapso de gotas, el ensayo de propagación de aceite, el ensayo de índice de emulsión y la medición de la tensión superficial. Luego, los biosurfactantes se extrajeron del caldo libre de células y su naturaleza se identificó mediante cromatografía de capa delgada y se identificaron aún más utilizando LCMS, NMR y FT-IR. En el siguiente paso, los biosurfactantes extraídos se mezclaron y se determinó el potencial de la mezcla resultante para mejorar la recuperación de petróleo utilizando la técnica de columna de paquete de arena. Haga clic aquí para ver una versión más grande de esta figura.
El cribado de estas cepas microbianas para producir biosurfactantes se realizó mediante colapso por gota, propagación de aceite, ensayo de índice de emulsión y determinación de la reducción de la tensión superficial del medio libre de células debido al crecimiento de los microbios. Los biosurfactantes fueron extraídos, caracterizados e identificados químicamente por LCMS, RMN 1H y FT-IR. Finalmente, se preparó una mezcla de biosurfactantes producidos por estos microbios y se utilizó para recuperar el aceite residual en una columna de paquete de arena simulada.
El presente estudio solo ilustra los métodos involucrados en la detección, identificación, caracterización estructural y aplicación de la combinación de biosurfactantes para mejorar la recuperación de petróleo residual. No proporciona una caracterización funcional detallada de los biosurfactantes producidos por las cepas microbianas15,16. Se realizan varios experimentos, como la determinación crítica de micelas, el análisis termogravimétrico, la humectabilidad de la superficie y la biodegradabilidad para la caracterización funcional detallada de cualquier biosurfactante. Pero dado que este documento es un documento de métodos, el enfoque está en la detección, identificación, caracterización estructural y aplicación de la combinación de biosurfactantes para mejorar la recuperación de petróleo residual; estos experimentos no se han incluido en este estudio.
Protocolo
1. Crecimiento de cepas microbianas
- Pesar 2 g de caldo de Luria en polvo y añadir a 50 ml de agua destilada en un matraz cónico de 250 ml. Mezclar el contenido hasta que el polvo se disuelva completamente y hacer el volumen a 100 ml con agua destilada.
- Del mismo modo, prepare dos matraces más de 100 ml de caldo de Luria y coloque tapones de algodón en el cuello de los matraces.
- Cubra los tapones de algodón con papel de aluminio y autoclave los matraces durante 15 min a 121 °C y 15 psi para esterilizar el medio.
- Después del autoclave, deje que el medio se enfríe a temperatura ambiente.
- Para la preparación del cultivo primario de una cepa, elija una sola colonia de una placa de LA utilizando un lazo de inoculación e inocule en un tubo de ensayo que contenga 5 ml de caldo estéril de Luria.
- Incubar el tubo de ensayo durante la noche a 30 °C a 180 rpm.
- Inocular los matraces que contienen 100 ml de caldo de Luria en autoclave agregando 1 ml de cultivos de semillas cultivados durante la noche a los matraces dentro del gabinete de flujo de aire laminar.
- Incubar los matraces en una incubadora rotativa a 30 °C y 180 rpm durante 7 días.
- Después de completar el período de incubación, cosecha los matraces y transfiere el caldo de cultivo a los tubos de la centrífuga. Centrifugar el cultivo a 4.500 x g durante 20 min en una centrífuga refrigerada a 4 °C.
- Vierta suavemente el sobrenadante libre de células en un vaso de precipitados fresco y úselo en ensayos de detección para la producción de biosurfactantes.
2. Ensayos de cribado para la producción de biosurfactantes
NOTA: En las siguientes secciones, se utilizó surfactante comercial (Saponina) como control positivo, mientras que agua y medios no ininoculados se utilizaron como control negativo.
- Ensayo de colapso de gotas
- Tome un portaobjetos de vidrio limpio y cubra la superficie del portaobjetos con 200 μL de aceite.
- Agregue 20 μL del sobrenadante libre de células al centro del aceite y déjelo sin molestar durante 2-3 min.
NOTA: Si la gota colapsa, puntúe el sobrenadante positivo para la presencia de biosurfactante.
- Ensayo de propagación de aceite
- Tome 20 ml de agua destilada doble en una placa de Petri (75 mm de diámetro) y agregue 200 μL de petróleo crudo a la superficie del agua.
- Agregue 20 μL de sobrenadante libre de células al centro del aceite y déjelo sin molestar durante 1 min.
NOTA: Si se forma una zona de desbroce debido al desplazamiento del petróleo, puntúe el sobrenadante positivo para la presencia del biosurfactante.
- Ensayo de índice de emulsión (ensayo E24 )
- Agregue 4 ml de gasolina (gasolina) y sobrenadante sin celdas cada uno en un tubo de ensayo de vidrio limpio.
- Vórtice la mezcla vigorosamente durante 3 minutos y déjela sin molestar durante las próximas 24 h.
- Después de 24 h, determine el índice E24 como porcentaje de la altura de la capa emulsionada (cm) con respecto a la altura de toda la columna líquida (cm).
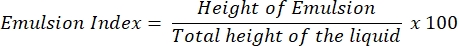
NOTA: Si se observa una emulsión (aceite en agua o agua en aceite) después de 24 h, es probable que el sobrenadante contenga el biosurfactante.
- Medición de tensión superficial
NOTA: La tensión superficial se midió utilizando el método del anillo du Noüy17. El instrumento utilizado en este experimento (ver Tabla de Materiales) es muy sensible, así que asegúrese de una limpieza adecuada del recipiente de vidrio y la sonda.- Encienda el sistema y haga doble clic en el software asociado para abrirlo.
- Limpie el recipiente de vidrio con el líquido cuya tensión superficial se va a determinar.
- Agregue el líquido (40 ml) en el recipiente y monte el recipiente en el soporte del recipiente.
- Desbloquee el soporte de la sonda y monte la sonda en él. Ahora bloquee el soporte de la sonda presionando el botón Bloquear en el controlador manual.
- Usando el controlador manual, ajuste la altura de la plataforma de tal manera que la sonda esté a unos 2-3 mm de distancia de la superficie del líquido.
- Ahora use el software para medir la tensión superficial. Haga clic en Archivo ubicado en el panel superior izquierdo de la pantalla. Haga clic en Abrir espacio de trabajo. Aparecerá una ventana emergente.
- Desplácese hacia abajo y haga doble clic en el icono K100: Tensión superficial e interfacial .
- Ahora, haga clic en el icono Archivo ubicado en la esquina superior izquierda de la pantalla. Haga clic en Nueva base de datos. Introduzca el nombre para guardar los datos y haga clic en Aceptar.
- Nuevamente, haga clic en Archivo > Nuevo anillo de medición > SFT >. Introduzca el nombre de la medición. Asegúrese de que la plantilla de configuración muestre el anillo SFT.
- Rellene los detalles en la ventana Configuración de medición seleccionando la sonda y el recipiente que se está utilizando para la medición. Además, complete los detalles del líquido y la fase gaseosa.
NOTA: La fase líquida será agua, mientras que la fase gaseosa será aire. La densidad de la fase líquida es la densidad del sobrenadante libre de células. Esto se puede determinar tomando el peso de 50 ml del líquido y calculando la densidad como Kg / m3. - Ahora haga clic en la pestaña Procedimiento y complete los siguientes detalles: Velocidad de detección: 6 mm / min, Sensibilidad de detección: 0.005 g, Velocidad de búsqueda: 6 mm / min, Sensibilidad de búsqueda: 0.005 g, Velocidad de medición: 3 mm / min, Sensibilidad de medición: 0.001 g, Profundidad de inmersión: 3 mm, Distancia de retorno: 10%, corrección: Harkins & Jordan, valores máximos: 5. Haga clic en Aceptar.
- En la ventana emergente, seleccione la base de datos para almacenar datos y haga clic en Aceptar.
NOTA: Se puede crear una nueva base de datos aquí o agregar nuevas mediciones a los datos existentes. - Ahora haga clic en el botón Reproducir ubicado en la parte superior central de la pantalla. El sistema comenzará a ejecutar el script. Después de que el sistema se estabilice, detectará la superficie. Sumerja la sonda en el líquido, mueva la sonda hacia adelante y hacia atrás y detecte la tensión en la lámina formada.
- Para obtener los resultados, haga clic en el icono Medición en el lado medio izquierdo de la pantalla. Haga clic en Datos y anote la tensión superficial determinada.
- Después de completar la medición, baje la altura de la plataforma y desbloquee y desmonte la sonda y el recipiente del instrumento.
NOTA: Para determinar la disminución de la tensión superficial debido a la producción de biosurfactantes, se debe utilizar LB no ininoculado como control.
3. Extracción de biosurfactantes
- Ajuste el pH del sobrenadante libre de células a 2 usando 2 N HCl. Guarde la mezcla a 4 °C durante la noche.
- Agregue el mismo volumen de mezcla de cloroformo-metanol (2:1) al sobrenadante y mezcle vigorosamente durante 20 min.
- Deje la mezcla sin perturbaciones para que se produzca la separación de fases.
- Retire la fase superior que contiene agua y metanol y deje que la fase inferior que contiene el biosurfactante se evapore en una campana extractora de humos.
- Después de la evaporación de la fase orgánica, vuelva a disolver el biosurfactante crudo de color miel en 3 ml de cloroformo y utilice esta mezcla para una mayor identificación y caracterización del biosurfactante.
4. Estudios de estabilidad de la emulsión
-
Estabilidad de la emulsión a diferentes temperaturas
- Tome 5 ml de sobrenadantes libres de células en diferentes tubos de ensayo.
- Agregue 5 ml de gasolina a cada tubo de ensayo y mezcle vigorosamente mediante vórtice durante 3 min.
- Incubar los tubos de ensayo durante la noche en diferentes baños de agua a diferentes temperaturas (30 °C, 40 °C, 50 °C, 60 °C y 70 °C).
- Después de 24 h, estime los índices de emulsión como se mencionó anteriormente.
-
Estabilidad de la emulsión a diferentes valores de pH
- Tome 5 ml del sobrenadante libre de células en tubos de ensayo limpios.
- Ajuste el pH de los sobrenadantes libres de células (2, 4, 6, 8 y 10) utilizando 1 N HCl y 1 N NaOH.
- Agregue una cantidad igual de gasolina a los tubos de ensayo y mezcle vigorosamente mediante vórtice durante 3 minutos.
- Deje los tubos de ensayo sin perturbar a temperatura ambiente durante 24 h.
- Estime el índice de emulsión como se mencionó anteriormente.
-
Estabilidad de la emulsión a diferentes concentraciones de sal
- Tome 5 ml del sobrenadante libre de células en tubos de ensayo limpios.
- Añadir diferentes cantidades de sal (NaCl) a los sobrenadantes (0 g/L, 5 g/L, 10 g/L, 20 g/L, 60 g/L y 80 g/L).
- Disuelva las sales en los sobrenadantes libres de células mediante vórtice durante 3 min.
- Agregue una cantidad igual de gasolina a los tubos de ensayo y mezcle vigorosamente mediante vórtice durante 3 minutos.
- Deje los tubos de ensayo sin perturbar a temperatura ambiente durante 24 h.
- Estimar el índice de emulsión después de 24 h.
5. Determinación de la naturaleza del biosurfactante
-
TLC del biosurfactante extraído
- Spot 20 μL de los biosurfactantes en placas TLC. Punto 2 μL a la vez.
- Detecte los biosurfactantes en tres placas TLC diferentes.
- Preparar una mezcla de 100 ml del eluyente que contiene cloroformo:metanol (2:1) y añadir el eluyente a la cámara TLC. Cierre la tapa de la cámara y deje que se sature durante 20 min.
- Después de secar las placas, coloque las placas TLC dentro de la cámara saturada con una mezcla de metanol cloroformo y ejecute la TLC.
- Después de que el eluyente haya llegado a la parte superior de la placa TLC (a 1 cm de distancia de la parte superior), saque las placas y déjelas secar al aire.
-
Tinción para la detección de lípidos
- Tome una cámara TLC limpia y agregue algunos (5-10) gránulos de yodo en la cámara fresca y sature la cámara durante 5 a 10 minutos.
- Coloque la placa TLC dentro de la cámara y observe el desarrollo de las manchas amarillas. Si aparecen las manchas, puntúe el biosurfactante positivo para la presencia del componente lipídico.
-
Tinción para la detección de péptidos o aminoácidos
- Prepare una solución de ninhidrina disolviendo 0,4 g de ninhidrina en 20 ml de butanol. Agregue 0.6 ml de ácido acético glacial 100% a la mezcla.
- Rocíe la placa TLC con solución de ninhidrina y déjela secar al aire durante 2 min. Calentar la placa a 110 °C y observar el desarrollo del color.
NOTA: Si aparecen las manchas azules, puntúe el biosurfactante positivo para la presencia de cualquier cadena peptídica o aminoácido.
-
Tinción para la detección de carbohidratos
- Preparar una solución de p-anisaldehído añadiendo 2 mL de p-anisaldehído a 48 mL de ácido acético glacial que contenga 1 mL de H2SO4. Añadir 0,6 ml de ácido acético a la mezcla.
- Rocíe la mezcla uniformemente en una placa TLC y déjela secar al aire durante 2 min.
- Incubar la placa a 110 °C y vigilar el desarrollo de manchas.
NOTA: Si aparecen las manchas verdes o marrones, califique el biosurfactante como positivo para la presencia de carbohidratos.
6. Identificación química del biosurfactante
- LCMS del biosurfactante
- Disolver 25 mg del biosurfactante extraído en 1 ml de cloroformo.
- Realice LCMS (en una configuración de pulverización de bloqueo con una frecuencia de escaneo de referencia de 10 s) utilizando una columna C18.
- Utilice cloroformo:metanol (1:1) como fase móvil e inyecte 2 μL de la muestra en la columna a un caudal de 0,1 mL/min.
- Ajuste los parámetros experimentales a: polaridad: ES positivo, voltaje capilar: 3 kV, temperatura de la fuente: 80 °C, temperatura de dessolvación: 300 °C, caudal de gas de dessolvación: 7.000 L/h y caudal de gas trampa: 0,40 mL/min.
- Escanee los rangos de 100 a 1.200 Da durante un tiempo de detección de 20 minutos y estudie los iones en modo ES positivo.
- Analice los valores m/z utilizando cualquier software de espectrometría de masas cuantitativamente.
- Para el análisis, inicie sesión en el software.
- Haga clic en Búsqueda por lotes e introduzca la lista de las masas obtenidas. Estudie los resultados en un modo de carga positiva y use M + H y M + Na como aductos. Mantenga la precisión a 10 PPM y marque en la estructura de la pantalla.
- Haga clic en Buscar y, de la lista de compuestos, seleccione el que tenga el nivel de PPM más bajo.
- 1 H RMN del biosurfactante
NOTA: 1H NMR del biosurfactante se realizó utilizando un espectrómetro de RMN de 400 MHz (ver Tabla de Materiales).- Disolver 5 mg del biosurfactante en 1 ml de cloroformo deuterado (CdCl3).
- Transfiera la mezcla a un tubo de RMN. Tapa el tubo correctamente e inserta el tubo en la llave inglesa. Ajuste la altura del tubo con el tubo ajustador.
- Coloque el tubo junto con la llave inglesa en la máquina de RMN y siga los pasos que se mencionan a continuación para obtener un espectro de RMN.
- Para seleccionar el tipo de tubo de muestra: sx N, donde N es la posición donde se colocó el tubo (por ejemplo, sx 13, si el tubo se colocó en la13ª posición) en el software asociado.
- Escriba edc y presione Entrar para crear una nueva carpeta donde se puedan almacenar los datos.
- Aparecerá una ventana emergente. Seleccione el disolvente haciendo clic en CdCl 3 en la lista e introduzca el nombre de la muestra.
- Para iniciar el protocolo, escriba "getprosol"; para bloquear el disolvente, escriba "lock cdcl3".
- Escriba "topshim" para ajustar la muestra y, finalmente, escriba "rga;zgefp" para adquirir los datos. Esto iniciará el protocolo.
- Una vez obtenidos los espectros, escriba "apk;abs n" y pulse Intro para la corrección de fase y línea de base.
- Para seleccionar los picos primarios, escriba "pp" y presione Entrar. Para seleccionar solo picos intensos, ingrese "mi" y escriba la intensidad por encima de la cual se deben seleccionar los picos. El valor predeterminado será 0,2.
- Para integrar los picos, haga clic en Integrar y coloque el cursor en el lado izquierdo del pico a integrar y mientras mantiene presionado el cursor haga clic y arrastre el cursor alrededor del pico.
- Guarde los datos haciendo clic en Archivo en la esquina superior izquierda y luego haga clic en Guardar.
- La muestra se puede expulsar de la máquina escribiendo "sx ej".
- Analizar los picos y determinar el entorno de los átomos de H.
- Espectroscopía infrarroja por transformada de Fourier del biosurfactante
NOTA: FT-IR del biosurfactante extraído se realizó utilizando un espectrofotómetro disponible comercialmente en modo ATR (ver Tabla de Materiales).- Encienda el espectrofotómetro y compruebe la purga, el desecante y el detector.
- Para recolectar un espectro, primero recolecte el espectro de fondo sin una muestra en su lugar.
- Tome el biosurfactante extraído y séquelo por completo. Coloque el biosurfactante seco directamente sobre el cristal de diamante, aplique presión y presione el punto de contacto ATR.
- En el software, seleccione el número de escaneos (ingrese 30) y escanee el espectro de 400 cm-1 a 4,000 cm-1.
- Haga clic en Aceptar para agregar el espectro de muestra a la ventana espectral.
- Haga clic en Archivos > Guardar > Guardar como e ingrese el nombre del archivo seguido de la extensión .spa y haga clic en Aceptar.
7. Aplicación de biosurfactante (recuperación mejorada de petróleo)
NOTA: En este experimento, se utilizó agua destilada doble como control negativo y se utilizó 10% SDS, 10% Tween 80 y 10% saponina comercial como controles positivos.
- Tome el vidrio y selle la salida inferior con lana de vidrio y cuentas de vidrio.
- Empaque la columna con tierra arenosa de tal manera que se pueda agregar algo de líquido en la parte superior del suelo y el flujo a través se pueda recolectar en la parte inferior. Monte la columna en el soporte y agregue algunas cuentas de vidrio en la parte superior del suelo.
- Inunde la columna con 50 ml de solución de salmuera y recoja el flujo para determinar el volumen de poros.
volumen de poro = volumen de salmuera añadido en la parte superior - volumen de flujo a través recogido. - Retire la salmuera de la columna forzando el paso del petróleo crudo a través de ella después de agregarla desde la parte superior de la columna. Recoja el volumen de la salmuera y el aceite que sale de la columna para determinar el volumen inicial de saturación de aceite. El volumen de la salmuera liberada de la columna será el volumen de saturación de aceite inicial o el aceite original en su lugar.
- Deje la columna sin molestar durante 24 h.
- Después de 24 h, inunde la columna con 10 volúmenes porosos de salmuera y recoja el aceite que sale de la columna para estimar la recuperación secundaria de petróleo. El aceite que queda en la columna después de la recuperación secundaria de petróleo corresponde al aceite residual.
- Prepare una mezcla de biosurfactantes agregando volúmenes iguales del biosurfactante extraído (extraído después del paso 3.5) al vaso de precipitados de vidrio. Agregue los biosurfactantes a la parte superior de la columna e incube la columna durante 24 h.
- Después de 24 h, mida la cantidad de aceite y agua para determinar la recuperación de aceite adicional o mejorada. El volumen del aceite liberado de la columna corresponderá al aceite residual recuperado.
- Estimar la recuperación mejorada de petróleo con la siguiente ecuación:
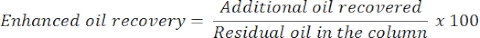
Resultados
Tres cepas bacterianas (Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 y Paenibacillus sp. IITD108) fueron examinadas para la producción de biosurfactantes mediante varios ensayos, que incluyeron ensayo de colapso de gotas, ensayo de desplazamiento de aceite, ensayo de índice de emulsión y reducción de tensión superficial. Los sobrenadantes libres de células de las tres cepas bacterianas y una solución de surfactante químico resultaron en un colapso de gota y, por lo tanto, se cali...
Discusión
Los biosurfactantes son uno de los grupos más versátiles de componentes biológicamente activos que se están convirtiendo en alternativas atractivas a los tensioactivos químicos. Tienen una amplia gama de aplicaciones en numerosas industrias, como detergentes, pinturas, cosméticos, alimentos, productos farmacéuticos, agricultura, petróleo y tratamiento de agua debido a su mejor humectabilidad, menor CMC, estructura diversificada y respeto al medio ambiente18. Esto ha llevado a un mayor inte...
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Los autores desean dar las gracias al Departamento de Biotecnología del Gobierno de la India por su apoyo financiero.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
Referencias
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados