È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificazione del trasporto del ferro attraverso la placenta di topo in vivo utilizzando isotopi di ferro non radioattivi
In questo articolo
Riepilogo
Questo articolo dimostra come preparare e somministrare ferro isotopico non radioattivo legato alla transferrina per studi sul trasporto del ferro nella gravidanza del topo. Viene anche descritto l'approccio per quantificare il ferro isotopico nei compartimenti fetoplacentari.
Abstract
Il ferro è essenziale per la salute materna e fetale durante la gravidanza, con circa 1 g di ferro necessario negli esseri umani per sostenere una gravidanza sana. La dotazione di ferro fetale dipende interamente dal trasferimento di ferro attraverso la placenta e le perturbazioni di questo trasferimento possono portare a esiti avversi della gravidanza. Nei topi, la misurazione dei flussi di ferro attraverso la placenta si basava tradizionalmente su isotopi di ferro radioattivi, un approccio altamente sensibile ma oneroso. Gli isotopi stabili del ferro (57Fe e 58Fe) offrono un'alternativa non radioattiva per l'uso negli studi sulla gravidanza umana.
In condizioni fisiologiche, il ferro legato alla transferrina è la forma predominante di ferro assorbito dalla placenta. Pertanto, 58Fe-transferrina sono state preparate e iniettate per via endovenosa in madri gravide per valutare direttamente il trasporto di ferro placentare e bypassare l'assorbimento intestinale materno del ferro come variabile confondente. Il ferro isotopico è stato quantificato nella placenta e nei tessuti embrionali di topo mediante spettrometria di massa al plasma accoppiato induttivamente (ICP-MS). Questi metodi possono anche essere impiegati in altri sistemi di fisiologia o malattia modello animale per quantificare la dinamica del ferro in vivo .
Introduzione
Il ferro è fondamentale per vari processi metabolici, tra cui la crescita e lo sviluppo, la produzione di energia e il trasporto di ossigeno1. Il mantenimento dell'omeostasi del ferro è un processo dinamico e coordinato. Il ferro viene assorbito dal cibo nel duodeno e trasportato in tutto il corpo nella circolazione legato alla proteina transferrina di trasporto del ferro (Tf). È utilizzato da ogni cellula per i processi enzimatici, incorporato nell'emoglobina negli eritrociti nascenti e riciclato dagli eritrociti invecchiati dai macrofagi. Il ferro viene immagazzinato nel fegato quando in eccesso e perso dal corpo attraverso emorragia o desquamazione cellulare. La quantità di ferro in circolazione è il risultato dell'equilibrio tra il consumo e l'apporto di ferro, quest'ultimo strettamente regolato dall'ormone epatico epcidina (HAMP), il regolatore centrale dell'omeostasi del ferro1. L'epcidina funziona per limitare la biodisponibilità del ferro nel sangue occludendo o inducendo ubiquitinazione e degradando l'esportatore di ferro ferroportina (FPN)2. La riduzione dell'FPN funzionale porta a una diminuzione dell'assorbimento del ferro nella dieta, al sequestro del ferro nel fegato e alla diminuzione del riciclaggio del ferro dai macrofagi1.
L'epcidina è regolata dallo stato del ferro, dall'infiammazione, dalla spinta eritropoietica e dalla gravidanza (rivisto in 3). Dato che l'omeostasi del ferro è altamente dinamica, è importante comprendere e misurare il pool totale di ferro e la distribuzione e il turnover del ferro. Gli studi sugli animali si basavano tradizionalmente su isotopi di ferro radioattivi, un approccio altamente sensibile ma oneroso per misurare la dinamica del ferro. Tuttavia, in studi più recenti, incluso lo studio presentato qui4, gli isotopi di ferro stabili non radioattivi (58Fe) sono utilizzati per misurare il trasporto di ferro durante la gravidanza 5,6,7,8,9. Gli isotopi stabili sono strumenti preziosi per studiare il metabolismo dei nutrienti (rivisto in 10). L'uso di isotopi di ferro stabili negli studi sull'uomo ha dimostrato che i) l'assorbimento del ferro aumenta verso la fine della gestazione5,6, ii) il trasferimento di ferro alimentare al feto dipende dallo stato di ferro materno7, iii) il ferro eme ingerito per via materna è più facilmente incorporato dal feto rispetto al ferro nonheme 8 e iv) il trasferimento di ferro al feto è negativamente correlato con i livelli di epcidina materna 8, 9. Questi esperimenti hanno misurato gli isotopi di ferro nei sieri o la loro incorporazione nei globuli rossi; tuttavia, la misurazione del ferro incorporato nei globuli rossi da sola può sottostimare il vero assorbimento del ferro9. Nel presente studio, sia l'eme che il ferro nonheme sono misurati nei tessuti.
Durante la gravidanza, il ferro è necessario per sostenere l'espansione del volume dei globuli rossi materni e per il trasferimento attraverso la placenta per sostenere la crescita e lo sviluppo del feto11. La dotazione di ferro fetale dipende interamente dal trasporto di ferro attraverso la placenta. Durante la gravidanza umana 12 e roditore 4,13, i livelli di epcidina diminuiscono drasticamente, aumentando la disponibilità di ferro plasmatico per il trasferimento al feto.
I fondamenti del trasporto placentare del ferro sono stati inizialmente caratterizzati negli anni 1950-70 utilizzando traccianti radioattivi (59Fe e 55Fe). Questi studi hanno determinato che il trasporto di ferro attraverso la placenta è unidirezionale 14,15 e che la transferrina ferrica è una delle principali fonti di ferro per la placenta e il feto 16,17. L'attuale comprensione del trasporto placentare del ferro è più completa, anche se alcuni trasportatori chiave del ferro e meccanismi di regolazione rimangono sconosciuti. I modelli murini sono stati essenziali per comprendere la regolazione e il trasporto del ferro18 perché i trasportatori e i meccanismi chiave sono notevolmente simili. Sia le placenta umane che quelle di topo sono emocoriali, cioè il sangue materno è in contatto diretto con il corion fetale19. Tuttavia, ci sono alcune notevoli differenze strutturali.
Il sinciziotrofoblasto è lo strato cellulare placentare che separa la circolazione materna e fetale e trasporta attivamente ferro e altri nutrienti20. Nell'uomo, il sinciziotrofoblasto è un singolo strato di cellule fuse. Al contrario, la placenta del topo è costituita da due strati di sincitiotrofoblasto21, Syn-I e Syn-II. Tuttavia, le giunzioni gap all'interfaccia di Syn-I e Syn-II consentono la diffusione di nutrienti tra gli strati22,23. Pertanto, questi strati funzionano come un singolo strato sinciziale simile al sinciziotrofoblasto umano. Ulteriori somiglianze e differenze tra placenta umana e di topo sono esaminate da Rossant e Cross21. Il trasporto placentare del ferro è innescato dal legame di ferro-Tf dal sangue materno al recettore della transferrina (TfR1) localizzato sul lato apicale del sinciziotrofoblasto24. Questa interazione induce l'internalizzazione del ferro-Tf/TfR1 tramite endocitosi mediata da clatrina25. Il ferro viene quindi rilasciato dal Tf nell'endosoma acido26, ridotto a ferro ferroso da una ferrieductasi indeterminata ed esportato dall'endosoma al citoplasma da un trasportatore ancora da determinare. Resta da descrivere anche come il ferro viene accompagnato all'interno del sinciziotrofoblasto. Il ferro viene infine trasportato sul lato fetale dall'esportatore di ferro, FPN, localizzato sulla superficie basale o fetale del sinciziotrofoblasto (rivisto in27).
Per comprendere come la regolazione fisiologica e patologica di TfR1, FPN ed epcidina influenzi il trasporto placentare del ferro, sono stati utilizzati isotopi di ferro stabili per quantificare il trasporto di ferro dalla circolazione materna alla placenta e all'embrione in vivo4. Questo documento presenta i metodi per la preparazione e la somministrazione isotopica di ferro-transferrina a topi gravidi, l'elaborazione dei tessuti per ICP-MS e il calcolo delle concentrazioni di ferro nei tessuti. L'uso di isotopi stabili del ferro in vivo può essere adattato per studiare la regolazione e la distribuzione del ferro in diversi modelli animali per studiare la regolazione fisiologica e patologica del ferro.
Protocollo
Tutti i protocolli sugli animali e le procedure sperimentali sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) dell'Università della California di Los Angeles.
1. Preparazione di 58Fe-Tf
NOTA: il protocollo utilizza 58Fe; tuttavia, un protocollo identico può essere utilizzato per 57Fe. Entrambi gli isotopi possono essere utilizzati e smaltiti come sostanza chimica standard del ferro senza ulteriori precauzioni.
- Sciogliere 58 Fe in 12 N HCl a 50 μL di HCl/mg di 58Fe.
- Aggiungere HCl al metallo nella fiala di vetro fornita dal fornitore e sostituire il tappo liberamente. Per sciogliere il ferro, riscaldare la soluzione di 58Fe/HCl a 60 °C per 1 ora. Se ancora non è disciolto, lasciare la soluzione per una notte a temperatura ambiente nella cappa aspirante per sciogliersi.
NOTA: La soluzione disciolta di 58Fe/HCl è di colore giallo-arancio.
Fe 3 O 4(s) + 8HCl(aq) → Fe(II)Cl 2(aq) + 2Fe(III)Cl3(aq) + 4H2 O
- Aggiungere HCl al metallo nella fiala di vetro fornita dal fornitore e sostituire il tappo liberamente. Per sciogliere il ferro, riscaldare la soluzione di 58Fe/HCl a 60 °C per 1 ora. Se ancora non è disciolto, lasciare la soluzione per una notte a temperatura ambiente nella cappa aspirante per sciogliersi.
- Ossidare qualsiasi residuo di Fe(II)Cl2 per generare la soluzione di Fe(III)Cl3 .
- Riscaldare la soluzione di 58Fe/HCl a 60 °C con il tappo spento per facilitare l'ossidazione.
- Aggiungere 1 μL di H 2 O2al 35% per 50 μL di soluzione di 58Fe/HCl per facilitare ulteriormente l'ossidazione.
Fe(II)Cl2(aq) + O 2 + 4HCl → 4Fe(III)Cl3(aq) + 2H2 O
- Preparare la soluzione di cloruro ferrico (58Fe(III)Cl3).
- Lasciare la soluzione di cloruro ferrico nella cappa a 60 °C con il tappo spento per far evaporare il campione.
NOTA: l'evaporazione può richiedere da uno a diversi giorni. - Ricostituire da58 Fe(III)Cl 3 a 100 mM con H 2 O ultrapuro e calcolare la quantità di H 2 O ultrapuro necessaria in base al peso iniziale del metallo utilizzato nella fase 1.1 (il peso molecolare di 58Fe(III)Cl 3 è 162,2).
- Lasciare la soluzione di cloruro ferrico nella cappa a 60 °C con il tappo spento per far evaporare il campione.
- Preparare 58 Fe(III)-nitrilotriacetato (NTA) incubando 58Fe(III)Cl 3 con NTA in rapporto molare 1:5 in presenza di 20 mM NaHCO3.
- Preparare 500 mM NTA in 1 N NaOH.
- Preparare 5 tampone di carico transferrina (0,5 M HEPES, pH 7,5; 0,75 M NaCl).
- Preparare 1 M NaHCO3 in H2O ultrapuro.
- In un tubo conico da 15 mL, aggiungere 150 μL di soluzione 100 mM 58 Fe(III)Cl 3 (dal punto 1.3.2), 150 μL di 500 mM NTA preparati in 1 N NaOH, 480 μL di H2O ultrapuro, 200 μL di tampone di carico 5xtransferrina e 20 μL di soluzione 1 M NaHCO3.
- Incubare la miscela per 5 minuti a temperatura ambiente.
- Caricare apo-Tf con 58 Fe(III)-NTA per formare 58Fe-Tf.
NOTA: Questo protocollo è stato adattato da McCarthy e Kosman28.- Sciogliere 500 mg di apo-Tf in 4 mL di tampone caricante 1x Tf.
- Al tubo conico da 15 mL del punto 1.4.4 contenente 1 mL della soluzione di 58Fe(III)-NTA, aggiungere 4 mL di soluzione apo-Tf.
NOTA: Questo è un rapporto molare 3: 1 di 58Fe-NTA con apo-Tf. Ogni Tf contiene 2 siti di legame Fe; l'eccesso di 58Fe-NTA è stato aggiunto per garantire che Tf fosse completamente carico. - Per consentire il carico massimo di 58Fe-NTA su apo-Tf, controllare che la soluzione sia a pH 7,5 e regolare il pH, se necessario, con NaHCO3 o HCl.
- Incubare per 2,5 ore a temperatura ambiente.
- Rimuovere l'eccesso non legato 58Fe(III)-NTA e rilasciato NTA.
- Trasferire la soluzione di 58 Fe-Tf in una colonna di taglio del peso molecolare (cutoff 30 kDa) e centrifugare a 2.500× g per 15 minuti a temperatura ambiente.
- Lavare la colonna con 10 ml di 1x tampone di carico transferrina e centrifugare a 2.500 × g per 15 minuti a temperatura ambiente. Ripetere il lavaggio e la centrifugazione, eseguire un lavaggio salino con 10 ml di soluzione salina e centrifugare a 2.500 × g per 15 minuti a temperatura ambiente.
- Calcola la concentrazione di 58Fe-Tf.
NOTA: A causa dell'aggiunta di un eccesso di 58Fe al punto 1.5.2, si supponga che tutta la transferrina sia differenziante. Poiché sono stati utilizzati 500 mg di apo-Tf, ~500 mg 58Fe-Tf sono stati prodotti nella fase 1.5.4.- Misurare il volume recuperato dalla centrifugazione dopo il lavaggio salino nella fase 1.6.2.
- Dividere 500 mg per il volume recuperato per determinare la concentrazione (in mg/ml) della soluzione di 58Fe-Tf.
- Sterilizzare la soluzione 58Fe-Tf utilizzando un filtro a siringa da 0,22 μm; conservare a 4 °C fino al momento dell'uso.
NOTA: la soluzione 58Fe-Tf è stata utilizzata tra 1 e 4 settimane dopo la preparazione.
2. Impostare gravidanze a tempo con il topo
- Usa topi femmina di 6-8 settimane. Mettere gli animali su una dieta a basso contenuto di ferro (4 ppm di ferro) o chow standard (185 ppm di ferro) per 2 settimane prima dell'accoppiamento e mantenere gli animali sulle rispettive diete durante la gravidanza.
- Opzione 01: confermare la gravidanza con l'aumento di peso a E7.5.
- Impostare più gabbie di allevamento. Per ogni gabbia, combinare 2 femmine con 1 maschio durante la notte; il giorno successivo, quando gli animali sono separati, è considerato giorno embrionale (E)0,5. Pesare le femmine a E7.5 per determinare se incinta. Accoppia di nuovo i maschi con le femmine che non hanno guadagnato peso.
NOTA: In WT C57BL / 6, un aumento di peso di 1 g a E7.5 è un buon indicatore di gravidanza. Questo metodo garantisce che l'impianto avvenga entro un periodo di tempo specifico di 16 ore, consentendo il trattamento sincrono di tutti gli animali che sono rimasti incinta durante lo stesso periodo di accoppiamento.
- Impostare più gabbie di allevamento. Per ogni gabbia, combinare 2 femmine con 1 maschio durante la notte; il giorno successivo, quando gli animali sono separati, è considerato giorno embrionale (E)0,5. Pesare le femmine a E7.5 per determinare se incinta. Accoppia di nuovo i maschi con le femmine che non hanno guadagnato peso.
- Opzione 02: confermare la gravidanza tramite controlli della spina.
- Combina 2 femmine con 1 maschio ed esegui controlli giornalieri della spina per determinare se si è verificata la copulazione.
NOTA: Questo metodo può comportare gravidanze scaglionate e la presenza di una spina non garantisce la gravidanza.
- Combina 2 femmine con 1 maschio ed esegui controlli giornalieri della spina per determinare se si è verificata la copulazione.
3. Somministrare 58Fe-Tf per via endovenosa a topi gravidi E17.5
- Preparare 58Fe-Tf dal passaggio 1.8 per l'iniezione.
- Preparare la soluzione di 58Fe-Tf a 35 mg/ml in soluzione salina; iniettare 100 μL per topo.
- Riempire una siringa da insulina con 100 μL della soluzione di 58Fe-Tf.
NOTA: Ogni dose contiene 3,5 mg di 58 Fe-Tf umano (5 μg di 58Fe).
- Anestetizzare un topo gravido usando isoflurano.
- Utilizzare un regolatore di isoflurano con una camera.
- Utilizzare le seguenti impostazioni: 5% isoflurano, 2 L/mL di O 2,2 min.
- Conferma che il topo è anestetizzato cercando la mancanza di risposta a un pizzico del piede.
- Applicare il lubrificante per gli occhi sulla superficie dell'occhio e posizionare il mouse su una piastra riscaldante.
- Iniettare lentamente e con attenzione la soluzione di 58Fe-Tf nel seno retroorbitale.
- Consentire al mouse di riprendersi dall'anestesia; Non lasciare l'animale incustodito fino a quando non ha riacquistato sufficiente coscienza per mantenere la recumbentenza sternale.
- Sei ore dopo l'iniezione, eutanasia E17.5 donne gravide per sovradosaggio di isoflurano.
- Eseguire una puntura cardiaca per dissanguare il topo come forma di eutanasia secondaria.
- Fissare i piedi verso il basso con aghi per la stabilizzazione.
- Raccogli i fegati di placenta e embrione.
- Usando una pinza sterile e forbici da dissezione, rimuovere con cura l'utero dal topo gravido. Tagliare un'unità fetale-placentare placentare, che comprende un singolo feto e placenta nel sacco amniotico circondato da una porzione dell'utero.
- Tagliare con cura attraverso l'utero e il sacco amniotico senza disturbare il feto e la placenta.
- Staccare il sacco amniotico e rimuovere il feto e la placenta.
- Taglia il cordone ombelicale.
- Asciugare il feto e la placenta su una pulizia per rimuovere il liquido amniotico in eccesso.
- Registra i pesi di tutte le placentae.
- Tagliare ogni placenta a metà con una lama di rasoio, posizionare ogni metà in un tubo da 2,0 ml e congelare a scatto in azoto liquido.
NOTA: Poiché 58Fe non richiede particolari precauzioni di manipolazione e smaltimento, metà delle placenta può essere utilizzata per la misurazione di 58Fe e l'altra metà per qualsiasi altra analisi, inclusa la quantificazione dell'espressione del recettore della transferrina (TFR1) e della ferroportina (FPN) mediante western blotting e qPCR. - Per raccogliere fegati embrionali, sacrifica l'embrione: usa una lametta per decapitare rapidamente l'embrione.
NOTA: A E17.5, tutti gli embrioni nell'utero devono essere eutanizzati individualmente, anche se non vengono utilizzati nello studio. - Appuntare l'embrione per la stabilizzazione, lasciando l'addome esposto.
- Usando le forbici da dissezione, fare una piccola incisione dove è stato attaccato il cordone ombelicale, inserire un'estremità delle forbici di dissezione nell'incisione ed eseguire un piano mediano tagliato verso il piano coronale di circa 1/4 di pollice. Quindi, eseguire tagli piani trasversali per esporre il fegato fetale.
- Utilizzare una pinza per rimuovere il fegato fetale.
- Registra i pesi dell'intero fegato embrionale.
- Mettere i fegati dell'embrione intero in provette da 2 ml e congelarli in azoto liquido.
NOTA: In alternativa, solo una parte del fegato embrionale può essere utilizzata per la misurazione del 58Fe se si desiderano ulteriori analisi. L'utilizzo di provette da 2,0 ml consente una migliore omogeneizzazione dei tessuti rispetto alle provette da 1,5 ml.
- Conservare i tessuti a tempo indeterminato a -80 °C.
4. Tessuti di processo per l'analisi quantitativa del ferro mediante ICP-MS
- Elaborare le placenta e i fegati fetali per la quantificazione del ferro noneme.
- Scongelare le metà placentari e i fegati fetali interi e pesare le metà placentari (vedere il punto 3.6.12 per la registrazione del peso del fegato fetale).
- Aggiungere 400 μL di soluzione di precipitazione proteica (0,53 N HCl, 5,3% TCA).
- Omogeneizzare il tessuto usando un omogeneizzatore elettrico.
- Incubare i campioni a 100 °C per 1 ora.
- Raffreddare i campioni in acqua a temperatura ambiente per 2 minuti.
- Aprire i tappi per rilasciare la pressione, quindi chiudere nuovamente i tubi.
- Centrifugare a 17.000 × g per 10 minuti a temperatura ambiente per pellettare i detriti di tessuto.
- Trasferire con cautela il surnatante in un nuovo tubo etichettato.
- Inviare campioni per l'analisi ICP-MS.
- Elaborare le placenta e i fegati fetali per la quantificazione del ferro eme.
NOTA: Dopo l'estrazione del ferro nonheme nella fase 1, il ferro rimanente nel pellet è prevalentemente eme.- Registrare il peso di ciascun pellet dal punto 4.1.7.
- Digerire i pellet in 10 ml di concentrato 70% HNO3 integrato con 1 mL di 30% H 2 O2
NOTA: Consultare il nucleo o il centro ICP-MS per ottimizzare il volume di HNO3 per studi specifici; Il volume dipenderà in parte dal peso del campione. - Riscaldare i campioni a 200 °C per 15 minuti.
- Inviare i campioni per l'analisi ICP-MS.
NOTA: Se non è richiesta la distinzione tra fonti di ferro eme e nonheme e viene misurato solo il ferro totale, l'intero tessuto può essere digerito in HNO3 come primo passo.
5. Analisi dei dati
NOTA: I dati di ICP-MS sono stati forniti come concentrazioni di 56Fe e 58Fe in ng/mL o mg, ppb (Tabella 1). 56 Fe è l'isotopo di ferro più abbondante in natura e la sua misurazione riflette l'accumulo di ferro nella placenta / embrione durante l'intera gravidanza, mentre la misurazione di 58Fe riflette il ferro che è stato trasferito durante 6 ore dopo l'iniezione.
- Sottrarre l'abbondanza naturale di 58 Fe (0,28% del Fe) totale dai valori misurati di 58Fe.
- Calcola il totale nonheme 58Fe.
- Calcolare il ferro noneme totale del fegato embrionale (ng) moltiplicando prima la concentrazione di ferro (ng/mL) calcolata al punto 5.1 per il volume (mL) durante l'elaborazione iniziale al punto 4.1.2 per stimare il totale di 58Fe.
- Calcolare la quantità di ferro nell'intera placenta prendendo il peso totale della placenta misurato nella fase 3.6.6 e dividendolo per il peso della placenta trattata nella fase 4.1.1. Moltiplicare questo valore per il ferro noneme totale (ng) calcolato al punto 5.2.1 per ottenere il contenuto totale di nonheme 58Fe della placenta.
- Calcola eme totale 58Fe.
- Calcolare l'eme totale 58Fe moltiplicando prima la concentrazione di ferro (ng/mg) calcolata nella fase 5.1 per il peso del pellet (in mg) misurato nella fase 4.2.1.
- Quindi, dividere il peso totale della placenta misurato nella fase 3.5.1 per il peso del pellet di placenta misurato nella fase 4.2.1. Moltiplicare questo valore per il ferro eme totale (ng) calcolato al punto 5.3.1 per ottenere il contenuto totale di eme 58Fe della placenta.
- Sommare i valori calcolati di nonheme ed eme 58Fe per determinare il contenuto totale di ferro per ciascun tessuto.
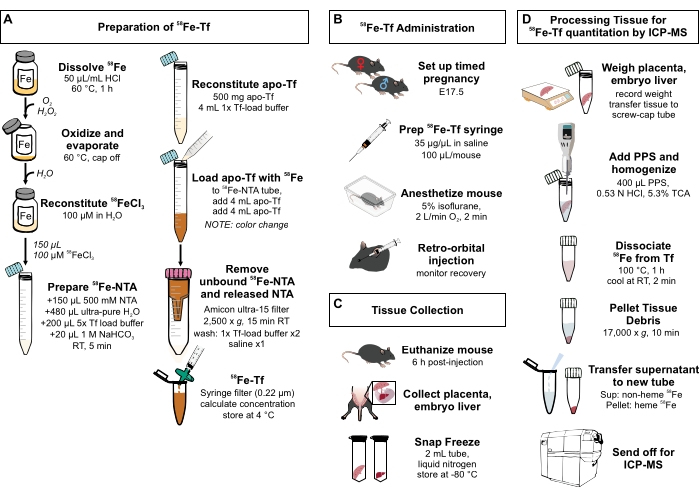
Figura 1: Riepilogo visivo dei passaggi del protocollo . (A) Preparazione di 58Fe-transferrina. (B) Somministrazione in vivo di 58Fe-transferrina. (C) Raccolta e conservazione dei tessuti. (D) Trattamento della placenta e del fegato embrionale per la quantificazione di specie metalliche mediante ICP-MS. Abbreviazioni: Fe = ferro; NTA = acido nitrilotriacetico; Tf = transferrina; PPS = soluzione di precipitazione proteica; Sup = supernatante; TCA = acido tricloroacetico; ICP-MS = spettrometria di massa al plasma accoppiato induttivamente. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Uno studio precedente che utilizzava isotopi di ferro stabili per misurare il trasporto del ferro ha dimostrato che la carenza materna di ferro ha provocato la downregulation dell'esportatore di ferro della placenta, FPN4. FPN è l'unico esportatore di ferro noto per i mammiferi e l'assenza di FPN durante lo sviluppo provoca la morte embrionale prima di E9.529. Per determinare se la diminuzione osservata nell'espressione di FPN si traducesse funzionalmente in una diminuzion...
Discussione
Il ferro è importante per molti processi biologici e il suo movimento e la sua distribuzione all'interno del corpo sono altamente dinamici e regolati. Gli isotopi stabili del ferro forniscono un'alternativa coerente e conveniente agli isotopi radioattivi per la valutazione della dinamica dell'omeostasi del ferro. Un passo fondamentale nel protocollo è tenere traccia di tutti i pesi e volumi dei tessuti. Il ferro è un elemento e quindi non può essere sintetizzato né scomposto. Pertanto, se tutti i pesi e i volumi son...
Divulgazioni
EN è co-fondatore scientifico di Intrinsic LifeSciences e Silarus Pharma e consulente per Protagonist, Vifor, RallyBio, Ionis, Shield Therapeutics e Disc Medicine. VS non dichiara conflitti.
Riconoscimenti
Gli autori riconoscono l'uso della struttura ICP-MS all'interno del Centro UC per le implicazioni ambientali della nanotecnologia nel CNSI dell'UCLA per la loro assistenza nell'ottimizzazione del protocollo per 58misurazioni Fe. Lo studio è stato sostenuto dal NIH National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) (K01DK127004, a VS) e NIH National Institute of Child Health and Human Development (NICHD) (R01HD096863, a EN).
Materiali
| Name | Company | Catalog Number | Comments |
| 58Fe-iron metal | Trace Sciences International | Fe-58 | |
| Amicon ultra-15 centrifugal filter, 30 kDa cutoff | Millipore Sigma | UFC903024 | |
| Centrifuge tubes, 15 mL | Fisher Scientific | 14-959-49B | |
| Centrifuge tubes, 50 mL | Millipore Sigma | CLS430829 | |
| Centrifuge, Sorvall Legend Micro 17 Microcentrifuge | Fisher Scientific | 75002432 | |
| Centrifuge, Sorvall Legend RT | |||
| Delicate task wipers | Fisher Scientific | 06-666 | |
| Diet: iron-deficient (4 ppm iron) | Envigo Teklad | TD.80396 | |
| Diet: standard chow (185 ppm iron) | PicoLab | 5053 | |
| Dissecting scissor with 30 mm cutting edge | VWR | 25870-002 | |
| Forceps 4-1/2 inch length | McKesson | 157-469 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Homogenizer, Bio-Gen PRO200 | PROScientific | 01-01200 | |
| Human apo-transferrin (apo-Tf) | Celliance | 4452-01 | no longer available, alternative: Millipore 616419 |
| Hydrochloric acid (HCl) | Fisher Scientific | A144S-500 | |
| Hydrogen peroxide (H2O2), 35 wt.% solution in water | Cole-Parmer | EW-88216-36 | |
| Insulin Syringes, BD Lo-Dose U-100 | Fisher Scientific | 14-826-79 | |
| Isoflurane | VETone | 502017 | |
| Isoflurane vaporizor | Summit Anesthesia Solutions | ||
| Metal heat block | Fisher Scientific | ||
| Micro centrifuge tube with flat screw-cap | VWR | 16466-064 | |
| Microcentrifuge tubes 1.5 mL low-retention | Fisher Scientific | 02-681-320 | |
| Microcentrifuge tubes 2.0 mL low-retention | Fisher Scientific | 02-681-321 | |
| Millex-GP syringe filter unit, 0.22 µm, polyethersulfone, 33 mm, gamma-sterilized | Millipore Sigma | SLGP033RS | |
| Nitrilotriacetic acid (NTA) | Sigma | 72560-100G | |
| Needle 25 G x 5/8 in. hypodermic general use | Fisher Scientific | 14-826AA | |
| pH Strips, plastic pH5.0-9.0 | Fisher Scientific | 13-640-519 | |
| Razor blades 0.22 mm | VWR | 55411-050 | |
| Scale (g) | Mettler Toledo | PB1502-S | |
| Scale (mg) | Mettler Toledo | Balance XS204 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761-500G | |
| Sodium chloride (NaCl) | Fisher Scientific | S671-3 | |
| Sodium hydroxide (NaOH) | Fisher Scientific | SS266-1 | |
| Sterile syringe, slip tip (1 mL) | Fisher Scientific | 309659 | |
| Trichloroacetic acid (TCA) | Fisher Scientific | A322-500 | |
| Software | |||
| ImageLab | Bio-Rad | ||
| SigmaPlot | Systat |
Riferimenti
- Ganz, T. Systemic iron homeostasis. Physiological Reviews. 93 (4), 1721-1741 (2013).
- Aschemeyer, S., et al. Structure-function analysis of ferroportin defines the binding site and an alternative mechanism of action of hepcidin. Blood. 131 (8), 899-910 (2018).
- Sangkhae, V., Nemeth, E. Regulation of the iron homeostatic hormone hepcidin. Advances in Nutrition. 8 (1), 126-136 (2017).
- Sangkhae, V., et al. Effects of maternal iron status on placental and fetal iron homeostasis. Journal of Clinical Investigation. 130 (2), 625-640 (2020).
- Whittaker, P. G., Lind, T., Williams, J. G. Iron absorption during normal human pregnancy: a study using stable isotopes. British Journal of Nutrition. 65 (3), 457-463 (1991).
- Whittaker, P. G., Barrett, J. F., Lind, T. The erythrocyte incorporation of absorbed non-haem iron in pregnant women. British Journal of Nutrition. 86 (3), 323-329 (2001).
- O'Brien, K. O., Zavaleta, N., Abrams, S. A., Caulfield, L. E. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy. American Journal of Clinical Nutrition. 77 (4), 924-930 (2003).
- Young, M. F., et al. Maternal hepcidin is associated with placental transfer of iron derived from dietary heme and nonheme sources. Journal of Nutrition. 142 (1), 33-39 (2012).
- Delaney, K. M., et al. Iron absorption during pregnancy is underestimated when iron utilization by the placenta and fetus is ignored. American Journal of Clinical Nutrition. 112 (3), 576-585 (2020).
- Klatt, K. C., Smith, E. R., Barberio, M. D. Toward a more stable understanding of pregnancy micronutrient metabolism. American Journal of Physiology-Endocrinology Metabolism. 321 (2), 260-263 (2021).
- Fisher, A. L., Nemeth, E. Iron homeostasis during pregnancy. American Journal of Clinical Nutrition. 106, 1567-1574 (2017).
- van Santen, S., et al. The iron regulatory hormone hepcidin is decreased in pregnancy: a prospective longitudinal study. Clinical Chemistry and Laboratory Medicine. 51 (7), 1395-1401 (2013).
- Millard, K. N., Frazer, D. M., Wilkins, S. J., Anderson, G. J. Changes in the expression of intestinal iron transport and hepatic regulatory molecules explain the enhanced iron absorption associated with pregnancy in the rat. Gut. 53 (5), 655-660 (2004).
- Bothwell, T. H., Pribilla, W. F., Mebust, W., Finch, C. A. Iron metabolism in the pregnant rabbit; iron transport across the placenta. American Journal of Physiology. 193 (3), 615-622 (1958).
- Dyer, N. C., Brill, A. B., Raye, J., Gutberlet, R., Stahlman, M. Maternal-fetal exchange of 59 Fe: radiation dosimetry and biokinetics in human and sheep studies. Radiation Research. 53 (3), 488-495 (1973).
- Contractor, S. F., Eaton, B. M. Role of transferrin in iron transport between maternal and fetal circulations of a perfused lobule of human placenta. Cell Biochemistry & Function. 4 (1), 69-74 (1986).
- Baker, E., Morgan, E. H. The role of transferrin in placental iron transfer in the rabbit. Quartly Jounrnal of Experimental Physiolology and Cognate Medical Sciences. 54 (2), 173-186 (1969).
- Fleming, R. E., Feng, Q., Britton, R. S. Knockout mouse models of iron homeostasis. Annual Review of Nutrition. 31, 117-137 (2011).
- Soares, M. J., Varberg, K. M., Iqbal, K. Hemochorial placentation: development, function, and adaptations. Biology of Reproduction. 99 (1), 196-211 (2018).
- Jones, H. N., Powell, T. L., Jansson, T. Regulation of placental nutrient transport--a review. Placenta. 28 (8-9), 763-774 (2007).
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nature Reviews Genetics. 2 (7), 538-548 (2001).
- Takata, K., Kasahara, T., Kasahara, M., Ezaki, O., Hirano, H. Immunolocalization of glucose transporter GLUT1 in the rat placental barrier: possible role of GLUT1 and the gap junction in the transport of glucose across the placental barrier. Cell and Tissue Research. 276 (3), 411-418 (1994).
- Shin, B. C., et al. Immunolocalization of GLUT1 and connexin 26 in the rat placenta. Cell and Tissue Research. 285 (1), 83-89 (1996).
- Bastin, J., Drakesmith, H., Rees, M., Sargent, I., Townsend, A. Localisation of proteins of iron metabolism in the human placenta and liver. British Journal of Haematology. 134 (5), 532-543 (2006).
- Klausner, R. D., Ashwell, G., van Renswoude, J., Harford, J. B., Bridges, K. R. Binding of apotransferrin to K562 cells: explanation of the transferrin cycle. Proceedings of the National Academy of Sciences of the United States of America. 80 (8), 2263-2266 (1983).
- Tsunoo, H., Sussman, H. H. Characterization of transferrin binding and specificity of the placental transferrin receptor. Archives of Biochemistry and Biophysics. 225 (1), 42-54 (1983).
- Sangkhae, V., Nemeth, E. Placental iron transport: The mechanism and regulatory circuits. Free Radical Biology and Medicine. 133, 254-261 (2019).
- McCarthy, R. C., Kosman, D. J. Mechanistic analysis of iron accumulation by endothelial cells of the BBB. Biometals. 25 (4), 665-675 (2012).
- Donovan, A., et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell Metabolism. 1 (3), 191-200 (2005).
- Stefanova, D., et al. Endogenous hepcidin and its agonist mediate resistance to selected infections by clearing non-transferrin-bound iron. Blood. 130 (3), 245-257 (2017).
- Ramos, E., et al. Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice. Hepatology. 53 (4), 1333-1341 (2011).
- Kulandavelu, S., Qu, D., Adamson, S. L. Cardiovascular function in mice during normal pregnancy and in the absence of endothelial NO synthase. Hypertension. 47 (6), 1175-1182 (2006).
- Lu, C. C., Matsumoto, N., Iijima, S. Placental transfer and body distribution of nickel chloride in pregnant mice. Toxicology and Applied Pharmacology. 59 (3), 409-413 (1981).
- Gunshin, H., et al. Slc11a2 is required for intestinal iron absorption and erythropoiesis but dispensable in placenta and liver. Journal of Clinical Investigation. 115 (5), 1258-1266 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon