A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد العائد الكمومي للأيزومرات الضوئية ل Hydrazone Photoswitch
* These authors contributed equally
In This Article
Summary
العائد الكمومي للأيزومرات الضوئية هو خاصية فيزيائية ضوئية أساسية يجب تحديدها بدقة في التحقيق في مفاتيح التبديل الضوئية المطورة حديثا. هنا ، نصف مجموعة من الإجراءات لقياس العائد الكمومي للأيزومرات الضوئية للهيدرازون الفوتوكرومي كنموذج تبديل ضوئي ثنائي الاستقرار.
Abstract
تعد الجزيئات العضوية التي تخضع لتحولات هيكلية مدفوعة بالضوء مكونات رئيسية لبناء أنظمة جزيئية تكيفية ، ويتم استخدامها في مجموعة واسعة من التطبيقات. في معظم الدراسات التي تستخدم مفاتيح التبديل الضوئي ، يتم تحديد العديد من الخصائص الفيزيائية الضوئية المهمة مثل الأطوال الموجية القصوى للامتصاص والانبعاثات ، ومعامل التوهين المولي ، وعمر التألق ، والعائد الكمومي للأيزومرات الضوئية بعناية للتحقيق في حالاتها الإلكترونية وعملياتها الانتقالية. ومع ذلك، فإن قياس العائد الكمومي للأيزومرات الضوئية، وكفاءة الأيزومرات الضوئية فيما يتعلق بالفوتونات الممتصة، في بيئة مختبرية نموذجية غالبا ما يكون معقدا وعرضة للخطأ لأنه يتطلب تنفيذ قياسات وحسابات طيفية صارمة تستند إلى طريقة تكامل مناسبة. تقدم هذه المقالة مجموعة من الإجراءات لقياس العائد الكمومي للإيزومرات الضوئية لمبدل ضوئي ثنائي الاستقرار باستخدام هيدرازون فوتوكرومي. نتوقع أن تكون هذه المقالة دليلا مفيدا للتحقيق في مفاتيح التبديل الضوئية ثنائية الاستقرار التي يتم تطويرها بشكل متزايد.
Introduction
جذبت الجزيئات العضوية الفوتوكرومية اهتماما كبيرا في مجموعة واسعة من التخصصات العلمية حيث أن الضوء هو حافز فريد يمكن أن يدفع النظام بعيدا عن توازنه الديناميكي الحراري بشكل غير جراحي1. يسمح تشعيع الضوء بالطاقات المناسبة بالتشكيل الهيكلي للمفاتيح الضوئية بدقة مكانية زمانية عالية2،3،4. وبفضل هذه المزايا، تم تطوير واستخدام أنواع مختلفة من مفاتيح التبديل الضوئي القائمة على الأيزومرات التكوينية للروابط المزدوجة (مثل ستيلبين، وأزوبنزين، وإيمين، وفوماراميدس، وثيوانديجوس) وفتح/إغلاق الحلقة (مثل السبيروبيران، وثنائي ثيينيليثينز، والفولجيد، وقنوات ستينهاوس المتقبلة من المانحين) كمكونات أساسية للمواد التكيفية على مختلف مقاييس الطول. تتضمن التطبيقات التمثيلية للمفاتيح الضوئية المواد الفوتوكرومية ، وتوصيل الأدوية ، والمستقبلات والقنوات القابلة للتحويل ، وتخزين المعلومات أو الطاقة ، والآلات الجزيئية5،6،7،8،9،10،11،12. في معظم الدراسات التي تقدم مفاتيح ضوئية مصممة حديثا ، تتميز خصائصها الفيزيائية الضوئية مثل λmax للامتصاص والانبعاث ، ومعامل التوهين المولي (ε) ، وعمر التألق ، والعائد الكمومي للأيزومرات الضوئية بدقة. ويوفر التحقيق في هذه الخصائص معلومات أساسية عن الحالات والتحولات الإلكترونية الحاسمة لفهم الخصائص البصرية وآلية الأيزومير.
ومع ذلك، فإن القياس الدقيق للعائد الكمومي للأيزومرات الضوئية - عدد أحداث الأيزومرات الضوئية التي حدثت مقسوما على عدد الفوتونات عند الطول الموجي للإشعاع الذي يمتصه المتفاعل - غالبا ما يكون معقدا في بيئة مختبرية نموذجية لعدة أسباب. يتم تحديد العائد الكمومي للأيزومرات الضوئية بشكل عام من خلال مراقبة تقدم التفاعل وقياس عدد الفوتونات الممتصة أثناء التشعيع. الشاغل الرئيسي هو أن كمية امتصاص الفوتون لكل وحدة زمنية تتغير تدريجيا لأن الامتصاص الكلي بواسطة المحلول يتغير بمرور الوقت مع استمرار التفاعل الكيميائي الضوئي. لذلك ، يعتمد عدد المواد المتفاعلة المستهلكة لكل وحدة زمنية على القسم الزمني الذي يتم قياسه فيه أثناء التشعيع. وبالتالي ، فإن المرء ملزم بتقدير العائد الكمومي للأيزومرات الضوئية الذي يتم تعريفه بشكل تفاضلي.
تنشأ مشكلة أكثر إزعاجا عندما يمتص كل من المتفاعل والمنتج الضوئي الضوء عند الطول الموجي للإشعاع. في هذه الحالة ، يحدث الأيزومرات الكيميائية الضوئية في كلا الاتجاهين (أي تفاعل قابل للانعكاس الضوئي). لا يمكن الحصول على العائدين الكموميين المستقلين للتفاعلات الأمامية والخلفية مباشرة من معدل التفاعل المرصود. شدة الضوء غير الدقيقة هي أيضا سبب شائع للخطأ. على سبيل المثال ، تغير شيخوخة المصباح تدريجيا من شدته ؛ ينخفض إشعاع مصباح قوس زينون عند 400 نانومتر بنسبة 30٪ بعد 1000 ساعة من العملية14. إن انتشار الضوء غير المتزامن يجعل إشعاع الحادث الفعلي أصغر بكثير من القوة الاسمية للمصدر. وبالتالي ، من الأهمية بمكان تحديد تدفق الفوتون الفعال بدقة. تجدر الإشارة إلى أن الاسترخاء الحراري للشكل غير المستقر في درجة حرارة الغرفة يجب أن يكون صغيرا بما يكفي لتجاهله.
تقدم هذه الورقة مجموعة من الإجراءات لتحديد العائد الكمومي للأيزومرات الضوئية لمفتاح ضوئي ثنائي الاستقرار. تم تسليط الضوء على عدد من مفاتيح الهيدرازون الضوئية التي طورتها مجموعة Aprahamian ، فريق البحث الرائد في هذا المجال ، بفضل الأيزومرات الضوئية الانتقائية والاستقرار الملحوظ لأيزومراتها غير المستقرة15،16،17. وتتألف مفاتيح التبديل الضوئية للهيدرازون من حلقتين عطريتين تربطهما مجموعة هيدرازون، وتخضع الرابطة C=N لأيزومرات E/Z انتقائية عند التشعيع بأطوال موجية مناسبة (الشكل 1). وقد تم دمجها بنجاح كمكونات متحركة للأنظمة الجزيئية الديناميكية18،19،20،21. في هذا العمل، قمنا بإعداد مجموعات أميد جديدة تحمل مشتقات الهيدرازون وحققنا في خصائصها الضوئية لتحديد العائد الكمومي للأيزومرات الضوئية.
Protocol
1. 1H الحصول على طيف الرنين المغناطيسي النووي في الحالة الثابتة ضوئيا (PSS)
- في أنبوب الرنين المغناطيسي النووي للكوارتز الطبيعي الذي يحتوي على 4.2 ملغ (0.01 ملليمول) من مفتاح الهيدرازون 1 ، أضف 1.0 مل من ثنائي ميثيل سلفوكسيد الوتر (DMSO-d 6). نقل نصف الحل إلى أنبوب NMR آخر.
- ضع أحد أنابيب الرنين المغناطيسي النووي 1 سم أمام مصباح قوس زينون المجهز بمرشح تمرير النطاق الترددي 436 نانومتر. ابدأ التشعيع إلى عينة الرنين المغناطيسي النووي وسجل طيفا 1H NMR كل يوم حتى لا يكون هناك تغيير في الأطياف حيث يصل المفتاح 1 إلى PSS. بعد الوصول إلى PSS ، احتفظ بأنبوب الرنين المغناطيسي النووي في الظلام في درجة حرارة الغرفة وسجل طيف الرنين المغناطيسي النووي 1H بعد 12 ساعة لمراقبة تقدم الاسترخاء الحراري.
ملاحظة: لا يظهر المفتاح 1 أي تغيير ملموس في طيف الرنين المغناطيسي النووي 1H في درجة حرارة الغرفة بسبب طبيعته المستقرة. - بالنسبة لأنبوب الرنين المغناطيسي النووي الآخر، كرر الخطوة 1.2 باستخدام مرشح ممر نطاق ترددي 340 نانومتر للحصول على طيف الرنين المغناطيسي النووي 1H في PSS تحت تشعيع 340 نانومتر.
- افتح ملفات fid لأطياف الرنين المغناطيسي النووي في PSSs باستخدام برنامج معالجة الرنين المغناطيسي النووي. دمج مجموعة مميزة من القمم (H1: C2 بروتون الكينولين، H2: البروتون في وضع شبه مع مجموعة الهيدرازون، H3: CH3 من إستر الإيثيل) من الأيزومرات المميزة وحساب نسبة الأيزومرية (الشكل 2).
ملاحظة: التراكيب (نسبة [1-Z]:[1-E]) تحت 436 نانومتر و 340 نانومتر تشعيع هي 8:92 و 82:18 ، على التوالي.
2. التحليل الطيفي لامتصاص الأشعة فوق البنفسجية في PSS
- في قارورة زجاجية تحتوي على 12.6 ملغ (0.03 ملليمول) من 1 ، أضف 2 مل من DMSO من الدرجة الطيفية. خذ 100 ميكرولتر من المحلول وخفف مع 1400 ميكرولتر من DMSO لجعل محلول 1 mM من 1. انقل 20 ميكرولتر من محلول 1 mM من 1 إلى كوفيت كوارتز بطول مسار بصري 1.0 سم وتمييع باستخدام 1980 ميكرولتر من DMSO لصنع محلول 10 ميكرومتر من 1. أغلق الكوفيت بسدادة PTFE واحتفظ بالعينة في الظلام.
- تحضير كوفيت كوارتز آخر يحتوي على 2 مل من DMSO كعينة فارغة. قم بقياس طيف UV-Vis للعينة الفارغة لتصحيح خط الأساس.
- ضع العينة من الخطوة 2.1 1 سم أمام مصباح قوس زينون المجهز بمرشح تمرير النطاق الترددي 436 نانومتر. ابدأ التشعيع في العينة وقم بقياس طيف UV-Vis كل 2 ساعة حتى لا يكون هناك تغيير في الأطياف حيث يصل 1 إلى PSS (الشكل 3).
ملاحظة: الوقت المستغرق للوصول إلى PSS لعينة التحليل الطيفي UV-Vis أقصر بكثير من عينة الرنين المغناطيسي النووي ذات التركيز الأعلى. - كرر الخطوة 2.3 باستخدام مرشح ممر النطاق الترددي 340 نانومتر للحصول على طيف UV-Vis في PSS تحت تشعيع 340 نانومتر.
- استنتج أطياف الامتصاص النقية 1-Z و 1-E باستخدام Eq (1) و Eq (2) (الشكل 4).
 (1)
(1)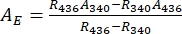 (2)
(2)
حيث R 436 = نسبة 1-Z في PSS تحت 436 نانومتر من التشعيع ؛ R 340 = نسبة 1-Z في PSS تحت 340 نانومتر من التشعيع ؛ A 436 = امتصاص 1 في DMSO في PSS تحت تشعيع 436 نانومتر ؛ A 340 = امتصاص 1 في DMSO في PSS تحت تشعيع 340 نانومتر. - احسب معاملات التوهين المولية النقية 1-Z و1-E في جميع الأطوال الموجية بقسمة الامتصاص المرصود على تركيز العينة (10 ميكرومتر) وطول المسار البصري (1 سم).
3. الدراسات الحركية على الاسترخاء الحراري
- قم بتسخين زيت السيليكون المملوء في دورة حمام التدفئة إلى درجة الحرارة المطلوبة (131 درجة مئوية) وتحقق مما إذا كانت درجة حرارة الحمام مستقرة. اغمر عينتين من الرنين المغناطيسي النووي من الخطوة 1.2 في حمام التدفئة.
ملاحظة: يتم ضبط درجة الحرارة ومدة التدفئة اعتمادا على معدل الاسترخاء. - بعد 1 ساعة من التسخين ، انقل أنابيب الرنين المغناطيسي النووي بسرعة إلى حمام ثلج جاف لإيقاف الاسترخاء الحراري الناجم عن الحرارة الكامنة (الشكل 5).
ملاحظة: قد تؤدي درجة حرارة التسخين غير الدقيقة أو الوقت إلى خطأ جسيم في تقدير ثابت المعدل. - قم بإذابة عينات الرنين المغناطيسي النووي التي تم الحصول عليها من الخطوة 3.2 في درجة حرارة الغرفة وتأكد من إزالة الجليد من DMSO. سجل أطياف الرنين المغناطيسي النووي 1H للعينات.
- كرر الخطوات 3.1-3.3 حتى لا يكون هناك تغيير في أطياف الرنينالمغناطيسي النووي 1 H حيث يصل 1 إلى التوازن الديناميكي الحراري.
- كرر الخطوات من 3.1 إلى 3.4 عند درجات حرارة مختلفة (134 و137 و140 و143 درجة مئوية).
- افتح ملفات fid لأطياف الرنين المغناطيسي النووي التي تم الحصول عليها أثناء التسخين عند 131 درجة مئوية. احسب متوسط نسب الأيزومرية كما هو موضح في الخطوة 1.4. احسب تركيز 1-E (أيزومر غير مستقر) استنادا إلى إجمالي تركيز العينة (10 مللي متر) ونسبة الأيزومر.
- ارسم متوسط تركيز 1-E (C E) كدالة لوقت التسخين. قم بإجراء ملاءمة أسية للبيانات للحصول على معدل ثابت للاسترخاء الحراري باستخدام Eq (3) 15,22 (الشكل 6).
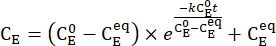 (3)
(3)
حيث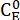 (M) = تركيز 1-E في الحالة الأولية ؛ (M) = تركيز 1-E عند التوازن الديناميكي الحراري عند درجة حرارة محددة ؛
(M) = تركيز 1-E في الحالة الأولية ؛ (M) = تركيز 1-E عند التوازن الديناميكي الحراري عند درجة حرارة محددة ؛ 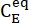 k (s-1) = معدل ثابت الاسترخاء الحراري عند درجة حرارة محددة ؛ t (s) = وقت التسخين.
k (s-1) = معدل ثابت الاسترخاء الحراري عند درجة حرارة محددة ؛ t (s) = وقت التسخين. - كرر الخطوات من 3.6 إلى 3.7 باستخدام البيانات التي تم الحصول عليها في درجات حرارة مختلفة.
- قم برسم ln(k) مقابل
 إجراء تناسب خطي وفقا لمعادلة Arrhenius (Eq (4)) لاستقراء ثابت المعدل في درجة حرارة الغرفة (الشكل 7).
إجراء تناسب خطي وفقا لمعادلة Arrhenius (Eq (4)) لاستقراء ثابت المعدل في درجة حرارة الغرفة (الشكل 7).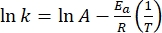 (4)
(4)
حيث A = العامل ما قبل الأسي ؛ Ea (J·mol-1) = طاقة التنشيط للاسترخاء الحراري. R = ثابت الغاز المثالي (8.3145 J·mol-1 K-1) ؛ T (K) = درجة الحرارة المطلقة. - احسب عمر النصف الحراري 1-E في درجة حرارة الغرفة باستخدام Eq (5).
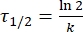 (5)
(5)
حيث τ 1/2 (s) = عمر النصف الحراري ل 1-E في درجة حرارة الغرفة ؛ k (s-1) = معدل ثابت الاسترخاء الحراري في درجة حرارة الغرفة الذي تم الحصول عليه من الخطوة 3.9. - إذا تم تقدير ثابت معدل الاسترخاء الحراري عند درجة حرارة واحدة فقط، فاحسب ثابت المعدل في درجة حرارة الغرفة باستخدام معادلة آيرينغ المعاد ترتيبها التالية (Eq (6))18,23.
 (6)
(6)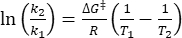 (7)
(7)
حيث (J·mol-1) = طاقة جيبس للتنشيط للاسترخاء الحراري ؛ k 1 (s-1) = ثابت معدل الاسترخاء الحراري المقدر عند درجة الحرارة المرتفعة ؛ k2 (s-1) = ثابت معدل الاسترخاء الحراري في درجة حرارة الغرفة (298.15 K) ؛ T 1 (K) = درجة الحرارة المطلقة التي يتم عندها الحصول على k1 ؛ (K) = درجة حرارة الغرفة (298.15 K).
(J·mol-1) = طاقة جيبس للتنشيط للاسترخاء الحراري ؛ k 1 (s-1) = ثابت معدل الاسترخاء الحراري المقدر عند درجة الحرارة المرتفعة ؛ k2 (s-1) = ثابت معدل الاسترخاء الحراري في درجة حرارة الغرفة (298.15 K) ؛ T 1 (K) = درجة الحرارة المطلقة التي يتم عندها الحصول على k1 ؛ (K) = درجة حرارة الغرفة (298.15 K).
4. قياس الأكتينومترية فيريوكسولات
ملاحظة: يجب إجراء جميع إجراءات قياس الأكتينومترات فيريوكسالات في الظلام أو >600 نانومتر لمنع تأثير الضوء المحيط.
- في قارورة زجاجية سعة 20 مل تحتوي على 29.48 ملغ (0.06 ملليمول) من ثلاثي هيدرات فيريوكسالات البوتاسيوم، أضف 8 مل من الماء منزوع الأيونات. أضف 1 مل من 0.5 م مائي H 2 SO 4 إلى محلول فيريوكسالات وخفف إلى 10 مل بالماء منزوع الأيونات لإعداد 0.006 م فيريوكسالات في محلول مائي H2SO4 0.05 م.
- في قارورة زجاجية أخرى سعة 20 مل تحتوي على 10 ملغ من 1,10-phenanthroline و 1.356 g من خلات الصوديوم اللامائية ، أضف 10 مل من 0.5 M مائي H2SO4 لصنع محلول فينانثرولين مخزن مؤقتا بنسبة 0.1٪ (w / v).
- انقل 2 مل من محلول فيريوكسالات 0.006 M من الخطوة 4.1 إلى كوفيت كوارتز بطول مسار بصري 1.0 سم. أغلق الكوفيت بسدادة PTFE واحتفظ بالعينة في الظلام.
- تحضير كوفيت كوارتز آخر يحتوي على 2 مل من 0.05 م مائي H2SO4 كعينة فارغة. قياس امتصاص الأشعة فوق البنفسجية للعينة الفارغة لتصحيح خط الأساس.
- قم بقياس امتصاص الأشعة فوق البنفسجية لمحلول 0.006 M ferrioxalate. أوجد جزء الضوء الممتص باستخدام امتصاصات محلول فيريوكسالات 0.006 M عند 340 و436 نانومتر وEq (8) (الشكل 8).
 (8)
(8)
حيث f = جزء الضوء الممتص بواسطة محلول 0.006 M ferrioxalate ؛ A λ = امتصاص محلول فيريوكسالات 0.006 M عند الطول الموجي λ. - قم بإعداد اثنين من كوفيت الكوارتز بطول مسار بصري 1.0 سم وأضف 2 مل من محلول 0.006 M ferrioxalate.
- ضع إحدى العينات من الخطوة 4.6 1 سم أمام مصباح قوس زينون المجهز بمرشح ممر نطاق 436 نانومتر. احتفظ بالعينة الأخرى في الظلام. بدء التشعيع إلى العينة لمدة 90 ثانية. بعد التشعيع ، أضف 0.35 مل من محلول الفينانثرولين المخزن مؤقتا بنسبة 0.1٪ وشريط مغناطيسي إلى كلا الكوفيتين متبوعا بالتحريك لمدة 1 ساعة في الظلام لتشكيل مركب [Fe(phen)3] 2+ .
ملاحظة: يتم تقليل Ferrioxalate كيميائيا ضوئيا إلى Fe2 + ، يليه التكوين الكمي تقريبا لمركب حديد tris-1,10-phenanthroline (II). - قم بقياس طيف امتصاص الأشعة فوق البنفسجية للعينة غير المشععة من الخطوة 4.6 لتصحيح خط الأساس.
- قم بقياس طيف امتصاص UV-Vis للعينة المشععة من الخطوة 4.7.
- كرر الخطوات من 4.6 إلى 4.9 باستخدام عامل تصفية ممر نطاق ترددي 340 نانومتر (الشكل 9).
ملاحظة: بمجرد تعرض عينة فيريوكسالات للضوء، لا يمكن إعادة استخدام العينة. - احسب تدفق الفوتون المولي الذي يصل إلى الكوفيت باستخدام Eq (9).
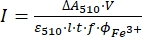 (9)
(9)
حيث I (mol·s-1) = تدفق الفوتون المولي الذي يصل إلى الكوفيت ؛ ΔA 510 = الفرق في الامتصاص عند 510 نانومتر بين العينات غير المشععة والمشععة. V = الحجم الكلي للمحلول (2.35 مل) ؛ ε510 = معامل التوهين المولي ل [Fe(phen)3]2+ المركب (11100 M-1 cm-1)24; I = طول المسار البصري لكوفيت الكوارتز (1.0 سم) ؛ t = وقت التشعيع (90 ثانية) ؛ f = الجزء الممتص من الضوء الذي تم الحصول عليه من الخطوة 4.5 ؛ Φ Fe 3+ = العائد الكمومي للاختزال الضوئي ل Fe 3+ إلى Fe 2+ (1.22 ل 340 نانومتر ، 1.11 ل 436 نانومتر)25.
5. تحديد العائد الكمومي للأيزومرات الضوئية
- قم بإعداد كوفيت كوارتز بطول مسار بصري 1.0 سم يحتوي على 2 مل من DMSO كعينة فارغة. قياس امتصاص الأشعة فوق البنفسجية للعينة الفارغة لتصحيح خط الأساس.
- قم بإعداد كوفيت كوارتز بطول مسار بصري 1.0 سم يحتوي على 2 مل من محلول 10 ميكرومتر من 1 في DMSO تم الحصول عليه من الخطوة 2.4 (مخصب Z). ختم كوفيت مع سدادة PTFE.
- ضع العينة من الخطوة 5.2 1 سم أمام مصباح قوس زينون المجهز بمرشح تمرير النطاق الترددي 436 نانومتر. ابدأ التشعيع عند 436 نانومتر للعينة وقم بقياس طيف امتصاص الأشعة فوق البنفسجية - Vis بفترات مختلفة حتى لا يكون هناك تغيير في الأطياف عندما يصل 1 إلى PSS (الشكل 10).
ملاحظة: يجب أن يكون إعداد التشعيع هو نفسه المستخدم لقياس تدفق الفوتون المولي. وينبغي تعديل الفاصل الزمني للتشعيع استنادا إلى معدل الأيزومرات الضوئية. بشكل عام ، 15-20 نقطة بيانات قبل الوصول إلى PSS مناسبة. - قم بإعداد كوفيت كوارتز بطول مسار بصري 1.0 سم يحتوي على 2 مل من محلول 10 ميكرومتر من 1 في DMSO تم الحصول عليه من الخطوة 2.3 (E-enriched). ختم كوفيت مع سدادة PTFE.
- استبدل عامل تصفية ممر النطاق الترددي 436 نانومتر بمرشح ممر النطاق الترددي 340 نانومتر وكرر الخطوة 5.3 للعينة التي تم الحصول عليها من الخطوة 5.4.
- احسب العامل الحركي الضوئي F(t) باستخدام الامتصاص المرصود من الخطوة 5.3 و Eq (10)26.
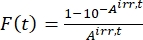 (10)
(10)
حيث Airr,t = الامتصاص عند الطول الموجي للتشعيع في الوقت t. - احسب العائد الكمومي الزائف Q باستخدام قيم العامل الحركي الضوئي التي تم الحصول عليها من الخطوة 5.6 و Eq (11)27.
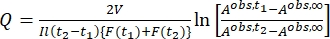 (11)
(11)
حيث Q (M-1 cm-1) = العائد الكمومي الزائف المعرف على أنه ;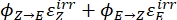 ; V(L) = حجم العينة; I (mol·s-1) = تدفق الفوتون المولي الذي يصل إلى الكوفيت. l (cm) = طول المسار البصري ؛ t 1, t2 (s) = النقطتان الزمنيتان المتتاليتان للإشعاع؛ F(t 1), F(t 2) = العوامل الحركية الضوئية في الوقت t 1 و t2 ، على التوالي ؛ A obs,t 1, A obs,t 2,A obs,∞ = الامتصاص عند طول موجي محدد في الوقت المناسب، t 1، و t 2 عند PSS، على التوالي.
; V(L) = حجم العينة; I (mol·s-1) = تدفق الفوتون المولي الذي يصل إلى الكوفيت. l (cm) = طول المسار البصري ؛ t 1, t2 (s) = النقطتان الزمنيتان المتتاليتان للإشعاع؛ F(t 1), F(t 2) = العوامل الحركية الضوئية في الوقت t 1 و t2 ، على التوالي ؛ A obs,t 1, A obs,t 2,A obs,∞ = الامتصاص عند طول موجي محدد في الوقت المناسب، t 1، و t 2 عند PSS، على التوالي.
ملاحظة: يوصى باستخدام الامتصاص عند λmax من 1-Z لضمان الدقة. - احسب متوسط قيمة العائد الكمومي الزائف باستخدام نقاط البيانات العشر الأولى.
- احسب الغلة الكمومية أحادية الاتجاه للإيزومرات الضوئية من Z-to-E وE-to-Z باستخدام Eq (12) وEq (13).
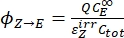 (12)
(12) (13)
(13)
حيث Φ Z→E و Φ E→Z = الغلة الكمومية أحادية الاتجاه لعمليات الأيزومرات الضوئية من Z إلى E و E-to-Z ، على التوالي ؛ ، (M-1 cm-1) = معاملات التوهين المولية 1-Z و 1-E عند الطول الموجي للإشعاع؛ (M) = تركيزات 1-Z و 1-Eعند PSS،
، (M-1 cm-1) = معاملات التوهين المولية 1-Z و 1-E عند الطول الموجي للإشعاع؛ (M) = تركيزات 1-Z و 1-Eعند PSS،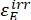 على التوالي؛
على التوالي؛ 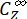
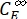 Ctot (M) = التركيز الكلي ل 1.
Ctot (M) = التركيز الكلي ل 1. - كرر الخطوات 5.6-5.9 باستخدام البيانات التي تم الحصول عليها من الخطوة 5.5 لحساب الغلة الكمومية للإيزومرات الضوئية أحادية الاتجاه تحت التشعيع عند 340 نانومتر.
النتائج
عند تشعيع 1 في أنبوب NMR مع ضوء 436 نانومتر (Z: E = 54: 46 في الحالة الأولية) ، تزداد نسبة 1-E بسبب أيزومرات Z-to-E السائدة لرابطة hydrazone C = N (الشكل 1). ويمكن الحصول بسهولة على النسبة الأيزومرية من شدة الإشارة النسبية للأيزومرات المتميزة في طيف الرنين ا...
Discussion
تم تطوير استراتيجيات مختلفة لضبط الخصائص الطيفية والتبديل للمفاتيح الضوئية ، ويتوسع سجل مفاتيح التبديل الضوئية بسرعة28. وبالتالي ، من الأهمية بمكان تحديد خصائصها الفيزيائية الضوئية بشكل صحيح ، ونتوقع أن تكون الطرق الملخصة في هذه المقالة دليلا مفيدا للمجربين. شريطة أن يكون م?...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من خلال منح أبحاث جامعة تشونغ آنغ في عام 2019 والمؤسسة الوطنية للبحوث في كوريا (NRF-2020R1C1C1011134).
Materials
| Name | Company | Catalog Number | Comments |
| 1,10-phenanthroline | Sigma-Aldrich | 131377-2.5G | |
| 340 nm bandpass filter, 25 mm diameter, 10 nm FWHM | Edmund Optics | #65-129 | |
| 436 nm bandpass filter, 25 mm diameter, 10 nm FWHM | Edmund Optics | #65-138 | |
| Anhydrous sodium acetate | Alfa aesar | A13184.30 | |
| Dimethyl sulfoxide | Samchun | D1138 | HPLC grade |
| Dimethyl sulfoxide-d6 | Sigma-Aldrich | 151874-25g | |
| Gemini 2000; 300 MHz NMR spectrometer | Varian | ||
| H2SO4 | Duksan | 235 | |
| Heating bath | JeioTech | CW-05G | |
| MestReNova 14.1.1 | Mestrelab Research S.L., https://mestrelab.com/ | ||
| Natural quartz NMR tube | Norell | S-5-200-QTZ-7 | |
| Potassium ferrioxalate trihydrate | Alfa aesar | 31124.06 | |
| Quartz absorption cell | Hellma | HE.110.QS10 | |
| UV-VIS spectrophotometer | Scinco | S-3100 | |
| Xenon arc lamp | Thorlabs | SLS205 | Fiber adapter was removed |
References
- Kathan, M., Hecht, S. Photoswitchable molecules as key ingredients to drive systems away from the global thermodynamic minimum. Chemical Society Reviews. 46, 5536-5550 (2017).
- Feringa, B. L., Browne, W. R. . Molecular Switches. 2nd ed. , (2011).
- Baroncini, M., Silvi, S., Credi, A. Photo- and redox-driven artificial molecular motors. Chemical Reviews. 120 (1), 200-268 (2020).
- Goulet-Hanssens, A., Eisenreich, F., Hecht, S. Enlightening materials with photoswitches. Advanced Materials. 32 (20), 1905966 (2020).
- Basílio, N., Pischel, U. Drug delivery by controlling a supramolecular host-guest assembly with a reversible photoswitch. Chemistry-A European Journal. 22 (43), 15208-15211 (2016).
- Wegener, M., Hansen, M. J., Driessen, A. J. M., Szymanski, W., Feringa, B. L. Photocontrol of antibacterial activity: shifting from UV to red light activation. Journal of the American Chemical Society. 139 (49), 17979-17986 (2017).
- Izquierdo-Serra, M., et al. Optical control of endogenous receptors and cellular excitability using targeted covalent photoswitches. Nature Communications. 7 (1), 12221 (2016).
- Mourot, A., et al. Rapid optical control of nociception with an ion-channel photoswitch. Nature Methods. 9 (4), 396-402 (2012).
- Griffiths, K., Halcovitch, N. R., Griffin, J. M. Long-term solar energy storage under ambient conditions in a MOF-based solid-solid phase-change material. Chemistry of Materials. 32 (23), 9925-9936 (2020).
- Sun, C. -. L., Wang, C., Boulatov, R. Applications of photoswitches in the storage of solar energy. ChemPhotoChem. 3 (6), 268-283 (2019).
- Gu, M., Zhang, Q., Lamon, S. Nanomaterials for optical data storage. Nature Reviews Materials. 1 (12), 16070 (2016).
- Roke, D., Wezenberg, S. J., Feringa, B. L. Molecular rotary motors: Unidirectional motion around double bonds. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 9423-9431 (2018).
- Stranius, K., Börjesson, K. Determining the photoisomerization quantum yield of photoswitchable molecules in solution and in the solid state. Scientific Reports. 7 (1), 41145 (2017).
- Schneider, W. E. Long term spectral irradiance measurements of a 1000-watt xenon arc lamp. NASA-CR. , 132533 (1974).
- Qian, H., Pramanik, S., Aprahamian, I. Photochromic hydrazone switches with extremely long thermal half-lives. Journal of the American Chemical Society. 139 (27), 9140-9143 (2017).
- Shao, B., et al. Solution and solid-state emission toggling of a photochromic hydrazone. Journal of the American Chemical Society. 140 (39), 12323-12327 (2018).
- Shao, B., Qian, H., Li, Q., Aprahamian, I. Structure property analysis of the solution and solid-state properties of bistable photochromic hydrazones. Journal of the American Chemical Society. 141 (20), 8364-8371 (2019).
- Moran, M. J., Magrini, M., Walba, D. M., Aprahamian, I. Driving a liquid crystal phase transition using a photochromic hydrazone. Journal of the American Chemical Society. 140 (42), 13623-13627 (2018).
- Guo, X., Shao, B., Zhou, S., Aprahamian, I., Chen, Z. Visualizing intracellular particles and precise control of drug release using an emissive hydrazone photochrome. Chemical Science. 11 (11), 3016-3021 (2020).
- Yang, S., et al. Dynamic enzymatic synthesis of γ-cyclodextrin using a photoremovable hydrazone template. Chem. 7 (8), 2190-2200 (2021).
- Yang, S., et al. Multistage reversible Tg photomodulation and hardening of hydrazone-containing polymers. Journal of the American Chemical Society. 143 (40), 16348-16353 (2021).
- Connors, K. A. . Chemical kinetics : the study of reaction rates in solution. , (1990).
- Shao, B., Qian, H., Li, Q., Aprahamian, I. Structure property analysis of the solution and solid-state properties of bistable photochromic hydrazones. Journal of the American Chemical Society. 141 (20), 8364-8371 (2019).
- Kuhn, H., Braslavsky, S., Schmidt, R. Chemical actinometry (IUPAC technical report). Pure and Applied Chemistry. 76 (12), 2105-2146 (2004).
- Murov, S. L., Carmichael, I., Hug, G. L. . Handbook of hotochemistry 2nd ed. Rev. And expanded. , (1993).
- Dürr, H., Bouas-Laurent, H. . Photochromism: Molecules and Systems. , (2003).
- Klán, P., Wirz, J. . Photochemistry of Organic Compounds: From Concepts to Practice. , (2009).
- Harris, J. D., Moran, M. J., Aprahamian, I. New molecular switch architectures. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 9414-9422 (2018).
- Maafi, M., Brown, R. G. The kinetic model for AB(1ϕ) systems: A closed-form integration of the differential equation with a variable photokinetic factor. Journal of Photochemistry and Photobiology A: Chemistry. 187, 319-324 (2007).
- Lahikainen, M., et al. Tunable photomechanics in diarylethene-driven liquid crystal network actuators. ACS Applied Materials & Interfaces. 12 (42), 47939-47947 (2020).
- Mallo, N., et al. Photochromic switching behaviour of donor-acceptor Stenhouse adducts in organic solvents. Chemical Communications. 52, 13576-13579 (2016).
- Feldmeier, C., Bartling, H., Riedle, E., Gschwind, R. M. LED based NMR illumination device for mechanistic studies on photochemical reactions - Versatile and simple, yet surprisingly powerful. Journal of Magnetic Resonance. 232, 39-44 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved