Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение квантового выхода фотоизомеризации гидразонового фотопереключателя
* Эти авторы внесли равный вклад
В этой статье
Резюме
Квантовый выход фотоизомеризации является фундаментальным фотофизическим свойством, которое должно быть точно определено при исследовании недавно разработанных фотопереключателей. Здесь мы описываем набор процедур для измерения квантового выхода фотоизомеризации фотохромного гидразона в качестве модельного бистабильного фотопереключателя.
Аннотация
Фотопереключающие органические молекулы, которые претерпевают структурные преобразования, управляемые светом, являются ключевыми компонентами для построения адаптивных молекулярных систем, и они используются в самых разных приложениях. В большинстве исследований с использованием фотопереключателей несколько важных фотофизических свойств, таких как максимальные длины волн поглощения и излучения, коэффициент затухания моляров, время жизни флуоресценции и квантовый выход фотоизомеризации, тщательно определяются для исследования их электронных состояний и переходных процессов. Однако измерение квантового выхода фотоизомеризации, эффективности фотоизомеризации по отношению к поглощенным фотонам, в типичных лабораторных условиях часто бывает сложным и подверженным ошибкам, поскольку требует выполнения строгих спектроскопических измерений и расчетов, основанных на соответствующем методе интеграции. В этой статье представлен набор процедур для измерения квантового выхода фотоизомеризации бистабильного фотопереключателя с использованием фотохромного гидразона. Мы ожидаем, что эта статья станет полезным руководством для исследования бистабильных фотопереключателей, которые все чаще разрабатываются.
Введение
Фотохромные органические молекулы привлекли значительное внимание в широком спектре научных дисциплин, поскольку свет является уникальным стимулом, который может оттолкнуть систему от ее термодинамического равновесия неинвазивно1. Облучение света соответствующими энергиями позволяет структурно модулировать фотопереключатели с высокой пространственно-временной точностью 2,3,4. Благодаря этим преимуществам были разработаны и использованы в качестве основных компонентов адаптивных материалов в различных масштабах адаптивных материалов в различных масштабах. Репрезентативные применения фотопереключателей включают фотохромные материалы, доставку лекарств, переключаемые рецепторы и каналы, хранение информации или энергии и молекулярные машины 5,6,7,8,9,10,11,12. В большинстве исследований, представляющих недавно разработанные фотопереключатели, их фотофизические свойства, такие как λmax поглощения и излучения, коэффициент затухания моляров (ε), время жизни флуоресценции и квантовый выход фотоизомеризации, характеризуются тщательно. Исследование таких свойств дает ключевую информацию об электронных состояниях и переходах, которые имеют решающее значение для понимания оптических свойств и механизма изомеризации.
Однако точное измерение квантового выхода фотоизомеризации — числа событий фотоизомеризации, которые произошли, деленного на количество фотонов на длине волны облучения, поглощенной реагентом, — часто осложняется в типичных лабораторных условиях по нескольким причинам. Определение квантового выхода фотоизомеризации обычно достигается путем мониторинга продвижения реакции и измерения количества поглощенных фотонов во время облучения. Основная проблема заключается в том, что количество поглощения фотонов в единицу времени постепенно изменяется, потому что общее поглощение раствором изменяется со временем по мере протекания фотохимической реакции. Поэтому количество потребляемых реагентов в единицу времени зависит от временного отрезка, в котором оно измеряется во время облучения. Таким образом, необходимо оценить квантовый выход фотоизомеризации, который определяется дифференциально.
Более неприятная проблема возникает, когда и реагент, и фотопродукт поглощают свет на длине волны облучения. В этом случае фотохимическая изомеризация происходит в обоих направлениях (т.е. фоторежимая реакция). Два независимых квантовых выхода для прямой и обратной реакций не могут быть получены непосредственно из наблюдаемой скорости реакции. Неточная интенсивность света также является распространенной причиной ошибки. Например, старение луковицы постепенно меняет ее интенсивность; излучение ксеноновой дуговой лампы при 400 нм снижается на 30% после 1000 ч работы14. Распространение неколлимированного света делает фактическое падающее излучение значительно меньшим, чем номинальная мощность источника. Таким образом, крайне важно точно количественно оценить эффективный поток фотонов. Следует отметить, что тепловая релаксация метастабильной формы при комнатной температуре должна быть достаточно мала, чтобы ее игнорировать.
В этой статье представлен набор процедур для определения квантового выхода фотоизомеризации бистабильного фотопереключателя. Ряд фотопереключателей гидразона, разработанных группой Aprahamian, новаторской исследовательской группой в этой области, оказались в центре внимания благодаря их селективной фотоизомеризации и замечательной стабильности их метастабильных изомеров 15,16,17. Их гидразонные фотопереключатели содержат два ароматических кольца, соединенных гидразонной группой, а связь C=N подвергается селективной изомеризации E/Z при облучении на соответствующих длинах волн (рисунок 1). Они были успешно включены в качестве подвижных компонентов динамических молекулярных систем 18,19,20,21. В этой работе мы подготовили новое производное гидразона, несущее амидные группы, и исследовали его фотопереключающие свойства для определения квантового выхода фотоизомеризации.
протокол
1. Получение спектра ЯМР 1Ч в фотостационарном состоянии (PSS)
- В естественную кварцевую ЯМР-трубку, содержащую 4,2 мг (0,01 ммоль) гидразонового переключателя 1, добавляют 1,0 мл дейтерированного диметилсульфоксида (DMSO-d 6). Перенесите половину раствора в другую ЯМР-трубку.
- Поместите одну из ЯМР-трубок на 1 см перед ксеноновой дуговой лампой, оснащенной полосовым фильтром 436 нм. Начните облучение образца ЯМР и записывайте спектр ЯМР 1Ч каждый день, пока не произойдет изменения в спектрах по мере того, как переключатель 1 достигнет PSS. После достижения PSS держите ЯМР-трубку в темноте при комнатной температуре и записывайте спектр ЯМР 1Ч через 12 ч для мониторинга прогресса тепловой релаксации.
ПРИМЕЧАНИЕ: Переключатель 1 не показывает каких-либо заметных изменений в спектре ЯМР 1Ч при комнатной температуре из-за его бистабильной природы. - Для другой ЯМР-трубки повторите шаг 1.2 с полосовым фильтром 340 нм для получения спектра ЯМР 1Ч на PSS при облучении 340 нм.
- Откройте fid-файлы спектров ЯМР на PSSs с помощью программного обеспечения для обработки ЯМР. Интегрируйте отличительный набор пиков (H1: C2 протон хинолина, H2: протон в парапозиционном положении к группе гидразонов, H3:CH3 этилового эфира) различных изомеров и рассчитайте изомерное соотношение (рисунок 2).
ПРИМЕЧАНИЕ: Композиции ([1-Z]:[1-E] ratio) при облучении 436 нм и 340 нм составляют 8:92 и 82:18 соответственно.
2. Абсорбционная спектроскопия UV-Vis в PSS
- В стеклянный флакон, содержащий 12,6 мг (0,03 ммоль) 1, добавляют 2 мл спектроскопии марки ДМСО. Взять 100 мкл раствора и разбавить 1400 мкл ДМСО до получения 1 мМ раствора 1. Переложить 20 мкл 1 мМ раствора 1 мМ в кварцевую кювету с длиной оптического пути 1,0 см и разбавить 1980 мкл ДМСО, чтобы получить 10 мкМ раствор 1. Запечатайте кювету пробкой из PTFE и держите образец в темноте.
- Приготовьте еще одну кварцевую кювету, содержащую 2 мл ДМСО в качестве пустого образца. Измерьте спектр UV-Vis пустого образца для коррекции исходного уровня.
- Поместите образец со стадии 2,1 1 см перед ксеноновой дуговой лампой, оснащенной полосовым фильтром 436 нм. Начните облучение образца и измеряйте спектр UV-Vis каждые 2 ч до тех пор, пока не произойдет изменения спектров по мере достижения PSS 1 (рисунок 3).
ПРИМЕЧАНИЕ: Время, необходимое для достижения PSS для образца спектроскопии UV-Vis, намного короче, чем для образца ЯМР с более высокой концентрацией. - Повторите шаг 2.3 с полосовым фильтром 340 нм для получения спектра UV-Vis на PSS при облучении 340 нм.
- Выводите спектры поглощения чистых 1-Z и 1-E с помощью Eq (1) и Eq (2) (фиг.4).
 (1)
(1)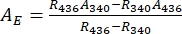 (2)
(2)
Где R436 = отношение 1-Z при PSS при облучении 436 нм; R340 = отношение 1-Z при ПСС при облучении 340 нм; A436 = поглощение 1 в ДМСО при ПСС при облучении 436 нм; A340 = поглощение 1 в ДМСО при PSS при облучении 340 нм. - Рассчитайте коэффициенты молярного затухания чистых 1-Z и 1-E на всех длинах волн, разделив наблюдаемое поглощение на концентрацию образца (10 мкМ) и длину оптического пути (1 см).
3. Кинетические исследования по тепловой релаксации
- Нагрейте силиконовое масло, заполненное в термостате для нагревательной ванны, до желаемой температуры (131 °C) и проверьте, стабилизирована ли температура ванны. Погрузите два образца ЯМР из шага 1.2 в нагревательную ванну.
ПРИМЕЧАНИЕ: Температура и продолжительность нагрева регулируются в зависимости от скорости релаксации. - После 1 ч нагрева быстро перенесите ЯМР-трубки в ванну с сухим льдом, чтобы приостановить тепловую релаксацию, вызванную скрытым теплом (рисунок 5).
ПРИМЕЧАНИЕ: Неточная температура или время нагрева может привести к серьезной ошибке в оценке константы скорости. - Разморозьте образцы ЯМР, полученные на этапе 3.2, при комнатной температуре и убедитесь, что ДМСО размораживается. Запишите спектрыЯМР 1 H образцов.
- Повторяйте шаги 3.1-3.3 до тех пор, пока не произойдет изменения в спектрах ЯМР 1H по мере достижения термодинамического равновесия 1 .
- Повторите шаги 3.1-3.4 при различных температурах (134, 137, 140 и 143 °C).
- Открываются фид-файлы спектров ЯМР, полученных в процессе нагрева при 131 °C. Рассчитайте усредненные изомерные соотношения, как описано в шаге 1.4. Рассчитать концентрацию 1-Е (метастабильного изомера) на основе общей концентрации образца (10 мМ) и изомерного соотношения.
- График усредненной концентрации 1-Е (СЕ) в зависимости от времени нагрева. Выполните экспоненциальную подгонку к данным для получения константы скорости тепловой релаксации с помощью Eq (3)15,22 (рисунок 6).
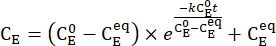 (3)
(3)
где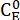 (M) = концентрация 1-E в исходном состоянии;
(M) = концентрация 1-E в исходном состоянии; 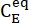 (M) = концентрация 1-E в термодинамическом равновесии при определенной температуре; k (s-1) = константа скорости тепловой релаксации при определенной температуре; t (s) = время нагрева.
(M) = концентрация 1-E в термодинамическом равновесии при определенной температуре; k (s-1) = константа скорости тепловой релаксации при определенной температуре; t (s) = время нагрева. - Повторите шаги с 3.6 по 3.7, используя данные, полученные при различных температурах.
- Построить ln(k) против
 и выполнить линейную подгонку в соответствии с уравнением Аррениуса (Eq (4)) для экстраполяции константы скорости при комнатной температуре (рисунок 7).
и выполнить линейную подгонку в соответствии с уравнением Аррениуса (Eq (4)) для экстраполяции константы скорости при комнатной температуре (рисунок 7).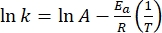 (4)
(4)
Где A = предэкспоненциальный множитель; Ea (J·mol-1) = энергия активации для тепловой релаксации; R = постоянная идеального газа (8,3145 Дж·моль-1 К-1); T (K) = абсолютная температура. - Рассчитайте тепловой период полураспада 1-E при комнатной температуре, используя Eq (5).
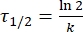 (5)
(5)
где τ1/2 (s) = тепловой период полураспада 1-E при комнатной температуре; k (s-1) = константа скорости тепловой релаксации при комнатной температуре, полученная из шага 3,9. - Если константа скорости тепловой релаксации оценивается только при одной температуре, рассчитайте константу скорости при комнатной температуре, используя следующее перестроенное уравнение Айринга (Eq (6)))18,23.
 (6)
(6)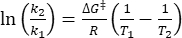 (7)
(7)
Где (J·mol-1) = энергия активации Гиббса для тепловой релаксации; k1 (s-1) = константа скорости тепловой релаксации, рассчитанная при повышенной температуре; k2 (s-1) = константа скорости тепловой релаксации при комнатной температуре (298,15 K); T1 (K) = абсолютная температура, при которой получается k1; (K) = комнатная температура (298,15 K).
(J·mol-1) = энергия активации Гиббса для тепловой релаксации; k1 (s-1) = константа скорости тепловой релаксации, рассчитанная при повышенной температуре; k2 (s-1) = константа скорости тепловой релаксации при комнатной температуре (298,15 K); T1 (K) = абсолютная температура, при которой получается k1; (K) = комнатная температура (298,15 K).
4. Ферриоксалатная актинометрия
ПРИМЕЧАНИЕ: Все процедуры ферриоксалатной актинометрии должны выполняться в темноте или >600 нм света для предотвращения влияния окружающего света.
- В стеклянный флакон объемом 20 мл, содержащий 29,48 мг (0,06 ммоль) тригидрата ферриоксалата калия, добавьте 8 мл деионизированной воды. Добавьте 1 мл 0,5 М водного раствораH2SO4 в раствор ферриоксалата и разбавьте до 10 мл деионизированной водой для получения 0,006 М ферриоксалата в 0,05 М водного раствораH2SO4 .
- В другой стеклянный флакон объемом 20 мл, содержащий 10 мг 1,10-фенантролина и 1,356 г безводного ацетата натрия, добавляют 10 мл 0,5 М водного раствораH2SO4 для получения буферного 0,1% (мас./об.) раствора фенантролина.
- Перенесите 2 мл раствора ферриоксалата 0,006 М со стадии 4,1 в кварцевую кювету с длиной оптического пути 1,0 см. Запечатайте кювету пробкой из PTFE и держите образец в темноте.
- Готовят еще одну кварцевую кювету, содержащую 2 мл 0,05 М водного раствораH2SO4 в виде пустого образца. Измерьте поглощение UV-Vis пустого образца для коррекции исходного уровня.
- Измерьте поглощение UV-Vis раствора ферриоксалата 0,006 М. Определяют долю поглощенного света, используя поглощения раствора ферриоксалата 0,006 М при 340 и 436 нм и экв (8) (рисунок 8).
 (8)
(8)
где f = доля света, поглощенного 0,006 М раствором ферриоксалата; Aλ = поглощение 0,006 М раствора ферриоксалата на длине волны λ. - Приготовьте две кварцевые кюветы с длиной оптического пути 1,0 см и добавьте 2 мл раствора ферриоксалата 0,006 М.
- Поместите один из образцов с шага 4,6 1 см перед ксеноновой дуговой лампой, оснащенной полосовым фильтром 436 нм. Держите другой образец в темноте. Начинают облучение к образцу в течение 90 с. После облучения добавляют 0,35 мл буферизованного 0,1% раствора фенантролина и магнитный стержень к обеим кюветам с последующим перемешиванием в течение 1 ч в темноте с образованием комплекса [Fe(phen)3]2+ .
ПРИМЕЧАНИЕ: Ферриоксалат фотохимически восстанавливается до Fe2+, после чего происходит почти количественное образование комплекса трис-1,10-фенантролинового железа (II). - Измерьте спектр поглощения UV-Vis необлученного образца на этапе 4.6 для коррекции исходного уровня.
- Измерьте спектр поглощения UV-Vis облученного образца с этапа 4.7.
- Повторите шаги 4.6-4.9 с полосовым фильтром 340 нм (рисунок 9).
ПРИМЕЧАНИЕ: После того, как образец ферриоксалата подвергается воздействию света, образец не может быть использован повторно. - Рассчитайте поток молярных фотонов, поступающих в кювету, используя Eq (9).
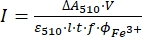 (9)
(9)
Где I (mol·s-1) = поток молярных фотонов, поступающий в кювету; ΔA510 = разница в поглощении при 510 нм между необлученными и облученными образцами; V = общий объем раствора (2,35 мл); ε510 = коэффициент молярного затухания [Fe(фен)3]2+ комплекса (11100 М-1 см-1)24; I = длина оптического пути кварцевой кюветы (1,0 см); t = время облучения (90 с); f = поглощенная доля света, полученная на этапе 4.5; ΦFe3+ = квантовый выход фоторедукции Fe3+ в Fe2+ (1,22 для 340 нм, 1,11 для 436 нм)25.
5. Определение квантового выхода фотоизомеризации
- Подготовьте кварцевую кювету длиной оптического пути 1,0 см, содержащую 2 мл ДМСО в качестве пустого образца. Измерьте поглощение UV-Vis пустого образца для коррекции исходного уровня.
- Готовят кварцевую кювету с длиной оптического пути 1,0 см, содержащую 2 мл 10 мкМ раствора 1 в ДМСО, полученного на стадии 2.4 (Z-обогащенный). Запечатайте кюветы пробкой из PTFE.
- Поместите образец с шага 5,2 1 см перед ксеноновой дуговой лампой, оснащенной полосовым фильтром 436 нм. Начните облучение при 436 нм к образцу и измерьте спектр поглощения UV-Vis с различными интервалами до тех пор, пока не произойдет изменения спектров по мере достижения PSS 1 (рисунок 10).
ПРИМЕЧАНИЕ: Установка облучения должна быть точно такой же, как и для измерения молярного потока фотонов. Интервал облучения следует корректировать исходя из скорости фотоизомеризации. Как правило, 15-20 точек данных до достижения PSS подходят. - Готовят кварцевую кювету длиной оптического пути 1,0 см, содержащую 2 мл 10 мкМ раствора 1 в ДМСО, полученного на стадии 2.3 (обогащенная Е). Запечатайте кюветы пробкой из PTFE.
- Замените полосовой фильтр 436 нм на полосовой фильтр 340 нм и повторите шаг 5.3 для образца, полученного из шага 5.4.
- Рассчитайте фотокинетический коэффициент F(t), используя наблюдаемые поглощения из шага 5.3 и Eq (10)26.
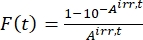 (10)
(10)
Где Airr,t = поглощение на длине волны облучения в момент времени t. - Рассчитайте псевдоквантовый выход Q , используя значения фотокинетического фактора, полученные из шага 5.6 и Eq (11)27.
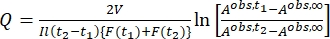 (11)
(11)
Где Q (M-1 см-1) = псевдоквантовый выход, определяемый как ;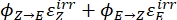 ; V(L) = объем пробы; I (mol·s-1) = поток молярных фотонов, поступающий в кювету; l (см) = длина оптического пути; t1, t2 (s) = две последовательные точки времени облучения; F(t1), F(t2) = фотокинетические факторы во времени t1 и t2, соответственно; Aobs,t1, Aobs,t2, Aobs,∞ = поглощения на определенной длине волны в момент времени, t1 и t2 в PSS, соответственно.
; V(L) = объем пробы; I (mol·s-1) = поток молярных фотонов, поступающий в кювету; l (см) = длина оптического пути; t1, t2 (s) = две последовательные точки времени облучения; F(t1), F(t2) = фотокинетические факторы во времени t1 и t2, соответственно; Aobs,t1, Aobs,t2, Aobs,∞ = поглощения на определенной длине волны в момент времени, t1 и t2 в PSS, соответственно.
ПРИМЕЧАНИЕ: Для точности рекомендуется использовать поглощения при λmax 1-Z. - Рассчитайте усредненное значение псевдоквантового выхода, используя первые десять точек данных.
- Рассчитайте однонаправленные квантовые выходы для фотоизомеризаций Z-to-E и E-to-Z, используя Eq (12) и Eq (13).
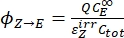 (12)
(12) (13)
(13)
где ΦZ→E, ΦE→Z = однонаправленный квант, дающий для процессов фотоизомеризации Z-to-E и E-to-Z соответственно; ,
, 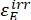 (M-1 см-1) = коэффициенты молярного затухания 1-Z и 1-E на длине волны облучения;
(M-1 см-1) = коэффициенты молярного затухания 1-Z и 1-E на длине волны облучения; 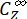 ,
, 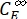 (M) = концентрации 1-Z и 1-E в PSS, соответственно; Ctot (M) = общая концентрация 1.
(M) = концентрации 1-Z и 1-E в PSS, соответственно; Ctot (M) = общая концентрация 1. - Повторите шаги 5.6-5.9, используя данные, полученные из шага 5.5, для расчета однонаправленных квантовых выходов фотоизомеризации при облучении при 340 нм.
Результаты
При облучении 1 в ЯМР-трубке светом 436 нм (Z:E = 54:46 в исходном состоянии) доля 1-E увеличивается за счет доминирующей изомеризации Z-to-E связи гидразона C=N (рис. 1). Изомерное соотношение может быть легко получено из относительной интенсивно...
Обсуждение
Разработаны различные стратегии настройки спектральных и коммутационных свойств фотопереключателей, а регистр фотопереключателей стремительно расширяется28. Таким образом, крайне важно правильно определить их фотофизические свойства, и мы ожидаем, что методы, обобщенны...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана исследовательскими грантами Университета Чунг-Анг в 2019 году и Национальным исследовательским фондом Кореи (NRF-2020R1C1C1011134).
Материалы
| Name | Company | Catalog Number | Comments |
| 1,10-phenanthroline | Sigma-Aldrich | 131377-2.5G | |
| 340 nm bandpass filter, 25 mm diameter, 10 nm FWHM | Edmund Optics | #65-129 | |
| 436 nm bandpass filter, 25 mm diameter, 10 nm FWHM | Edmund Optics | #65-138 | |
| Anhydrous sodium acetate | Alfa aesar | A13184.30 | |
| Dimethyl sulfoxide | Samchun | D1138 | HPLC grade |
| Dimethyl sulfoxide-d6 | Sigma-Aldrich | 151874-25g | |
| Gemini 2000; 300 MHz NMR spectrometer | Varian | ||
| H2SO4 | Duksan | 235 | |
| Heating bath | JeioTech | CW-05G | |
| MestReNova 14.1.1 | Mestrelab Research S.L., https://mestrelab.com/ | ||
| Natural quartz NMR tube | Norell | S-5-200-QTZ-7 | |
| Potassium ferrioxalate trihydrate | Alfa aesar | 31124.06 | |
| Quartz absorption cell | Hellma | HE.110.QS10 | |
| UV-VIS spectrophotometer | Scinco | S-3100 | |
| Xenon arc lamp | Thorlabs | SLS205 | Fiber adapter was removed |
Ссылки
- Kathan, M., Hecht, S. Photoswitchable molecules as key ingredients to drive systems away from the global thermodynamic minimum. Chemical Society Reviews. 46, 5536-5550 (2017).
- Feringa, B. L., Browne, W. R. . Molecular Switches. 2nd ed. , (2011).
- Baroncini, M., Silvi, S., Credi, A. Photo- and redox-driven artificial molecular motors. Chemical Reviews. 120 (1), 200-268 (2020).
- Goulet-Hanssens, A., Eisenreich, F., Hecht, S. Enlightening materials with photoswitches. Advanced Materials. 32 (20), 1905966 (2020).
- Basílio, N., Pischel, U. Drug delivery by controlling a supramolecular host-guest assembly with a reversible photoswitch. Chemistry-A European Journal. 22 (43), 15208-15211 (2016).
- Wegener, M., Hansen, M. J., Driessen, A. J. M., Szymanski, W., Feringa, B. L. Photocontrol of antibacterial activity: shifting from UV to red light activation. Journal of the American Chemical Society. 139 (49), 17979-17986 (2017).
- Izquierdo-Serra, M., et al. Optical control of endogenous receptors and cellular excitability using targeted covalent photoswitches. Nature Communications. 7 (1), 12221 (2016).
- Mourot, A., et al. Rapid optical control of nociception with an ion-channel photoswitch. Nature Methods. 9 (4), 396-402 (2012).
- Griffiths, K., Halcovitch, N. R., Griffin, J. M. Long-term solar energy storage under ambient conditions in a MOF-based solid-solid phase-change material. Chemistry of Materials. 32 (23), 9925-9936 (2020).
- Sun, C. -. L., Wang, C., Boulatov, R. Applications of photoswitches in the storage of solar energy. ChemPhotoChem. 3 (6), 268-283 (2019).
- Gu, M., Zhang, Q., Lamon, S. Nanomaterials for optical data storage. Nature Reviews Materials. 1 (12), 16070 (2016).
- Roke, D., Wezenberg, S. J., Feringa, B. L. Molecular rotary motors: Unidirectional motion around double bonds. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 9423-9431 (2018).
- Stranius, K., Börjesson, K. Determining the photoisomerization quantum yield of photoswitchable molecules in solution and in the solid state. Scientific Reports. 7 (1), 41145 (2017).
- Schneider, W. E. Long term spectral irradiance measurements of a 1000-watt xenon arc lamp. NASA-CR. , 132533 (1974).
- Qian, H., Pramanik, S., Aprahamian, I. Photochromic hydrazone switches with extremely long thermal half-lives. Journal of the American Chemical Society. 139 (27), 9140-9143 (2017).
- Shao, B., et al. Solution and solid-state emission toggling of a photochromic hydrazone. Journal of the American Chemical Society. 140 (39), 12323-12327 (2018).
- Shao, B., Qian, H., Li, Q., Aprahamian, I. Structure property analysis of the solution and solid-state properties of bistable photochromic hydrazones. Journal of the American Chemical Society. 141 (20), 8364-8371 (2019).
- Moran, M. J., Magrini, M., Walba, D. M., Aprahamian, I. Driving a liquid crystal phase transition using a photochromic hydrazone. Journal of the American Chemical Society. 140 (42), 13623-13627 (2018).
- Guo, X., Shao, B., Zhou, S., Aprahamian, I., Chen, Z. Visualizing intracellular particles and precise control of drug release using an emissive hydrazone photochrome. Chemical Science. 11 (11), 3016-3021 (2020).
- Yang, S., et al. Dynamic enzymatic synthesis of γ-cyclodextrin using a photoremovable hydrazone template. Chem. 7 (8), 2190-2200 (2021).
- Yang, S., et al. Multistage reversible Tg photomodulation and hardening of hydrazone-containing polymers. Journal of the American Chemical Society. 143 (40), 16348-16353 (2021).
- Connors, K. A. . Chemical kinetics : the study of reaction rates in solution. , (1990).
- Shao, B., Qian, H., Li, Q., Aprahamian, I. Structure property analysis of the solution and solid-state properties of bistable photochromic hydrazones. Journal of the American Chemical Society. 141 (20), 8364-8371 (2019).
- Kuhn, H., Braslavsky, S., Schmidt, R. Chemical actinometry (IUPAC technical report). Pure and Applied Chemistry. 76 (12), 2105-2146 (2004).
- Murov, S. L., Carmichael, I., Hug, G. L. . Handbook of hotochemistry 2nd ed. Rev. And expanded. , (1993).
- Dürr, H., Bouas-Laurent, H. . Photochromism: Molecules and Systems. , (2003).
- Klán, P., Wirz, J. . Photochemistry of Organic Compounds: From Concepts to Practice. , (2009).
- Harris, J. D., Moran, M. J., Aprahamian, I. New molecular switch architectures. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 9414-9422 (2018).
- Maafi, M., Brown, R. G. The kinetic model for AB(1ϕ) systems: A closed-form integration of the differential equation with a variable photokinetic factor. Journal of Photochemistry and Photobiology A: Chemistry. 187, 319-324 (2007).
- Lahikainen, M., et al. Tunable photomechanics in diarylethene-driven liquid crystal network actuators. ACS Applied Materials & Interfaces. 12 (42), 47939-47947 (2020).
- Mallo, N., et al. Photochromic switching behaviour of donor-acceptor Stenhouse adducts in organic solvents. Chemical Communications. 52, 13576-13579 (2016).
- Feldmeier, C., Bartling, H., Riedle, E., Gschwind, R. M. LED based NMR illumination device for mechanistic studies on photochemical reactions - Versatile and simple, yet surprisingly powerful. Journal of Magnetic Resonance. 232, 39-44 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены