É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Determinação da Fotoisomerização Quantum Yield de um Fotowitch Hydrazone
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O rendimento quântico da fotoisomerização é uma propriedade fotofísica fundamental que deve ser apurada com precisão na investigação de fotoswitches recém-desenvolvidos. Aqui, descrevemos um conjunto de procedimentos para medir o rendimento quântico fotoisomerização de uma hidrato fotocrômica como um modelo de fotochódite bistosa.
Resumo
Fotosstar moléculas orgânicas que sofrem transformações estruturais orientadas pela luz são componentes-chave para construir sistemas moleculares adaptativos, e são utilizadas em uma grande variedade de aplicações. Na maioria dos estudos que empregam fotossensíveis, várias propriedades fotofísicas importantes, como comprimentos de onda máximo de absorção e emissão, coeficiente de atenuação molar, vida útil da fluorescência e rendimento quântico fotoisomerização são cuidadosamente determinados a investigar seus estados eletrônicos e processos de transição. No entanto, a medição do rendimento quântico da fotoisomerização, a eficiência da fotoisomerização em relação aos fótons absorvidos, em um ambiente de laboratório típico é muitas vezes complicada e propensa a erros, pois requer a implementação de rigorosas medições e cálculos espectroscópicos baseados em um método de integração adequado. Este artigo introduz um conjunto de procedimentos para medir o rendimento quântico fotoisomerização de um fotochúrio bistável usando uma hidrato fotocrômica. Prevemos que este artigo será um guia útil para a investigação de fotossenvolvidos que estão sendo cada vez mais desenvolvidos.
Introdução
Moléculas orgânicas fotocrômicas têm atraído considerável atenção em uma ampla gama de disciplinas científicas, pois a luz é um estímulo único que pode afastar um sistema de seu equilíbrio termodinâmico não invasivo1. A irradiação de luz com energias adequadas permite a modulação estrutural de fotossenhões com alta precisão espacial 2,3,4. Graças a essas vantagens, vários tipos de fotoswitches baseados na isomerização configuracional das ligações duplas (por exemplo, stilbenes, azobenzenes, iminas, fumaramides, tioindigos) e abertura/fechamento de anel (por exemplo, spiropyrans, dithienylethenes, fulgides, adutos stenhouse aceitadores de doadores) foram desenvolvidos e utilizados como componentes centrais de materiais adaptativos em várias escalas de comprimento. Aplicações representativas de fotossensíveis envolvem materiais fotocrômicos, entrega de drogas, receptores e canais comutadores, armazenamento de informações ou energia e máquinas moleculares 5,6,7,8,9,10,11,12. Na maioria dos estudos apresentando fotoswitches recém-projetados, suas propriedades fotofísicas como λmax de absorção e emissão, coeficiente de atenuação molar (ε), vida fluorescência e rendimento quântico fotoisomerização são caracterizadas minuciosamente. A investigação dessas propriedades fornece informações fundamentais sobre os estados eletrônicos e transições que são cruciais para a compreensão das propriedades ópticas e do mecanismo de isomerização.
No entanto, a medição precisa do rendimento quântico da fotoisomerização - o número de eventos de fotoisomerização que ocorreram dividido pelo número de fótons no comprimento de onda de irradiação absorvido pelo reagente - muitas vezes é complicado em um ambiente de laboratório típico devido a várias razões. A determinação do rendimento quântico da fotoisomerização é geralmente alcançada monitorando o avanço da reação e medindo o número de fótons absorvidos durante a irradiação. A principal preocupação é que a quantidade de absorção de fótons por unidade mude progressivamente porque a absorção total pela solução muda ao longo do tempo à medida que a reação fotoquímica prossegue. Portanto, o número de reagentes consumidos por tempo unitário depende da seção de tempo em que é medida durante a irradiação. Assim, é obrigado a estimar o rendimento quântico da fotoisomerização que é definido diferencialmente.
Um problema mais problemático surge quando tanto o reagente quanto o fotoproduto absorvem a luz no comprimento de onda da irradiação. Neste caso, a isomerização fotoquímica ocorre em ambas as direções (ou seja, uma reação fotoreversível). Os dois rendimentos quânticos independentes para as reações para a frente e para trás não podem ser obtidos diretamente da taxa de reação observada. A intensidade da luz imprecisa também é uma causa comum de erro. Por exemplo, o envelhecimento da lâmpada muda gradualmente sua intensidade; a irradiação da lâmpada de arco xenon a 400 nm diminui 30% após 1000 h de operação14. A disseminação de luz não colidida torna a irradiação do incidente significativamente menor do que o poder nominal da fonte. Assim, é crucial quantificar com precisão o fluxo de fótons eficaz. Note-se que o relaxamento térmico da forma metastável à temperatura ambiente deve ser suficientemente pequeno para ser ignorado.
Este artigo introduz um conjunto de procedimentos para determinar o rendimento quântico da fotoisomerização de um photoswitch bistável. Uma série de fotossenvolvimentos de hidrazona desenvolvidos pelo grupo de Aprahamian, a equipe pioneira de pesquisa no campo, estiveram sob os holofotes graças à sua fotoisomerização seletiva e à notável estabilidade de seus isômerosmetastáveis 15,16,17. Seus fotossentotes de hidrato compreendem dois anéis aromáticos unidos por um grupo de hortênsia, e o vínculo C=N passa por isomerização seletiva E/Z após irradiação em comprimentos de onda apropriados (Figura 1). Eles foram incorporados com sucesso como componentes motile de sistemas moleculares dinâmicos 18,19,20,21. Neste trabalho, preparamos um novo derivado de hidrazona com grupos de amidas e investigamos suas propriedades de fototaria para a determinação do rendimento quântico da fotoisomerização.
Protocolo
1. Aquisição de espectro de NMR de 1H em estado fotoestacionário (PSS)
- Em um tubo de NMR de quartzo natural contendo 4,2 mg (0,01 mmol) de interruptor de hidespa zona 1, adicione 1,0 mL de sulfóxido de dimetil deuterado (DMSO-d 6). Transfira metade da solução para outro tubo NMR.
- Coloque um dos tubos NMR 1 cm na frente de uma lâmpada de arco Xenon equipada com um filtro de bandpass de 436 nm. Inicie a irradiação para a amostra NMR e regisse um espectro de 1H NMR todos os dias até que não haja alteração nos espectros à medida que o switch 1 atingir o PSS. Depois de chegar ao PSS, mantenha o tubo NMR no escuro à temperatura ambiente e regise o espectro de 1H NMR após 12 h para monitorar o progresso do relaxamento térmico.
NOTA: O Switch 1 não apresenta nenhuma alteração considerável no espectro de 1H NMR à temperatura ambiente devido à sua natureza bissável. - Para o outro tubo NMR, repita o passo 1.2 com um filtro de bandpass de 340 nm para obter um espectro de 1H NMR no PSS sob irradiação de 340 nm.
- Abra arquivos fid do espectro NMR no PSSs com software de processamento NMR. Integre um conjunto distinto de picos (H1: C2 proton de quinolina, H2: próton em para-posição ao grupo hidrato, H3: CH3 de éster etílico) dos isômeros distintos e calcule a razão isomeric (Figura 2).
NOTA: As composições ([1-Z]:[1-E] em relação à irradiação de 436 nm e 340 nm são 8:92 e 82:18, respectivamente.
2. Espectroscopia de absorção UV-Vis no PSS
- Em um frasco de vidro contendo 12,6 mg (0,03 mmol) de 1, adicione 2 mL de espectroscopia grau DMSO. Pegue 100 μL da solução e dilua com 1400 μL de DMSO para fazer uma solução de 1 mM de 1. Transfira 20 μL de solução de 1 mM de 1 para um cuvette de quartzo com comprimento óptico de 1,0 cm e diluir com 1980 μL de DMSO para fazer uma solução de 10 μM de 1. Sele a cuvette com uma rolha PTFE e mantenha a amostra no escuro.
- Prepare outra cuvette de quartzo contendo 2 mL de DMSO como uma amostra em branco. Meça o espectro UV-Vis da amostra em branco para correção da linha de base.
- Coloque a amostra a partir da etapa 2,1 1 1 cm na frente de uma lâmpada de arco Xenon equipada com um filtro de bandpass de 436 nm. Inicie a irradiação para a amostra e meça o espectro UV-Vis a cada 2 h até que não haja alteração no espectro à medida que 1 atinge o PSS (Figura 3).
NOTA: O tempo de acesso ao PSS para a amostra de espectroscopia UV-Vis é muito menor do que para a amostra de RMN com maior concentração. - Repita o passo 2.3 com um filtro de bandpass de 340 nm para obter o espectro UV-Vis no PSS sob irradiação de 340 nm.
- Deduza os espectros de absorvência dos puros 1-Z e 1-E usando Eq (1) e Eq (2) (Figura 4).
 (1)
(1)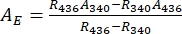 (2)
(2)
Onde R436 = a razão de 1-Z no PSS abaixo de irradiação de 436 nm; R340 = a razão de 1-Z no PSS sob irradiação de 340 nm; A436 = a absorvância de 1 em DMSO no PSS sob irradiação de 436 nm; A340 = a absorvância de 1 em DMSO no PSS sob irradiação de 340 nm. - Calcule os coeficientes de atenuação molar de puros 1-Z e 1-E em todos os comprimentos de onda, dividindo a absorvância observada pela concentração amostral (10 μM) e o comprimento do caminho óptico (1 cm).
3. Estudos cinéticos sobre relaxamento térmico
- Aqueça o óleo de silício preenchido em um circulador de banho aquecedor até a temperatura desejada (131 °C) e verifique se a temperatura do banho está estabilizada. Submerse duas amostras de RMN do passo 1.2 no banho de aquecimento.
NOTA: A temperatura e a duração do aquecimento são ajustadas dependendo da taxa de relaxamento. - Após 1h de aquecimento, transfira os tubos de RMN rapidamente para um banho de gelo seco para pausar o relaxamento térmico causado pelo calor latente (Figura 5).
NOTA: Temperatura ou tempo de aquecimento imprecisos podem levar a um erro grave na estimativa da constante da taxa. - Descongele as amostras de RMN obtidas da etapa 3.2 em temperatura ambiente e garanta que o DMSO seja descongelado. Registo o espectro de 1H NMR das amostras.
- Repita as etapas 3.1-3.3 até que não haja alteração no espectro de 1H NMR à medida que 1 atinge o equilíbrio termodinâmico.
- Repetição de passos 3.1-3.4 em temperaturas diferentes (134, 137, 140 e 143 °C).
- Abra arquivos fid do espectro NMR obtidos no curso do aquecimento a 131 °C. Calcule as razões médias isomericas descritas na etapa 1.4. Calcule a concentração de 1-E (isômero metastável) com base na concentração amostral total (10 mM) e na razão isomeric.
- Plote a concentração média de 1-E (CE) em função do tempo de aquecimento. Realize um ajuste exponencial nos dados para obter a constante de taxa de relaxamento térmico utilizando Eq (3)15,22 (Figura 6).
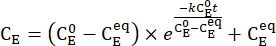 (3)
(3)
Onde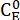 (M) = a concentração de 1-E no estado inicial;
(M) = a concentração de 1-E no estado inicial; 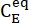 (M) = a concentração de 1-E no equilíbrio termodinâmico a uma temperatura específica; k (s-1) = a constante de taxa de relaxamento térmico a uma temperatura específica; t (s) = o tempo de aquecimento.
(M) = a concentração de 1-E no equilíbrio termodinâmico a uma temperatura específica; k (s-1) = a constante de taxa de relaxamento térmico a uma temperatura específica; t (s) = o tempo de aquecimento. - Repita as etapas 3.6 a 3.7 usando os dados obtidos em temperaturas diferentes.
- Plotar(k) versus
 e realizar um ajuste linear de acordo com a equação de Arrhenius (Eq (4)) para extrapolar a constante de taxa à temperatura ambiente (Figura 7).
e realizar um ajuste linear de acordo com a equação de Arrhenius (Eq (4)) para extrapolar a constante de taxa à temperatura ambiente (Figura 7).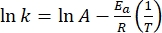 (4)
(4)
Onde A = o fator pré-exponencial; Ea (J·mol-1) = a energia de ativação para relaxamento térmico; R = a constante de gás ideal (8,3145 J·mol-1 K-1); T (K) = a temperatura absoluta. - Calcule a meia-vida térmica de 1-E à temperatura ambiente usando Eq (5).
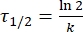 (5)
(5)
Quando τ1/2 (s) = a meia-vida térmica de 1-E à temperatura ambiente; k (s-1) = a taxa constante de relaxamento térmico à temperatura ambiente obtida a partir da etapa 3.9. - Se a taxa constante de relaxamento térmico for estimada apenas a uma única temperatura, calcule a taxa constante à temperatura ambiente usando a seguinte equação de Eyring reorganizada (Eq (6))18,23.
 (6)
(6)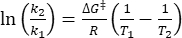 (7)
(7)
Onde (J·mol-1) = a energia Gibbs de ativação para relaxamento térmico; k1 (s-1) = a taxa constante de relaxamento térmico estimada na temperatura elevada; k2 (s-1) = a constante de taxa de relaxamento térmico à temperatura ambiente (298,15 K); T1 (K) = a temperatura absoluta na qual o k1 é obtido; (K) = temperatura ambiente (298,15 K).
(J·mol-1) = a energia Gibbs de ativação para relaxamento térmico; k1 (s-1) = a taxa constante de relaxamento térmico estimada na temperatura elevada; k2 (s-1) = a constante de taxa de relaxamento térmico à temperatura ambiente (298,15 K); T1 (K) = a temperatura absoluta na qual o k1 é obtido; (K) = temperatura ambiente (298,15 K).
4. Actinometria ferrioxalato
NOTA: Todos os procedimentos para atometria ferrioxalato devem ser realizados na luz escura ou >600 nm para evitar a influência da luz ambiente.
- Em um frasco de vidro de 20 mL contendo 29,48 mg (0,06 mmol) de trihidrato ferrioxalato de potássio, adicione 8 mL de água desionizada. Adicione 1 mL de 0,5 M aquoso H2SO4 à solução ferrioxalato e dilua para 10 mL com água deionizada para preparar um ferrioxato de 0,006 M em 0,05 M aquoso solução H2SO4 .
- Em outro frasco de vidro de 20 mL contendo 10 mg de 1,10-phenanthrolina e 1,356 g de acetato de sódio anidro, adicione 10 mL de 0,5 M aquoso H2SO4 para fazer uma solução de fenanthrolina de 0,1% (w/v) tamponada.
- Transfira 2 mL da solução ferrioxalate de 0,006 M da etapa 4.1 para um cuvette de quartzo com comprimento óptico de 1,0 cm. Sele a cuvette com uma rolha PTFE e mantenha a amostra no escuro.
- Prepare outra cuvette de quartzo contendo 2 mL de 0,05 M aquoso H2SO4 como uma amostra em branco. Meça a absorvância UV-Vis da amostra em branco para correção da linha de base.
- Meça a absorvância UV-Vis da solução ferrioxalate de 0,006 M. Determine a fração de luz absorvida utilizando as absorvâncias da solução ferrioxalate de 0,006 M a 340 e 436 nm e Eq (8) (Figura 8).
 (8)
(8)
Quando f = a fração de luz absorvida por solução ferrioxalate de 0,006 M; Aλ = a absorvância de solução ferrioxalate de 0,006 M no comprimento de onda λ. - Prepare duas cuvetas de quartzo com comprimento óptico de 1,0 cm e adicione 2 mL da solução ferrioxalate de 0,006 M.
- Coloque uma das amostras da etapa 4,6 1 cm em frente à lâmpada de arco Xenon equipada com um filtro de bandpass de 436 nm. Mantenha a outra amostra no escuro. Inicie a irradiação para a amostra para 90 s. Após a irradiação, adicione 0,35 mL da solução de fenoanthrolina tamponada de 0,1% e uma barra magnética para ambas as cuvetas seguidas de agitação por 1 h no escuro para formar um complexo [Fe(phen)3]2+ .
NOTA: Ferrioxalate é fotoquimicamente reduzido a Fe2+, seguido pela formação quase quantitativa do complexo de ferro tris-1,10-phenanthrolina (II). - Meça o espectro de absorção UV-Vis da amostra não irradiada da etapa 4.6 para correção da linha de base.
- Meça o espectro de absorção UV-Vis da amostra irradiada a partir da etapa 4.7.
- Repetir passos 4.6-4.9 com um filtro de bandpass de 340 nm (Figura 9).
NOTA: Uma vez que a amostra de ferrioxato é exposta à luz, a amostra não pode ser reutilizada. - Calcule o fluxo de fóton molar que chega ao cuvette usando Eq (9).
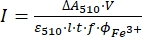 (9)
(9)
Onde eu (mol·s-1) = o fluxo de fóton molar que chega ao cuvette; ΔA510 = a diferença de absorvância em 510 nm entre as amostras não irradiadas e irradiadas; V = o volume total da solução (2,35 mL); ε510 = o coeficiente de atenuação molar do complexo [Fe(phen)3]2+ (11100 M-1 cm-1)24; I = o comprimento óptico do caminho da cuvette de quartzo (1,0 cm); t = tempo de irradiação (90 s); f = a fração absorvida de luz obtida a partir da etapa 4.5; ΦFe3+ = o rendimento quântico da fotoredução de Fe3+ para Fe2+ (1,22 por 340 nm, 1,11 por 436 nm)25.
5. Determinação do rendimento quântico da fotoisomerização
- Prepare uma cuvette de quartzo com comprimento óptico de 1,0 cm contendo 2 mL de DMSO como a amostra em branco. Meça a absorvância UV-Vis da amostra em branco para correção da linha de base.
- Prepare um cuvette de quartzo com comprimento de caminho óptico de 1,0 cm contendo 2 mL de solução de 1 μM de 1 em DMSO obtido a partir da etapa 2.4 (enriquecido por Z). Sele as cuvetas com uma rolha PTFE.
- Coloque a amostra a partir da etapa 5,2 1 cm em frente à lâmpada de arco Xenon equipada com um filtro de bandpass de 436 nm. Inicie a irradiação a 436 nm para a amostra e meça espectro de absorção UV-Vis com intervalos diferentes até que não haja alteração nos espectros à medida que 1 atinge PSS (Figura 10).
NOTA: A configuração de irradiação deve ser exatamente a mesma usada para a medição do fluxo de fótons molar. O intervalo de irradiação deve ser ajustado com base na taxa de fotoisomerização. Geralmente, 15-20 pontos de dados antes de chegar ao PSS são adequados. - Prepare um cuvette de quartzo com comprimento óptico de 1,0 cm contendo 2 mL de solução de 10 μM de 1 em DMSO obtido a partir da etapa 2.3 (E-enriquecido). Sele as cuvetas com uma rolha PTFE.
- Substitua o filtro de bandpass de 436 nm pelo filtro de bandpass de 340 nm e repita o passo 5.3 para a amostra obtida a partir da etapa 5.4.
- Calcule o fator fotocinético F(t) utilizando as absorvâncias observadas das etapas 5.3 e Eq (10)26.
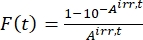 (10)
(10)
Onde Airr,t = a absorvância no comprimento de onda de irradiação no tempo t. - Calcule o rendimento pseudo quântico Q usando os valores do fator fotocinético obtidos a partir da etapa 5.6 e Eq (11)27.
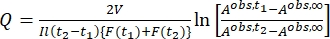 (11)
(11)
Onde Q (M-1 cm-1) = o rendimento pseudo quântico definido como ;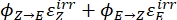 ; V(L) = o volume da amostra; I (mol·s-1) = o fluxo de fóton molar que chega ao cuvette; l (cm) = o comprimento do caminho óptico; t1, t2 (s) = os dois pontos de tempo consecutivos de irradiação; F(t1), F(t2) = os fatores fotocinéticos no tempo t1 e t2, respectivamente; Aobs,t1, Aobs,t2, Aobs,∞ = as absorvâncias em comprimento de onda específico no tempo , t1, e t2 no PSS, respectivamente.
; V(L) = o volume da amostra; I (mol·s-1) = o fluxo de fóton molar que chega ao cuvette; l (cm) = o comprimento do caminho óptico; t1, t2 (s) = os dois pontos de tempo consecutivos de irradiação; F(t1), F(t2) = os fatores fotocinéticos no tempo t1 e t2, respectivamente; Aobs,t1, Aobs,t2, Aobs,∞ = as absorvâncias em comprimento de onda específico no tempo , t1, e t2 no PSS, respectivamente.
NOTA: Recomenda-se o uso de absorventes nomáximo de 1 Z para precisão. - Calcule o valor médio do rendimento pseudo quântico usando os primeiros dez pontos de dados.
- Calcule os rendimentos quânticos unidirecionais para fotoisomerizações Z-to-E e E-to-Z usando Eq (12) e Eq (13).
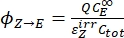 (12)
(12) (13)
(13)
Onde ΦZ→E, ΦE→Z = os rendimentos quânticos unidirecionais para os processos de fotoisomerização Z-to-E e E-to-Z, respectivamente; ,
, 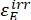 (M-1 cm-1) = os coeficientes de atenuação molar de 1-Z e 1-E no comprimento de onda de irradiação;
(M-1 cm-1) = os coeficientes de atenuação molar de 1-Z e 1-E no comprimento de onda de irradiação; 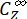 ,
, 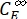 (M) = as concentrações de 1-Z e 1-E no PSS, respectivamente; Ctot (M) = a concentração total de 1.
(M) = as concentrações de 1-Z e 1-E no PSS, respectivamente; Ctot (M) = a concentração total de 1. - Repetir as etapas 5.6-5.9 utilizando os dados obtidos a partir da etapa 5.5 para cálculo dos rendimentos quânticos de fotoisomerização unidirecional sob irradiação a 340 nm.
Resultados
Após a irradiação de 1 em um tubo de RMN com luz de 436 nm (Z:E = 54:46 no estado inicial), a proporção de 1-E aumenta devido à isomerização dominante Z-to-E da ligação hidráuona C=N (Figura 1). A razão isomeric pode ser facilmente obtida a partir das intensidades relativas de sinal de isômeros distintos no espectro 1H NMR (Figura 2). Após 5 dias de irradiação a 436 ...
Discussão
Várias estratégias para ajustar as propriedades espectrais e de comutação de fotoswitches foram desenvolvidas, e o registro de fotoswitches está se expandindo rapidamente28. Portanto, é crucial determinar corretamente suas propriedades fotofísicas, e antecipamos que os métodos resumidos neste artigo serão um guia útil para os experimentadores. Desde que a taxa de relaxamento térmico seja muito lenta à temperatura ambiente, a medição de composições de PSS em diferentes comprimentos ...
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pelas Bolsas de Pesquisa da Universidade Chung-Ang em 2019 e pela Fundação Nacional de Pesquisa da Coreia (NRF-2020R1C1C1011134).
Materiais
| Name | Company | Catalog Number | Comments |
| 1,10-phenanthroline | Sigma-Aldrich | 131377-2.5G | |
| 340 nm bandpass filter, 25 mm diameter, 10 nm FWHM | Edmund Optics | #65-129 | |
| 436 nm bandpass filter, 25 mm diameter, 10 nm FWHM | Edmund Optics | #65-138 | |
| Anhydrous sodium acetate | Alfa aesar | A13184.30 | |
| Dimethyl sulfoxide | Samchun | D1138 | HPLC grade |
| Dimethyl sulfoxide-d6 | Sigma-Aldrich | 151874-25g | |
| Gemini 2000; 300 MHz NMR spectrometer | Varian | ||
| H2SO4 | Duksan | 235 | |
| Heating bath | JeioTech | CW-05G | |
| MestReNova 14.1.1 | Mestrelab Research S.L., https://mestrelab.com/ | ||
| Natural quartz NMR tube | Norell | S-5-200-QTZ-7 | |
| Potassium ferrioxalate trihydrate | Alfa aesar | 31124.06 | |
| Quartz absorption cell | Hellma | HE.110.QS10 | |
| UV-VIS spectrophotometer | Scinco | S-3100 | |
| Xenon arc lamp | Thorlabs | SLS205 | Fiber adapter was removed |
Referências
- Kathan, M., Hecht, S. Photoswitchable molecules as key ingredients to drive systems away from the global thermodynamic minimum. Chemical Society Reviews. 46, 5536-5550 (2017).
- Feringa, B. L., Browne, W. R. . Molecular Switches. 2nd ed. , (2011).
- Baroncini, M., Silvi, S., Credi, A. Photo- and redox-driven artificial molecular motors. Chemical Reviews. 120 (1), 200-268 (2020).
- Goulet-Hanssens, A., Eisenreich, F., Hecht, S. Enlightening materials with photoswitches. Advanced Materials. 32 (20), 1905966 (2020).
- Basílio, N., Pischel, U. Drug delivery by controlling a supramolecular host-guest assembly with a reversible photoswitch. Chemistry-A European Journal. 22 (43), 15208-15211 (2016).
- Wegener, M., Hansen, M. J., Driessen, A. J. M., Szymanski, W., Feringa, B. L. Photocontrol of antibacterial activity: shifting from UV to red light activation. Journal of the American Chemical Society. 139 (49), 17979-17986 (2017).
- Izquierdo-Serra, M., et al. Optical control of endogenous receptors and cellular excitability using targeted covalent photoswitches. Nature Communications. 7 (1), 12221 (2016).
- Mourot, A., et al. Rapid optical control of nociception with an ion-channel photoswitch. Nature Methods. 9 (4), 396-402 (2012).
- Griffiths, K., Halcovitch, N. R., Griffin, J. M. Long-term solar energy storage under ambient conditions in a MOF-based solid-solid phase-change material. Chemistry of Materials. 32 (23), 9925-9936 (2020).
- Sun, C. -. L., Wang, C., Boulatov, R. Applications of photoswitches in the storage of solar energy. ChemPhotoChem. 3 (6), 268-283 (2019).
- Gu, M., Zhang, Q., Lamon, S. Nanomaterials for optical data storage. Nature Reviews Materials. 1 (12), 16070 (2016).
- Roke, D., Wezenberg, S. J., Feringa, B. L. Molecular rotary motors: Unidirectional motion around double bonds. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 9423-9431 (2018).
- Stranius, K., Börjesson, K. Determining the photoisomerization quantum yield of photoswitchable molecules in solution and in the solid state. Scientific Reports. 7 (1), 41145 (2017).
- Schneider, W. E. Long term spectral irradiance measurements of a 1000-watt xenon arc lamp. NASA-CR. , 132533 (1974).
- Qian, H., Pramanik, S., Aprahamian, I. Photochromic hydrazone switches with extremely long thermal half-lives. Journal of the American Chemical Society. 139 (27), 9140-9143 (2017).
- Shao, B., et al. Solution and solid-state emission toggling of a photochromic hydrazone. Journal of the American Chemical Society. 140 (39), 12323-12327 (2018).
- Shao, B., Qian, H., Li, Q., Aprahamian, I. Structure property analysis of the solution and solid-state properties of bistable photochromic hydrazones. Journal of the American Chemical Society. 141 (20), 8364-8371 (2019).
- Moran, M. J., Magrini, M., Walba, D. M., Aprahamian, I. Driving a liquid crystal phase transition using a photochromic hydrazone. Journal of the American Chemical Society. 140 (42), 13623-13627 (2018).
- Guo, X., Shao, B., Zhou, S., Aprahamian, I., Chen, Z. Visualizing intracellular particles and precise control of drug release using an emissive hydrazone photochrome. Chemical Science. 11 (11), 3016-3021 (2020).
- Yang, S., et al. Dynamic enzymatic synthesis of γ-cyclodextrin using a photoremovable hydrazone template. Chem. 7 (8), 2190-2200 (2021).
- Yang, S., et al. Multistage reversible Tg photomodulation and hardening of hydrazone-containing polymers. Journal of the American Chemical Society. 143 (40), 16348-16353 (2021).
- Connors, K. A. . Chemical kinetics : the study of reaction rates in solution. , (1990).
- Shao, B., Qian, H., Li, Q., Aprahamian, I. Structure property analysis of the solution and solid-state properties of bistable photochromic hydrazones. Journal of the American Chemical Society. 141 (20), 8364-8371 (2019).
- Kuhn, H., Braslavsky, S., Schmidt, R. Chemical actinometry (IUPAC technical report). Pure and Applied Chemistry. 76 (12), 2105-2146 (2004).
- Murov, S. L., Carmichael, I., Hug, G. L. . Handbook of hotochemistry 2nd ed. Rev. And expanded. , (1993).
- Dürr, H., Bouas-Laurent, H. . Photochromism: Molecules and Systems. , (2003).
- Klán, P., Wirz, J. . Photochemistry of Organic Compounds: From Concepts to Practice. , (2009).
- Harris, J. D., Moran, M. J., Aprahamian, I. New molecular switch architectures. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 9414-9422 (2018).
- Maafi, M., Brown, R. G. The kinetic model for AB(1ϕ) systems: A closed-form integration of the differential equation with a variable photokinetic factor. Journal of Photochemistry and Photobiology A: Chemistry. 187, 319-324 (2007).
- Lahikainen, M., et al. Tunable photomechanics in diarylethene-driven liquid crystal network actuators. ACS Applied Materials & Interfaces. 12 (42), 47939-47947 (2020).
- Mallo, N., et al. Photochromic switching behaviour of donor-acceptor Stenhouse adducts in organic solvents. Chemical Communications. 52, 13576-13579 (2016).
- Feldmeier, C., Bartling, H., Riedle, E., Gschwind, R. M. LED based NMR illumination device for mechanistic studies on photochemical reactions - Versatile and simple, yet surprisingly powerful. Journal of Magnetic Resonance. 232, 39-44 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados