Method Article
Uma abordagem de ensaio de cometa de alto rendimento para avaliar danos ao DNA celular
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O ensaio de cometa é um meio popular de detectar danos ao DNA. Este estudo descreve uma abordagem para a execução de lâminas em variantes representativas do ensaio do cometa. Essa abordagem aumentou significativamente o número de amostras, diminuindo o tempo de execução do ensaio, o número de manipulações de lâminas e o risco de danos aos géis.
Resumo
As células são continuamente expostas a agentes provenientes dos ambientes interno e externo, que podem danificar o DNA. Esse dano pode causar função celular aberrante e, portanto, o dano ao DNA pode desempenhar um papel crítico no desenvolvimento, possivelmente, de todas as principais doenças humanas, por exemplo, câncer, doenças neurodegenerativas e cardiovasculares e envelhecimento. A eletroforese em gel de célula única (ou seja, o ensaio cometa) é um dos métodos mais comuns e sensíveis para estudar a formação e o reparo de uma ampla gama de tipos de danos ao DNA (por exemplo, quebras de fita simples e dupla, sítios alcalino-lábeis, ligações cruzadas DNA-DNA e, em combinação com certas enzimas de reparo, purinas oxidadas e pirimidinas), tanto in vitro quanto in vivo . Sistemas. No entanto, o baixo rendimento da amostra do ensaio convencional e a laboriosa investigação da amostra são fatores limitantes para sua aplicação mais ampla possível. Com a "pontuação" de cometas cada vez mais automatizada, a limitação é agora a capacidade de processar um número significativo de deslizamentos de cometas. Aqui, uma variante de alto rendimento (HTP) do ensaio cometa (HTP comet assay) foi desenvolvida, o que aumenta significativamente o número de amostras analisadas, diminui o tempo de execução do ensaio, o número de manipulações individuais de lâminas, os requisitos de reagentes e o risco de danos físicos aos géis. Além disso, a pegada do tanque de eletroforese é significativamente diminuída devido à orientação vertical das lâminas e ao resfriamento integral. Também é relatada aqui uma nova abordagem para arrefecer os slides de ensaio de cometas, o que facilita de forma conveniente e eficiente a solidificação dos géis de cometa. Aqui, a aplicação desses dispositivos a métodos representativos de ensaio de cometas foi descrita. Essas inovações simples apoiam muito o uso do ensaio de cometa e sua aplicação a áreas de estudo, como biologia da exposição, ecotoxicologia, biomonitoramento, triagem / teste de toxicidade, juntamente com a compreensão da patogênese.
Introdução
As células são expostas continuamente a agentes provenientes dos ambientes interno e externo, que podem danificar o DNA 1,2. Esse dano pode causar função celular aberrante3 e, portanto, o dano ao DNA pode desempenhar um papel crítico no desenvolvimento de muitas doenças humanas importantes, por exemplo, câncer, doenças neurodegenerativas e cardiovasculares e envelhecimento4. O ensaio cometa (também chamado de eletroforese em gel de célula única) é um método cada vez mais popular para detectar e quantificar danos ao DNA celular.
Na sua forma mais simples, o ensaio de cometa alcalino (ACA) detecta quebras de filamentos (SB; simples e duplos), juntamente com sítios apurínicos/apirimidínicos e sítios alcalino-lábeis (ALS), ambos os quais se tornam quebras de fita simples em condições alcalinas5. O ensaio de cometa de pH neutro pode avaliar quebras francas de fita simples e dupla6. Além disso, o ACA, em combinação com várias enzimas de reparo de DNA, pode detectar uma gama considerável de tipos de danos ao DNA, por exemplo, purinas oxidadas (identificadas pelo uso de 8-oxoguanina DNA glicosilase humana 1; hOGG17); pirimidinas oxidadas (usando Endonuclease III; EndoIII) e dímeros pirimidina ciclobutano (usando endonuclease V T4; T4endoV)8. O ensaio cometa também pode ser usado para avaliar lesões de DNA induzidas por agentes de reticulação, como a cisplatina 9,10,11. Conforme indicado pelo nome formal do ensaio, ou seja, eletroforese em gel de célula única, o ensaio baseia-se em que as células em análise sejam uma suspensão de célula única; mais comumente, são células cultivadas, mas podem ser isoladas do sangue total 12,13, ou o próprio sangue total pode ser utilizado 14,15. Alternativamente, uma única suspensão celular pode ser gerada a partir de tecidos sólidos.
Com exceção de algumas exceções, mais notavelmente os relatórios CometChip do laboratório Engleward 16, o protocolo geral de ensaio de cometas não mudou drasticamente em relação ao originalmente descrito pelos inventores do ensaio (Östling e Johansson17 e Singh etal.18). O ensaio cometa envolve várias etapas (Figura 1). Muitas dessas etapas envolvem a transferência dos géis de agarose finos e contendo células, uma lâmina de cada vez, e, portanto, representam um risco de dano ou perda do gel, comprometendo o sucesso do experimento. Consequentemente, o ensaio do cometa pode ser demorado, particularmente se um número significativo de lâminas estiver sendo executado. Normalmente, um máximo de 40 lâminas são executadas em um grande tanque de eletroforese (33 cm x 59 cm x 9 cm), que fica dentro de uma bandeja ainda maior contendo gelo úmido para resfriamento. Foi relatado recentemente que o tempo de execução do ensaio pode ser encurtado para 1 dia, diminuindo a duração da etapa de lise e não secando as lâminas antes da coloração19.
Os autores do presente artigo relataram anteriormente uma nova abordagem para o ensaio de cometa alcalino de alto rendimento (HTP ACA), no qual múltiplas (lotes de 25) lâminas de microscópio de ensaio de cometa podem ser manipuladas simultaneamente ao longo do processo de ensaio de cometa20,21,22. Esta abordagem patenteada minimiza o risco de danos ou perda dos géis contendo amostras, removendo a necessidade de manipular as lâminas do microscópio individualmente e pode ser aplicada a todas as variantes do ensaio cometa, que usam lâminas de microscópio. Os racks contendo lâminas protegem os géis durante as manipulações e, consequentemente, o processamento da amostra é mais rápido e eficiente. As lâminas também podem sofrer eletroforese nas prateleiras, mantidas na orientação vertical, em vez de horizontal. Isso, e o resfriamento integral, diminuem significativamente a pegada do tanque de eletroforese e eliminam a necessidade de gelo úmido. Em conjunto, isso representa uma melhoria significativa em relação ao procedimento convencional. O equipamento utilizado é ilustrado na Figura 2. Os protocolos aqui descritos, utilizando essa nova abordagem, demonstram a aplicação representativa a células cultivadas e sangue total14 para detecção de sítios alcalino-lábeis (ELA), ligações cruzadas entre fitas de DNA (LCI) e substratos de várias enzimas de reparo de DNA.
Protocolo
Amostras de sangue comercialmente disponíveis foram utilizadas no presente estudo. Em nossa instituição, a aprovação do Comitê de Revisão Institucional não é necessária para o uso de sangue comercialmente disponível.
1. Preparação de materiais para o ensaio cometa
- Preparação das lâminas do microscópio
- Despeje 1% (p/v) de agarose de ponto de fusão normal [dissolvido em água duplamente destilada (ddH 2 O)] em um tubo de 50 mL e micro-ondas para dissolver a agarose no ddH2O. Armazenar a 37 °C para evitar a solidificação antes das lâminas de revestimento. Caso ocorra solidificação, descarte e prepare fresco.
- O microscópio pré-revestimento desliza mergulhando as lâminas no tubo de 50 mL contendo 1% (p/v) de acarose normal do ponto de fusão.
- Limpe a parte de trás dos slides rapidamente depois de mergulhar os slides.
NOTA: A falha em limpar a parte de trás das lâminas corretamente aumentará o ruído de fundo das lâminas durante a etapa de análise por microscópio. - Rotule a lâmina revestida com um marcador permanente no canto inferior direito da seção fosca (Figura 3A). Isso mostra qual lado do slide é pré-revestido.
- Deixe a agarose ajustada e seque durante a noite à temperatura ambiente.
- Embrulhe as lâminas secas em papel de seda e guarde-as numa caixa.
2. Preparação das amostras
- Células cultivadas
NOTA: Em primeiro lugar, trate as células com o(s) agente(s) prejudicial(is) antes de iniciar o ensaio cometa. Em seguida, execute o seguinte.- Se as células forem aderentes, tripsinizá-las para liberá-las do frasco de cultura celular ou da placa de Petri de cultura celular, na confluência apropriada das células. Neutralize a tripsina adicionando meios contendo soro.
- Transfira as células para um tubo de 50 mL, centrífuga (por exemplo, para HaCaTs, centrífuga a 300 x g por 5 min à temperatura ambiente), remova suavemente o sobrenadante e adicione 1 mL de PBS ao pellet celular.
- Execute a contagem de células.
- Transferir 30.000 células para um tubo de microcentrífuga de 1,5 mL e centrífuga a 7.607 x g por 5 min a 4 °C.
- Remova suavemente o sobrenadante e armazene a pelota de células no gelo no escuro antes de realizar o ensaio do cometa.
NOTA: As células devem ser regularmente testadas quanto à contaminação por Mycoplasma antes de realizar o ensaio cometa para prevenir, entre outros efeitos, a formação de danos ao DNA artefactual e resposta alterada a danos no DNA, conforme relatado em outros lugares23. As condições de centrifugação podem ser alteradas, conforme necessário, dependendo do tipo de célula utilizada.
- Preparação de células cultivadas para ensaio de reparação
- Células de cultura no balão de cultura celular ou placas de Petri.
- Lave as células com 1 mL de PBS duas vezes antes de tratar as células com agentes prejudiciais (por exemplo, para células BE-M17, tratar com 50 μM de H 2 O2por 20 min) no gelo para evitar que o reparo ocorra durante o tratamento.
- Lave as células suavemente com 1 mL de PBS duas vezes para remover quaisquer agentes prejudiciais residuais.
- Reintroduza o meio de cultura celular e permita que as células se reparem por durações variadas (por exemplo, 0 min, 30 min, 2 h, 6 h, 24 h e 30 h) em uma incubadora umidificada (37 °C, 5% CO2).
- Em cada ponto de tempo, coletar 30.000 células em meio de cultura celular contendo 10% de dimetilsulfóxido (DMSO) e armazená-las a -80 °C.
- Antes de realizar o ensaio cometa, descongele as células rapidamente a 37 °C em banho-maria e centrifuga-as a 7.607 x g durante 5 min a 4 °C.
- Remova o sobrenadante e armazene a pastilha de célula no gelo antes de realizar o ensaio (ou seja, a partir da etapa 3).
- Preparação de sangue total
NOTA: O método a seguir se beneficia de (i) ser uma abordagem minimamente invasiva para obter uma amostra de sangue, (ii) não exigir o isolamento do PBMC antes do ensaio do cometa e (iii) permitir que as amostras de sangue (com um volume < 250 μL) sejam armazenadas a -80 °C, por até 1 mês (embora evidências mais recentes sugiram que é possível um armazenamento mais longo), sem a necessidade de crioconservantes e sem risco ou formação de dano artefactual14. A aprovação ética, ou equivalente, pode ser necessária antes de obter amostras de sangue de pacientes ou animais. Alternativamente, amostras de sangue comercialmente disponíveis podem ser usadas como no presente estudo. Em nossa instituição, a aprovação do Comitê de Revisão Institucional não é necessária para o uso de sangue comercialmente disponível.- Usando uma pipeta, transfira amostras de sangue total (<250 μL) (Tabela de Materiais) para um tubo de coleta contendo um volume mínimo contendo 0,4 mg de EDTA (por 250 μL de sangue).
- Congele as amostras de sangue a -80 °C antes de realizar o ensaio do cometa HTP.
- Descongelar amostras de sangue armazenadas (<250 μL) à temperatura ambiente, sem aquecimento.
- Transfira 5 μL do sangue total para tubos de microcentrífuga antes de realizar o ensaio cometa (ver passo 3).
3. Lise celular
NOTA: Realize todos os procedimentos no gelo.
- Use 12.000 células ou 2,5 μL de sangue total por gel.
- Preparar a agarose de baixo ponto de fusão a 0,6% (p/v) dissolvida em PBS utilizando um micro-ondas e colocar em banho-maria a 37 °C para evitar que se solidifique.
- Rotule a extremidade fosca das lâminas pré-revestidas com o nome, a data e as informações de tratamento do investigador usando um marcador ou lápis permanente.
- Coloque uma placa de refrigeração em um banco plano e insira os dois pacotes de resfriamento congelados na gaveta deslizante abaixo da superfície metálica (como mostrado na Figura 4)21.
- Coloque as lâminas na placa de refrigeração e deixe que as lâminas pré-esfriem por 1-2 min antes de adicionar as células contendo acarose de baixo ponto de fusão a 0,6% (p/v) (etapa 3.7).
NOTA: Deixar as lâminas na placa de refrigeração por mais de 1-2 min pode causar a formação de condensação na superfície da lâmina devido à umidade ambiente. Isso pode tornar os géis de agarose de baixo ponto de fusão menos estáveis nas lâminas. - Dispersar o pellet (passo 2.2.7) por vórtice. Certifique-se de que todo o sobrenadante foi removido do pellet. Coloque os tubos de amostra (contendo as células peletizadas) imediatamente de volta no gelo.
NOTA: Ao colocar os tubos contendo amostras na centrífuga, coloque-os com a dobradiça voltada para fora, de modo que o pellet seja coletado neste lado do tubo. Às vezes é difícil ver o pellet, e é fácil desalojá-lo enquanto se remove o sobrenadante. A centrifugação com a tampa do tubo nesta orientação permitirá saber onde a pastilha da célula estará. - Ressuspeite o pellet celular com 200 μL de agarose de 0,6% de baixo ponto de fusão (LMP agarose) e misture pipetando para cima e para baixo sem criar bolhas. Em seguida, transfira rapidamente 80 μL de células contendo agarose LMP para uma lâmina resfriada e coloque rapidamente uma tampa no gel.
- Deixe o gel se fixar na placa de refrigeração por 1-2 min.
- Enquanto isso, prepare uma solução de trabalho de 500 mL de tampão de lise (Tabela 1) e despeje-a no prato de lise (Figura 2).
- Uma vez que os géis tenham sido ajustados, remova os deslizamentos de tampa rapidamente, segurando suavemente o deslizamento entre o polegar e o indicador e deslizando o deslizamento da tampa para fora do gel.
- Coloque as lâminas contendo amostras dentro do suporte de lâmina (todas as marcas pretas de "pontos" nas lâminas devem estar voltadas na mesma direção quando colocadas em um suporte) (Figura 3B) e, em seguida, coloque o transportador de lâminas dentro da placa de lise (Figura 2).
- Feche a tampa do prato de lise e mantenha o prato de lise no frigorífico durante a noite a 4 °C ou 30 min à temperatura ambiente, o que melhor se adequar ao horáriodo operador 19.
4. Eletroforese
- Retire cuidadosamente o suporte deslizante do prato de lise. Tome cuidado para não perturbar os géis.
- Coloque cuidadosamente o suporte deslizante numa antena de lavagem pré-carregada com ddH 2 O gelado e deixe-o durante 30 minutos, garantindo que os escorregadores estão completamente cobertoscom ddH2O.
- Insira um pacote de resfriamento congelado dentro da gaveta deslizante sob o tanque de eletroforese para manter a temperatura ideal do tampão.
- Adicionar cuidadosamente a solução de trabalho de eletroforese gelada (Tabela 1) ao tanque de eletroforese e transferir o transportador de lâmina para o tanque de eletroforese. Oriente as lâminas de tal forma que suas partes claras com os géis contendo células (ou seja, NÃO as extremidades foscas / de marcação) apontem para o cátodo (eletrodo vermelho).
- Deixe as lâminas sentarem no tanque de eletroforese por 20 minutos para que o DNA relaxe e relaxe. Mantenha a fonte de alimentação desligada durante esta etapa.
- Se necessário, insira um novo pacote de resfriamento congelado para maximizar o resfriamento.
- Realize eletroforese por 20 min a 1,19 V/cm, ou quaisquer condições que tenham sido otimizadas.
NOTA: A otimização das condições de funcionamento da eletroforese e do volume de tampão é recomendada para todos os laboratórios24. O uso de apenas um único suporte de lâmina durante a eletroforese não causa nenhum efeito das lâminas sobre a resistência do tampão de eletroforese, e os autores não observaram um efeito significativo na tensão ou corrente quando o número de lâminas mudou. - Desligue a fonte de alimentação, remova cuidadosamente o suporte deslizante do tanque de eletroforese e deixe-o drenar em papel de seda por 30 s.
- Coloque o suporte deslizante no prato que contém o tampão de neutralização (Tabela 1). Deixe por 20 min.
- Retire o suporte deslizante do prato de neutralização, coloque-o no prato de lavagem contendo ddH2O gelado e deixe-o por 20 min.
- Retire o suporte de lâminas da água e deixe que as lâminas sequem em uma incubadora a 37 °C por 1 h, ou à temperatura ambiente durante a noite, ou não sequem, dependendo do horário19 do operador.
NOTA: Se não houver secagem na etapa 4.11, execute a etapa de coloração da 5.2.
5. Coloração de iodeto de propídio (PI)
- Transfira o suporte de lâminas para um prato de lavagem contendo ddH2O gelado para reidratar as lâminas e deixe agir por 30 min.
- Coloque o transportador de lâmina em um prato de coloração contendo 2,5 μg/mL de solução de iodeto de propídio.
NOTA: O iodeto de propídio é sensível à luz, portanto, manuseie-o em uma área escurecida. Também é tóxico. - Feche a tampa do prato de coloração e incube-o por 20 minutos no escuro à temperatura ambiente.
- Transfira o suporte deslizante para um prato separado e lave-o com ddH2O gelado por 20 min.
- Retire o suporte deslizante do prato e seque-o completamente no escuro, seja numa incubadora a 37 °C ou à temperatura ambiente, dependendo da programação ou preferência do operador.
- Quando os slides estiverem totalmente secos, remova-os do suporte do slide e armazene-os em uma caixa de slide no escuro até que estejam prontos para a análise da imagem.
NOTA: Os slides permanecerão legíveis indefinidamente e podem ser retirados novamente, se necessário.
6. Ensaio de cometa alcalino modificado por enzimas
NOTA: O ensaio de cometa alcalino modificado por enzimas emprega uma etapa de tratamento enzimático após a lise, mas antes da eletroforese. A atividade da enzima causa quebras no DNA em locais que são substratos para a enzima. Antes de realizar este ensaio, a concentração enzimática e a duração da incubação enzimática devem ser otimizadas.
- Após a lise celular (passo 3), lave as lâminas duas vezes com ddH2O geladas por 20 min cada.
- Retire o suporte deslizante da água e transfira os escorregadores para uma bandeja forrada com toalhas de papel.
- Adicione 80 μL da enzima na concentração otimizada (por exemplo, 3,2 U/mL de hOGG1 para células BE-M17, diluídas em tampão de reação enzimática) e cubra com uma tampa para espalhar a enzima sobre a amostra contendo gel.
- Incubar as lâminas a 37 °C durante a duração otimizada (por exemplo, 45 min para hOGG1).
- Após a incubação, remova as tampas suavemente e transfira as lâminas para o suporte.
NOTA: Não lave as lâminas após o tratamento enzimático; realizar eletroforese diretamente a partir do passo 4.3.
7. Ensaio de cometa alcalino modificado por interfilamentos de DNA (ICL)
NOTA: O conceito desta variante da LCI-ACA é que a presença de LCI no DNA retardará a migração eletroforética do DNA danificado, induzida após a exposição a um insulto gerado oxidativamente. Neste caso, quanto menor a cauda do cometa, maior o número de ICL25,26,27,28.
- Trate as células com um reagente que induza a LCI (por exemplo, cisplatina; consulte Arquivo Suplementar).
- Expor as células tratadas com um dos seguintes agentes para induzir quebras de fita suficientes para criar uma cauda de cometa de tamanho adequado (~20% de DNA da cauda): peróxido de hidrogênio (50 μM H2O 2 por 30 min), radiação ionizante (2-5 Gy) ou ultravioleta B (UVB) (0,5 J/cm2).
- Além disso, produza uma fita de controle positivo de quebra tratando um lote de células com o mesmo agente e dose, conforme usado na etapa 7.2 (ou seja, sem tratamento com agente indutor de LCI).
- Centrifugar as células a 7.607 x g por 5 min, descartar o sobrenadante, lavar a pelota celular três vezes com 1 mL de PBS e processar quanto ao ensaio do cometa alcalino (etapas 3-5).
- Calcule os níveis de inter-fitas de DNA cross-linking usando a fórmula abaixo.
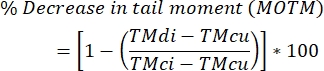
NOTA: MOTM (Mean Olive Tail Moment) é um ensaio de cometa amplamente utilizado ao descrever o ensaio de cometa modificado pela ICL, e é definido como o produto do comprimento da cauda e da fração do DNA total na cauda (ou seja, momento da cauda = comprimento da cauda x % do DNA na cauda)29; TMdi: momento da cauda das amostras tratadas com agente de reticulação e H2 O2 (ou outro indutor disjuntor de fios); TMcu: momento da cauda das amostras não tratadas com um agente de reticulação e não tratadas comH 2 O 2 (sem tratamento), e TMci: momento da cauda das amostras não tratadas com um agente de reticulação, mas tratadas com H 2 O 2.
8. Pontuação de cometas e análise de dados
NOTA: O termo "cometa" deriva das imagens de células danificadas quando vistas ao microscópio após a realização do ensaio (Figura 5). Sob condições de eletroforese, o DNA nas células não danificadas em grande parte não migra, mas permanece em um esferoide denominado "cabeça" do cometa. No entanto, a presença de quebras de fita permite que o DNA da célula migre para fora da cabeça e forme uma "cauda", levando a uma aparência de cometa (Figura 5). Quanto mais DNA na cauda, mais danos estão presentes.
- Ligue o microscópio de fluorescência com o filtro PI (vermelho) (λ = 536/617 nm) e o software de pontuação do ensaio cometa.
- Adicione uma gota de água usando uma pipeta Pasteur ao gel e cubra com uma tampa.
- Coloque as lâminas no microscópio de fluorescência e "pontuar" os cometas.
NOTA: A pontuação é um meio pelo qual os cometas são avaliados, para determinar a quantidade de dano presente em cada cometa. Em termos gerais, isso pode ser alcançado usando duas abordagens, de acordo com a preferência escolhida pelo usuário, seja por olho (medindo o tamanho dos cometas em uma escala de zero a quatro) ou usando livremente ou comercialmente disponível software30. Geralmente, ambas as abordagens avaliam o tamanho da cauda do cometa, embora uma variedade de pontos finais relacionados ao cometa possa ser determinada. Se estiver usando o software, clique no meio da cabeça do cometa e aguarde até que o software detecte o cometa automaticamente e, em seguida, avalie o ponto final escolhido (Figura 5). - Pontuação de 50 cometas por gel e 100 cometas por amostra (ou seja, cada amostra correspondente a diferentes tratamentos de danos ao DNA, ou suas replicações).
- Replicar os experimentos (n = 2) ou triplicar os experimentos (n = 3).
NOTA: Se apenas n=2 experimentos replicados forem realizados, a análise estatística não poderá ser realizada, mas se n=3, realizar o teste de normalidade de D'agostino. A maioria dos dados de ensaios de cometas não passa por um teste de normalidade. Neste caso, use um teste não paramétrico (teste de Kruskal-Wallis com o teste de comparações múltiplas de Dunn, e teste de significância de Mann-Whitney definido em p < 0,05).
Resultados
Otimização da tensão de eletroforese para o HTP ACA
Queratinócitos humanos (HaCaTs; Tabela de Materiais) foram irradiados com diferentes doses de radiação ultravioleta A (UVA) (5 ou 10 J/cm2; Figura 6A), UVB (0,5 ou 1 J/cm2; Figura 6B), ou tratados com 50 μM H 2 O2(Figura 6C) para induzir danos. Três tensões diferentes da eletroforese foram testadas para determinar a tensão ideal para eletroforese. Os resultados de todos os três tratamentos prejudiciais ao DNA revelaram que, enquanto todas as tensões geraram respostas lineares de dose, a resposta mais sensível foi obtida com 1,19 V/cm. As HaCaTs apresentaram o maior dano ao DNA basal usando 1,19 V/cm durante a eletroforese em comparação com 1 V/cm e 1,09 V/cm (Figura 6A-C). Além disso, utilizando 1,19 V/cm, observa-se a maior % de DNA da cauda, após todos os tratamentos prejudiciais (Figura 6)31.
Detecção de danos no DNA no sangue total humano usando Fpg modificado HTP ACA
O sangue de whold humano (Tabela de Materiais) foi irradiado com diferentes doses de 10 J/cm2 UVA para induzir danos. Quatro concentrações diferentes de Fpg (1, 2, 4 ou 8 U/mL) foram usadas para determinar a concentração ideal para o tratamento enzimático no HTP ACA. Os resultados mostraram que os níveis ótimos de dano ao DNA foram revelados com 4 U/mL de Fpg (Figura 7A). Imagens representativas de cometas de amostras de sangue irradiado por UVA (Figura 7B).
Detecção de DNA ICL em uma linhagem celular de câncer de ovário representativa usando o HTP ACA modificado por ICL
Uma linhagem celular de câncer de ovário (SKOV-3; Tabela de Materiais) foi tratada com combinações de cisplatina 200 μM e/ou tratamento subsequente com 50 μM H 2 O2por 30 min em gelo. Nenhum dano apreciável foi observado nas células não expostas (Figura 8A). A exposição a H 2O2 isoladamente gerou um MOTM significativo (Figura 8B). Em contraste, as células nas quais a LCI foi induzida apresentaram diminuição do MOTM (Figura 8C)28.
Formação e reparo de LCI de DNA induzida por cisplatina em uma linhagem celular representativa de câncer de ovário
O HHP ACA modificado por LCI foi usado para determinar o curso do tempo para a formação e reparo de LCI de DNA induzido pela cisplatina em uma linhagem celular de câncer de ovário (A2780; Tabela de Materiais). As células foram tratadas com cisplatina 100 μM por 1 h e, em seguida, incubadas em meio livre de cisplatina (meio RPMI 1640 suplementado com soro fetal bovino (FBS) a 10% (v/v)) para um curso de tempo subsequente. Em vários momentos, o HTP ACA modificado por LCI foi realizado para estabelecer os níveis de LCI (Figura 9)28. Nenhuma LCI foi detectada antes do tratamento com cisplatina. No entanto, após um único tratamento com cisplatina 100 μM, os níveis de LCI aumentaram significativamente, atingindo o pico às 12 h, após o que os níveis diminuíram de volta a zero após 30 h.
Correlação entre os níveis de DNA ICL e platina no DNA
Três células de câncer de ovário foram tratadas com cisplatina de 100 μM para induzir diferentes níveis de DNA-ICL, antes da análise pelo HTP ACA modificado por ICL e espectrometria de massa indutivamente acoplada (ICP-MS; consulte Arquivo Suplementar para detalhes). Como mostrado na Figura 10, diferentes níveis de DNA-ICL foram induzidos nas três linhagens celulares, juntamente com diferentes níveis de Pt no DNA. Uma correlação positiva (R2 = 0,9235) foi observada entre os níveis de LCI de DNA e as concentrações de platina, indicando a associação entre os níveis de platina de DNA e a CLI28 correspondente.
Reparo de excisão de base em células BE-M17 infectadas e não infectadas por Mycoplasma
As células BE-M17 infectadas e não infectadas por micoplasma foram tratadas com 50 μM H 2 O 2 por 30 min e incubadas com meio completo (meio Dulbecco modificado de Eagle suplementado com 10% (v/v) FBS) por diferentes durações (0 min, 30 min, 1 h,2h, 6 h, 24 h ou 30 h) durante as quais as células foram permitidas a reparação. Em cada ponto de tempo, as células foram coletadas e congeladas a -80 °C, em meio contendo DMSO a 10%, antes de realizar o HTP ACA modificado por hOGG1 (etapa 6). Após 30 min, os níveis de SB/ALS diminuíram para 21% de TD (porcentagem de DNA da cauda) nas células não infectadas, enquanto as células infectadas apresentaram 49% de DT (Figura 11A). Após ~15 h, os níveis de SB/ALS retornaram à linha de base em células infectadas e não infectadas. Para as purinas oxidadas, o BE-M17 não infectado apresentou inicialmente um pequeno aumento do dano, antes de retornar à linha de base em 30 h (Figura 11B). Em contraste, as células infectadas apresentaram um aumento sustentado e significativo das purinas oxidadas, que permaneceram elevadas, e não retornaram aos níveis basais mesmo após 30 h (Figura 11B)23.
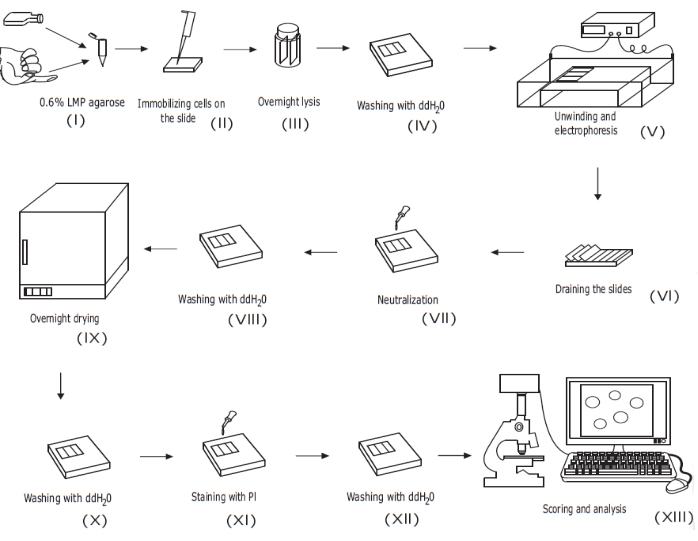
Figura 1: Visão geral do procedimento convencional de ensaio de cometa alcalino. (i) Uma suspensão unicelular de células cultivadas ou uma amostra de sangue total é misturada com acarose LMP a 0,6% (p/v). ii) A mistura célula/agarose é aplicada a lâminas de microscópio pré-revestidas e coberta com lâmina de cobertura até ser solidificada. (iii) As células são lisadas usando um tampão de lise de pH alto durante a noite, formando corpos nucleoides, antes de (iv) lavar com ddH2O. (v) O DNA celular se desenrola no tampão de eletroforese de pH alto. A presença de quebras de fita permite que o DNA relaxe e descontraia e, sob eletroforese, o DNA é retirado do corpo nucleoide, formando uma cauda. As lâminas são então (vi) drenadas, secas, (vii) neutralizadas e (viii) lavadas com ddH2O antes de (ix) serem secas durante a noite. As lâminas são então (x) reidratadas com ddH2O, (xi) coradas, (xii) lavadas e, finalmente, (xiii) pontuadas e analisadas, normalmente usando microscopia fluorescente e software de análise de imagens. Este número é reproduzido de uma publicação anterior20. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: Os materiais que compõem o sistema de eletroforese cometa de alto rendimento. Tanque de eletroforese HTP, racks HTP e os pratos para lise, lavagem, neutralização e coloração são mostrados. Por favor, clique aqui para ver uma versão maior desta figura.
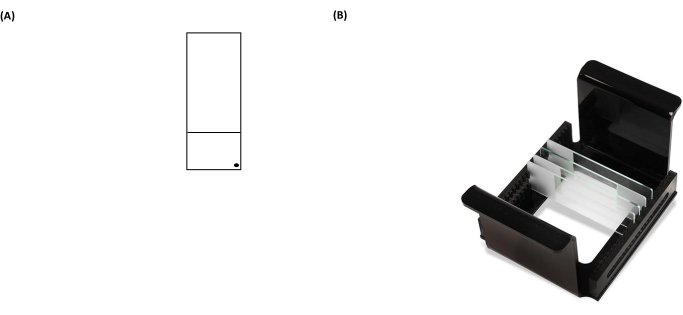
Figura 3: Imagens representativas de uma lâmina de ensaio cometa e rack HTP (transportador de lâmina de microscópio). (A) Para orientação correta, a face pré-revestida da lâmina de microscópio é reconhecida por um ponto preto no canto direito de uma lâmina de microscópio. (B) A imagem do rack HTP ilustra como as lâminas são mantidas em uma orientação vertical apertada, com abas no transportador para fixar sua orientação dentro do tanque de eletroforese. Cada transportadora pode acomodar até 25 slides. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 4: Representação da placa de refrigeração com lâminas de amostra e embalagens de freezer no lugar. Clique aqui para ver uma versão maior desta figura.

Figura 5: Captura de tela de cometas representativos tirada durante a pontuação. HaCaTs (A) sem tratamento e (B) tratados com 1 J/cm2 UVB antes de realizar HTP ACA. A maioria dos pacotes de software pode calcular uma variedade de endpoints de cometas, mas os mais comuns são o % de DNA da cauda (de preferência) ou o momento da cauda com base nessas imagens (azul: início da cabeça, verde: meio da cabeça e roxo: extremidade da cauda). A barra de escala é de 10 μm. Clique aqui para ver uma versão maior desta figura.
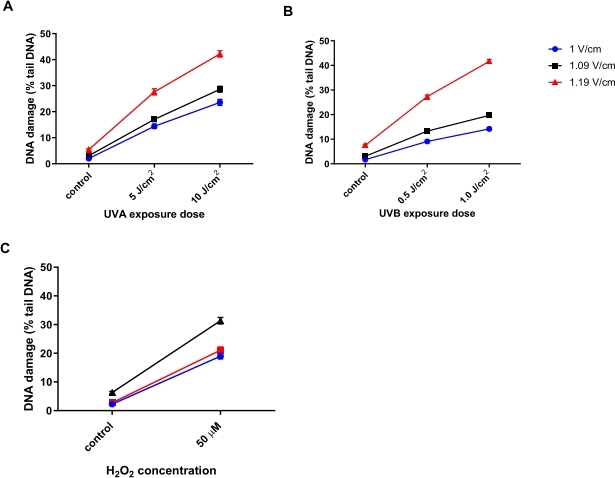
Figura 6: Gráficos representativos ilustrando o efeito da tensão de eletroforese na porcentagem de DNA da cauda, determinada usando o HTP ACA. As células foram expostas a (A) 5 ou 10 J/cm 2 UVA, (B) 0,5 ou 1,0 J/cm 2 UVB, ou (C) 50 μM H 2 O 2 antes do HTP ACA, com a tensão de eletroforese em 1, 1,09 ou 1,19 V/cm. Os dados representam a média de 200 determinações de n = 2 experimentos duplicados31. Por favor, clique aqui para ver uma versão maior desta figura.
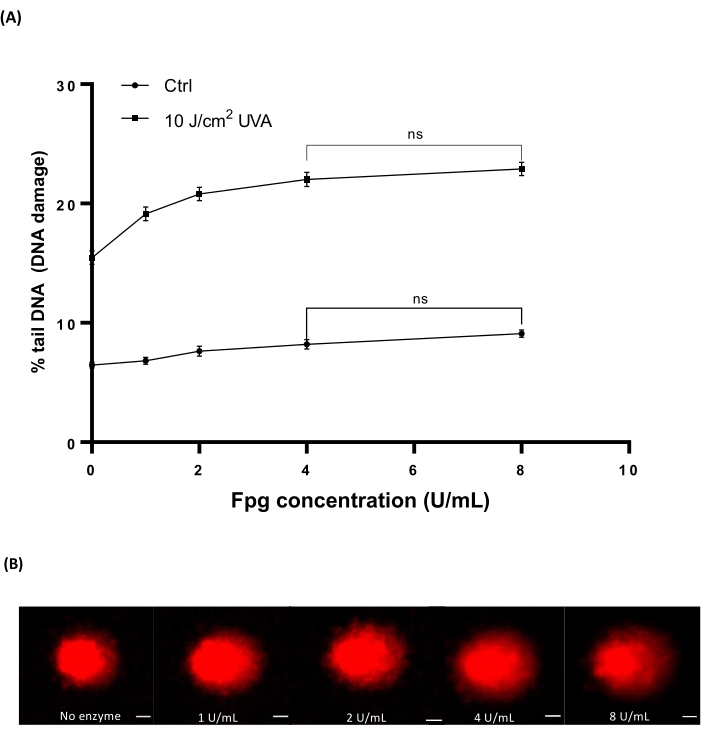
Figura 7: Gráfico representativo e imagens de cometas de sangue humano analisadas pelo HTP ACA modificado pelo Fpg. Amostras de sangue humano foram irradiadas com 10 J/cm2 UVA ou simulado irradiado ('ctrl') em gelo antes da etapa de lise. Diferentes concentrações de Fpg (1, 2, 4 ou 8 U/mL) foram utilizadas para o tratamento enzimático antes da eletroforese. (A) Os dados representam a média ± MEV de 300 determinações de n=3 experimentos. (B) Imagens representativas de cometas para cada concentração de Fpg em amostras de sangue irradiado UVA 10 J/cm2 . A barra de escala é de 10 μm. Clique aqui para ver uma versão maior desta figura.
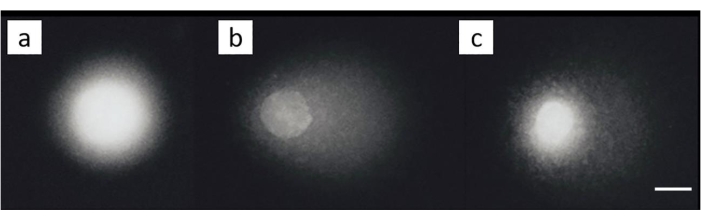
Figura 8: Imagens representativas de cometas ilustrando a detecção de LCI após tratamento com cisplatina. (A) Células de controle sem qualquer tratamento, (B) células que foram tratadas apenas com H 2 O 2 (50 μM), (C) células que foram tratadascom H2 O2 (50 μM) e cisplatina (200 μM), ilustrando que a cauda é mais curta do que em (B), devido à presença de ICL28. A barra de escala é de 10 μm. Clique aqui para ver uma versão maior desta figura.
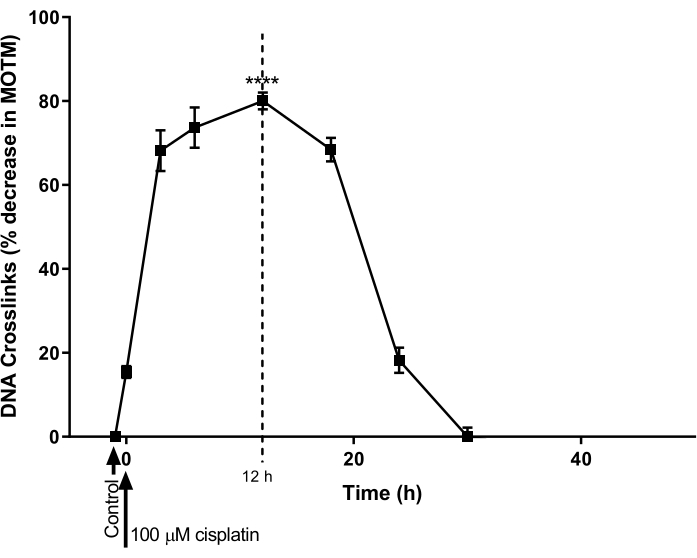
Figura 9: Demonstração da cinética da formação e reparo de LCI induzida por cisplatina. As células A2780 foram tratadas com 100 μM de cisplatina em meio de cultura por 1 h. O meio contendo cisplatina foi então removido e as células foram cultivadas por vários pontos de tempo, antes da análise por HTP ACA modificado por LCI. Os dados representam média ± MEV de n = 3 experimentos28. P < 0,0001. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 10: Correlação entre a LCI de DNA e a concentração de platina. As LCI de DNA foram determinadas pelo HTP ACA modificado por LCI e os níveis de platina foram medidos pela ICP-MS (com Discriminação de Energia Quádrupla Única, SQ-KED), em três linhagens celulares de câncer de ovário. R2 = 0,9235. Consulte Arquivo Suplementar para a metodologia ICP-MS para quantificar os níveis de platina no DNA28. Por favor, clique aqui para ver uma versão maior desta figura.
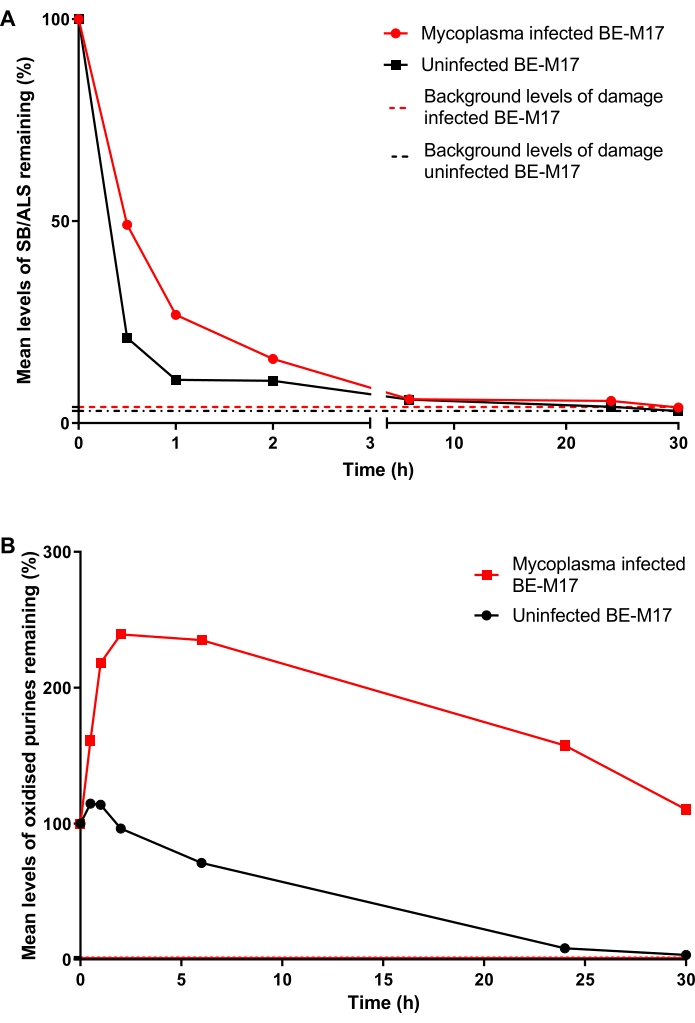
Figura 11: Um gráfico representativo ilustrando danos e reparos no DNA, determinados pelo ensaio de cometa modificado por hOGG1, em células BE-M17 infectadas por Mycoplasma versus não infectadas. Após o tratamento com 50 μM H 2 O2 por 30 min, as células foram autorizadas a reparar por diferentes durações (0, 30 min, 1 h,2 h, 6 h, 24 h ou 30 h). O HOGG1-modified HTP ACA foi usado para medir (A) SB/ALS e (B) purinas oxidadas em células BE-M17 infectadas (pontos de dados vermelhos) e não infectadas (pontos de dados pretos). Os dados representam a média de 200 determinações de n = 2 experimentos duplicados. Esta figura é reproduzida com permissão de uma publicação anterior23. Por favor, clique aqui para ver uma versão maior desta figura.
| Reagente | Solução de Estoque | Solução de trabalho | |
| Tampão de lise | 100 mM Na 2 EDTA, 2,5 M NaCl e 10 mM Tris Base em ddH2O; ajustar o pH para 10 com 10 M de NaOH | 1% Triton X-100 em solução de lise | |
| Tampão de eletroforese | 10 M NaOH e 200 mM Na 2 EDTA em ddH2O | 300 mM NaOH e 1 mM Na2EDTA; pH > 13 | |
| Buffer de neutralização | 0,4 M Tris Base em ddH2O; ajustar o pH para 7,5 com HCl | ||
| Buffer de coloração | 1 mg/mL de iodeto de propídio | 2,5 μg/mL de iodeto de propídio em ddH2O | |
Tabela 1: Composição dos reagentes utilizados no HTP ACA. O estoque e as concentrações de trabalho de lise, eletroforese, neutralização e tampões de coloração são mostrados.
Arquivo Suplementar. Clique aqui para baixar este arquivo.
Discussão
Este estudo demonstra a versatilidade fornecida pelo equipamento atual, que pode ser usado para alcançar um alto rendimento com uma variedade de variantes representativas e comuns do ensaio cometa (ou seja, alcalina, enzimicamente modificada, sangue e ICL, e outras variantes também serão adequadas). Além disso, a presente abordagem traz consigo vários benefícios 20,21: (a) o tempo de execução do ensaio é diminuído devido à manipulação de múltiplas lâminas em paralelo (o tempo de manuseio diminui em60%); b) O risco de danos nos géis e, por conseguinte, o risco para a experiência é diminuído; (c) os requisitos de reagentes são diminuídos (por exemplo, o volume do tanque de eletroforese é menor do que o tanque convencional); d) O número de diapositivos executados é aumentado. Um tanque pode fornecer um aumento de 20% no número de lâminas executadas em comparação com um único tanque convencional; no entanto, vários tanques de eletroforese podem ser executados ou escravizados (ou seja, vários tanques controlados por uma única fonte de alimentação), em paralelo a partir da mesma fonte de alimentação, e ainda exigem uma pegada de bancada menor do que um único tanque convencional com bandeja de gelo; e (e) a pegada do tanque é diminuída devido à orientação vertical das lâminas e ao resfriamento integral (economiza espaço no laboratório); o tanque HTP compreende uma base de resfriamento cerâmico de alto desempenho com uma gaveta deslizante que pode caber um pacote de resfriamento congelado para manter a temperatura ideal do tampão sem ter que executar o processo em uma câmara fria.
Além disso, a placa de resfriamento desenvolvida por nós acomoda 26 lâminas de cometa, permite a rápida solidificação da agarose de baixo ponto de fusão nas lâminas de ensaio do cometa e facilita uma fácil recuperação das lâminas após a solidificação do gel de agarose. As inovações acima tornam o processo de ensaio do cometa mais simples e fácil.
Embora outras abordagens de alto rendimento tenham sido desenvolvidas (por exemplo, ensaio de cometa de 12 gel, CometChip ou 96 formatos de mini-gel)25, muitos cientistas preferem usar as lâminas de microscópio convencionais (que incluem as lâminas pré-revestidas comercialmente disponíveis ou outras lâminas especializadas). A abordagem atual pode acomodar todos os tipos de lâminas de microscópio, permitindo que os experimentos usando essas lâminas sejam ampliados por meio de processamento e manuseio de lâminas mais rápidos. Como observado acima, o sistema de cometas HTP traz muitas vantagens, mas há uma limitação notável: a abordagem atual fornece apenas um aumento de 20% no número de amostras executadas, em comparação com um tanque horizontal convencional (embora o processamento de lâminas seja muito mais rápido). Os formatos CometChip e 96 mini-gel executam um número maior de amostras. Até o momento, não sabemos se a abordagem atual pode acomodar os formatos CometChip ou 96 mini-gel, embora prevejamos que isso aconteça. Como observado acima, o número de amostras pode ser aumentado ainda mais escravizando tanques para uma única fonte de alimentação. Como em todas as abordagens, ainda há uma chance de perder ou danificar os géis ao carregar amostras e analisá-las sob o microscópio, mas isso é mais devido ao erro do operador, e as chances disso são minimizadas com a abordagem atual.
O uso do sistema cometa HTP pode ajudar muito a analisar os danos ao DNA, facilitando o uso do ensaio do cometa em uma ampla gama de aplicações, como epidemiologia molecular, ciência reprodutiva masculina, estudos de genotoxicologia e toxicologia ambiental. Isso é particularmente verdadeiro para aqueles usuários que desejam ter todos os benefícios de melhor rendimento e facilidade de uso, sem se afastar das lâminas de microscópio convencionais familiares e econômicas.
Divulgações
O Dr. Cooke e o Dr. Karbaschi são inventores de três patentes concedidas relacionadas às tecnologias descritas aqui.
Agradecimentos
O trabalho relatado nesta publicação foi, em parte, apoiado pelo Instituto Nacional de Ciências da Saúde Ambiental dos Institutos Nacionais de Saúde sob o número do prêmio: 1R41ES030274. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a visão oficial dos Institutos Nacionais de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
Referências
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados