Method Article
Une approche de dosage de comète à haut débit pour évaluer les dommages à l’ADN cellulaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le test de comète est un moyen populaire de détecter les dommages à l’ADN. Cette étude décrit une approche pour exécuter des glissements dans des variantes représentatives du test de la comète. Cette approche a considérablement augmenté le nombre d’échantillons tout en réduisant la durée d’exécution des essais, le nombre de manipulations de lames et le risque d’endommagement des gels.
Résumé
Les cellules sont continuellement exposées à des agents provenant des environnements internes et externes, qui peuvent endommager l’ADN. Ces dommages peuvent causer une fonction cellulaire aberrante et, par conséquent, les dommages à l’ADN peuvent jouer un rôle essentiel dans le développement, éventuellement, de toutes les principales maladies humaines, par exemple le cancer, les maladies neurodégénératives et cardiovasculaires et le vieillissement. L’électrophorèse sur gel unicellulaire (c.-à-d. le test des comètes) est l’une des méthodes les plus courantes et les plus sensibles pour étudier la formation et la réparation d’un large éventail de types de dommages à l’ADN (p. ex. cassures simple et double brin, sites alcalins-labiles, liaisons croisées ADN-ADN et, en combinaison avec certaines enzymes de réparation, purines oxydées et pyrimidines), in vitro et in vivo . Systèmes. Cependant, le faible débit de l’échantillon du test conventionnel et le travail laborieux de l’échantillon limitent l’application la plus large possible. Avec la « notation » des comètes de plus en plus automatisée, la limitation est maintenant la capacité de traiter un nombre important de diapositives de comètes. Ici, une variante à haut débit (HTP) du test de comète (test de comète HTP) a été développée, ce qui augmente considérablement le nombre d’échantillons analysés, diminue le temps d’exécution du test, le nombre de manipulations individuelles de lames, les besoins en réactifs et le risque de dommages physiques aux gels. De plus, l’empreinte du réservoir d’électrophorèse est considérablement réduite en raison de l’orientation verticale des glissières et du refroidissement intégré. Une nouvelle approche pour refroidir les lames d’essai des comètes est également rapportée ici, qui facilite de manière pratique et efficace la solidification des gels de comètes. Ici, l’application de ces dispositifs à des méthodes représentatives de dosage des comètes a été décrite. Ces innovations simples soutiennent grandement l’utilisation du test cométaire et son application à des domaines d’étude tels que la biologie de l’exposition, l’écotoxicologie, la biosurveillance, le dépistage / test de toxicité, ainsi que la compréhension de la pathogenèse.
Introduction
Les cellules sont continuellement exposées à des agents provenant des environnements internes et externes, qui peuvent endommager l’ADN 1,2. Ces dommages peuvent causer une fonction cellulaire aberrante3 et, par conséquent, les dommages à l’ADN peuvent jouer un rôle essentiel dans le développement de nombreuses maladies humaines majeures, par exemple le cancer, les maladies neurodégénératives et cardiovasculaires et le vieillissement4. Le test des comètes (également appelé électrophorèse sur gel unicellulaire) est une méthode de plus en plus populaire pour détecter et quantifier les dommages à l’ADN cellulaire.
Dans sa forme la plus simple, le test des comètes alcalines (ACA) détecte les ruptures de brins (SB; simples et doubles), ainsi que les sites apyriniques / apyrimidiniques et les sites alcalins-labiles (ALS) qui deviennent tous deux des cassures simple brin dans des conditions alcalines5. Le test de comète à pH neutre peut évaluer les ruptures franches simple et double brin6. En outre, l’ACA, en combinaison avec un certain nombre d’enzymes de réparation de l’ADN, peut détecter une gamme considérable de types de dommages à l’ADN, par exemple, les purines oxydées (identifiées par l’utilisation de l’ADN glycosylase 1 de la 8-oxoguanine humaine; hOGG17); pyrimidines oxydées (à l’aide de l’endonucléase III; EndoIII) et les dimères cyclobutane pyrimidine (utilisant l’endonucléase T4 V; T4endoV)8. Le test des comètes peut également être utilisé pour évaluer les lésions de l’ADN induites par des agents de réticulation, tels que le cisplatine 9,10,11. Comme l’indique le nom officiel de l’essai, c’est-à-dire électrophorèse sur gel unicellulaire, l’essai repose sur le fait que les cellules analysées sont une suspension unicellulaire; Le plus souvent, ce sont des cellules en culture, mais peuvent être isolées du sang total 12,13, ou le sang total lui-même peut être utilisé 14,15. Alternativement, une suspension unicellulaire peut être générée à partir de tissus solides.
À quelques exceptions près, notamment les rapports CometChip du laboratoire Engleward 16, le protocole global de dosage des comètes n’a pas changé radicalement par rapport à celui décrit à l’origine par les inventeurs du test (Östling et Johansson17 et Singh etal.18). Le test des comètes comporte de nombreuses étapes (Figure 1). Bon nombre de ces étapes impliquent le transfert des gels d’agarose minces contenant des cellules, une lame à la fois, et, par conséquent, présentent un risque d’endommagement ou de perte du gel, compromettant le succès de l’expérience. Par conséquent, le test des comètes peut prendre beaucoup de temps, en particulier si un nombre important de lames sont exécutées. En règle générale, un maximum de 40 lames sont exécutées dans un grand réservoir d’électrophorèse (33 cm x 59 cm x 9 cm), qui se trouve dans un plateau encore plus grand contenant de la glace humide pour le refroidissement. Il a été récemment rapporté que la durée du test peut être raccourcie à 1 jour en diminuant la durée de l’étape de lyse et en ne séchant pas les lames avant la coloration19.
Les auteurs actuels ont déjà signalé une nouvelle approche du test de comète alcaline à haut débit (HTP ACA), dans lequel plusieurs lames de microscope d’essai de comètes (lots de 25) peuvent être manipulées simultanément tout au long du processus d’essai des comètes20,21,22. Cette approche brevetée minimise le risque d’endommagement ou de perte des gels contenant des échantillons en éliminant la nécessité de manipuler les lames de microscope individuellement et peut être appliquée à toutes les variantes du test de comète, qui utilisent des lames de microscope. Les racks contenant des lames protègent les gels pendant les manipulations et, par conséquent, le traitement des échantillons est plus rapide et plus efficace. Les glissières peuvent également subir une électrophorèse dans les racks, maintenus dans l’orientation verticale plutôt qu’horizontale. Ceci, ainsi que le refroidissement intégral, réduit considérablement l’empreinte du réservoir d’électrophorèse et élimine le besoin de glace humide. Dans l’ensemble, cela représente une amélioration significative par rapport à la procédure conventionnelle. L’équipement utilisé est illustré à la figure 2. Les protocoles décrits ici, utilisant cette nouvelle approche, démontrent l’application représentative aux cellules cultivées et au sang total14 pour la détection des sites alcalino-labiles (SLA), des liaisons croisées interbrins de l’ADN (ICL) et des substrats de diverses enzymes de réparation de l’ADN.
Protocole
Des échantillons de sang disponibles dans le commerce ont été utilisés dans la présente étude. Dans notre établissement, l’approbation du comité d’examen de l’établissement n’est pas nécessaire pour l’utilisation de sang disponible sur le marché.
1. Préparation du matériel pour le test cométaire
- Préparation des lames de microscope
- Verser 1 % (p/v) d’agarose à point de fusion normal [dissoute dans de l’eau bidistillée (ddH2O)] dans un tube de 50 mL et au micro-ondes pour dissoudre l’agarose dans le ddH2O. Conserver à 37 °C pour éviter la solidification avant de recouvrir les lames. En cas de solidification, jeter et préparer frais.
- Précouche de lames de microscope en plongeant les lames dans le tube de 50 ml contenant 1 % (p/v) du point de fusion normal agarose.
- Essuyez rapidement l’arrière des diapositives après les avoir trempées.
REMARQUE: Si vous n’essuyez pas correctement l’arrière des lames, le bruit de fond des lames augmentera pendant l’étape d’analyse au microscope. - Étiquetez la lame revêtue à l’aide d’un marqueur permanent dans le coin inférieur droit de la section givrée (figure 3A). Cela montre quel côté de la diapositive est pré-revêtu.
- Laisser l’agarose prendre et sécher pendant la nuit à température ambiante.
- Enveloppez les lames séchées dans du papier de soie et conservez-les dans une boîte.
2. Préparation des échantillons
- Cellules en culture
REMARQUE: Tout d’abord, traitez les cellules avec le ou les agents nuisibles avant de commencer le test de la comète. Ensuite, procédez comme suit.- Si les cellules adhèrent, trypsiniser les cellules pour les libérer du flacon de culture cellulaire ou des boîtes de Petri de culture cellulaire, à la confluence appropriée des cellules. Neutraliser la trypsine en ajoutant des milieux contenant du sérum.
- Transférer les cellules dans un tube de 50 mL, centrifuger (p. ex., pour les HaCaTs, centrifuger à 300 x g pendant 5 min à température ambiante), retirer doucement le surnageant et ajouter 1 mL de PBS à la pastille de cellule.
- Effectuer le comptage des cellules.
- Transférer 30 000 cellules dans un tube microcentrifuge de 1,5 mL et centrifuger à 7 607 x g pendant 5 minutes à 4 °C.
- Retirez doucement le surnageant et stockez la pastille cellulaire sur de la glace dans l’obscurité avant d’effectuer le test de la comète.
REMARQUE : Les cellules doivent être régulièrement testées pour la contamination par les mycoplasmes avant d’effectuer le test cométaire afin de prévenir, entre autres effets, la formation de dommages artéfactuels à l’ADN et la réponse altérée aux dommages à l’ADN, comme indiqué ailleurs23. Les conditions de centrifugation peuvent être modifiées, au besoin, selon le type de cellule utilisé.
- Préparation de cellules cultivées pour le test de réparation
- Cellules de culture dans le flacon de culture cellulaire ou les boîtes de Petri.
- Lavez les cellules avec 1 mL de PBS deux fois avant de traiter les cellules avec des agents nocifs (p. ex., pour les cellules BE-M17, traitez avec 50 μM de H 2O2 pendant 20 min) sur de la glace pour éviter que la réparation ne se produise pendant le traitement.
- Lavez doucement les cellules avec 1 mL de PBS deux fois pour éliminer tout agent nocif résiduel.
- Réintroduire le milieu de culture cellulaire et permettre aux cellules de se réparer pendant des durées variables (p. ex. 0 min, 30 min, 2 h, 6 h, 24 h et 30 h) dans un incubateur humidifié (37 °C, 5 % CO2).
- À chaque point temporel, prélever 30 000 cellules dans un milieu de culture cellulaire contenant du diméthylsulfoxyde (DMSO) à 10 % et les conserver à -80 °C.
- Avant d’effectuer le test de la comète, décongelez rapidement les cellules à 37 °C dans un bain-marie et centrifugez-les à 7 607 x g pendant 5 min à 4 °C.
- Retirer le surnageant et entreposer la pastille cellulaire sur de la glace avant d’effectuer le test (c.-à-d. à partir de l’étape 3).
- Préparation du sang total
NOTE: La méthode suivante bénéficie (i) d’une approche mini-invasive pour obtenir un échantillon de sang, (ii) ne nécessitant pas l’isolement de PBMC avant le test de la comète, et (iii) permettant aux échantillons de sang (d’un volume < 250 μL) d’être stockés à -80 ° C, jusqu’à 1 mois (bien que des preuves plus récentes suggèrent qu’un stockage plus long est possible), sans avoir besoin de cryoconservateurs, et sans risque ni formation de dommages artéfactuels14. Une approbation éthique, ou équivalente, peut être nécessaire avant d’obtenir des échantillons de sang de patients ou d’animaux. Alternativement, des échantillons de sang disponibles dans le commerce peuvent être utilisés comme dans la présente étude. Dans notre établissement, l’approbation du comité d’examen de l’établissement n’est pas nécessaire pour l’utilisation de sang disponible sur le marché.- À l’aide d’une pipette, transférer les échantillons de sang total (<250 μL) (tableau des matériaux) dans un tube de prélèvement contenant un volume minimal contenant 0,4 mg d’EDTA (par 250 μL de sang).
- Congeler les échantillons de sang à -80 °C avant d’effectuer le test de la comète HTP.
- Décongeler les échantillons de sang entreposés (<250 μL) à température ambiante, sans chauffage.
- Transférer 5 μL de sang total dans des tubes microcentrifugés avant d’effectuer le test cométaire (voir étape 3).
3. Lyse cellulaire
NOTE : Effectuez toutes les procédures sur la glace.
- Utilisez 12 000 cellules ou 2,5 μL de sang total par gel.
- Préparer l’agarose à bas point de fusion à 0,6 % (p/v) dissoute dans du PBS à l’aide d’un four à micro-ondes et la placer au bain-marie à 37 °C pour éviter qu’elle ne se solidifie.
- Étiquetez l’extrémité givrée des lames précouchées avec le nom, la date et les renseignements sur le traitement de l’investigateur à l’aide d’un marqueur permanent ou d’un crayon.
- Placer une plaque de refroidissement sur un banc plat et insérer les deux blocs réfrigérants congelés dans le tiroir coulissant sous la surface métallique (comme illustré à la figure 4)21.
- Placez les lames sur la plaque de refroidissement et laissez les lames prérefroidir pendant 1-2 minutes avant d’ajouter les cellules contenant de l’agarose à 0,6% (p / v) à bas point de fusion (étape 3.7).
REMARQUE: Laisser les lames sur la plaque de refroidissement pendant plus de 1-2 minutes peut provoquer la formation de condensation sur la surface de la lame en raison de l’humidité ambiante. Cela peut rendre les gels d’agarose à bas point de fusion moins stables sur les lames. - Disperser la pastille (étape 2.2.7) par vortex. Assurez-vous que tout le surnageant a été retiré de la pastille. Replacez immédiatement les tubes d’échantillon (contenant les cellules granulées) sur de la glace.
NOTE: Lorsque vous placez les tubes contenant l’échantillon dans la centrifugeuse, placez-les avec la charnière tournée vers l’extérieur afin que la pastille soit recueillie de ce côté du tube. Parfois, il est difficile de voir la pastille et il est facile de la déloger tout en enlevant le surnageant. La centrifugation avec le couvercle du tube dans cette orientation permettra de savoir où se trouvera la pastille de cellule. - Resuspendre la pastille de la cellule avec 200 μL d’agarose à bas point de fusion à 0,6 % (agarose LMP) et mélanger en pipetant de haut en bas sans créer de bulles. Ensuite, transférez rapidement 80 μL de cellules contenant de l’agarose LMP sur une lame réfrigérée et placez rapidement une lamelle de couverture sur le gel.
- Laisser le gel prendre sur la plaque de refroidissement pendant 1-2 min.
- Pendant ce temps, préparer une solution de travail de 500 ml de tampon de lyse (tableau 1) et la verser dans la boîte de lyse (figure 2).
- Une fois les gels pris, retirez rapidement les lamelles de couverture en maintenant doucement la lame entre le pouce et l’index et en faisant glisser la lame de couverture hors du gel.
- Placez les lames contenant des échantillons à l’intérieur du support de lame (toutes les marques de « points » noires sur les lames doivent être orientées dans la même direction lorsqu’elles sont placées dans un support) (Figure 3B), puis placez le support de diapositive à l’intérieur de l’antenne parabolique de lyse (Figure 2).
- Fermer le couvercle de la capsule de lyse et conserver la capsule de lyse au réfrigérateur pendant la nuit à 4 °C ou 30 minutes à température ambiante, selon l’horaire qui convient le mieux à l’horaire de l’opérateur19.
4. Électrophorèse
- Retirez délicatement le support de glissière de la boîte de lyse. Veillez à ne pas déranger les gels.
- Placez délicatement le support de glissière dans un plat de lavage préchargé de ddH2O glacé et laissez-le pendant 30 minutes en veillant à ce que les lames soient complètement recouvertes de ddH2O.
- Insérez un pack de refroidissement congelé dans le tiroir coulissant sous le réservoir d’électrophorèse pour maintenir une température tampon optimale.
- Ajouter délicatement une solution de travail d’électrophorèse glacée (tableau 1) dans le réservoir d’électrophorèse et transférer le support de glissière dans le réservoir d’électrophorèse. Orientez les lames de manière à ce que leurs parties transparentes avec les gels contenant des cellules (c.-à-d. PAS les extrémités givrées/étiqueteuses) pointent vers la cathode (électrode rouge).
- Laissez les lames reposer dans le réservoir d’électrophorèse pendant 20 minutes afin que l’ADN se détend et se déroule. Maintenez le bloc d’alimentation coupé pendant cette étape.
- Si nécessaire, insérez un nouveau pack de refroidissement congelé pour maximiser le refroidissement.
- Effectuer l’électrophorèse pendant 20 min à 1,19 V/cm, ou dans toutes les conditions optimisées.
NOTE: L’optimisation des conditions de fonctionnement de l’électrophorèse et du volume de tampon est recommandée pour chaque laboratoire24. L’utilisation d’un seul support de lame pendant l’électrophorèse ne provoque aucun effet des lames sur la résistance du tampon d’électrophorèse, et les auteurs n’ont pas vu d’effet significatif dans la tension ou le courant lorsque le nombre de lames changeait. - Éteignez l’alimentation, retirez délicatement le support de glissière du réservoir d’électrophorèse et laissez-le s’écouler sur du papier de soie pendant 30 s.
- Placer le support de glissière dans la parabole contenant le tampon de neutralisation (tableau 1). Laissez-le pendant 20 min.
- Retirez le support de glissière de la capsule de neutralisation, placez-le dans le plat de lavage contenant du ddH2O glacé et laissez-le pendant 20 min.
- Retirer le support de glissière de l’eau et laisser sécher les lames dans un incubateur à 37 °C pendant 1 h, ou à température ambiante pendant la nuit, ou ne pas sécher, selon l’horaire de l’opérateur19.
REMARQUE: S’il n’y a pas de séchage à l’étape 4.11, effectuez l’étape de coloration de 5.2.
5. Coloration à l’iodure de propidium (PI)
- Transférer le support de lame dans un plat de lavage contenant du ddH2O glacé pour réhydrater les lames et laisser reposer 30 min.
- Placer le support de lame dans une boîte de coloration contenant 2,5 μg/mL de solution d’iodure de propidium.
REMARQUE: L’iodure de propidium est sensible à la lumière, alors manipulez-le dans une zone sombre. Il est également toxique. - Fermez le couvercle du plat de coloration et incuberez-le pendant 20 minutes à l’obscurité à température ambiante.
- Transférer le support de glissière dans un plat séparé et le laver avec du ddH2O glacé pendant 20 min.
- Retirez le support de glissière de la capsule et séchez-le complètement dans l’obscurité, soit dans un incubateur à 37 °C, soit à température ambiante, selon l’horaire ou les préférences de l’opérateur.
- Une fois les diapositives complètement séchées, retirez-les du support de diapositives et rangez-les dans une boîte de diapositives dans l’obscurité jusqu’à ce qu’elles soient prêtes pour l’analyse de l’image.
REMARQUE: Les diapositives resteront lisibles indéfiniment et peuvent être re-colorées si nécessaire.
6. Dosage des comètes alcalines modifiées par des enzymes
REMARQUE: Le test de comète alcaline modifiée par enzyme utilise une étape de traitement enzymatique après lyse mais avant électrophorèse. L’activité de l’enzyme provoque des ruptures dans l’ADN sur les sites qui sont des substrats pour l’enzyme. Avant d’effectuer ce test, la concentration enzymatique et la durée d’incubation de l’enzyme doivent être optimisées.
- Après la lyse cellulaire (étape 3), laver les lames deux fois avec du ddH2O glacé pendant 20 minutes chacune.
- Retirez le support de glissière de l’eau et transférez-les sur un plateau tapissé de serviettes en papier.
- Ajouter 80 μL de l’enzyme à la concentration optimisée (p. ex. 3,2 U/mL de hOGG1 pour les cellules BE-M17, diluées dans un tampon de réaction enzymatique) et couvrir d’un capseau pour étaler l’enzyme sur l’échantillon contenant le gel.
- Incuber les lames à 37 °C pendant la durée optimisée (par exemple, 45 min pour hOGG1).
- Après l’incubation, retirez délicatement les lames de couverture et transférez les lames sur le support.
REMARQUE: Ne pas laver les lames après le traitement enzymatique; Effectuer directement l’électrophorèse à partir de l’étape 4.3.
7. Test de comètes alcalines modifiées par réticulation interbrin d’ADN (ICL)
NOTE: Le concept de cette variante de l’ICL-ACA est que la présence d’ICL dans l’ADN retardera la migration électrophorétique de l’ADN endommagé, induite à la suite d’une exposition à une insulte générée par oxydation. Dans ce cas, plus la queue de comète est courte, plus le nombre d’ICL25,26,27,28 est élevé.
- Traiter les cellules avec un réactif qui induit la LCI (p. ex. cisplatine; voir Fichier supplémentaire).
- Exposer les cellules traitées avec l’un des agents suivants pour induire des ruptures de brin suffisantes pour créer une queue de comète de taille appropriée (~20% d’ADN de queue): peroxyde d’hydrogène (50 μM H 2 O 2 pendant 30 min), rayonnement ionisant (2-5 Gy) ou ultraviolet B (UVB) (0,5 J / cm2).
- De plus, produire un témoin positif de rupture de brin en traitant un lot de cellules avec le même agent et la même dose, comme utilisé à l’étape 7.2 (c.-à-d. aucun traitement avec un agent inducteur de LCI).
- Centrifuger les cellules à 7 607 x g pendant 5 min, jeter le surnageant, laver la pastille cellulaire trois fois avec 1 mL de PBS et procéder comme pour le test de comète alcaline (étapes 3 à 5).
- Calculez les niveaux de réticulation interbrin de l’ADN à l’aide de la formule ci-dessous.
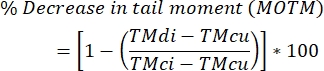
REMARQUE : MOTM (Mean Olive Tail Moment) est un critère d’évaluation de la comète largement utilisé pour décrire le test de comète modifié par la LMIC, et est défini comme le produit de la longueur de la queue et de la fraction d’ADN total dans la queue (c.-à-d. moment de la queue = longueur de la queue x % d’ADN dans la queue)29; TMdi: moment de queue des échantillons traités à la fois avec un agent de réticulation et H 2 O2(ou un autre inducteur de brins); TMcu : moment de queue des échantillons non traités avec un agent de réticulation et non traités avec H2O2 (pas de traitement), et TMci : moment de queue des échantillons non traités avec un agent de réticulation mais traités avecH2O2.
8. Notation des comètes et analyse des données
REMARQUE : Le terme « comète » dérive des images de cellules endommagées observées au microscope après la réalisation de l’essai (figure 5). Dans des conditions d’électrophorèse, l’ADN dans les cellules non endommagées ne migre en grande partie pas, mais reste dans un sphéroïde appelé « tête » de comète. Cependant, la présence de ruptures de brins permet à l’ADN de la cellule de migrer hors de la tête et de former une « queue », conduisant ainsi à une apparence de comète (Figure 5). Plus il y a d’ADN dans la queue, plus il y a de dommages.
- Allumez le microscope à fluorescence avec le filtre PI (rouge) (λ = 536/617 nm) et le logiciel de notation des comètes.
- Ajouter une goutte d’eau à l’aide d’une pipette Pasteur au gel et couvrir d’une lamelle de couverture.
- Placez les lames dans le microscope à fluorescence et « marquez » les comètes.
NOTE: La notation est un moyen par lequel les comètes sont évaluées, afin de déterminer la quantité de dommages présents dans chaque comète. En gros, cela peut être réalisé en utilisant deux approches, selon la préférence choisie par l’utilisateur, soit à l’œil nu (en mesurant la taille des comètes sur une échelle de zéro à quatre), soit en utilisant librement, ou un logiciel disponible dans le commerce30. En général, les deux approches évaluent la taille de la queue de la comète, bien qu’une variété de paramètres liés à la comète puissent être déterminées. Si vous utilisez le logiciel, cliquez sur le milieu de la tête de la comète et attendez que le logiciel détecte automatiquement la comète, puis évalue le point final choisi (Figure 5). - Score 50 comètes par gel et 100 comètes par échantillon (c’est-à-dire chaque échantillon correspondant à différents traitements endommageant l’ADN, ou leurs répliques).
- Répliquez les expériences (n = 2) ou triplez les expériences (n = 3).
NOTE: Si seulement n = 2 expériences répétées sont entreprises, l’analyse statistique ne peut pas être effectuée, mais si n = 3, effectuer le test de normalité D’agostino. La plupart des données d’essai de comètes ne passent pas un test de normalité. Dans ce cas, utilisez un test non paramétrique (test de Kruskal-Wallis avec le test de comparaisons multiples de Dunn, et test de Mann-Whitney de signification fixé à p < 0,05).
Résultats
Optimisation de la tension d’électrophorèse pour le HTP ACA
Kératinocytes humains (HaCaTs; Tableau des matériaux) ont été irradiés avec différentes doses de rayonnement ultraviolet A (UVA) (5 ou 10 J/cm2; Figure 6A), UVB (0,5 ou 1 J/cm2 ; Figure 6B), ou traité avec 50 μMH2O2(Figure 6C) pour induire des dommages. Trois tensions différentes de l’électrophorèse ont été testées pour déterminer la tension optimale pour l’électrophorèse. Les résultats des trois traitements endommageant l’ADN ont révélé que, bien que toutes les tensions aient généré des doses-réponses linéaires, la réponse la plus sensible a été obtenue avec 1,19 V / cm. Les HaCaTs ont montré les dommages à l’ADN les plus élevés à l’inclusion en utilisant 1,19 V / cm pendant l’électrophorèse par rapport à 1 V / cm et 1,09 V / cm (Figure 6A-C). De plus, en utilisant 1,19 V/cm, le plus grand % d’ADN de la queue est observé, après tous les traitements dommageables (Figure 6)31.
Détection de dommages à l’ADN dans le sang total humain à l’aide de HTP ACA modifié par Fpg
Le sang humain (tableau des matériaux) a été irradié avec différentes doses de 10 J/cm2 UVA pour induire des dommages. Quatre concentrations différentes de Fpg (1, 2, 4 ou 8 U/mL) ont été utilisées pour déterminer la concentration optimale pour le traitement enzymatique dans HTP ACA. Les résultats ont montré que les niveaux optimaux de dommages à l’ADN ont été révélés avec 4 U/mL de Fpg (Figure 7A). Images représentatives de comètes provenant d’échantillons de sang irradié par UVA (figure 7B).
Détection de l’ADN ICL dans une lignée cellulaire représentative de cancer de l’ovaire à l’aide de l’ACA HTP modifié par ICL
Une lignée cellulaire de cancer de l’ovaire (SKOV-3; Tableau des matériaux) a été traité avec des combinaisons de 200 μM de cisplatine et/ou un traitement ultérieur avec 50 μM H2O2 pendant 30 min sur glace. Aucun dommage appréciable n’a été observé dans les cellules non exposées (figure 8A). L’exposition àH2O2seule a généré un MOTM significatif (figure 8B). En revanche, les cellules dans lesquelles les LCI ont été induites ont montré une diminution du MOTM (Figure 8C)28.
Formation et réparation de l’ADN ICL induit par le cisplatine dans une lignée cellulaire représentative de cancer de l’ovaire
L’ACA HTP modifié par la LCI a été utilisé pour déterminer l’évolution temporelle de la formation et de la réparation de la LCI de l’ADN induite par le cisplatine dans une lignée cellulaire de cancer de l’ovaire (A2780; Tableau des matériaux). Les cellules ont été traitées avec 100 μM de cisplatine pendant 1 h, puis incubées dans un milieu exempt de cisplatine (milieu RPMI 1640 complété par 10% (v/v) de sérum fœtal bovin (FBS)) pour une évolution ultérieure. À divers moments, l’ACA HTP modifié par la LMIC a été effectuée pour établir les niveaux de LMIC (figure 9)28. Aucune LCI n’a été détectée avant le traitement par cisplatine. Cependant, après un seul traitement avec 100 μM de cisplatine, les niveaux de LCI ont augmenté de manière significative, culminant à 12 heures, après quoi les niveaux sont revenus à zéro après 30 heures.
Corrélation entre l’ADN ICL et les niveaux de platine ADN
Trois cellules cancéreuses de l’ovaire ont été traitées avec 100 μM de cisplatine pour induire différents niveaux d’ADN-ICL, avant l’analyse par l’ACA HTP modifié par ICL et la spectrométrie de masse à couplage inductif (ICP-MS; voir le dossier supplémentaire pour plus de détails). Comme le montre la figure 10, différents niveaux d’ADN-ICL ont été induits dans les trois lignées cellulaires, ainsi que différents niveaux de Pt dans l’ADN. Une corrélation positive (R2 = 0,9235) a été observée entre les niveaux d’ADN ICL et les concentrations de platine, indiquant l’association entre les niveaux de platine d’ADN et la CIL28 correspondante.
Réparation de l’excision de base dans les cellules BE-M17 infectées et non infectées par les mycoplasmes
Les cellules BE-M17 infectées et non infectées par des mycoplasmes ont été traitées avec 50 μM H 2 O 2 pendant 30 min et incubées avec un milieu complet (milieu d’Eagle modifié de Dulbecco complété par 10% (v/v) FBS) pendant différentes durées (0 min, 30 min, 1 h,2h, 6 h, 24 h ou 30 h) pendant lesquelles les cellules ont été autorisées à se réparer. À chaque point temporel, les cellules ont été collectées et congelées à -80 °C, dans un milieu contenant 10 % de DMSO, avant d’effectuer l’ACA HTP modifié par hOGG1 (étape 6). Après 30 minutes, les niveaux de SB/SLA avaient diminué à 21 % de TD (pourcentage d’ADN de queue) dans les cellules non infectées, tandis que les cellules infectées présentaient 49 % de TD (Figure 11A). Après ~15 h, les niveaux de SB/SLA étaient revenus à la valeur initiale dans les cellules infectées et non infectées. Pour les purines oxydées, le BE-M17 non infecté a d’abord montré une légère augmentation des dommages, avant de revenir à la ligne de base dans les 30 heures (Figure 11B). En revanche, les cellules infectées ont montré une augmentation soutenue et significative des purines oxydées, qui sont restées élevées et ne sont pas revenues aux niveaux de base même après 30 heures (Figure 11B)23.
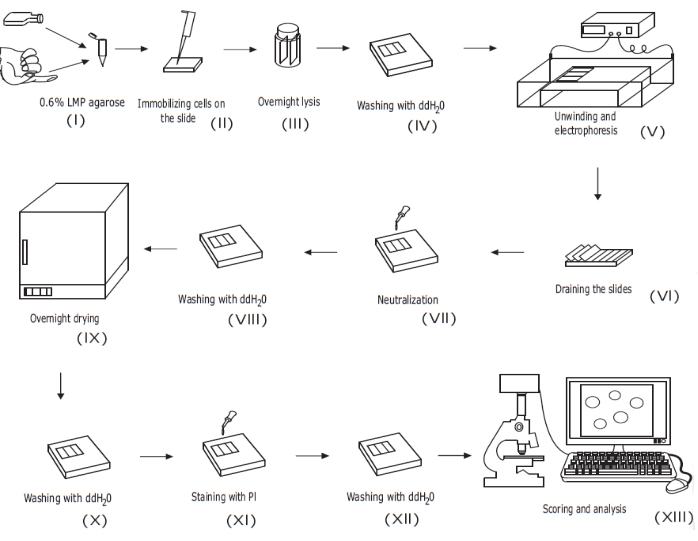
Figure 1 : Vue d’ensemble de la procédure conventionnelle d’essai des comètes alcalines. (i) Une suspension unicellulaire de cellules cultivées ou un échantillon de sang total est mélangé avec de l’agarose LMP à 0,6 % (p/v). ii) Le mélange cellule/agarose est appliqué sur des lames de microscope prérevêtues et recouvert d’une lamelle de couverture jusqu’à solidification. (iii) Les cellules sont lysées à l’aide d’un tampon de lyse à pH élevé pendant la nuit, formant des corps nucléoïdes, avant (iv) le lavage avec ddH2O. (v) L’ADN cellulaire se déroule dans le tampon d’électrophorèse à pH élevé. La présence de ruptures de brins permet à l’ADN de se détendre et de se dérouler, et sous électrophorèse, l’ADN est extrait du corps nucléoïde, formant une queue. Les lames sont ensuite (vi) égouttées, séchées, (vii) neutralisées et (viii) lavées avec duddH2Oavant (ix) séchées pendant une nuit. Les lames sont ensuite (x) réhydratées avec duddH2O, (xi) colorées, (xii) lavées, et enfin (xiii) notées et analysées, généralement à l’aide d’un logiciel de microscopie fluorescente et d’analyse d’images. Ce chiffre est tiré d’une publication précédente20. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Les matériaux composant le système d’électrophorèse cométaire à haut débit. Le réservoir d’électrophorèse HTP, les racks HTP et les plats pour la lyse, le lavage, la neutralisation et la coloration sont montrés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
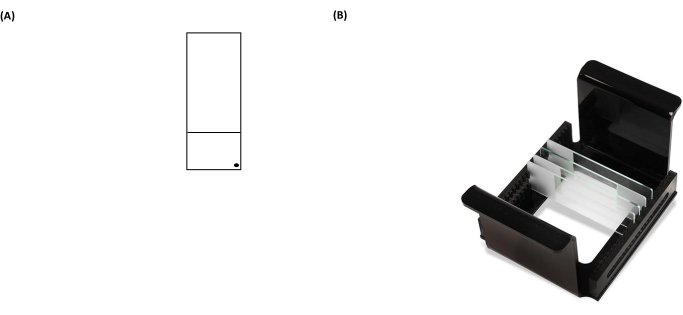
Figure 3 : Images représentatives d’une lame d’essai cométaire et d’un rack HTP (support de lame de microscope). (A) Pour une orientation correcte, la face pré-revêtue de la lame de microscope est reconnue par un point noir dans le coin droit d’une lame de microscope. (B) L’image du rack HTP illustre comment les glissières sont maintenues dans une orientation verticale serrée, avec des languettes sur le support pour fixer son orientation dans le réservoir d’électrophorèse. Chaque transporteur peut accueillir jusqu’à 25 glissières. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Représentation de la plaque de refroidissement avec des lames d’échantillon et des blocs de congélation en place. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5: Capture d’écran de comètes représentatives prises lors du scoring. HaCaTs (A) sans traitement et (B) traité avec 1 J/cm2 UVB avant d’effectuer HTP ACA. La plupart des progiciels peuvent calculer une variété de points de terminaison de comètes, mais les plus courants sont le % d’ADN de la queue (préféré) ou le moment de la queue basé sur ces images (bleu : début de la tête, vert : milieu de la tête et violet : fin de la queue). La barre d’échelle est de 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
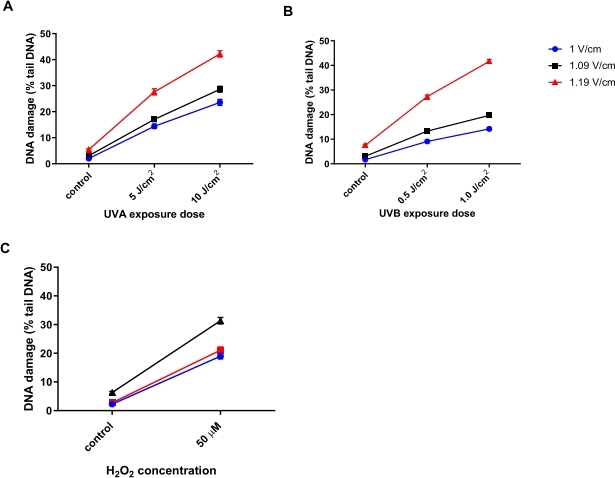
Figure 6 : Graphiques représentatifs illustrant l’effet de la tension d’électrophorèse sur le pourcentage d’ADN de queue, déterminé à l’aide de l’ACA HTP. Les cellules ont été exposées à (A) 5 ou 10 J/cm2 UVA, (B) 0,5 ou 1,0 J/cm2 UVB, ou (C) 50 μMH2O2avant le HTP ACA, avec une tension d’électrophorèse de 1, 1,09 ou 1,19 V/cm. Les données représentent la moyenne de 200 déterminations à partir de n = 2 expériences en double31. Veuillez cliquer ici pour voir une version agrandie de cette figure.
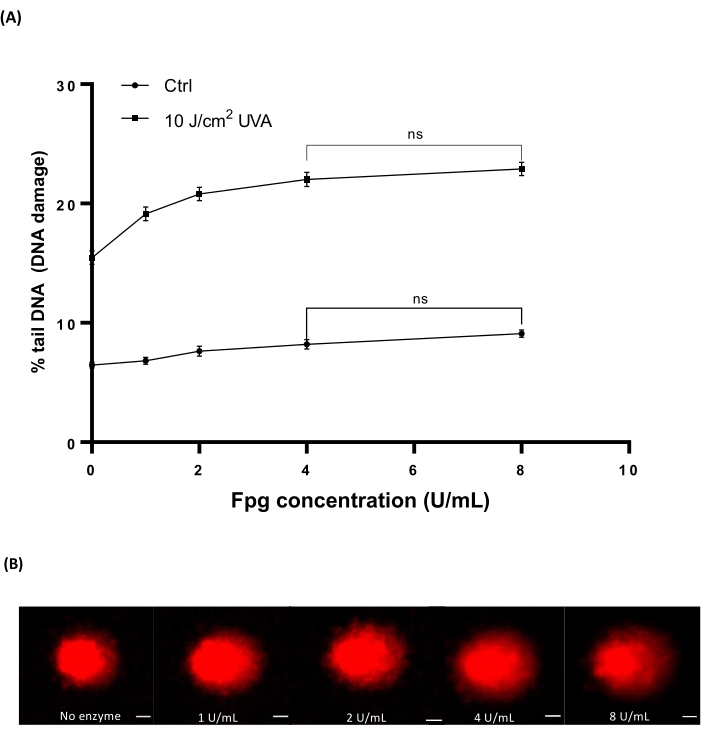
Figure 7 : Graphique représentatif et images cométaires du sang humain analysées par le HTP ACA modifié par le Fpg. Des échantillons de sang humain ont été irradiés avec 10 J/cm2 UVA ou irradiés fictivement (« ctrl ») sur de la glace avant l’étape de lyse. Différentes concentrations de Pfg (1, 2, 4 ou 8 U/mL) ont été utilisées pour le traitement enzymatique avant l’électrophorèse. (A) Les données représentent la moyenne ± MEB de 300 déterminations à partir de n = 3 expériences. (B) Images représentatives de comètes pour chaque concentration de Pfg dans 10 J/cm2 échantillons de sang irradié aux UVA. La barre d’échelle est de 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
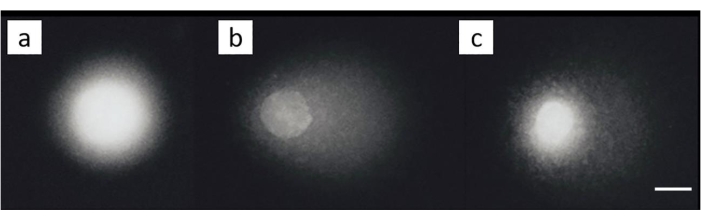
Figure 8 : Images représentatives des comètes illustrant la détection de la LCI après traitement au cisplatine. (A) cellules témoins sans aucun traitement, (B) cellules qui ont été traitées avec H2O2 (50 μM) seulement, (C) cellules qui ont été traitées avecH2O2(50 μM) et cisplatine (200 μM), montrant que la queue est plus courte que dans (B), en raison de la présence de ICL28. La barre d’échelle est de 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
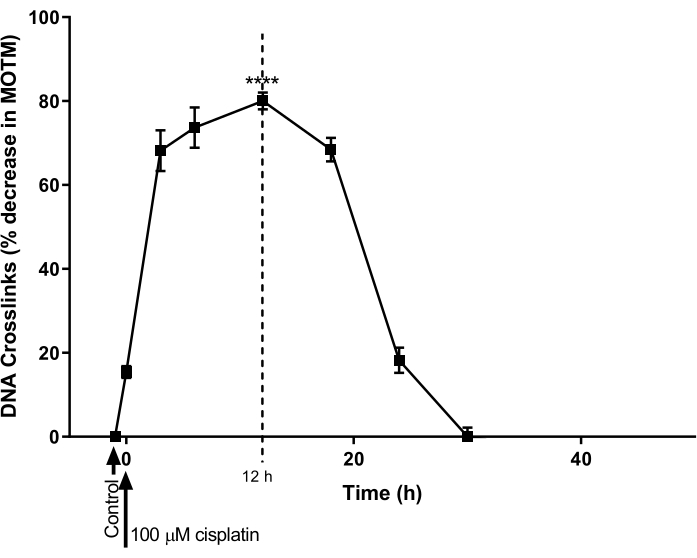
Figure 9 : Démonstration de la cinétique de la formation et de la réparation de la LCI induite par le cisplatine. Les cellules A2780 ont été traitées avec 100 μM de cisplatine dans le milieu de culture pendant 1 h. Le milieu contenant du cisplatine a ensuite été retiré et les cellules ont été cultivées à différents moments, avant d’être analysées par HTP ACA modifié par ICL. Les données représentent la moyenne ± MEB de n = 3 expériences28. P < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 10 : Corrélation entre la LMIC d’ADN et la concentration de platine. Les ICL d’ADN ont été déterminés par l’ACA HTP modifié par ICL et les niveaux de platine ont été mesurés par ICP-MS (avec Single Quad-Kinetic Energy Discrimination, SQ-KED), dans trois lignées cellulaires de cancer de l’ovaire. R2 = 0,9235. Voir le dossier supplémentaire pour la méthodologie ICP-MS pour quantifier les niveaux de platine dans l’ADN28. Veuillez cliquer ici pour voir une version agrandie de cette figure.
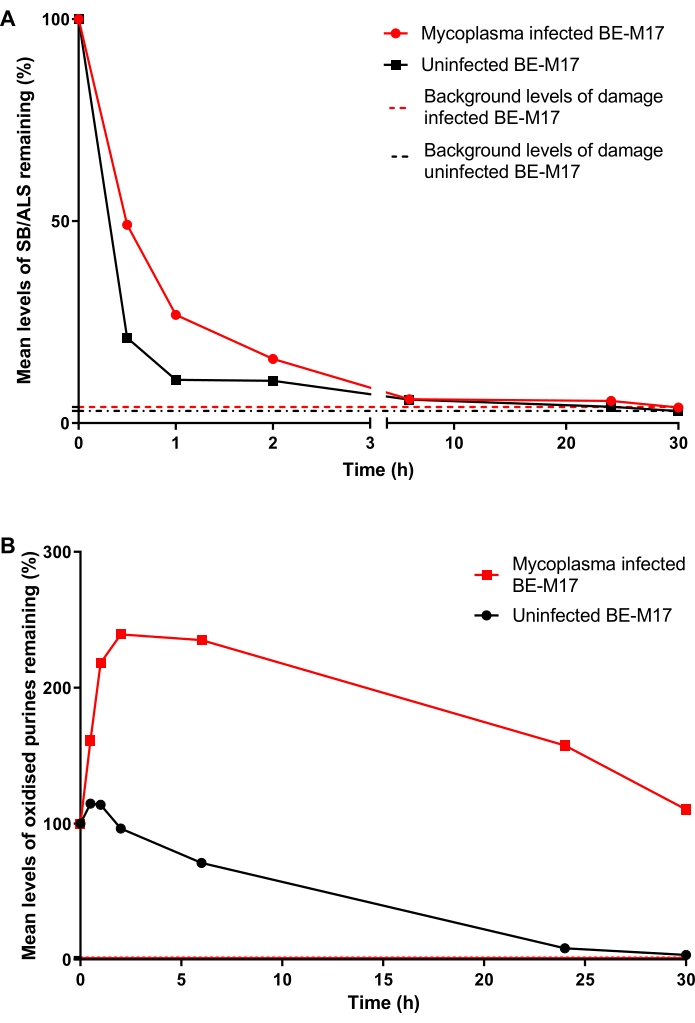
Figure 11 : Un graphique représentatif illustrant les dommages et la réparation de l’ADN, déterminés par le test de comète modifié par hOGG1, dans les cellules BE-M17 infectées par Mycoplasma par rapport aux cellules BE-M17 non infectées. Après traitement avec 50 μMH2O2pendant 30 min, les cellules ont été laissées réparer pendant différentes durées (0,30 min, 1 h, 2 h, 6 h, 24 h ou 30 h). L’ACA HTP modifié par hOGG1 a été utilisé pour mesurer (A) les purines SB/ALS et (B) oxydées dans les cellules BE-M17 infectées (points de données rouges) et non infectées (points de données noirs). Les données représentent la moyenne de 200 déterminations à partir de n = 2 expériences en double. Ce chiffre est reproduit avec la permission d’une publication précédente23. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Réactif | Solution mère | Solution de travail | |
| Tampon de lyse | 100 mM Na 2 EDTA, 2,5 M NaCl et 10 mM Tris Base en ddH2O; ajuster le pH à 10 avec 10 M NaOH | 1% Triton X-100 dans la solution mère de lyse | |
| Tampon d’électrophorèse | 10 M NaOH et 200 mMNa2EDTAenddH2O | 300 mM NaOH et 1 mM Na2EDTA; pH > 13 | |
| Tampon de neutralisation | 0,4 M Tris Base en ddH2O ; ajuster le pH à 7,5 avec HCl | ||
| Tampon de coloration | 1 mg/mL d’iodure de propidium | 2,5 μg/mL d’iodure de propidium dansddH2O | |
Tableau 1 : Composition des réactifs utilisés dans HTP ACA. Les concentrations de stock et de travail des tampons de lyse, d’électrophorèse, de neutralisation et de coloration sont indiquées.
Dossier supplémentaire. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cette étude démontre la polyvalence fournie par l’équipement actuel, qui peut être utilisé pour atteindre un débit élevé avec une variété de variantes représentatives et communes du test cométaire (c.-à-d. alcaline, modifiée par des enzymes, sanguine et ICL, et d’autres variantes conviendront également). En outre, la présente approche présente plusieurs avantages 20,21: a) la durée d’exécution de l’essai est réduite grâce à la manipulation de plusieurs lames en parallèle (le temps de manipulation diminue de60%); b) le risque d’endommagement des gels et, partant, le risque pour l’expérience sont réduits; c) les besoins en réactifs sont réduits (p. ex., le volume du réservoir d’électrophorèse est inférieur à celui du réservoir conventionnel); d) le nombre de diapositives exécutées est augmenté. Un réservoir peut fournir une augmentation de 20% du nombre de glissières par rapport à un seul réservoir conventionnel; Cependant, plusieurs réservoirs d’électrophorèse peuvent fonctionner ou être réduits en esclavage (c.-à-d. plusieurs réservoirs contrôlés par une seule source d’alimentation), en parallèle à partir de la même source d’alimentation, et nécessitent toujours une empreinte de paillasse plus petite qu’un seul réservoir conventionnel avec bac à glace; et e) l’encombrement du réservoir est réduit en raison de l’orientation verticale des glissières et du refroidissement intégré (économise de l’espace de laboratoire); le réservoir HTP comprend une base de refroidissement en céramique haute performance avec un tiroir coulissant qui peut accueillir un pack de refroidissement congelé pour maintenir une température tampon optimale sans avoir à effectuer le processus dans une chambre froide.
De plus, la plaque de refroidissement que nous avons développée accueille 26 lames de comètes, permet une solidification rapide de l’agarose à bas point de fusion sur les lames d’essai de comète et facilite la récupération des lames après solidification du gel d’agarose. Les innovations ci-dessus rendent le processus d’essai des comètes plus simple et plus facile.
Bien que d’autres approches à haut débit aient été mises au point (p. ex., test cométaire sur 12 gels, CometChip ou 96 formats de mini-gel)25, de nombreux scientifiques préfèrent utiliser les lames de microscope conventionnelles (qui comprennent les lames précouchées disponibles dans le commerce ou d’autres lames spécialisées). L’approche actuelle peut s’adapter à tous les types de lames de microscope, ce qui permet d’intensifier les expériences utilisant ces lames grâce à un traitement et une manipulation plus rapides des lames. Comme indiqué ci-dessus, le système de comètes HTP apporte de nombreux avantages, mais il y a une limite notable: l’approche actuelle ne prévoit qu’une augmentation de 20% du nombre d’échantillons exécutés, par rapport à un réservoir horizontal conventionnel (bien que le traitement des lames soit beaucoup plus rapide). Les formats CometChip et 96 mini-gel exécutent un plus grand nombre d’échantillons. À ce jour, nous ne savons pas si l’approche actuelle peut s’adapter aux formats CometChip ou 96 mini-gel, bien que nous prédisions que ce sera le cas. Comme indiqué ci-dessus, le nombre d’échantillons peut être encore augmenté en asservissant les réservoirs à une seule source d’alimentation. Comme pour toutes les approches, il y a toujours une chance de perdre ou d’endommager les gels lors du chargement des échantillons et de leur analyse au microscope, mais cela est davantage dû à une erreur de l’opérateur, et les chances que cela se produise sont minimisées avec l’approche actuelle.
L’utilisation du système de comètes HTP peut grandement aider à analyser les dommages à l’ADN, facilitant l’utilisation du test de comète dans un large éventail d’applications, telles que l’épidémiologie moléculaire, la science de la reproduction masculine, les études de génotoxicologie et la toxicologie environnementale. Cela est particulièrement vrai pour les utilisateurs qui souhaitent bénéficier de tous les avantages d’un débit amélioré et d’une facilité d’utilisation, sans s’éloigner des lames de microscope conventionnelles familières et rentables.
Déclarations de divulgation
M. Cooke et M. Karbaschi sont les inventeurs de trois brevets délivrés relatifs aux technologies décrites ici.
Remerciements
Les travaux rapportés dans cette publication ont été, en partie, soutenus par le National Institute of Environmental Health Sciences des National Institutes of Health sous le numéro d’attribution : 1R41ES030274. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement le point de vue officiel des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
Références
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon