Method Article
Comptage rapide des unités formant des colonies sous forme de plaque à 96 puits appliqué au microbiome de la drosophile
Dans cet article
Résumé
Cette méthode quantifie l’abondance microbienne à l’aide d’un format de plaque de 96 puits pour les unités formant colonie (UFC) et est appliquée au microbiome de la drosophile dans des échantillons d’homogénat de mouches entières. Les UFC sont comptées à l’aide d’un logiciel d’analyse d’images automatisé fourni ici.
Résumé
Les intestins des animaux sont colonisés par des microbes commensales, qui ont un impact sur le développement, la santé et le comportement de l’hôte. Une quantification précise de la colonisation est essentielle pour étudier les interactions complexes entre l’hôte et le microbe à la fois pour valider la composition microbienne et étudier ses effets. Drosophila melanogaster, qui a une faible diversité microbienne native et est économique à élever avec une composition microbienne définie, est apparu comme un organisme modèle pour l’étude du microbiome intestinal. L’analyse du microbiome d’un organisme individuel nécessite l’identification des espèces microbiennes présentes et la quantification de leur abondance absolue. Cet article présente une méthode pour l’analyse d’un grand nombre de microbiomes de mouches individuelles. Les mouches sont préparées dans des plaques de 96 puits, ce qui permet de manipuler un grand nombre d’échantillons à la fois. L’abondance microbienne est quantifiée en plaquant jusqu’à 96 homogénats de mouches entières sur une seule plaque de gélose dans un ensemble de taches, puis en comptant les unités formant colonie (UFC) qui se développent dans chaque endroit. Ce système de placage est associé à une plate-forme automatisée de quantification CFU, qui intègre la photographie des plaques, la différenciation des colonies fluorescentes et le comptage automatisé des colonies à l’aide d’un plugin ImageJ. Les avantages sont que (i) cette méthode est suffisamment sensible pour détecter les différences entre les traitements, (ii) la méthode de placage ponctuel est aussi précise que les méthodes de placage traditionnelles, et (iii) le processus de comptage automatisé est précis et plus rapide que le comptage manuel. Le flux de travail présenté ici permet une quantification à haut débit des UFC dans un grand nombre de réplicats et peut être appliqué à d’autres systèmes d’étude microbiologique, y compris in vitro et d’autres modèles de petits animaux.
Introduction
La relation entre le microbiote intestinal et leur hôte animal est de plus en plus au premier plan des études biologiques1, qui montrent que la composition de la souche du microbiome est importante pour la physiologie de l’hôte 2,3,4. Le rythme des découvertes a été limité par des facteurs de confusion tels qu’une forte variation naturelle interindividuelle et une grande diversité de bactéries colonisatrices 5,6,7. La mouche des fruits, Drosophila melanogaster, est apparue comme un modèle prometteur en raison de son microbiome naturellement peu diversifié, de sa facilité de manipulation et de sa génétique hôte robuste 8,9,10,11. Les mouches peuvent être exemptes de germes et réassociées à un microbiote défini12, et il a été démontré que la flore influence les traits physiologiques des mouches13,14. La flore innée se compose d’un ensemble limité de bactéries qui sont toutes cultivables, et leurs proches parents sont également endogènes à l’intestin des mammifères, y compris les lactobacilles, les protéobactéries et les entérocoques15.
L’étude de l’influence du microbiome sur les traits de l’hôte nécessite de quantifier le microbiome en termes d’espèces présentes et d’abondances absolues16. Les méthodes prédominantes d’analyse du microbiome de la mouche sont le nombre d’unités formant des colonies (UFC)17, le séquençage de l’amplicon du gène de l’ARNr16S 9 et la qPCR du gène 18S de l’ARNr16S. Le nombre d’UFC peut être obtenu sans réactifs coûteux, et ils confirment la viabilité des cellules bactériennes19. Les techniques 16S, y compris la qPCR, présentent des avantages en ce sens que les identités taxonomiques des microbes peuvent être déterminées sans tenir compte de leurs besoins de croissance ou de la morphologie des colonies20.
Dans le cas où les expériences utilisent des mouches avec un microbiome défini de bactéries connues (mouches gnotobiotiques), le nombre d’UFC présente des avantages particuliers par rapport au séquençage21. Le séquençage est coûteux, nécessitant une extraction d’ADN, une préparation de bibliothèque basée sur la PCR et un séquençage à haut débit pour obtenir des abondances relatives22. En raison de leur coût élevé, les méthodes de séquençage à haut débit doivent généralement être effectuées en vrac pour réduire le prix par échantillon23. D’autres méthodes telles que la qPCR sont nécessaires pour obtenir des abondances absolues16. En revanche, le nombre d’UFC est rapide et bon marché et donne le nombre absolu de cellules viables. La drosophile8 et d’autres petits modèles de microbiome 24, y compris le ver, Caenorhabditis elegans 25,26, et le poisson-zèbre larvaire, Danio rerio, cultivé gnotobiotiquement 27, ont une gamme limitée de bactéries, qui ont des caractéristiques de croissance connues 28. Dans ces cas, en particulier chez les animaux gnotobiotiques, le comptage de l’UFC peut différencier toutes les espèces de bactéries au sein des communautés intestinales multi-espèces21,27,29. Des méthodes de comptage CFU à débit plus élevé amélioreraient encore la rentabilité et la rapidité de la mesure de la composition du microbiome et pourraient être appliquées à de nombreuses autres expériences de microbiologie.
Le comptage des UFC par dilution en série d’une suspension bactérienne sur un milieu de croissance à base d’agar est une méthode standard dans le domaine de la microbiologie. Les colonies qui poussent sur les plaques sont ensuite comptées manuellement. Les dilutions permettent au chercheur de sélectionner une densité de colonies qui est dénombrable (p. ex., ~100 UFC par plaque), ce qui signifie que les colonies ne se développent pas les unes dans les autres et peuvent être comptées dans un laps de temps raisonnable. La plupart des microbiologistes utilisent essentiellement la même méthode de comptage de l’UFC développée il y a 140 ans dans le laboratoire de Robert Koch, et pour de nombreuses applications, cette méthode est encore adéquate. Cependant, un problème se pose lorsqu’on cherche à quantifier un grand nombre d’échantillons. Un seul échantillon peut nécessiter le placage de 1 à 10 dilutions en série de l’échantillon pour obtenir des UFC dénombrables, de sorte que les expériences impliquant plus de quelques dizaines d’échantillons deviennent éprouvantes. Diverses méthodes ont été mises au point pour accroître l’efficacité du dénombrement des UFC. Le placage en spirale automatisé élimine le besoin de dilutions en série30, ce qui rend une seule plaque nécessaire pour le comptage de l’UFC mais augmente le temps nécessaire pour plaquer l’échantillon. Le repérage de dilution sur plaque unique en série (SP-SDS) permet d’estimer l’UFC à partir d’un nombre réduit de plaques par échantillon31. Ces méthodes constituent une amélioration par rapport à la méthode traditionnelle de placage à tartiner, mais nécessitent toujours la manipulation et le placage d’échantillons bactériens seuls et ne sont donc pas idéales pour un débit élevé. La manipulation d’échantillons dans des plaques à 96 puits et le placage ponctuel de ces 96 échantillons sur des plaques de gélose rectangulaires améliorent considérablement le débit des échantillons19.
Les microbiomes sont généralement composés de plusieurs souches et espèces. Alors que les espèces peuvent souvent être distinguées par la morphologie de la colonie ou les milieux de croissance, la fluorescence peut être utilisée pour distinguer davantage différents types de bactéries et leurs caractéristiques de croissance32. Par exemple, différents génotypes de la même espèce peuvent être marqués avec différentes protéines fluorescentes codées génétiquement. Les méthodes d’imagerie sur plaque qui intègrent la fluorescence permettent aux chercheurs de tirer parti de ces techniques génétiques dans les tests basés sur l’UFC32. L’intégration de la fluorescence dans les méthodes de comptage des UFC à haut débit améliorerait encore leur utilité.
Le comptage manuel des UFC devient fastidieux lorsqu’il y a un grand nombre d’échantillons. Le comptage automatisé des UFC peut être effectué en photographiant la plaque et en traitant l’image à l’aide d’un logiciel spécialisé33. Sieuwerts et al. ont combiné l’efficacité améliorée du placage ponctuel avec le comptage automatisé des colonies à l’aide de la photographie numérique conventionnelle et du logiciel ImageJ19.
Une méthode à haut débit pour dépister les phénotypes de microbes spécifiques et les associations d’hôtes faciliterait les études sur l’assemblage de la communauté du microbiome et l’impact sur la santé et la forme physique de l’hôte. Pour les études du microbiome de la drosophile , une plateforme de microbiologie à haut débit intégrerait la manipulation d’échantillons de mouches dans un format de plaque à 96 puits, la lyse des mouches sans lyse bactérienne, l’efficacité du placage ponctuel, la capacité d’utiliser la fluorescence et de distinguer plusieurs fluorophores, un environnement lumineux contrôlé pour l’imagerie reproductible des plaques d’UFC et un logiciel de comptage de colonies automatisé fiable. Cet article décrit une méthode optimisée pour le dosage des UFC chez les mouches gnotobiotiques, qui est simple, rapide et automatisée. Ce protocole décrit un nouveau flux de travail combinant le meilleur des méthodes précédemment publiées et optimisé pour explorer le microbiome intestinal chez la drosophile.
Protocole
1. Colonisation des mouches
REMARQUE: Cette méthode convient à l’analyse quantitative des mouches avec un microbiome intestinal cultivable par placage de croissance des UFC. Un protocole détaillé pour l’élevage de mouches gnotobiotiques a déjà été publié12.
- Établir une colonisation stable par une espèce bactérienne commensale.
- Préparer une culture bactérienne fraîche, granuler par centrifugation à 400 x g pendant 3 min à température ambiante, et remettre en suspension le granulé cellulaire dans du PBS à un OD600 de 1,0. Pour ce protocole, Lactiplantibacillus plantarum (anciennement connu sous le nom de Lactobacillus plantarum) a été cultivé pendant la nuit à une OD600 de 2,0.
- Pipeter 100 μL sur l’aliment dans un flacon anti-mouches (voir le tableau des matériaux). Étaler uniformément et laisser le liquide absorber pendant 15-30 min.
- Transférer 20 mouches exemptes de germes dans ce flacon en utilisant la technique standard de retournement de flacon à flacon34. Chaque mouche mangera une quantité à peu près égale de la dose bactérienne35. Alternativement, des œufs sans germes peuvent être ajoutés.
- Transférer les mouches dans des aliments frais et stériles tous les jours pendant 3 jours. Faites tout cela dans une enceinte de biosécurité et utilisez une technique stérile (Figure 1A-1).
- Avant de mesurer la charge en UFC, transférer les mouches dans un flacon contenant de l’eau de gélose stérile pendant 4 heures pour éliminer les bactéries passagères de l’intestin. Les flacons d’eau de gélose fournissent une source d’humidité pour la mouche, mais pas de nutrition pour la mouche ou les bactéries à la surface. Ils sont préparés dans les mêmes flacons de mouches stériles qu’avec les aliments standard, mais ne contiennent que de l’eau désionisée et 1,5% d’agar.
2. Homogénéisation des mouches individuellement dans une plaque PCR à 96 puits
- Préparez les plaques de batteur de perles à l’avance.
- Versez des billes de verre de 0,5 μm (voir Tableau des matériaux) sur le plateau de mesure des billes (imprimées en 3D à l’aide du fichier de codage supplémentaire 1 S1-bead-measurer.stl). Étalez les perles sur le plateau afin que tous les puits soient pleins et de niveau, puis brossez les perles en excès dans un tube conique pour les récupérer.
- Placez une plaque PCR semi-jupe (voir le tableau des matériaux) à l’envers sur le plateau de mesure et alignez-la avec les puits en l’insérant dans l’indentation sur le plateau de mesure. Ensuite, retournez-le rapidement pour transférer les perles.
- Enlevez les billes en excès de la surface de la plaque PCR et recouvrez-la de papier d’aluminium. Inspectez la plaque PCR pour vous assurer que tous les puits contiennent des billes. Utilisez une pelle de pesée si nécessaire pour ajouter des perles à un seul puits. Si l’électricité statique provoque le collage de billes sur les surfaces de la plaque, essuyez ou vaporisez l’arrière du plateau de mesure et de la plaque PCR avec de l’éthanol à 70%.
- Couvercle avec papier d’aluminium. De nombreuses plaques peuvent être préparées de cette manière, puis autoclavées et stockées pour une utilisation ultérieure. Lorsque vous êtes prêt à l’emploi, ajoutez 100 μL de PBS à chaque puits à l’aide du pipeteur à 96 canaux (voir le tableau des matériaux).
- Stériliser en surface les mouches colonisées par les microbes (voir étape 1) avec de l’éthanol à 70 % avant l’homogénéisation.
- Anesthésier les mouches avec 100% de CO2 pendant 5 s. Transférer les mouches anesthésiées du flacon dans un tube microcentrifuge de 1,5 mL à l’aide d’un petit entonnoir (figure 1A-2). Dans cette étude, 25 mouches ont généralement été ajoutées par tube.
- Vaporiser immédiatement ~1 mL d’éthanol à 70% dans le tube, fermer le tube et mélanger par inversion pendant 10 s. Ensuite, aspirez l’éthanol avec une pipette P1000, en prenant soin de ne pas aspirer de mouches. Répéter une fois de plus avec de l’éthanol, puis deux fois avec du PBS stérile (figure 1A-3).
- Après le lavage final du PBS, fermez le tube et, avec le capuchon vers le bas, tapotez-le fort plusieurs fois sur le banc pour que les mouches pénètrent dans le bouchon.
- Ouvrez le tube et distribuez les mouches dans les puits à l’aide de pinces (figure 1A-4). Placez une mouche dans chaque puits (figure 1A-5). Gardez l’assiette sur la glace pendant le chargement pour garder les mouches anesthésiées.
- Scellez la plaque à l’aide d’une feuille de thermosoudage Thermal Bond (voir le tableau des matériaux).
- Tout d’abord, enlevez toutes les perles perdues qui se trouvent près des puits, car elles peuvent causer des fuites dans le joint de feuille. Assurez-vous que le côté terne de la feuille est orienté vers le bas sur la plaque et le côté brillant vers le haut vers le thermoscellant. Appuyez fermement sur le thermosoudeur (voir le tableau des matériaux) pendant 5 s (figure 1A-6). Polir avec l’applicateur à main (voir le tableau des matériaux) pour fixer la feuille.
REMARQUE: Une mauvaise étanchéité est une cause de perte d’échantillon.
- Tout d’abord, enlevez toutes les perles perdues qui se trouvent près des puits, car elles peuvent causer des fuites dans le joint de feuille. Assurez-vous que le côté terne de la feuille est orienté vers le bas sur la plaque et le côté brillant vers le haut vers le thermoscellant. Appuyez fermement sur le thermosoudeur (voir le tableau des matériaux) pendant 5 s (figure 1A-6). Polir avec l’applicateur à main (voir le tableau des matériaux) pour fixer la feuille.
- Fixez la plaque dans le vibreur de plaque. Homogénéiser pendant 5 min (figure 1A-7). Faire tourner la plaque de cordon pendant 30 s dans une mini-centrifugeuse (voir le tableau des matériaux) à 350 x g pour éliminer le liquide de la feuille d’étanchéité.
- Retirez la feuille tout en tenant la plaque afin de ne pas éclabousser des gouttelettes d’homogénat de mouches hors des puits.
3. Dilution en série de l’homogénat de mouches et taches sur les plaques d’UFC
- Placez quatre plaques rectangulaires de croissance de gélose MRS (voir le tableau des matériaux) dans l’enceinte de biosécurité et retirez leurs couvercles. Dans ce protocole, la gélose MRS a été utilisée pour la croissance de L. plantarum. Laissez sécher ces assiettes pendant au moins 10 minutes (20 minutes si elles sont fraîchement versées ou froides après l’entreposage).
REMARQUE: Si les plaques sont humides, les gouttelettes de la plaque de 96 puits couleront ensemble et ruineront les comptes. - Préparer trois plaques de dilution en ajoutant 100 μL de PBS à chaque puits d’une plaque stérile de 96 puits à l’aide d’un pipeteur à 96 canaux. Chargez un rack de pointes P20 sur le pipetor à 96 canaux.
- Effectuer une dilution de 1:10 en aspirant 11,1 μL d’homogénat de la plaque d’échantillonnage préparée dans la section 2 (figure 1A-8). Assurez-vous de puiser au milieu des puits plutôt qu’au fond des puits, car l’homogénat de mouches et les perles de verre obstrueront les pipettes. Les billes coulent et les particules de mouches flottent, laissant la couche intermédiaire presque claire.
- Verser les 11,1 μL dans la première plaque de dilution, qui contient déjà 100 μL de PBS stérile par puits. Maintenir la plaque de dilution sur l’agitateur à plaques pendant 10 s à 600 tr/min. Mélanger à nouveau en pipetant de haut en bas pendant cinq cycles. Transférer 11,1 μL de la première plaque de dilution à la deuxième plaque de dilution et répéter les étapes de mélange pour les deux plaques de dilution suivantes.
- Effectuer le placage en série de dilution comme décrit ci-dessous.
- Récupérez les plaques de croissance de l’armoire de biosécurité.
- En commençant par la plaque la plus diluée, repérer 2 μL de chaque puits sur les plaques de gélose à l’aide du pipeteur à 96 puits (figure 1A-9).
- Abaissez lentement la tête du pipeteur sur la plaque, en prenant soin de ne pas poignarder dans l’agar. Examinez attentivement la plaque et assurez-vous que toutes les taches ont été distribuées; sinon, ajoutez manuellement 2 μL à la position appropriée. Vérifiez que les taches liquides pénètrent rapidement dans la gélose et ne coulent pas ensemble.
- Si les taches courent ensemble, sécher un nouvel ensemble de plaques de gélose fraîche pendant une période plus longue et refaire les taches. S’il existe plusieurs types de plaques (p. ex. milieux différents ou avec des antibiotiques), repérez-les aussi. Remettre toute solution restante dans la plaque de dilution et passer à la concentration immédiatement plus élevée.
NOTA: Lors de la détection de dilutions, mélanger cinq fois la dilution suivante pour s’assurer que le contenu des embouts de la pipette est débarrassé de la dilution précédente. Les plaques de dilution peuvent être conservées >8 h à 4 °C sans affecter le nombre de colonies35.
- Répéter le procédé de placage décrit à l’étape 3.5 pour les plaques de dilution restantes, en passant de la plus diluée à la plus concentrée jusqu’à la tôle contenant l’homogénat d’origine.
- Lorsque tout le liquide a été absorbé dans l’agar-agar, retourner les plaques et les placer dans l’incubateur (figure 1A-10). Pour Lactiplantibacillus et Acetobacter de Drosophila, la température optimale est de 30 °C sur milieu MRS. Incuber jusqu’à ce que les colonies aient atteint la taille optimale : les colonies sont assez grandes pour les voir clairement, mais pas au point de fusionner ou d’interférer avec la croissance des autres (voir les résultats représentatifs pour la quantification de la taille optimale).
REMARQUE : Les conditions de croissance optimales dépendent de la déformation et doivent être déterminées empiriquement. Pour Lactiplantibacillus de Drosophila, le temps optimal d’incubation est de 26 h à 30 h sur gélose MRS. Pour Acetobacter de Drosophila, le temps optimal d’incubation est de 30 h à 48 h sur MRS selon la souche. - Après l’incubation, conserver les plaques à 4 °C si nécessaire jusqu’à ce qu’elles soient prêtes pour le comptage.
4. Quantification des UFC
- Quantifier les UFC en photographiant les plaques, puis en comptant les colonies à l’aide d’un logiciel automatisé, comme indiqué ci-dessous. Si les plaques ont été stockées à 4 °C, laissez-les d’abord atteindre la température ambiante afin qu’il n’y ait pas de condensation sur les plaques, ce qui produit de l’éblouissement.
- Organisez les plaques dans un ordre logique et conservez-les dans cet ordre pendant la photographie - il est plus facile de nommer les fichiers. Orientez toutes les plaques de sorte que A1 soit dans le coin supérieur gauche pour toutes les plaques. Il est recommandé d’étiqueter le coin A1 avec un identifiant unique pour éviter toute confusion des photos. Empiler chaque série de dilution dans l’ordre.
- Retirez le couvercle de la plaque et placez la plaque sur la scène avec A1 orienté dans le coin correct. Des dessins sont inclus pour la boîte à photos de plaque (fichier supplémentaire 1, fichier supplémentaire 2), qui est optimisée pour photographier ces plaques de plateau et comprend des options d’éclairage et de filtre pour imager les colonies fluorescentes.
- Imaginez les plaques. Utilisez l’appareil photo (voir Tableau des matériaux) avec des réglages manuels pour obtenir un niveau d’exposition constant entre les plaques. Un réglage de distance focale longue est recommandé pour minimiser la distorsion de perspective. Capturez la photo à l’aide d’un obturateur à distance pour minimiser le flou dû au tremblement de l’appareil photo.
- Transférez les images sur un ordinateur et renommez-les, y compris le nom de l’expérience, le type de média, le facteur de dilution et tout autre détail pertinent. Certains systèmes d’exploitation (voir Tableau des matières) disposent d’une fonction utile de changement de nom par lots dans le Finder en cliquant avec le bouton droit de la souris sur une sélection de fichiers.
5. Comptage automatisé des colonies à l’aide de la suite Count-On-It (fichier supplémentaire 3)
- Recadrez les images à l’aide du plugin Croptacular fourni (fichier de codage supplémentaire 2) pour ImageJ. Ce plugin permet de diviser l’image en un tableau ordonné de sous-régions (par exemple, 8 x 12 pour une plaque de 96 puits). Les sous-régions seront comptées individuellement.
Remarque : Un plug-in séparé pour compter les plaques circulaires appelé Circus est décrit dans le fichier de codage supplémentaire 3 Circus_.ijm.- Organisez les images à traiter pour la quantification dans un dossier. Choisissez des noms de fichiers qui distinguent les plaques, car ces noms de fichiers deviennent des titres de colonne pour chaque ensemble de comptes. Dans ce dossier, créez des sous-dossiers nommés « cropped » et « receipts ».
- Lancez Croptacular, puis cliquez sur OK pour commencer le recadrage.
REMARQUE:Les paramètres par défaut sont affichés et sont généralement suffisants. Selon la résolution de l’image, l’éclairage, la taille du spot, etc., il peut être utile d’ajuster les paramètres de base. - Si l’image est déjà droite, appuyez simplement sur Espace. Sinon, redressez l’image en traçant une ligne le long d’un bord qui doit devenir horizontal. Redessinez la ligne autant de fois que nécessaire si l’image n’apparaît toujours pas redressée.
- Ensuite, tracez une zone de délimitation de la zone pour laquelle le comptage doit être effectué. Ajustez la taille et la proportion jusqu’à ce que toutes les taches soient dans leurs cellules. Faites glisser le curseur en dehors de la zone de limite pour actualiser la grille. Lorsque la grille semble bonne, appuyez sur Espace.
- Assurez-vous que l’image suivante pivote automatiquement sous le même angle que la première; Le plugin suppose que toutes les photos sont alignées de la même manière. Si cela est exact, appuyez sur Espace pour continuer. Sinon, redressez l’image comme avant. La grille rappelle également la même position que l’image précédente; ajustez si nécessaire, puis appuyez sur Espace.
- Énumérez les colonies sur les plaques à l’aide du plug-in Count-On-It: Gridiron fourni pour ImageJ (fichier de codage supplémentaire 4). Des instructions détaillées pour l’installation et l’utilisation du plugin sont incluses dans le fichier supplémentaire 3.
- Lancez Count-On-It > Gridiron. Utilisez les mêmes paramètres de grille qu’avec Croptacular. Les utilisateurs peuvent regrouper un dossier entier, analyser une seule image ou partir de l’image actuelle.
- Définissez le seuil en fonction d’une valeur d’intensité de pixels supérieure et inférieure. Rendre le seuil aussi strict que possible tout en sélectionnant toutes les colonies. Idéalement, il y aura un peu d’espace entre les colonies sélectionnées, mais le logiciel est capable de segmenter les blobs dans une certaine mesure. Cliquez sur OK dans la boîte de dialogue « Action requise » lorsque le seuil est satisfaisant.
- Pour inspecter les résultats, zoomez et regardez de plus près le nombre de colonies. Cliquez sur Annuler pour abandonner le plugin. Cliquez sur OK pour continuer.
- Sur la première image, assurez-vous que l’option est donnée pour continuer ou revenir au menu de configuration, par exemple, pour modifier la taille minimale de la colonie. Pour poursuivre le traitement par lots, cliquez sur OK. Ensuite, sélectionnez un dossier pour conserver le tableau des reçus et des résultats. Utilisez le dossier « reçus » ou créez un nouveau dossier.
- Après la première image, les images suivantes seront par défaut au même seuil que les paramètres précédents. Cliquez sur OK pour utiliser ces paramètres ou ajuster les paramètres. Si les photos sont cohérentes et que le paramètre est précis, cliquez sur OK dans la boîte de dialogue « Action requise ».
REMARQUE: Une fois que toutes les images du lot sont terminées, le tableau des résultats est automatiquement enregistré dans le même dossier que les reçus. - Passez en revue les reçus de comptage produits par le logiciel et corrigez manuellement les erreurs de comptage. Le plug-in ImageJ est statistiquement précis, mais des erreurs se produisent. Prouvez les reçus pour examiner les valeurs aberrantes et identifier les erreurs de comptage. Le logiciel enregistre les données CFU sous forme de fichier .csv dans le même dossier que les reçus.
- Analysez les données à l’aide du logiciel préféré de l’utilisateur.
Résultats
Dénombrement des UFC chez des centaines de mouches individuelles sous forme de plaque à 96 puits à l’aide d’un essai de colonisation
Pour comprendre la composition de nombreux microbiomes de mouches individuelles, les UFC ont été mesurées à l’aide du protocole d’accompagnement, ce qui a permis d’identifier les espèces présentes, le pourcentage de mouches colonisées et l’abondance absolue de bactéries dans chaque mouche. Les raisons de la grande variation observée d’un individu à l’autre dans la composition du microbiome sont mal comprises, et la quantification de la distribution statistique de la colonisation peut aider à étudier cette variation36,37. Pour obtenir un nombre important de réplicats biologiques, un pipeline à haut débit a été développé pour la quantification de l’abondance des microbes chez de nombreuses mouches individuelles à l’aide du nombre d’UFC (figure 1A).
La quantification finale des UFC peut être influencée par la façon dont les mouches sont manipulées avant l’analyse, par exemple, des facteurs tels que la stérilisation de surface, le temps écoulé depuis la consommation de bactéries et l’élimination des bactéries transitoires de l’intestin. Tout d’abord, en se concentrant sur l’espèce bactérienne commensale Drosophila L. plantarum (Lp; voir la souche Lp WF dans Obadia et al.36), les mouches ont été nourries avec une dose de ~105 UFC de Lp et gardées en groupes de 25 mouches par flacon. Ces mouches ont été conservées dans le même flacon pendant 3 jours ou transférées quotidiennement (transférées) dans des aliments frais et stériles (figure 1B). Les mouches non transférées ont ensuite été lavées à l’éthanol pour éliminer les bactéries de surface (lavées) ou non lavées (non lavées). Le lavage a produit une réduction non significative du nombre total d’UFC mesurées (figure 1B), ce qui indique que dans ces conditions d’inoculation hautement contrôlées, la surface de la mouche n’est pas colonisée de manière significative par des bactéries en 3 jours. Les autres groupes de mouches ont été transférés chaque jour pour réduire l’accumulation de bactéries provenant de la croissance sur les aliments (Transferred); De plus, un groupe a été transféré dans des aliments frais pendant 4 heures avant l’échantillonnage (post-transfert), ou ils ont été placés dans des flacons avec seulement de l’eau de gélose stérile pendant 4 heures (éliminé) pour permettre aux microbes ingérés transitoirement de disparaître de l’intestin. Chacune de ces étapes visant à fournir une mesure plus rigoureuse de la colonisation a produit une réduction statistiquement significative de l’abondance des UFC chez les mouches, à l’exception du lavage de surface à l’éthanol. Le transfert dans des aliments stériles (post-transfert) ou de l’eau de gélose (nettoyée) pendant 4 heures avant la mesure a produit des effets indiscernables, ce qui indique que le transfert dans des conditions stériles 4 heures avant la mesure réduit la charge bactérienne. Ce résultat est cohérent avec l’interprétation selon laquelle certaines bactéries intestinales dans l’intestin de la mouche sont transitoires, tandis que d’autres sont associées de manière plus stable35. L’abondance de Lp variait de 1 x 10 4,3 UFC/mouche chez les mouches éliminées à 1 x 104,9 UFC chez les mouches non lavées (n = 724 mouches).
Ensuite, le même essai a été effectué à l’aide d’Acetobacter indonesiensis (Ai), une bactérie à Gram négatif qui colonise l’intestin de la mouche (figure 1C; voir la souche Ai SB003 dans Obadia et al.36). Comme pour les mouches colonisées par la Lp, la stérilisation de surface a entraîné une réduction non significative des UFC. De même, le transfert quotidien dans des aliments stériles a considérablement réduit la charge bactérienne et le transfert dans des conditions stériles pendant 4 heures avant l’homogénéisation a entraîné une réduction supplémentaire de la charge bactérienne. L’abondance d’Ai variait de 1 x 104,7 UFC/mouche chez les mouches éliminées à 1 x 105,0 UFC chez les mouches non lavées (n = 528 mouches). Ainsi, la quantification précise des bactéries intestinales dépend de la fréquence du transfert, y compris le jour du transfert. L’élimination de la charge bactérienne externe par lavage à l’éthanol a eu un effet non significatif, mais des effets plus significatifs peuvent être observés pour différentes souches de bactéries ou différentes conditions de culture. Ces facteurs doivent être contrôlés expérimentalement.
L’effet potentiel de la méthode d’homogénéisation sur le nombre d’UFC a également été testé. Les mouches ont été homogénéisées à l’aide d’un batteur de billes avec des billes de verre de 0,5 μm dans 100 μL de PBS, ce qui pourrait réduire la viabilité des cellules bactériennes. Tout d’abord, une suspension de bactéries Lp de culture a été préparée dans du PBS, puis plaquée pour compter les UFC comme un contrôle positif. La même culture a été placée dans la plaque batteuse de perles et (i) homogénéisée avec des perles, (ii) homogénéisée avec des perles et une mouche exempte de germes, ou (iii) homogénéisée dans du PBS sans perles (figure 1D). L’homogénéisation dans les billes lorsqu’une mouche était présente n’a pas eu d’impact significatif sur l’abondance des cellules viables en solution, alors que l’homogénéisation des bactéries en l’absence de mouche a tué un nombre important de cellules bactériennes. L’homogénéisation dans le PBS sans billes a également réduit de manière significative le nombre de cellules viables. De même, la viabilité de l’IA a été préservée lorsqu’elle était homogénéisée en présence d’une mouche, tandis que l’homogénéisation sans mouche réduisait le nombre de cellules viables en solution (Figure 1E). Ces résultats indiquent que le tissu de mouche protège les bactéries contre la destruction par les billes lors de l’homogénéisation. Cependant, les expériences de la figure 1D et de la figure 1E ont été réalisées avec plus de 10 8 UFC par puits. En pratique, les puits avec ~106 cellules par puits ou moins présentaient peu de perte de cellules lorsque des billes étaient utilisées sans mouche. Le refroidissement de la plaque sur de la glace à mi-chemin du battement des perles améliore également la viabilité cellulaire. L’importance de ces résultats est que les lecteurs doivent être conscients de ces problèmes potentiels et concevoir des contrôles appropriés pour leur cas d’utilisation spécifique.
Précision des plaques de placage ponctuel à 96 puits pour la quantification CFU à haut débit
Étant donné que l’objectif est de mesurer l’abondance de l’UFC pour des centaines à des milliers de mouches individuelles, les méthodes traditionnelles de placage à étalement exigent beaucoup de temps et de matériel. Le placage ponctuel est une méthode efficace et efficiente pour la croissance et le dénombrement des UFC19,31. La méthode de placage ponctuel utilise un pipeteur à 96 canaux pour distribuer 2 μL de suspension bactérienne sur un milieu préparé dans des plaques de plateau rectangulaires (figure 2A). Chaque point représente la charge bactérienne d’un seul échantillon, de sorte que 96 mouches peuvent être analysées avec une seule plaque (Figure 2B). La précision du placage ponctuel a été comparée à celle du placage traditionnel en inoculant des plaques de croissance en utilisant exactement la même suspension de Lp de 0,0001 OD pour les deux méthodes. La suspension a été diluée cinq fois en série dans du PBS. À titre de comparaison, 50 μL de l’inoculum ont été étalés sur des plaques rondes individuelles, ou 2 μL de taches ont été faites sur des plaques MRS rectangulaires. Les plaques ont ensuite été incubées à 30 °C jusqu’à ce que les colonies soient dénombrables. Les numérations d’UFC résultantes pour chaque dilution ont été utilisées pour calculer la concentration initiale de la suspension et comparées (figure 2C). Les plaques rondes contenant 50 à 500 UFC ont été comptées comme témoins. Aucune différence significative n’a été observée entre les méthodes de placage à haut débit et les méthodes traditionnelles de placage rond.
Comme la densité des colonies peut affecter leur croissance et leur quantification, l’effet de la densité de l’UFC sur les dénombrements finaux a été testé. Les taches avec 2 à 25 colonies par point n’ont montré aucune différence dans le dénombrement final par rapport à la méthode traditionnelle des plaques rondes (figure 2C). Les taches avec une moyenne de 35 colonies ont produit des résultats légèrement inférieurs à ceux des plaques d’étalement témoins (figure 2C; p = 0,0017). Un examen attentif des photographies des taches individuelles a indiqué que cette inclinaison était due au chevauchement des colonies dans des taches denses. Les mesures fondées sur des taches avec une moyenne de 11 colonies par tache ont donné des concentrations les plus proches de celles basées sur les plaques étalées (figure 2C; Plaques étalées: moyenne = 1 x 104,4 UFC; ET = 0,086 par rapport aux taches avec 11 colonies moyennes : moyenne = 1 x 104,4 UFC; ET = 0,12, p = 0,42, test t de Welch).
Génération d’images de haute qualité pour la quantification à l’aide d’une plate-forme de photographie spécialisée avec lumière blanche ou fluorescence
Le placage ponctuel à haut débit génère naturellement un grand nombre de zones cibles, qui doivent être comptées avec précision. Des photographies de qualité peuvent être utilisées pour documenter les données et faciliter le comptage des UFC. Une plate-forme photographique robuste et simple a été développée à l’aide de matériaux disponibles dans le commerce (figure 3A). Un appareil photo numérique était attaché à un support au-dessus d’une boîte à lumière construite sur mesure, appelée FluoroBox, et était pointé directement vers le bas, perpendiculairement au centre de la plaque. Un filtre d’émission coloré a été positionné en option devant l’objectif à l’aide d’un curseur de filtre. Un écran lumineux empêchait l’éclatement de l’objectif en bloquant la lumière directe des bandes de LED ci-dessous. Des bandes de LED éclairaient la plaque sur les côtés, plutôt qu’au-dessus, pour éviter l’éblouissement sur la plaque. En plus de la lumière blanche, des LED bleues et vertes unicolores ont été utilisées pour exciter les protéines fluorescentes vertes et rouges, respectivement. La plaque était maintenue en place par un porte-plaque sur le tiroir, et le tiroir était équipé de curseurs de tiroir pour faciliter l’insertion de la plaque. Les conceptions complètes sont disponibles dans le dossier supplémentaire 1 et le dossier supplémentaire 2.
Une photo d’une plaque ponctuelle de colonies de Lp a été prise à l’aide de LED à lumière blanche et d’un appareil photo numérique pour aider à compter les colonies et à distinguer les différentes couleurs et morphologies (Figure 3B). Pour valider que l’intensité lumineuse était uniforme, l’intensité de fond de la gélose a été mesurée dans différentes régions d’une photographie sur plaque (figure 3C). Pour démontrer que les colonies peuvent être clairement distinguées du fond, l’intensité sur le diamètre de 10 colonies différentes sur différentes parties de la plaque a été mesurée et s’est avérée être environ ~300% plus élevée que le bruit de fond (figure 3C). La plaque a été inoculée avec Lp avec un plasmide exprimant la protéine fluorescente mCherry, ainsi que de la Lp qui ne contenait pas le plasmide, de sorte que les colonies étaient soit mCherry-positives, soit mCherry-négatives. Pour distinguer ces deux types de colonies, la plaque a été photographiée à l’aide du même appareil photo avec une lumière LED verte (515-525 nm) et un filtre rouge (Tiffen #29), provoquant la fluorescence des colonies positives mCherry (Figure 3D). La différence d’intensité entre mCherry-positive et mCherry-negative a été quantifiée en mesurant l’intensité sur un échantillon de colonies (n = 10 colonies). Les colonies mCherry-positives étaient ~1 000 % plus intenses que les mCherry-négatives (Figure 3E). Des colonies d’Ai exprimant la GFP et des colonies d’Ai n’exprimant aucune fluorescence ont été photographiées à l’aide de lumières LED bleues (465-475 nm) et d’un filtre vert (Tiffen #58) (Figure 3F). Les colonies positives à la GFP ont montré une intensité 200 % plus élevée que les colonies à la GFP négative (Figure 3G).
Comptage automatisé des UFC sur des plaques ponctuelles à l’aide du plug-in personnalisé ImageJ Count-On-It
Les photos seules aident à compter les colonies (par exemple, en stockant les données, en partageant les données, en zoomant, en marquant une superposition, en séparant les couleurs, etc.). Cependant, le fait de compter et d’organiser manuellement les résultats de centaines de points peut être fastidieux, chronophage et sujet à des différences humaines dans les dénombrements finaux. Pour accélérer le processus de comptage et normaliser la reproductibilité des comptages, un plug-in spécialisé ImageJ appelé Count-On-It (Figure 4A) a été développé. Ce plug-in permet un comptage semi-automatisé précis des UFC sur des plaques de gélose agsé. L’utilisateur prépare les images pour le comptage en les recadrant d’abord et en les redressant à l’aide du plug-in supplémentaire Croptacular . Les photos peuvent éventuellement être traitées par lots et le seuil peut être ajusté pour chaque plaque. Plusieurs autres options permettent à l’utilisateur d’augmenter la précision du comptage des plaques, notamment le réglage des longueurs d’onde lumineuses (images RVB), la définition d’une plage de taille de colonie (en pixels), la modification du rapport d’aspect maximal et la personnalisation des dimensions de la grille de sélection active. Count-On-It produit un tableau de résultats avec chaque plaque représentée par une colonne de comptes CFU. Il génère également un reçu photo montrant une superposition pour documenter visuellement ses résultats de comptage et faciliter la correction manuelle des erreurs (Figure 4B). Bien que des erreurs se produisent, lorsque le nombre de colonies comptées manuellement a été comparé au nombre de colonies comptées à l’aide de ce plug-in (figure 4C), la relation était généralement équivalente, avec une régression linéaire entre les dénombrements manuels et automatisés montrant une pente de 0,95 avec une précision de plus de 90% (R2 = 0,93), bien que l’erreur ait augmenté lorsque le nombre de colonies dépassait 20.
Count-On-It peut également être utilisé pour compter séparément les colonies fluorescentes en utilisant la fonction de fluorescence de la FluoroBox. Le nombre de colonies mCherry-positive (Figure 4D) par plug-in logiciel par rapport au manuel avait un R2 de 0,92 (Figure 4E). De même, les colonies GFP positives (Figure 4F) comptées avec un plug-in logiciel par rapport à une version manuelle avaient un R2 de 0,90 (Figure 4G). Les colonies fluorescentes et non fluorescentes peuvent être distinguées au sein d’un seul échantillon, et la taille et la forme des colonies peuvent également être utilisées pour distinguer des sous-populations distinctes (figure 4H-K). Les reçus photo fournissent un enregistrement qui permet à l’utilisateur de vérifier rapidement l’exactitude des comptages et de corriger manuellement les erreurs. Dans la figure 4C,E,G,I,K, les reçus photo n’ont pas été utilisés pour améliorer la précision du comptage afin que les lecteurs puissent voir la sortie brute de la méthode. Des cas comme dans la figure 4G, où un comptage manuel de 1 a donné un comptage automatisé de 21, peuvent être rapidement détectés à l’aide des reçus photo. Dans ce cas, l’éblouissement sur le bord de la plaque a créé des taches qui ont été comptées comme des colonies. Pour chaque cas d’utilisation, les paramètres optimaux du plug-in logiciel doivent être déterminés avant le comptage à haut débit.

Figure 1 : L’essai de colonisation mesure les UFC chez des centaines de mouches individuelles en utilisant un format de plaque de 96 puits. (A) Aperçu illustré de l’essai de colonisation et de la méthode de quantification à haut débit utilisée, tel que décrit dans la section sur le protocole. (B) L’abondance de Lactiplantibacillus plantarum (Lp) chez les mouches après l’essai de colonisation a été mesurée dans diverses conditions à l’aide de la méthode de quantification de l’UFC à haut débit. Les mouches ont été conservées dans le même flacon pendant 3 jours, puis homogénéisées et plaquées (non lavées), lavées à l’éthanol avant le placage (lavées), lavées et transférées tous les jours (transférées), transférées quotidiennement puis conservées sur des aliments stériles avant l’assiette (post-transférées), ou conservées dans des flacons avec seulement de l’eau pendant 4 h (éliminées) (n = 724 mouches au total, 3 répétitions biologiques et ~72 mouches au total par traitement). (C) Le même dosage qu’en (B) a été réalisé avec Acetobacter indonesiensis (Ai) (n = 528 mouches). (D) La suspension bactérienne Lp a été préparée dans du PBS, puis plaquée pour compter les UFC ou d’abord homogénéisée par battement de billes, battue en perles en combinaison avec une mouche exempte de germes (GF) ou agitée sur le batteur de billes sans perles ni mouche (n = 236 puits d’échantillonnage). (E) La viabilité de l’IA après homogénéisation a été testée de la même manière que dans (D) (n = 282 puits échantillons). La signification statistique pour les panels (B-E) a été calculée à l’aide d’un test de Kruskal-Wallis suivi de tests de somme de rang de Wilcoxon par paires avec correction de comparaisons multiples de Bonferroni. La case donne l’intervalle interquartile. La ligne indique la médiane. Les moustaches donnent une portée totale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
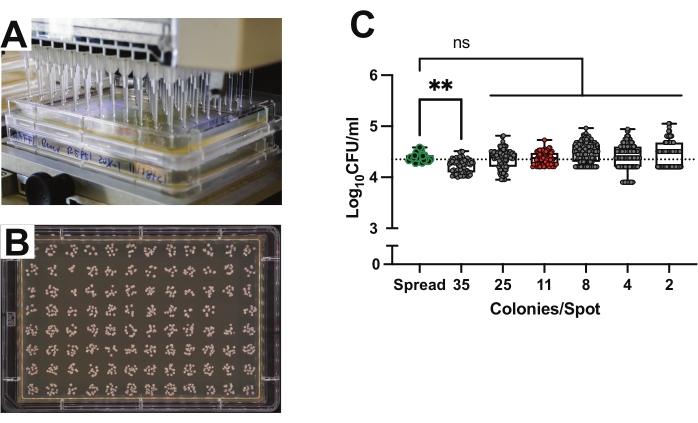
Figure 2 : Précision des plaques de placage ponctuel de 96 puits pour la quantification des UFC à haut débit. (A) Placage ponctuel à l’aide d’un pipeteur à 96 canaux pour distribuer 2 μL sur des milieux préparés dans des plaques de plateau rectangulaires. (B) Plaque de croissance MRS-agar avec 96 taches de colonies Lp. (C) Concentration de la suspension de Lp basée sur le nombre d’UFC provenant de plaques rondes traditionnelles (n = 24 plaques) par rapport à la concentration basée sur le nombre d’UFC provenant de plaques ponctuelles (n = 680 points) diluées en série et organisées par nombre moyen de colonies par point (~48 points pour chaque facteur de dilution unique pour trois plaques répliquées ont été comptés). Chaque point de données représente les colonies exactes par spot, tandis que chaque colonne représente les colonies moyennes pour cette dilution. La ligne pointillée horizontale indique le nombre calculé d’UFC de la culture qui a été plaquée. Les points soulignés en vert mettent en évidence le nombre traditionnel de plaques rondes. Les points remplis de rouge mettent en évidence la densité optimale de colonies de 11 UFC par point de 2 μL. La signification statistique a été calculée à l’aide d’ANOVA unidirectionnelle ordinaire comparant la moyenne de chaque colonne à la moyenne de la colonne de contrôle de la plaque étalée avec la correction des comparaisons multiples de Bonferroni. La case donne l’intervalle interquartile. La ligne indique la médiane. Les moustaches donnent une portée totale. **p < 0,01. ns = non significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Une plate-forme photographique produit des images quantifiables de plaques en utilisant la lumière blanche ou la fluorescence. (A) Vue d’ensemble de la conception de la FluoroBox. (B) Photo d’une plaque ponctuelle de colonies de Lp utilisant la lumière blanche. (C) Profil d’intensité des colonies individuelles sous lumière blanche par rapport à l’intensité du fond (BKG) (n = 10 colonies, la ligne pointillée représente l’écart-type). (D) Photo de la même plaque ponctuelle que dans (B), en utilisant des lumières vertes unicolores et le filtre rouge pour sélectionner les colonies Lp positives pour les cerises. (E) Profil d’intensité des colonies individuelles illustrant la différence entre les colonies avec et sans émission de cerises. (F) Photo d’une plaque de spot contenant des colonies d’Aï, dont certaines portent une étiquette GFP. (G) Profil d’intensité des colonies individuelles illustrant la différence entre les colonies positives à la BPV. E, F, G: n = 10 colonies pour chaque placette. Le diamètre des colonies est d’environ 1,5 mm. La ligne pointillée est SD. Veuillez cliquer ici pour voir une version agrandie de cette figure.
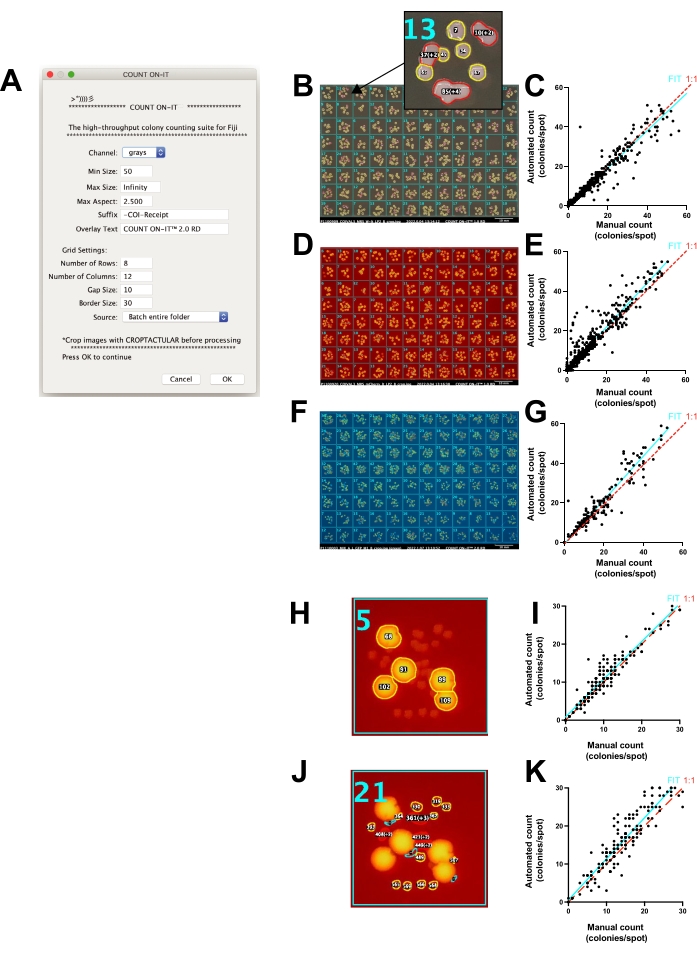
Figure 4 : Comptage précis des plaques ponctuelles par le plug-in ImageJ Count-On-It. (A) Capture d’écran de la fenêtre de configuration du plug-in. (B) Le plug-in génère un reçu pour documenter le comptage et aider à la correction des erreurs. Introduire: Superposition avec le nombre de colonies comptées pour chaque région ponctuelle; Le contour jaune indique qu’une seule colonie a été comptée et rouge que plusieurs colonies ont été comptées. (C) Graphique montrant le nombre de colonies comptées manuellement par rapport au nombre de colonies comptées à l’aide du plug-in (automatisé) lorsqu’une image en lumière blanche a été utilisée, où chaque point du graphique représente un seul point compté manuellement ou automatiquement (pente d’ajustement = 0,95, ligne cyan; la ligne 1:1 est pointillée rouge; R2 = 0,93, coefficient de corrélation de Pearson, p < 0,0001). (D) Image de réception photo du plug-in lorsque des colonies mCherry-positives ont été sélectionnées à l’aide de la fonction de fluorescence de la boîte à photos. (E) Graphique montrant le nombre de colonies mCherry-positives comptées à l’aide d’une méthode manuelle par rapport à une méthode automatisée lorsque la fluorescence rouge a été utilisée (pente d’ajustement = 1,1, ligne cyan; la ligne 1:1 est pointillée rouge; R2 = 0,92, coefficient de corrélation de Pearson, p < 0,0001). Il est à noter que les valeurs aberrantes et les erreurs n’ont pas été corrigées à l’aide des reçus d’analyse pour E, G, I, K. (F) Image de réception photo du plug-in lorsque les colonies GFP positives ont été sélectionnées à l’aide de la fonction de fluorescence verte de la boîte à photos et en sélectionnant le canal vert avec le plug-in. (G) Graphique montrant le nombre de colonies GFP positives comptées manuellement par rapport à la méthode automatisée lorsque l’éclairage à fluorescence verte a été utilisé (pente d’ajustement = 1,1, ligne cyan; la ligne 1:1 est pointillée rouge; R2 = 0,90, coefficient de corrélation de Pearson, p < 0,0001). (H) Colonies mCherry-positive sélectionnées parmi des morphologies de colonies mixtes utilisant un seuil de fluorescence élevé dans le plug-in. (I) Graphique montrant le nombre de colonies mCherry-positives comptées manuellement par rapport à la méthode automatisée lorsque l’éclairage à fluorescence rouge a été utilisé (pente d’ajustement = 0,99; R2 = 0,91, coefficient de corrélation de Pearson, p < 0,0001). (J) les colonies mCherry-négatives sélectionnées parmi les morphologies de colonies mixtes en utilisant un seuil de fluorescence bas. (K) Graphique montrant le nombre de colonies mCherry-négatives comptées à l’aide d’une méthode manuelle par rapport à une méthode automatisée lorsque le seuil d’intensité a été réglé pour sélectionner des colonies non fluorescentes (pente d’ajustement = 1,1; R2 = 0,85, coefficient de corrélation de Pearson, p < 0,0001). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Instructions de montage de la FluoroBox. Ce fichier guide le lecteur étape par étape dans la construction du boîtier d’éclairage contrôlé utilisé dans la vidéo. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2 : découpe laser acrylique FluoroBox. Ce fichier fournit un gabarit de découpe pour découper au laser les pièces en acrylique pour la boîte d’éclairage contrôlée. Le fichier peut être envoyé à un fournisseur d’acrylique découpé au laser. Voir le tableau des matériaux pour le fournisseur utilisé dans ce protocole. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 3 : Instructions du logiciel. Ce fichier guide le lecteur étape par étape à travers l’installation et l’utilisation des logiciels Croptacular et Count-On-It fournis avec ce protocole. Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 1 : code d’impression 3D pour plateau de mesure de billes (S1-bead-measurer.stl). Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 2: Plug-in ImageJ (Croptacular_.ijm) de photo-recadrage de plaque rectangulaire . Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 3: plugin de recadrage de photo de plaque ronde (Circus_.ijm). Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 4 : Plug-in compteur de points de la plaque rectangulaire 96 (Gridiron_.ijm). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les techniques détaillées présentées ici permettent de multiplier par > 100 le nombre d’échantillons pouvant être évalués dans une expérience de comptage de l’UFC. Cette technique fait progresser les méthodes existantes pour les expériences sur le microbiome chez la drosophile 12,35,36 en utilisant le format de plaque à 96 puits pour tester les mouches individuelles. En outre, il applique une méthode de placage ponctuelplus efficace 19,31 et un flux de travail automatisé avec une plate-forme de photographie et de comptage de colonies. L’importance de cette méthode pour la drosophile est de standardiser les expériences au format de plaque à 96 puits, ce qui permet la manipulation simultanée d’un grand nombre de réplicats biologiques avec automatisation pour obtenir une quantification à haut débit des UFC.
La plateforme de 96 puits montre que l’augmentation de la fréquence de transfert et de « l’élimination » des bactéries transitoires entraîne une réduction significative de l’abondance moyenne et de la variation entre les échantillons (Figure 1B,C), démontrant la rigueur de ce protocole amélioré. L’une des limites des mouches de cohabitation est le transfert horizontal de bactéries entre les mouches. Une solution proposée consiste à garder les mouches individuellement dans un format de plaque de 96 puits, comme le plat d’alimentation des animaux entiers38.
Bien qu’une réduction significative de la charge bactérienne n’ait pas été observée lorsque les mouches ont été lavées à l’éthanol, ces mouches n’avaient été gardées en présence de bactéries externes que pendant 3 jours. Le logement pendant de plus longues périodes pourrait permettre à une plus grande charge bactérienne de s’accumuler39. Par conséquent, le lavage à l’éthanol est toujours recommandé.
Le transfert des mouches dans la plaque de 96 puits est la première étape critique pour la mise en place du flux de travail (Figure 1A). Une fois les mouches lavées, elles sont distribuées dans les puits une à la fois. Un tableau des plaques est utile à ce stade pour noter quelles conditions sont présentes dans chaque puits et ajouter des notes telles que « la mouche a été perdue ». L’homogénéisation est une autre étape critique avec quelques mises en garde importantes. Les bactéries survivent au processus d’homogénéisation en présence d’une mouche (Figure 1D,E), et vraisemblablement, ce principe est également vrai lorsque les bactéries sont à l’intérieur de l’intestin de la mouche. Cependant, les bactéries sont également tuées lorsqu’elles sont homogénéisées uniquement dans des plaques de battement de billes, démontrant que l’homogénéisation peut tuer les cellules bactériennes dans certaines circonstances, une limitation qui peut être importante si l’on homogénéise des intestins disséqués, par exemple. Notamment, la perte d’UFC lors de l’homogénéisation dépend du nombre d’UFC dans l’échantillon, et la perte est minime lorsque ~105 UFC par puits sont utilisés. Une préservation plus poussée des UFC peut être obtenue en arrêtant l’homogénéisation à mi-chemin et en refroidissant la plaque sur la glace.
L’homogénéisation a été effectuée pendant 5 minutes dans ce protocole sur la base d’expériences de contrôle où un nombre connu d’UFC ont été mélangées avec une mouche exempte de germes, ce qui a fonctionné empiriquement pour les bactéries de mouches. Moins de coups ont entraîné la présence de plus grandes parties de mouches, ce qui interfère avec le pipetage, tandis que des temps d’homogénéisation significativement plus longs de ~ 10 min ont rendu le nombre d’UFC plus variable. On a observé que le plus petit volume et la forme inclinée des puits à plaques coniques réduisaient l’efficacité du battage des billes par rapport aux tubes cylindriques de 2 mL. De nombreuses variantes de cette approche générale sont possibles, y compris quelles souches bactériennes, quel récipient de battage de perles, quelles perles et quel génotype de mouche sont utilisés. Les cas d’utilisation individuels doivent utiliser des contrôles positifs pour établir leur approche.
La méthode de placage ponctuel a été utilisée d’une manière spécifique : des dilutions 1:2 de L. plantarum WF dans le PBS ont été repérées sur des plaques MRS et incubées à 30 °C pendant 2 jours (des temps d’incubation plus courts peuvent être mis en œuvre pour générer des colonies plus petites). La méthode nécessite un certain investissement initial dans l’équipement, principalement le batteur de billes et le pipettor à 96 canaux (figure 2A), ce qui est nécessaire à la fois pour la série de dilution et le placage ponctuel. Cependant, des options moins coûteuses sont disponibles, y compris un réplicateur de plaques de 96 puits avec des broches fendues. La série de dilutions est une étape critique qui affecte l’exactitude des résultats du comptage de l’UFC. En termes de modes de défaillance, il est possible de boucher les pointes de pipette avec des pièces de mouche ou des perles de verre et que les extrémités de pipette ne scellent pas correctement sur la pipette ou tombent en panne pour une autre raison. Tous ces problèmes entraînent un sous-dénombrement des puits touchés et doivent être surveillés. Un mélange adéquat à chaque étape de la série de dilution est également crucial. Chaque dilution doit être soigneusement mélangée soit en mettant la plaque sur un agitateur à plaques, soit en pipetant de haut en bas 15 à 20 fois, ce qui sert également à rincer les pointes. En repérant de la tôle la plus diluée à la moins diluée, les embouts peuvent être réutilisés pour toute la série de dilution. Avec des dilutions de 1:2, le comptage est précis sur une plage de 2 à 25 colonies, couvrant un ordre de grandeur (Figure 2C). Par conséquent, les dilutions 1:10 permettent d’économiser du temps et des matériaux. Une autre variable dont on peut tirer parti est le temps d’incubation, qui peut être ajusté pour produire des colonies plus petites et, ainsi, augmenter la gamme des taches dénombrables en empêchant la fusion des colonies adjacentes.
Une photo de qualité de la plaque est essentielle car elle devient la source brute des données à partir desquelles les UFC sont analysées et peuvent être archivées indéfiniment. La FluoroBox est conçue pour produire des photos des plaques avec une intensité lumineuse uniforme, ce qui minimise l’éblouissement sur la surface de la gélose. De plus, la conception est capable de photographier sélectivement des colonies fluorescentes à l’aide de lumières LED unicolores et de filtres photo colorés (Figure 3A). La construction d’une installation comme la FluoroBox, avec un éclairage contrôlé et des réglages de caméra, peut augmenter considérablement la reproductibilité des images CFU, ce qui est important pour l’analyse automatisée. La morphologie des colonies, l’intensité de fluorescence et les effets du temps ou de la densité sur la croissance des colonies ne sont que quelques-unes des propriétés qui peuvent être analysées à l’aide des photographies. La boîte à photos peut être construite sans les filtres de couleur et les lumières unicolores si aucune bactérie fluorescente n’est utilisée, ce qui réduit le coût et la complexité. Différents feux d’excitation et filtres d’émission pourraient être substitués à ceux recommandés ici si un fluorophore différent est utilisé par un laboratoire. Une caméra connectée à une tablette via WiFi à l’aide d’une application est utile à la fois pour la fonction d’obturateur automatisé afin d’éviter les tremblements et pour faciliter le transfert de données. Les images peuvent être transférées sur la tablette, puis sur un ordinateur portable à l’aide d’un logiciel de transfert de fichiers sans fil. Les caméras recommandées avec ces capacités sont indiquées dans le tableau des matériaux.
Count-On-It est un plug-in écrit en ImageJ. Le logiciel de comptage CFU automatisé segmente l’image de la plaque dans une grille uniforme de 96 puits, compte les colonies dans chaque cellule de grille et regroupe les résultats dans une simple feuille de calcul. Comme il y a toujours une variation dans la position de la grille spot sur la plaque et sur la photo, l’utilisateur doit conformer manuellement la grille à la photo à l’aide du plug-in Croptacular . Cela permet également d’exclure les zones proches du bord de la plaque, qui présentent un éblouissement. La définition du seuil est essentielle pour obtenir le nombre d’UFC le plus précis à partir de l’image. Si le seuil est fixé trop haut, les colonies fusionneront; Si le seuil est fixé trop bas, les colonies seront exclues. Une fois le seuil défini, la macro applique un flou gaussien pour adoucir les bords et réduire le repliement, le filtre du bassin versant divise les colonies qui se chevauchent et les taches sont comptées à l’aide des particules d’analyse.
Parfois, la densité de colonies est trop élevée à un endroit particulier. Count-On-It fournit un moyen de faire face à cela. Pour estimer le nombre de colonies dans une cellule de grille avec des colonies partiellement fusionnées, on considère d’abord la surface moyenne d’un blob circulaire de la plaque entière comme C moyenne. Ensuite, l’aire du blob A 1 est divisée par la surface moyenne d’un blob circulaire A1/Cmoyenne. Ce nombre est arrondi à l’entier le plus proche, et c’est l’estimation du nombre de colonies dans un blob. Cette fonction est l’une des raisons pour lesquelles le seuil peut influencer les résultats du comptage : la surface moyenne relative de la colonie par rapport à une zone d’objets blob fusionnés sera différente selon la façon dont le seuil affecte les objets blob fusionnés.
Les méthodes présentées ont plusieurs limites. Il s’agit notamment de la nécessité de disposer d’équipements pour distribuer avec précision les fluides liquides à partir de plaques à 96 puits. Cet équipement, qu’il s’agisse d’un pipeteur à 96 canaux ou d’un outil à broche de réplicateur à fente, peut coûter des milliers de dollars à obtenir. Des alternatives moins chères existent mais sont moins précises. Le comptage automatisé via Count-On-It présente également certaines limites. Par exemple, si deux types de colonies dans une population mixte étaient délimités en fonction de la taille seule, le comptage des blob ne serait pas en mesure d’affecter les colonies au type correct. Dans ce cas, les taches avec des blobs devraient être éliminées des dénombrements. Une différenciation plus poussée des colonies en fonction de la morphologie serait une extension précieuse de la méthode qui n’est pas actuellement mise en œuvre. L’utilisation de milieux sélectifs, y compris des nutriments spécifiques à la souche et des antibiotiques, simplifie le besoin d’analyse d’images complexes.
Le maintien des expériences sur les mouches des fruits dans des plaques de 96 puits multiplie le nombre d’échantillons et les conditions qui peuvent être testés dans une seule expérience et peut faciliter les criblages à haut débit dans les phénotypes d’association drosophile-bactérie. Nous envisageons que cette méthode puisse être étendue en utilisant des milieux sélectifs pour différencier de nombreuses souches bactériennes dans des mélanges complexes. La méthode ne se limite pas à l’étude du microbiome des mouches. La quantification des UFC est courante dans de nombreuses applications de la microbiologie, de la numération des coliformes dans l’eau potable à l’identification des agents pathogènes. Le système de placage CFU présenté ici permet des criblages à haut débit, ainsi que l’acquisition, le traitement, le stockage et la livraison automatisés des résultats.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le Dr Kerwyn Casey Huang, le Dr Andrés Aranda-Díaz, Ted Cooper et les membres du laboratoire de Ludington ont apporté une contribution précieuse à l’élaboration de ce protocole. Le financement a été fourni par la subvention NSF IOS 2032985, la subvention DP5OD017851 des NIH, une subvention de l’Institut Carnegie du Canada et le Fonds de dotation du Carnegie Institute for Science.
matériels
| Name | Company | Catalog Number | Comments |
| Bead beating and spot plating | |||
| Fly vials | Genesee | 32-121 | autoclavable |
| Fly vial stoppers | Genesee | 59-201 | autoclavable |
| Hand Applicator | 3M | 3M PA1 | |
| Heat Sealer | Eppendorf | 5390 | |
| Mini-Beadbeater 96 | BioSpec | 1001 | |
| Mini-BeadBeater Glass Mill Beads, 0.5 mm | BioSpec | 11079105 | |
| MPS 1000 Mini PCR Plate Spinner | Labnet | LI-CF-P1000 | |
| Rainin BenchSmart 96 semi-automated pipettor | Mettler Toledo | 30296705 | Less expensive options available, including slotted 96 well pin tool from VP Scientific |
| TempPlate semi-skirted 96-well PCR plate, straight skirt, natural | USA scientific | 1402-9220 | Must be polypropylene for heat sealer |
| Thermal Bond Heat Seal Foil | 4titude | 4ti-0591 | Keep sterile |
| Tray Plate,128 x 85 mm, Polystyrene, Sterile | SPL Life Sciences | 31001 | For making rectangular agar plates |
| Photobox construction | |||
| ¼”-20 X ½” Bolts (X2) | Amazon | ASIN: B07BP1WR3H | To attach the camera bracket. Brand not important. Any 1/4"-20 1/2" bolt works. |
| ¼”-20 x ½” Connector Nut | Amazon | UPC: 799862376780 | AKA cap nut or connector bolt. This is for attaching the rubber bands on the plate holder. Brand not important. |
| ¼”-20 x ¾” bolts (X3) | Amazon | ASIN: B003QZSZY4 | For the plate holder. Brand not important. |
| 1/8” x ½” washer | Amazon | UPC: 611982484599 | Washer for the cap nuts on outside of box. Brand not important. Spray paint black before attaching to blend with the acrylic. |
| 18 Gauge Wire - Two Conductor Power Wire - 18 AWG Power Wire – 10ft | Superbrightleds.com | WP18-2 | |
| 22-10 AWG Red Wire Nut - WN-R2210 – Quantity 4 | Superbrightleds.com | WN-R2210 | |
| 22-18 AWG 3/16in Female Push On Connector - 22-18 AWG – Quantity 3 | Superbrightleds.com | SCFP-2218 | |
| 4" Solderless Clamp-On Jumper Connector - 8mm Single Color LED Strip Lights - Quantity 3 | Superbrightleds.com | SBL-MA2P-8-2 | |
| 4" Solderless Clamp-On Pigtail Adaptor - 8mm Single Color LED Strip Lights – Quantity 3 | Superbrightleds.com | SBL-MA2P-8-1 | |
| 6” drawer handle | Amazon | ASIN: B07Z331P99 | Any drawer handle should work. |
| 6” Drawer slides | Btibpse | UPC: 712243424979 | Trim the soft close rubber stoppers on the drawer sliders. |
| 8-32 x ½” Cap Nuts (x4) | Amazon | ASIN: B00HYLZB98 | Attaches drawer slide bolts on outside of box. Brand not important. Nylon won't damage the acrylic. Spray paint black before attaching to blend with the acrylic. |
| 8-32 x ½” Nylon Bolts (x4) | Amazon | ASIN: B07KX9T7NF | To attach drawer slides. Brand not important. Any bolt or machine screw meeting the specifications works. Nylon won't damage the acrylic and allows you to cut the bolt flush with the nut. Spray paint black before attaching to blend with the acrylic. |
| Acrylic Glue | SCIGRIP | Ean: 7844908489337 | SCIGRIP Weld-On #4 Adhesive, Pint and Weld-On Applicator Bottle with Needle |
| Black Cable Ties - 10 Pack - 4 Inch Long | Superbrightleds.com | CT-B04-10 | |
| Camera L-Bracket | WLPREOE, Vikerer, Unbranded | ASIN: B09X46YKQZ | The bracket should be "reversed" from its intended configuration so that the camera is on the "outside" of the L. Some brackets come in two pieces and allow for this alternate configuration, some don't, you'll need one that can be flipped. Also should have 1/4" holes for attachment. WLPREOE, Vikerer, Unbranded. Amazon Serial Identification Number given as an example. |
| Canon T series camera for tethering option OR | Canon, Panasonic, Sony, Nikon, etc.. | 1894C002 | The Canon Ti series cameras are a good option and can tether to a computer. Use with the 18-55mm standard kit lens. Used options are recommended from the Canon T5 to T7 (current model). |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Blue - 2 meters | Superbrightleds.com | STN-BBLU-B6A-08C1M-24V | |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Green – 2 meters | Superbrightleds.com | STN-BGRE-B6A-08C1M-24V | |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Natural White 4000K – 2 meters | Superbrightleds.com | STN-A40K80-B6A-08C1M-24V | |
| Drill with ¼”, 1/8” drill bits | Black & Decker | BDCDD12PK | Brand not important. |
| Flat Black Spray Paint, 2X Ultra-Matte | Rustoleum | 331182 | Paint the interior of everything FLAT black. Brand not important. |
| Laser Cut Acrylic Walls | Big Blue Saw | www.bigbluesaw.com | Use the attached PDF, delete all cutouts in the top piece except desired hole for camera |
| Mean Well LED Switching Power Supply - LPV Series 20-100W Single Output LED Power Supply - 24V DC - 20 Watt | Superbrightleds.com | LPV-20-24 | |
| Panasonic ZS100 for wifi connection to a phone, tablet, or computer | Canon, Panasonic, Sony, Nikon, etc. | DMC-ZS100K | Panasonic cameras can be wirelessly connected to a computer for data transfer and remote shutter options. Used options are good. |
| Quick Release Plate | Neewer Aluminium 50mm Quick Release Plate QR Clamp 3/8-inch with 1/4-inch | ASIN: B07417F21D | Add this to the bracket so the camera can be easily removed for changing color filters. Amazon Serial Identification Number given as an example. |
| Rubber Bands, Assorted sizes | BAZIC Products | Alliance Rubber 26649 | Rubber bands go on the plate holder. Brand not important. |
| Screw/Adhesive Cable Tie Mounting Bases - 3/4 inch base – Quantity 4 | Superbrightleds.com | CTMB-20 | |
| SPST Round Rocker Switch - No LED – Quantity 3 | Superbrightleds.com | RRS-SP | |
| Tiffen 29 Filter (Red) 72 mm | Tiffen | 72R29 | |
| Tiffen 58 Filter (Green) 72 mm | Tiffen | 7258 | |
| Software | |||
| ImageJ64 | https://imagej.net/downloads | N/A | Free. Just cite: Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., … Cardona, A. (2012). Fiji: an open-source platform for biological-image analysis. Nature Methods, 9(7), 676–682. doi:10.1038/nmeth.2019 |
| MacOSX | Apple | N/A | Has a useful batch rename feature in Finder to rename a group of photos to facilitate organizing and analyzing in Count-on-it. |
| Unix | BSD | N/A | 64 bit |
| Windows | Microsoft | N/A | 64 bit |
Références
- McFall-Ngai, M., et al. Animals in a bacterial world, a new imperative for the life sciences. Proceedings of the National Academy of Sciences. 110 (9), 3229-3236 (2013).
- Shepherd, E. S., Deloache, W. C., Pruss, K. M., Whitaker, W. R., Sonnenburg, J. L. An exclusive metabolic niche enables strain engraftment in the gut microbiota. Nature. 557 (7705), 434-438 (2018).
- Taur, Y., et al. Intestinal domination and the risk of bacteremia in patients undergoing allogeneic hematopoietic stem cell transplantation. Clinical Infectious Diseases. 55 (7), 905-914 (2012).
- Buffie, C. G., et al. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature. 517 (7533), 205-208 (2015).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- Vandeputte, D., et al. Temporal variability in quantitative human gut microbiome profiles and implications for clinical research. Nature Communications. 12 (1), 6740 (2021).
- D'hoe, K., et al. Integrated culturing, modeling and transcriptomics uncovers complex interactions and emergent behavior in a three-species synthetic gut community. eLife. 7, 2892 (2018).
- Ludington, W. B., Ja, W. W. Drosophila as a model for the gut microbiome. PLoS Pathogens. 16 (4), 1008398 (2020).
- Chandler, J. A., Lang, J. M., Bhatnagar, S., Eisen, J. A., Kopp, A. Bacterial communities of diverse Drosophila species: Ecological context of a host-microbe model system. PLoS Genetics. 7 (9), 1002272 (2011).
- Pais, I. S., Valente, R. S., Sporniak, M., Teixeira, L. Drosophila melanogaster establishes a species-specific mutualistic interaction with stable gut-colonizing bacteria. PLoS Biology. 16 (7), 2005710 (2018).
- Adair, K. L., et al. Host determinants of among-species variation in microbiome composition in drosophilid flies. The ISME Journal. 14, 217-229 (2019).
- Koyle, M. L., et al. Rearing the fruit fly Drosophila melanogaster under axenic and gnotobiotic conditions. Journal of Visualized Experiments. (113), e54219 (2016).
- Lesperance, D. N. A., Broderick, N. A. Microbiomes as modulators of Drosophila melanogaster homeostasis and disease. Current Opinion in Insect Science. 39, 84-90 (2020).
- Grenier, T., Leulier, F. How commensal microbes shape the physiology of Drosophila melanogaster. Current Opinion in Insect Science. 41, 92-99 (2020).
- Broderick, N. A., Lemaitre, B. Gut-associated microbes of Drosophila melanogaster. Gut Microbes. 3 (4), 307-321 (2012).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110 (2018).
- Téfit, M. A., Gillet, B., Joncour, P., Hughes, S., Leulier, F. Stable association of a Drosophila-derived microbiota with its animal partner and the nutritional environment throughout a fly population's life cycle. Journal of Insect Physiology. 106, 2-12 (2017).
- Ryu, J. -. H., et al. Innate immune homeostasis by the homeobox gene caudal and commensal-gut mutualism in Drosophila. Science. 319 (5864), 777-782 (2008).
- Sieuwerts, S., De Bok, F. A. M., Mols, E., De Vos, W. M., Van Hylckama Vlieg, J. E. T. A simple and fast method for determining colony forming units. Letters in Applied Microbiology. 47 (4), 275-278 (2008).
- Eckburg, P. B., et al. Diversity of the human intestinal microbial flora. Science. 308 (5728), 1635-1638 (2005).
- Newell, P. D., Douglas, A. E. Interspecies interactions determine the impact of the gut microbiota on nutrient allocation in Drosophila melanogaster. Applied and Environmental Microbiology. 80 (2), 788-796 (2013).
- Costello, E. K., et al. Bacterial community variation in human body habitats across space and time. Science. 326 (5960), 1694-1697 (2009).
- Fadrosh, D. W., et al. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform. Microbiome. 2 (1), 6 (2014).
- Vega, N. M., Ludington, W. B. From a parts list to assembly instructions and an operating manual: How small host models can re-write microbiome theory. Current Opinion in Microbiology. 64, 146-151 (2021).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. -. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10, 1998-2009 (2016).
- Sundarraman, D., et al. Higher-order interactions dampen pairwise competition in the zebrafish gut microbiome. mBio. 11 (5), 1-15 (2020).
- Douglas, A. E. Simple animal models for microbiome research. Nature Reviews Microbiology. 17, 764-775 (2019).
- Friedman, J., Higgins, L. M., Gore, J. Community structure follows simple assembly rules in microbial microcosms. Nature Ecology & Evolution. 1, 0109 (2017).
- Gilchrist, J. E., Campbell, J. E., Donnelly, C. B., Peeler, J. T., Delaney, J. M. Spiral plate method for bacterial determination. Applied Microbiology. 25 (2), 244-252 (1973).
- Thomas, P., Sekhar, A. C., Upreti, R., Mujawar, M. M., Pasha, S. S. Optimization of single plate-serial dilution spotting (SP-SDS) with sample anchoring as an assured method for bacterial and yeast cfu enumeration and single colony isolation from diverse samples. Biotechnology Reports. 8, 45-55 (2015).
- Nuñez, I., et al. Low cost and open source multi-fluorescence imaging system for teaching and research in biology and bioengineering. PLoS One. 12 (11), 0187163 (2017).
- Putman, M., Burton, R., Nahm, M. H. Simplified method to automatically count bacterial colony forming unit. Journal of Immunological Methods. 302 (1-2), 99-102 (2005).
- Ashburner, M. . Drosophila. A Laboratory Handbook. , (1989).
- Dodge, R., et al. A gut commensal niche regulates stable association of a multispecies microbiota. bioRxiv. , (2021).
- Obadia, B., et al. Probabilistic invasion underlies natural gut microbiome stability. Current Biology. 27 (13), 1999-2006 (2017).
- Vega, N. M., Gore, J. Stochastic assembly produces heterogeneous communities in the Caenorhabditis elegans intestine. PLoS Biology. 15 (3), 2000633 (2017).
- Jaime, M., et al. The high-throughput WAFFL system for treating and monitoring individual Drosophila melanogaster adults. bioRxiv. , (2018).
- Ren, C., Webster, P., Finkel, S. E., Tower, J. Increased internal and external bacterial load during Drosophila aging without life-span trade-off. Cell Metabolism. 6 (2), 144-152 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon