Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Antikanser Aptamerinin Seçiciliğini ve Özgüllüğünü Değerlendirmek için Akış Sitometrisine Dayalı Hücre Yüzeyi Protein Bağlama Testi
Bu Makalede
Özet
Antikanser aptamer gelişiminde gerekli bir adım, hedefe bağlanmasını test etmektir. Bu bağlanmayı incelemek için akış sitometrik tabanlı bir tahlil gösteriyoruz ve negatif bir kontrol aptamer ve bu belirli protein için pozitif veya negatif olan kanser hücrelerinin dahil edilmesinin önemini vurguluyoruz.
Özet
Bir antikanser aptamer geliştirmede önemli bir zorluk, geliştirilen aptamerin hedef proteine seçiciliğini ve özgüllüğünü etkili bir şekilde belirlemektir. Monoklonal antikorlara göre çeşitli avantajları nedeniyle, aptamer gelişimi kanser araştırmacıları arasında muazzam bir popülerlik kazanmıştır. Ligandların üstel zenginleştirme (SELEX) ile sistematik evrimi, ilgilenilen proteinlere özgü aptamerler geliştirmenin en yaygın yöntemidir. SELEX'i takiben, hızlı ve etkili bir bağlama testi, aptamerin seçiciliğini ve özgüllüğünü doğrulayarak tanımlama sürecini hızlandırır.
Bu yazıda, epitelyal hücresel adezyon molekülü (EpCAM) için spesifik bir aptamerin adım adım akış sitometrik tabanlı bağlanma testi açıklanmaktadır. Transmembran glikoprotein EpCAM çoğu karsinomda aşırı eksprese edilir ve kanser başlangıcı, progresyonu ve metastazda rol oynar. Bu nedenle, tümörlere hedefe yönelik ilaç dağıtımı için değerli bir adaydır. Aptamerin membrana bağlı EpCAM'e seçiciliğini ve özgüllüğünü değerlendirmek için, EpCAM-pozitif ve -negatif hücreler gereklidir. Ek olarak, EpCAM bağlayıcı aptamer'e benzer uzunlukta ve 2 boyutlu (2D) yapıya sahip bağlayıcı olmayan bir EpCAM aptamer gereklidir. Bağlama tahlili farklı tamponlar (blokaj tamponu, yıkama tamponu, inkübasyon tamponu ve FACS tamponu) ve inkübasyon adımlarını içerir.
Aptamer, hücre hatları ile inkübe edilir. Kuluçka ve yıkama adımlarını takiben, hücreler hassas bir akış sitometri testi kullanılarak değerlendirilecektir. Sonuçların analizi, EpCAM'e özgü aptamerin EpCAM-negatif hücrelere değil, EpCAM-pozitif hücrelere bağlandığını göstermektedir. EpCAM-pozitif hücrelerde bu, bağlanmayan aptamer kontrolüne kıyasla EpCAM aptamer'in sağa bağlanmasında bir bant kayması olarak tasvir edilir. EpCAM-negatif hücrelerde, karşılık gelen EpCAM bağlayıcı ve -bağlanmayan aptamer bantları üst üste biner. Bu, EpCAM aptamerinin seçiciliğini ve özgüllüğünü gösterir. Bu protokol EpCAM aptamerine odaklanırken, protokol yayınlanan diğer aptamerler için geçerlidir.
Giriş
Kanser hala dünya çapında mortalitenin önde gelen nedenlerinden biridir1. Son yıllarda kanser tedavisindeki önemli iyileşmeye rağmen, antikanser ilaç geliştirme hala çok tartışılan bir konudur. Bunun nedeni, kanser tedavisinin temel dayanağı olan kemoterapiye, hastanın tedaviye uyumunu sınırlayan ciddi yan etkilerin eşlik etmesidir. Ayrıca, kemoterapiye bağlı kanserin tedaviye direnci, tıbbi müdahalenin tek tercihi olarak uygulanmasını kısıtlamıştır. Monoklonal antikorların (mAbs) uygulanması, kanser tedavilerine gelişmiş bir yanıtgetirmiştir 2. mAbs kullanmanın mantığı, kemoterapötiklerin etkinliğini artırmak ve advers reaksiyonlarını en aza indirmekti. Bununla birlikte, mAbs'lerin yönetimi de bir zorluk haline geldi. Bu sadece mAb kaynaklı immünolojik reaksiyonlardan değil, aynı zamanda hayvana bağımlı ve pahalı üretim maliyetlerinden ve zorlu depolama koşullarından da kaynaklanıyordu3. 1990'larda aptamerlerin tanıtılması4 , kanser tedavisinde yeni umutlar yarattı, çünkü aptamerlerin uygulanması mAbs ile ilgili zorlukları ele alabilir.
Aptamerler, belirli bir hedef için özel olarak üretilen kısa nükleik asit dizileridir. Ligandların üstel zenginleştirme (SELEX) ile sistematik evrimi, aptamer üretiminde yaygın bir yöntemdir. SELEX'te, ilgilenilen protein, rastgele nükleotid dizilerinden oluşan bir kütüphane ile inkübe edilir ve bir dizi yinelemeli döngü yoluyla, bu protein için spesifik aptamer saflaştırılır. Aptamerler, mAb'lere benzer hedef seçiciliğe ve özgüllüğe sahiptir ve bu nedenle bu alandaki ilaç geliştirme, gelecekteki umut verici uygulamaları göstermektedir. Kanser biyobelirteçlerine özgü aptamerler tek ilaç ve kanser tanı araçları olarak uygulanabilir 5,6,7. Nano boyutlu yapıları nedeniyle, bu aptamerler ayrıca sitotoksik ajanları özellikle tümöre vermek için ilaç taşıyıcıları olarak da işlev görebilir8. Bu, hedeflenen ilaç dağıtımının etkinliğini artıracak ve kemoterapi ile ilişkili, hedef dışı advers reaksiyonları azaltacaktır. Dahası, bu nanoilaçlar yüksek doku penetrasyonuna sahiptir, bu da onları derin tümör ilaç dağıtımı ve tedavisi için arzu edilen bir aday haline getirir. Aptamerler ayrıca beyin tümörlerine ilaç dağıtımını iyileştirmek için kan-beyin bariyerinde (BBB) ifade edilen taşıyıcıları hedeflemek üzere tasarlanabilir9. Böyle bir aptamerin iyi bir örneği, BBB boyunca ilaç dağıtımını arttırmak için transferrin reseptörünü (TfR)10 hedefleyen ve tümör hücrelerine sitotoksik bir ilaç yükü veren iki işlevli aptamerlerdir11.
Aptamers'ın tüm avantajlarına rağmen, bu alandaki ilaç geliştirme henüz pazarlanmış, başarılı bir antikanser ilacı vermemiştir. Bunun bir nedeni, alandaki araştırmacılar tarafından küresel olarak takip edilebilecek standart ve tekrarlanabilir yöntemlerin eksikliği olabilir. Bu yazıda, hücre yüzeyinde eksprese edilen doğal bir proteine bağlanan bir aptamerin adım adım protokolü gösterilmiştir. Bu protokol, antikanser aptamerlerinin klinik öncesi değerlendirmesinde ön koşul adımıdır. Tahlil, seçicilik ve özgüllüğün doğrulanması için SELEX'ten toplanan saflaştırılmış aptamerin veya yayınlanmış bir aptamer dizisinin seçiciliğini ve özgüllüğünü göstermek için yapılır. Bu akış sitometrik tabanlı tahlil, aptamerin hücre yüzeyindeki proteinlere karşı test edildiği aptamerin seçiciliğini ve özgüllüğünü doğru bir şekilde gösteren hızlı, güvenilir, hassas bir tahlildir12,13,14. Bu yöntem, bu makalede gösterilen EpCAM için spesifik bir aptamerin bağlanması kullanılarak gösterilmiştir15. EpCAM, bir transmembran glikoprotein olarak, tümör hücresi sinyalizasyonu, progresyonu, migrasyon ve metastazda rol oynar16,17. Bu aptamerin seçiciliğini ve özgüllüğünü göstermek için EpCAM-pozitif ve -negatif kanser hücreleri kullanıldı. Daha önce geliştirilen EpCAM'e özgü aptamer, TEPP (5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′) ve negatif kontrol aptameri TENN (5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3), sırasıyla10 EpCAM bağlayıcı ve -bağlayıcı olmayan aptamers olarak kullanılmıştır. Hem TEPP hem de TERN'in 3' ucu bir TYE665 florofor ile etiketlendi.
TEPP, bir uçtan EpCAM'i ve diğer uçtan TfR'yi hedefleyen iki işlevli bir aptamerdir. Bu, TEPP'yi EpCAM + beyin tümörlerine ilaç dağıtımı için uygun bir aday haline getirmiştir. TEPP, TfR'ye özgü ucunu kullanarak kan-beyin bariyerini geçer ve EpCAM'e özgü ucu kullanarak tümörü bulur ve kargosunu (örneğin, sitotoksik ilaçlar) tümöre iletir. TERN, TEPP ile benzer bir uzunluğa ve 2D yapıya sahiptir, ancak EpCAM veya TfR için afiniteye sahip değildir ve bu nedenle uygun bir negatif kontrol aptameridir. TEPP ve TENN kullanılarak, bir aptamerin hedef proteine bağlanmasının akış sitometrisi kullanılarak test edilmesi bu makalede gösterilmiştir. Bu protokol, hücreye özgü aptamerlerin gelişimi için geçerlidir. Ayrıca literatürde mevcut olan aptamer dizilerinin tamamlayıcı ve doğrulama analizleri için de geçerlidir. Protokol, daha önce yayınlanmış bir aptamer'ı araştırma ve geliştirme (Ar-Ge) amaçları için kullanmayı düşünen aptamer alanında yeni olanlar tarafından da kullanılabilir. Bu yazıda literatürde mevcut olan iki aptamer dizisi incelenmiştir.
Protokol
NOT: Deneye başlamadan önce, laboratuvar önlüğü, eldiven ve gözlük dahil olmak üzere kişisel koruyucu ekipman giyin. Bu protokolde kullanılan malzemeler, reaktifler, ekipman ve yazılımlar hakkında ayrıntılar için Malzeme Tablosu'na bakın.
1. Tahlil için gerekli tamponlar
- Bu deney için gerekli tamponları (aptamer katlama için gerekli olan SELEX tamponu, Blokaj Tamponu (BB), Yıkama Tamponu (WB) ve Bağlayıcı Tampon (BiB) (Tablo 1) - deney gününde taze olarak hazırlayın ve buz üzerinde veya 4 ° C'de tutun.
NOT: Her aptamer benzersiz bir katlama koşulu gerektirir. Buna SELEX tamponu ve katlanma sıcaklığı koşulları dahildir. aptamer10'u tanımlayan orijinal makaledeki yöntemlerin tamamen çoğaltılmasına özen gösterilmelidir. Bu deneyde, tüm tamponlar Dulbecco'nun fosfat tamponlu salininde (DPBS) hazırlanır. Her deneyde gereken arabellek hacmi, hücre çizgilerinin sayısına, replikasyon sayısına ve test edilen aptamer konsantrasyonlarının sayısına bağlıdır.
| Malzemeler | Gerekli hacim | ||
| Madde | Konsantrasyon | ||
| SELEX tampon | MgCl2 | 5 mM | Numune başına 50 μL + %10 pipetleme hatası |
| Arabelleği Engelleme | MgCl2 | 5 mM | Hücre hattı başına 500 μL |
| BSA a | 1 mg/mL | ||
| tRNA b | 0.1 mg/mL | ||
| FBS c | %10 (d/d) | ||
| Yıkama Tamponu | MgCl2 | 5 mM | İlk yıkama için 1 mL + Test numunesi başına 100 μL + %10 pipetleme hatası |
| Bağlama Arabelleği | MgCl2 | 5 mM | Numune başına 50 μL + %10 pipetleme hatası |
| BSA | 2 mg/mL | ||
| tRNA | 0.2 mg/mL | ||
| FBS (Serbest Dolaşım | %20 (d/d) | ||
Tablo 1: Bağlama testi için gerekli tamponlar. a Sığır Serum Albümini, bTransfer Ribonükleik Asit, cFetal Sığır Serumu.
2. Aptamerlerin hazırlanması
NOT: Tahlilde kullanılan aptamerler bir floresan muhabir molekülü ile etiketlenmiştir ve bu nedenle onları ışıktan korumak için özen gösterilmelidir.
- Deneyden önce, pirojenik ve RNaz içermeyen ultra saf su kullanarak 100 μM'lik bir test ve kontrol aptamers stoğu (stok A) hazırlayın (Şekil 1).
NOT: Uzun süreli koruma için, stok A, -20 ° C'de bir dondurucuda tutulmalıdır. - SELEX tamponu kullanarak stok A'yı seyrelterek stok B'yi aptamerlerin çalışma konsantrasyonu olarak hazırlayın (Tablo 1). Bu protokolü takip etmek için, stok A'yı 1.000 nM'lik bir stoka seyrelterek B stoğunu hazırlayın (Şekil 1).
- Aptamer'i 3 boyutlu (3D) yapının oluşumuna hazır hale getirmek için, 250 μL'lik bir tüpte, katlama için aptamerin gerekli hacmini ve konsantrasyonunu hazırlamak için stok B'yi SELEX tamponu ile seyreltin.
NOT: Katlanmış aptamerler eşit miktarda hücreye maruz kalacaktır. Bu nedenle, katlama için ayarlanan aptamer konsantrasyonu, istenen nihai konsantrasyondan 2 kat daha konsantre olmalıdır. Gerekli hacimleri ve konsantrasyonları hesaplamak için denklem (1)'i kullanın. Pipetleme hatası için fazladan %10'luk bir hacim kullanmayı unutmayın.
Konsantrasyon stoğu A × Hacim stoğu A = Konsantrasyon stoğu B × Hacim stoğu B (1)
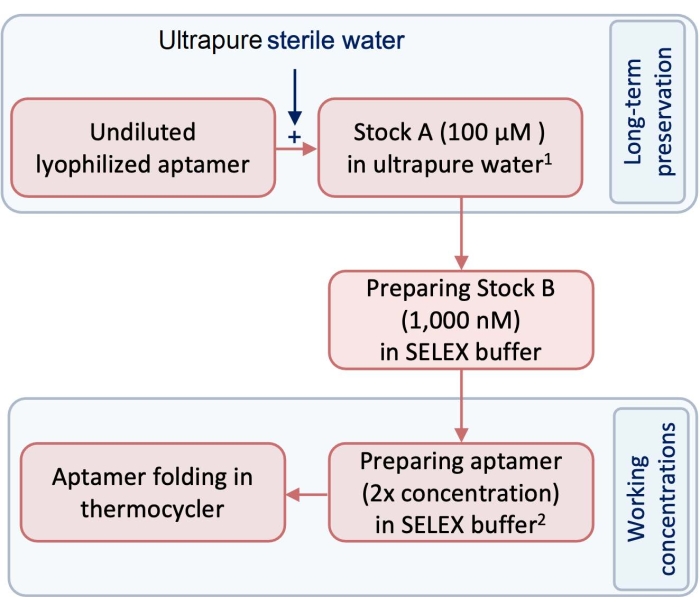
Şekil 1: Aptamerlerin hazırlanmasındaki adımları gösteren bir diyagram. 1 Stok 1, uzun süreli koruma için -20 ° C'de saklanır. 2 adet Çalışma konsantrasyonları SELEX tamponunda hazırlanır ve depolanmaz. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Kanser hücrelerinin bakımı
NOT: Çalışmaya başlamadan önce, hücrelerin erken geçiş sayılarında olduklarından, tipik morfolojik özelliklerini gösterdiklerinden ve mikoplazmasız olduklarından emin olun. Aptamerin seçiciliğini ve özgüllüğünü test etmek için, ilgilenilen proteinin yüksek, orta ve düşük / negatif ekspresyonları olan hücre çizgileri ideal olarak gereklidir.
- Hücreleri uygun kültür koşullarını kullanarak bir T75 kültür şişesinde tohumlayın. Onları 37 ° C'de% 5 CO2 nemlendirilmiş inkübatörde büyütün.
NOT: Bu çalışmada, %10 fetal sığır serumu (tam ortam) ile desteklenmiş Dulbecco'nun Modifiye Kartal Ortamı (DMEM) kullanılmıştır. - Hücreler ~% 80 akıcılığa ulaştığında, onları taze tam ortam içeren yeni bir şişeye geçirin.
NOT: İlgilenilen proteine ve hücre hattına bağlı olarak,% 80 akıcılık, bağlanma testi için uygun bir hücre popülasyonu sağlayabilir. Bu deneydeki hücre hatları için, MDA-MB-231 ve HEK 293T,% 80 akıcılık uygundur. Bu aşamada, bağlayıcı tahlil olan bölüm 4'e geçin. Her zaman ilgilenilen proteinin ekspresyonunu kontrol edin, bu proteine özgü mAbs kullanarak.
4. Bağlayıcı tahlil
NOT: Şekil 2 , yapışkan hücrelerdeki bağlama tahlilinde gerekli adımları özetlemektedir.
- Sınıf II biyogüvenlik kabininde, her şişenin hücrelerini tüplerde aşağıdaki gibi toplayın:
- Şişedeki medyayı toplayın ve atın, 2 mL PBS ekleyin, hücrelerin üzerine yayın ve ardından PBS'yi toplayıp atın. Tripsini devre dışı bırakabilecek tüm ortam izlerini kaldırmak için bu adımı iki kez daha tekrarlayın. Her şişeye 1 mL% 0.25 tripsin / EDTA ekleyin ve 37 oC'de 5-10 dakika kuluçkaya yatırın.
- Hücrelere 1 mL tam ortam ekleyin ve tek hücreli bir süspansiyon oluşturmak için hücreleri yukarı ve aşağı pipetleyin. Hücreleri uygun bir tüpe pipetleyin ve 5 dakika boyunca 200 × g'da santrifüj yapın.
NOT: Yapışkan olmayan hücreler için, hücreleri bir tüp içinde toplayın, santrifüj yapın (200 × g, 5 dakika) ve adım 4.1.3'e geçin. - Süpernatantı atın ve hücreleri 1 mL taze ortamda yeniden askıya alın. Tripan mavisi boyamasını kullanarak, belirli bir hücre süspansiyonu hacmini tripan mavisi ile seyrelterek hücreleri sayın. Karışımın ~ 15 μL'sini bir hemositometre ve bir kapak camı arasında dağıtın. Denklem (2)'yi kullanarak hücreleri daha önce açıklandığı gibi18 sayın:
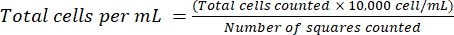 (2)
(2)
NOT: Mümkün olan en düşük hücre süspansiyonu hacmini kullanın ve seyreltme faktörünü not alın. Örneğin, eşit hacimlerde hücre süspansiyonu ve% 0.04 tripan mavisinin karıştırılması, 2'lik bir seyreltme faktörü verir. Devam etmeden önce çoğu yapışkan hücre hattı için ~% 90'lık yüksek canlılık (canlı hücreler / toplam hücreler × 100) sağlayın. Ölü hücreler spesifik olmayan aptamerleri alır ve sonuçları değiştirir19. Hücre sayacı kullanmak gibi diğer hücre sayma tekniklerini kullanmak mümkündür. - Test örneği başına 10 × 104 hücreye sahip olduğunuzdan emin olarak gerekli sayıda hücreyi toplayın. Pipetleme hatası için fazladan %10'luk bir hacim düşünün.
NOT: Deneyler ve çoğaltmalar arasında her zaman aynı hücre sayısını korumak önemlidir. - Enzimatik ayrılmayı takiben hücre zarı üzerindeki ilgili proteinin stabilizasyonuna izin vermek için hücreleri 2 saat boyunca 37 ° C'de inkübe edin.
NOT: Bu kuluçka süresi, ilgilenilen proteine göre farklılık gösterebilir.
- Bu 2 saatlik inkübasyon sırasında:
- Santrifüjün sıcaklığını 4 °C'ye ayarlayın. Çözülmesi için tRNA ve aptamer stoklarını oda sıcaklığında veya buz üzerinde bırakın. Floresan muhabir molekülünü korumak için, aptamer tüplerini ışıktan koruyun.
NOT: tRNA'nın rolü, nükleik asit bağlanma bölgelerini bloke etmektir. - SELEX tamponu, BB, WB ve BiB'yi hazırlayın (bkz. bölüm 1), hepsini buz üzerinde veya 4 °C'de tutun. Termosikler makinesini boş bir döngüye ayarlayın. Buzun üzerine 96 delikli siyah bir plaka ve akış sitometri tüpleri yerleştirin.
NOT: Termosikler'i boş bir döngüye ayarlamak, soğutma ve ısıtma sistemini hazırlar ve daha tekrarlanabilir sonuçlar üretmeye yardımcı olur.
- Santrifüjün sıcaklığını 4 °C'ye ayarlayın. Çözülmesi için tRNA ve aptamer stoklarını oda sıcaklığında veya buz üzerinde bırakın. Floresan muhabir molekülünü korumak için, aptamer tüplerini ışıktan koruyun.
- 2 saatlik inkübasyonu takiben, hücreleri 5 dakika boyunca 500 × g'da santrifüj edin. Süpernatantı atın ve hücreleri 500 μL BB'de yeniden askıya alın. Hücreleri aralıklı karıştırma ile 30 dakika boyunca 4 ° C'de inkübe edin.
- Bu 30 dakikalık inkübasyon sırasında, aşağıdaki gibi aptamer katlama işlemi gerçekleştirin:
- Aptamerlerin 2x konsantrasyonlarını oluşturun (bakınız bölüm 2) ve daha sonra gerekli katlama koşullarına göre aptamerleri termosikler makinesinde karıştırın ve inkübe edin. Bu EpCAM aptamer için, 95 ° C, 5 dakika, ardından 22 ° C, 10 dakika ve 37 ° C, 15 dakika aşağıdaki katlama koşullarını kullanın.
NOT: Her zaman negatif bir kontrol ekleyin (yani, aptamersiz SELEX tamponu).
- Aptamerlerin 2x konsantrasyonlarını oluşturun (bakınız bölüm 2) ve daha sonra gerekli katlama koşullarına göre aptamerleri termosikler makinesinde karıştırın ve inkübe edin. Bu EpCAM aptamer için, 95 ° C, 5 dakika, ardından 22 ° C, 10 dakika ve 37 ° C, 15 dakika aşağıdaki katlama koşullarını kullanın.
- 30 dakikalık inkübasyonu takiben, hücreleri santrifüj edin (500 × g, 5 dakika, 4 ° C), süpernatanı çıkarın, 1 mL WB ekleyin ve hücreleri tekrar santrifüj edin (500 × g, 5 dakika, 4 ° C). Süpernatantı çıkarın ve hücreleri BiB'nin uygun bir hacminde yeniden askıya alın.
- Pipet, yeniden askıya alınan hücrelerin 50 μL'sini buz gibi soğuk, 96 delikli siyah bir plakanın her bir kuyucuğuna yerleştirin. İlgilenilen proteinin içselleştirilmesini engellemek için hücreleri buz üzerinde tutun.
- Aptamerlerin 50 μL'lik pipeti, 50 μL'lik bir hücre hacmine koyun, karıştırın ve 30 dakika boyunca 4 ° C'de karanlıkta inkübe edin. Plakayı 500 × g, 5 dakika, 4 ° C'de santrifüj yapın ve süpernatanı dikkatlice çıkarın.
- Peleti WB'de dikkatlice askıya alın ve 5 dakika boyunca 500 × g'da santrifüj yapın. Yıkama adımını (4,7) 2 kat tekrarlayın ve akış sitometrik analizi için 100 μL WB'de yeniden askıya alın.
NOT: Aptamerler ve hücreler arasındaki etkileşimlerin diyagramı için Şekil 3'e bakınız.

Şekil 2: Bir aptamer-protein-bağlayıcı tahlil gerçekleştirmedeki adımları gösteren bir diyagram. Kısaltmalar: SELEX = Dışsal Zenginleştirme ile Ligandların Sistematik Evrimi; BB = Engelleme Arabelleği; WB = Yıkama Tamponu; BiB = Bağlama Arabelleği. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: aptamer bağlama testini gerçekleştirmek için gereken farklı hücre tiplerini ve aptamerleri gösteren bir diyagram. Kısaltma: EpCAM = epitel hücresel adezyon molekülü. Bu rakam Biorender.com kullanılarak oluşturulmuştur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. Akış sitometrisi ve veri analizi
NOT: Akış sitometresini açmadan önce, membran filtre ünitelerinde kapatma çözeltisi, temizleme çözeltisi ve kılıf sıvısı (%0,9 NaCl) için "kabarcık" olmadığından emin olun. Kapsüllerde kabarcıklar varsa "Kanama" kabarcıkları. Atık kabının boş olduğundan ve kılıf sıvısı, su ve% 1 çamaşır suyu kaplarının ultra saf suda dolu olduğundan emin olun.
- Akış sitometresini ve ardından bilgisayarı açın.
NOT: Burada açıklanan akış sitometresini çalıştırmanın ayrıntıları, videoda gösterilen makine ve yazılıma özgüdür (bkz. Diğer yazılımların kullanımı için uygun eğitim gerekir. - Akış sitometrisi analiz yazılımını açın, programda oturum açın ve Sitometre sekmesi altında Fluidics Start up komutunu çalıştırın.
- Yeni bir deneme oluşturmak için, deneme sekmesinin altında Yeni Klasör'ü tıklatın ve klasörü/denemeyi uygun şekilde adlandırın.
- Vurgulamak için yeni klasörü tıklayın, ardından deneme sekmesinin altında tekrar Yeni Deneme'yi tıklayın ve denemeyi uygun şekilde adlandırın.
- İlk numuneyi/numuneyi eklemek için, deneme sekmesinin altında Yeni Örnek'e tıklayın ve bu örneği uygun şekilde adlandırın (hücre hattı/kontrol örneği/deney örneği adı).
- Bir tüp örneği eklemek için, numuneyi (grup) vurgulayın ve deneme sekmesinin altında Yeni Tüp'ü tıklatın. Uygun sayıda tüp ve ad ekleyin.
- Gerekli grafikleri hazırlamak için, çalışma sayfası sekmesinin altında yeni bir çalışma sayfası açın. Yeni çalışma sayfası penceresi açıldığında, çalışma sayfası ekranını kullanarak aşağıdakileri açın (adları bulmak için fareyi logonun / resimlerin üzerine getirin):
- İlgilenilen popülasyonu seçmek için ileri dağılım (FSC) ve yan dağılım (SCC) noktalı bir leke grafiği hazırlayın. Bir ileri ve yan dağılım yoğunluğu grafiğinde ilgilenilen popülasyonu (P1) tanımlayarak ve seçerek ilk kapıyı tanımlayın. En düşük ileri saçılma sinyaline sahip popülasyonu oluşturan enkazı hariç tutun.
NOT: FSC parametresi hücreleri veya olayları boyutlarına göre algılar ve SCC bunları ayrıntı düzeyi20'ye göre ayırır. - Tek hücreli popülasyonu seçmek için FSC alanı (FSC-A) ile FSC yüksekliği (FSC-H) arasında bir nokta lekesi grafiği hazırlayın. Çifte hücre popülasyonlarını hariç tutarak ikinci kapıyı tanımlayın, çünkü çift hücreler sonuçları ve sonuçları önemli ölçüde etkiler. Aynı boyuttaki hücrelerin benzer bir alan ve yükseklik gösterdiği FSC-H ve FSC-A yoğunluk grafiklerini kullanarak çiftleri hariç tutun. Bu nedenle, tekiller çapraz olarak kümelenir ve çiftlerden ayrılır.
NOT: FSC kabaca hücre boyutuyla orantılıdır. Gerilim darbeleri FSC-H, sinyalin yoğunluğu, hücre boyutunu ve sinyalin süresini yansıtan FSC-genişliği ve H × W olan FSC-A olarak tanımlanır; bu nedenle, tekiller için geçit, çiftlerin neden olduğu H, W ve A arasındaki orantısızlıkları tespit etmeye dayanır. - İlgilenilen florofora karşı olay sayısının histogramını hazırlayın.
- İlgilenilen popülasyonu seçmek için ileri dağılım (FSC) ve yan dağılım (SCC) noktalı bir leke grafiği hazırlayın. Bir ileri ve yan dağılım yoğunluğu grafiğinde ilgilenilen popülasyonu (P1) tanımlayarak ve seçerek ilk kapıyı tanımlayın. En düşük ileri saçılma sinyaline sahip popülasyonu oluşturan enkazı hariç tutun.
- Akış sitometrisine başlamadan önce, voltaj parametrelerini ayarlamak için numune alımını, denetçiyi ve sitometreyi kontrol etmek için alım panosunun ve tüm grafiklerin bulunduğu çalışma sayfasının açık olduğundan emin olun.
NOT: Analizi gerçekleştirmek için bir akış sitometri tüpünde 10 × 104 hücreli bir süspansiyonun en az 100 μL'si gereklidir. Özellikle daha düşük canlılıklar durumunda, canlı hücre popülasyonu21,22'yi seçmek için propidium iyodür boyama yapılabilir. - İlk örneği çalıştırmak için, ekranın sol tarafında, tüpe işaret eden okun yeşil olduğundan emin olun. Bu ok yeşil değilse, yeşil yapmak için oka tıklayın.
- Bir pipet kullanarak, her bir numuneyi 96 delikli siyah plakadan bir akış sitometri tüpüne aktarın. İşlenmemiş, lekesiz kontrol örneğini düşük hızda çalıştırın.
- Edinme panosunda, kaydedilecek uygun sayıda olay seçin (30.000), akış hızını düşük olarak değiştirin ve Veri Al'a tıklayın.
- FSC ve SCC parametreleri için voltajı ayarlayın. Hücre popülasyonunun nokta grafiği içinde merkezileştirildiğinden ve ilgilenilen hücreleri kaybetmemek için hiçbir hücrenin grafiğin her iki eksenine de dokunmadığından emin olun.
- Örnekleri daha hızlı analiz etmek için alım hızını orta veya yüksek seviyeye yükseltin, ancak 200'den fazla olayı / s'yi aşmayın. Ardından, Verileri Kaydet'i tıklatın.
- P1 (Şekil 4A) ve tek hücreli popülasyon (Şekil 4B) için geçit gerçekleştirin. Kullanılan florokroma karşı olayların histogramını oluşturun ve verilere dayanarak P1'i seçin (bu durumda allofikosiyanin (APC)) (Şekil 4C).
- Voltajı ayarladıktan sonra, verileri geçit ve kaydettikten sonra, numuneyi çıkarın ve Sonraki Tüp'e tıklayın.
- Bir sonraki örneği ekleyin ve tüm kontrol ve test örnekleri için kayıt verilerini tekrarlayın (Şekil 3).
- Tüm veriler toplandıktan sonra, akış sitometresini, her biri 5 dakika boyunca yüksek bir akış hızında üç tüp ağartıcı, FACS durulama ve ultra saf su çalıştırarak yıkayın.
- Ardından, Sitometre açılır menüsünden Fluidics Shut Down'ı (Akışkanlar Kapat) tıklayın.
- Yazılımı kapatmadan ve makineyi ve bilgisayarı kapatmadan önce, sonuçları aşağıdaki gibi aktarmak ve analiz etmek için bir USB sürücüsüne .fcs dosyaları olarak dışa aktarın:
- Analiz yazılımında, analizi işlemek üzere yeni bir belge ve pencere oluşturmak için YENİ düğmesine basın. Örnek dosyaları yeni pencereye sürükleyin.
- Lekesiz örneği açmak için çift tıklatın. P1 popülasyonunu seçin, FSC-H ve FSC-A grafiği oluşturmak için P1 popülasyonuna çift tıklayın ve tek hücreli popülasyonu geçin.
- Kullanılan florokroma karşı olayların histogramını oluşturmak için kapılı tek hücrelere çift tıklayın.
- Orijinal pencerede, P1 ve tek hücreleri seçin ve tüm örneklerin artık aynı geçidi içermesi için bunları Tüm Örnekler'e sürükleyin.
- Mizanpajlar penceresini açmak için Mizanpaj Düzenleyicisi düğmesine tıklayın. Bindirme histogramı oluşturmak için iki örneği (kontrol ve test) birbirinin üzerine sürükleyin.
Sonuçlar
Yeni ilaç keşfi ve geliştirilmesinin önemli bir yönü, ilaç adayının seçiciliğini ve özgüllüğünü sağlamaktır. Bu, ilaç adayının farklı hücreler arasında ayrım yapabilmesi ve yalnızca ilgilenilen hücre popülasyonunu (seçicilik) etkilemesi gerektiği anlamına gelir. Seçicilik, ilgilenilen proteinin ekspresyonu açısından farklılık gösteren hücre hatları kullanılarak incelenir. Bu çalışmada MDA-MB-231 ve HEK 293T hücre hatları EpCAM-pozitif ve -negatif hücreler olarak seçilmişt...
Tartışmalar
Yeni aptamers geliştirmenin temel zorluğu, bu sürecin farklı adımlarına uygulanan standart kılavuzların eksikliğidir. McKeague ve ark. son zamanlarda, yayınlardaki verilerin belirsiz sunumlarına ve araştırmanın çoğaltılamamasına yol açan bazı ilgili zorlukları göstermiştir. Aptamerlerin19'unu karakterize etmede dikkate alınması gereken temel kılavuzları önerdiler. Bir aptamer bağlama testi, alandaki araştırmacılar tarafından yaygın olarak kullanılan aptamers
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Zihinsel ve Fiziksel Sağlık ve Klinik Çeviri Enstitüsü (IMPACT) SEED finansmanını, Deakin Üniversitesi'ndeki "Alfred Deakin Doktora Sonrası Araştırma Bursu" programını ve "Avustralya Hükümeti Araştırma Eğitim Programı Bursu" nu kabul etmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes with attached lid | Sigma-Aldrich | T6649 | |
| 15 mL CellStar blue screw cap, conical bottom tube | Greiner Bio One | 188271 | |
| 5 mL serological pipettes | Greiner Bio One | 606180 | |
| BD FACSCanto II Flow Becton Dickinson Cytometer | Becton Dickinson | N/A | |
| BD FACSDiva V9.0 | BD Biosciences | N/A | |
| Bovine Serum Albumin (BSA), Lyophilized powder | Sigma-AldrichTM | A7906-50G | |
| Bright-line Hemocytometer | Sigma-Aldrich | Z359629 | |
| Dulbecco’s Modified Eagle Medium (DMEM) High Glucose Media Powder | Life Technologies | 12100046 | |
| Dulbecco’s Phosphate- Buffered Saline (DPBS) | Life Technologies | 21300025 | |
| FlowJo, LLC 10.8.1 | BD Biosciences | N/A | |
| Foetal Bovine Serum (FBS) | Bovogen | SFBS-F | |
| HEK293T | American Type Culture Collection | ACS-4500 | |
| Heracell 150i CO2 Incubator | Thermo Fisher Scientific | N/A | |
| Heraeus Megafuge 16R Centrifuge | Thermo Fisher Scientific | N/A | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M8266 | |
| MDA-MB-231 | American Type Culture Collection | CRM-HTB-26 | |
| Microplate, PS, 96 well, F-bottom (Chimney well), Black | Greiner Bio One | 655076 | |
| MiniAmp Thermal Cycler | Thermo Fisher Scientific | A37834 | |
| Phosphate-Buffered Saline (PBS) tablets | Life Technologies | 18912014 | |
| Pyrogen- and RNase-free ultrapure water | Milli-Q | ||
| T75 Cell Culture flask | Cellstar | 658170 | |
| TENN | Integrated DNA Technologies | N/A | 5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3 |
| TEPP | Integrated DNA Technologies | N/A | 5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′ |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8508-5X1ML | |
| Trypan Blue Solution | Life Technologies | 15250061 | |
| Trypsin-EDTA | Gibco | 15400054 |
Referanslar
- Cancer. World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cancer#:~:text=Cancer%20is%20a%20leading%20cause.and%20rectum%20and%20prostate%20cancers (2022)
- Liu, J. K. H. The history of monoclonal antibody development - Progress, remaining challenges and future innovations. Annals of Medicine and Surgery. 3 (4), 113-116 (2014).
- Nakhjavani, M., Shigdar, S. Future of PD-1/PD-L1 axis modulation for the treatment of triple-negative breast cancer. Pharmacological Research. 175, 106019 (2022).
- Bukari, B., Samarasinghe, R. M., Noibanchong, J., Shigdar, S. L. Non-invasive delivery of therapeutics into the brain: the potential of aptamers for targeted delivery. Biomedicines. 8 (5), 120 (2020).
- Wu, X., Chen, J., Wu, M., Zhao, J. X. Aptamers: active targeting ligands for cancer diagnosis and therapy. Theranostics. 5 (4), 322 (2015).
- Feng, X., et al. The aptamer functionalized nanocomposite used for prostate cancer diagnosis and therapy. Journal of Nanomaterials. 2022, (2022).
- Huang, J., et al. Advances in aptamer-based biomarker discovery. Frontiers in Cell and Developmental Biology. 9, 571 (2021).
- Ashrafuzzaman, M. Aptamers as both drugs and drug-carriers. BioMed Research International. 2014, (2014).
- Nakhjavani, M., Samarasinghe, R. M., Shigdar, S. Triple-negative breast cancer brain metastasis: an update on druggable targets, current clinical trials, and future treatment options. Drug Discovery Today. , (2022).
- Macdonald, J., et al. Development of a bifunctional aptamer targeting the transferrin receptor and epithelial cell adhesion molecule (EpCAM) for the treatment of brain cancer metastases. ACS Chemical Neuroscience. 8 (4), 777-784 (2017).
- Macdonald, J., et al. Bifunctional aptamer-doxorubicin conjugate crosses the blood-brain barrier and selectively delivers its payload to EpCAM-positive tumor cells. Nucleic Acid Therapeutics. 30 (2), 117-128 (2020).
- Shigdar, S., Agnello, L., Fedele, M., Camorani, S., Cerchia, L. Profiling cancer cells by cell-SELEX: use of aptamers for discovery of actionable biomarkers and therapeutic applications thereof. Pharmaceutics. 14 (1), 28 (2021).
- Rahimizadeh, K., et al. Development of cell-specific aptamers: recent advances and insight into the selection procedures. Molecules. 22 (12), 2070 (2017).
- Chen, M., et al. Development of cell-SELEX technology and its application in cancer diagnosis and therapy. International Journal of Molecular Sciences. 17 (12), 2079 (2016).
- Shigdar, S., et al. The use of sensitive chemical antibodies for diagnosis: detection of low levels of EpCAM in breast cancer. PLoS One. 8 (2), 57613 (2013).
- Ni, J., et al. Role of the EpCAM (CD326) in prostate cancer metastasis and progression. Cancer and Metastasis Reviews. 31 (3), 779-791 (2012).
- Ni, J., et al. Epithelial cell adhesion molecule (EpCAM) is associated with prostate cancer metastasis and chemo/radioresistance via the PI3K/Akt/mTOR signaling pathway. The International Journal of Biochemistry & Cell Biology. 45 (12), 2736-2748 (2013).
- McKeague, M., Kruse, P. F., Patterson, M. K., et al. . Tissue Culture. , 395-397 (1973).
- McKeague, M., et al. The minimum aptamer publication standards (MAPS guidelines) for de novo aptamer selection. Aptamers. 6, 10-18 (2022).
- Schoofs, G., Van Hout, A., D'huys, T., Schols, D., Van Loy, T. A flow cytometry-based assay to identify compounds that disrupt binding of fluorescently-labeled CXC Chemokine ligand 12 to CXC Chemokine receptor 4. Journal of Visualized Experiments. (133), e57271 (2018).
- McKinnon, K. M. Flow cytometry: an overview. Current Protocols in Immunology. 120 (1), 1-11 (2018).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglu, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Ruscito, A., DeRosa, M. C. Small-molecule binding aptamers: Selection strategies, characterization, and applications. Frontiers in Chemistry. 4, 14 (2016).
- McKeague, M., et al. Comprehensive analytical comparison of strategies used for small molecule aptamer evaluation. Analytical Chemistry. 87 (17), 8608-8612 (2015).
- Henri, J., Bayat, N., Macdonald, J., Shigdar, S. A guide to using nucleic acid aptamers in cell based assays. Aptamers. 23, (2019).
- Mao, H., et al. The mechanism and regularity of quenching the effect of bases on fluorophores: the base-quenched probe method. Analyst. 143 (14), 3292-3301 (2018).
- McKeague, M., et al. Analysis of in vitro aptamer selection parameters. Journal of Molecular Evolution. 81 (5), 150-161 (2015).
- Chen, B., et al. Targeting negative surface charges of cancer cells by multifunctional nanoprobes. Theranostics. 6 (11), 1887 (2016).
- Shigdar, S., et al. RNA aptamers targeting cancer stem cell marker CD133. Cancer Letters. 330 (1), 84-95 (2013).
- Amraee, M., Oloomi, M., Yavari, A., Bouzari, S. DNA aptamer identification and characterization for E. coli O157 detection using cell based SELEX method. Analytical Biochemistry. 536, 36-44 (2017).
- Yu, X. -. X., et al. Selection and characterization of a novel DNA aptamer, Apt-07S specific to hepatocellular carcinoma cells. Drug Design, Development and Therapy. 14, 1535 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır