È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Bendaggio aortico O-ring rispetto alla costrizione aortica trasversale tradizionale per modellare l'ipertrofia cardiaca indotta da sovraccarico pressorio
In questo articolo
Riepilogo
Il presente protocollo descrive una nuova tecnica di bendaggio aortico nei topi per indurre l'ipertrofia cardiaca da sovraccarico di pressione. Per le fascette, viene utilizzato un anello di gomma con un diametro interno fisso. Questa nuova tecnica promette meno varianza e dati più riproducibili per esperimenti futuri.
Abstract
Il banding aortico nei topi è uno dei modelli sperimentali più comunemente usati per l'ipertrofia cardiaca indotta da sovraccarico di pressione cardiaca e l'induzione dell'insufficienza cardiaca. La tecnica precedentemente utilizzata si basa su una sutura filettata attorno all'arco aortico legato su un ago smussato da 27 G per creare stenosi. Questo metodo dipende dal chirurgo che stringe manualmente il filo e, quindi, porta ad un'elevata varianza nella dimensione del diametro. Un metodo recentemente perfezionato descritto da Melleby et al. promette meno varianza e più riproducibilità dopo l'intervento chirurgico. La nuova tecnica, o-ring-aortic banding (ORAB), utilizza un anello di gomma antiscivolo invece di una sutura con un filo, con conseguente riduzione della variazione del sovraccarico di pressione e fenotipi riproducibili di ipertrofia cardiaca. Durante l'intervento chirurgico, l'o-ring viene posizionato tra le arterie brachiocefalica e carotide sinistra. La costrizione di successo è confermata dall'ecocardiografia. Dopo 1 giorno, il corretto posizionamento dell'anello determina un aumento della velocità del flusso nell'aorta trasversale sulla stenosi indotta dall'o-ring. Dopo 2 settimane, la funzione cardiaca compromessa è dimostrata dalla diminuzione della frazione di eiezione e dall'aumento dello spessore della parete. È importante sottolineare che, oltre a una minore varianza nella dimensione del diametro, l'ORAB è associato a tassi di mortalità intra e post-operatoria più bassi rispetto alla costrizione aortica trasversa (TAC). Pertanto, l'ORAB rappresenta un metodo superiore alla chirurgia TAC comunemente utilizzata, con risultati più riproducibili e una possibile riduzione del numero di animali necessari.
Introduzione
Mentre l'ipertrofia cardiaca fisiologica può essere osservata durante lo sviluppo, l'esercizio fisico e la gravidanza, l'ipertrofia cardiaca patologica risponde a condizioni di stress emodinamico come ipertensione arteriosa, cardiopatia valvolare o mutazioni genetiche. Inizialmente, il cuore subisce un rimodellamento caratterizzato da aumento delle dimensioni dei cardiomiociti e ispessimento delle pareti ventricolari per mantenere la funzione cardiaca 1,2. D'altra parte, il rimodellamento cardiaco patologico è associato ad un aumentato rischio di aritmia, morte improvvisa e alta mortalità. Infine, con il tempo, si traduce in dilatazione ventricolare, una forte diminuzione della funzione contrattile e un'eventuale progressione verso l'insufficienza cardiaca (HF), che è associata ad alta morbilità, mortalità e costi sociali3. Pertanto, vi è un urgente bisogno di comprendere il background molecolare al fine di sviluppare nuove strategie terapeutiche4.
Il bendaggio aortico è un modello che imita l'ipertrofia ventricolare sinistra (LV) indotta da sovraccarico di pressione e l'insufficienza cardiaca nei topi5. Con questo metodo, è possibile esaminare in vivo i meccanismi patologici del rimodellamento cardiaco indotto da sovraccarico di pressione. La prima procedura di banding aortico nei topi è stata riportata da Rockman et al.6. Il sovraccarico di pressione è indotto da una legatura basata sulla sutura del filo intorno all'aorta (tra l'arteria carotide brachiocefalica e quella comune sinistra). Per creare una stenosi di 0,4 mm di diametro, una sutura viene posizionata attorno a un ago da 27 G e all'aorta. Dopo la legatura, l'ago viene rimosso 6,7.
Anche se il diametro dell'ago è fisso, la tenuta del filo dipende fortemente dal chirurgo e, quindi, influenza il fenotipo indotto dell'ipertrofia cardiaca. Inoltre, nel metodo basato su fili/suture, vi è un grado variabile di diametro stenosi dopo l'intervento chirurgico, associato ad un'elevata varianza nella mortalità 8,9. Inoltre, l'allenamento di questo metodo è impegnativo, soprattutto per quanto riguarda la ricerca del giusto livello e coerenza nel serraggio del filo. Infine, all'inizio dell'allenamento, si verifica un'elevata mortalità intra e post-operatoria dovuta all'interruzione dell'aorta o ad altre lesioni tissutali, nonché un'elevata variazione nell'entità della stenosi negli animali sopravvissuti.
Recentemente, una procedura ottimizzata di banding aortico è stata descritta da Melleby et al.10. Hanno presentato il metodo ORAB (o-ring aortic banding) con meno varianza nella stenosi e livelli altamente riproducibili di sovraccarico di pressione utilizzando un o-ring in gomma antiscivolo con un diametro interno fisso di 0,71 mm, 0,66 mm e 0,61 mm. In breve, l'o-ring viene aperto, posizionato attorno all'arco ascendente e richiuso da fili. Altri scienziati che hanno utilizzato questi o-ring hanno riportato una minore variabilità nell'ipertrofia cardiaca indotta9. Hanno anche osservato mortalità intra e post-operatoria, nonché una migliore riproducibilità e una minore varianza nel fenotipo ipertrofico indotto 9,11. Il presente articolo descrive la procedura di questa strategia unica in un protocollo passo-passo. L'esperienza condivisa in questo rapporto aiuterà altri scienziati a migliorare le loro tecniche in questo settore.
Per indurre ipertrofia cardiaca con conseguente insufficienza cardiaca dopo 6 settimane, i topi maschi C57BL / 6N di 12 settimane sono raccomandati per la chirurgia. Un confronto 2 settimane dopo il banding aortico tra i sottoceppi di topo C57BL/6N e C57BL/6J ha mostrato una grave disfunzione cardiaca e un aumento associato della mortalità nei topi C57BL/6N. Pertanto, questi sono più adatti per i modelli di insufficienza cardiaca12. I topi maschi e femmine di dodici settimane hanno una dimensione ottimale per l'esposizione dell'aorta e il posizionamento dell'o-ring con strumenti speciali.
Protocollo
Gli esperimenti sugli animali sono stati condotti secondo i principi del comitato regionale (Ministerium für Energiewende, Landwirtschaft, Umwelt, Natur und Digitalisierung des Landes Schleswig-Holstein, numero di autorizzazione: V242-21249/2020 [38-4/20]). I topi utilizzati per il presente studio sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali). Gli animali sono stati tenuti in condizioni standard con un ciclo di 12 ore di luce, 12 ore di notte; Acqua e cibo erano offerti ad libitum.
1. Cura degli animali
- Ospita i topi in gabbie specializzate con lettiera, materiale di nidificazione, un nascondiglio e un accesso adeguato all'acqua potabile e al cibo.
- Mantenere gli animali sotto continuo controllo e trattamento veterinario specializzato.
NOTA: Per i topi ordinati da fornitori esterni, si prega di assicurare 7 giorni di acclimatazione prima di iniziare la procedura.
2. Preparazione dell'o-ring
NOTA: Si raccomanda un o-ring con un diametro fisso di 0,4 mm per indurre l'ipertrofia cardiaca dopo 2 settimane. L'estensione e la gravità del fenotipo cardiaco indotto dipendono dalla dimensione del diametro dell'o-ring.
- In primo luogo, eseguire un taglio dell'o-ring (vedi Tabella dei materiali) al microscopio usando le forbici o un bisturi per consentire il posizionamento intorno all'aorta (Figura 1A, B).
- Forare ogni lato dell'anello vicino al taglio con un ago collegato con un 8-0 sutura non assorbibile e tirare il filo. Tagliare e lasciare 2-3 cm su un lato e 2 cm sull'altro lato per fissare l'o-ring attorno all'aorta nella fase finale (Figura 1C, D).
- Prima dell'intervento chirurgico, prendere l'ausilio di legatura (strumento di specie, vedi Tabella dei materiali) e tirare l'estremità del filo (che viene mantenuto più a lungo) di un lato dell'anello attraverso il foro della costrizione (Figura 1E, F). Mettere da parte l'ausilio di legatura con l'o-ring attaccato per posizionarlo nella fase successiva (passaggio 6).
- Per la disinfezione dell'anello con i fili, posizionare l'anello in una soluzione alcolica per mezz'ora. Successivamente, adagiarlo sulla cellulosa per asciugare. Conservare l'anello essiccato in una vasca o custodia chiusa fino all'uso. Durante l'intervento chirurgico, dopo aver tirato il filo attraverso l'ausilio di legatura, posizionare l'anello su una superficie pulita fino all'uso.
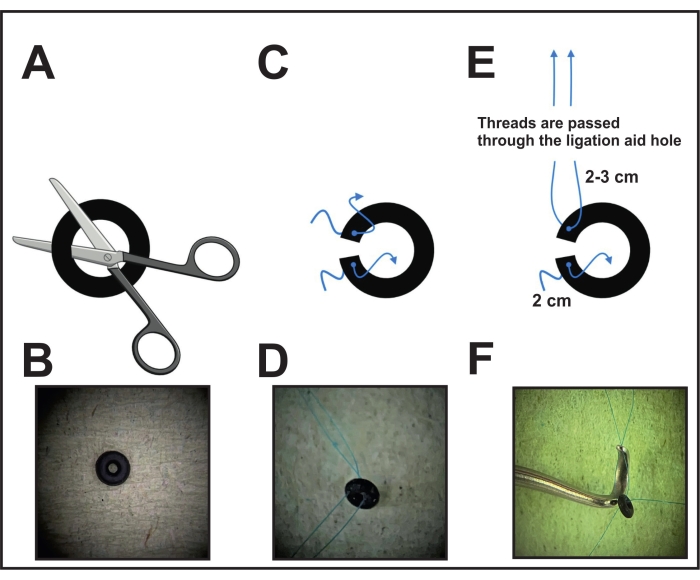
Figura 1: Esecuzione della preparazione dell'o-ring per la legatura . (A) Un o-ring con diametro fisso viene tagliato con forbici o bisturi su un lato. (B) Immagine di un o-ring. (C) Ogni lato o-ring è forato con un 8-0 filo di prolene. (D) O-ring forato con due filettature. (E) Le filettature di un lato dell'anello dell'o-ring sono tirate attraverso il foro dell'ausilio di legatura. (F) Posizione finale prima del posizionamento: i fili di un lato sono posti attraverso il foro dell'ausilio di legatura, mentre i fili dell'altro lato sono mantenuti sciolti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Premedicazione dei topi e preparazione del campo operatorio
- Per ricevere un'analgesia sufficiente durante l'intervento chirurgico, iniettare la buprenorfina analgesica (0,1 mg/kg, vedere Tabella dei materiali) per via intraperitoneale 20 minuti prima di procedere all'intervento.
NOTA: Per il presente studio, il farmaco antidolorifico è stato utilizzato seguendo le raccomandazioni della Gesellschaft für Versuchstierkunde/Society of Laboratory Animal Science (GV-SOLAS). - Dopo la premedicazione, anestetizzare il topo in una camera di induzione con isoflurano al 2%-4% miscelato con 0,5-1,0 L/min di 100% di O2.
- Rasare la pelliccia sul lato torace sinistro del topo sedato. Dopo la rasatura, rimettere il topo nella camera piena di isoflurano e attendere una sedazione sufficiente prima di intubare l'animale.
NOTA: Il giusto punto temporale della sedazione mostra una respirazione lenta ma evita la respirazione a scatto. A seconda dell'impostazione del gas isoflurano, ci vogliono 2-3 minuti per ottenere il giusto livello di sedazione. - Accendere il termoforo prima dell'intervento chirurgico per mantenere la temperatura corporea dell'animale (37 °C). Collegare il termoforo a una sonda rettale (vedere Tabella dei materiali) per mantenere automaticamente la temperatura corporea del mouse.
4. Intubazione dei topi
- Preparare gli strumenti necessari (Figura 2A). Disinfettare il laringoscopio prima dell'intervento mettendolo in alcool per circa 1-3 minuti e poi conservandolo per l'asciugatura durante la notte.
- Allungare un elastico attorno alla piastra riscaldante per fissare il mouse con i denti anteriori sulla piastra. Posizionare il mouse sedato sul termoforo in posizione supina.
- Posizionare l'elastico sui denti anteriori dell'animale per estendere il collo sulla piastra.
- Focalizzare una sorgente luminosa sulla gola per una buona visibilità dell'apertura della trachea per l'intubazione endotracheale (Figura 2B).
- Aprire delicatamente la bocca con una mano posizionando un ausilio per l'intubazione (laringoscopio fatto a mano, vedi Tabella dei materiali) (Figura 2A[3]).
- Con l'altra mano e una piccola pinza, muovi delicatamente la lingua per liberare l'apertura della trachea.
- Usa questa mano anche per introdurre il tubo endotracheale nella trachea. D'altra parte, tenere ancora l'aiuto per l'intubazione. Per l'intubazione, utilizzare una cannula da 22 G (vedi Tabella dei materiali) (Figura 2A[1]).
- Collegare la posizione del tubo endotracheale tramite un rubinetto a tre vie a un ventilatore (vedere la tabella dei materiali) per i topi per confermare la corretta posizione del tubo endotracheale (endotracheale).
- Monitorare la giusta ventilazione secondo le istruzioni del produttore (volume corrente di 200 μL e frequenza respiratoria tra 100-150 respiri / min) (Figura 2C).
- Confermare una profondità anestetica sufficiente con un controllo del riflesso del pizzico del piede (nessuna risposta riflessa).
- Portare l'impostazione dell'anestesia al 2% di isoflurano miscelato con 0,5-1,0 L/min 100% O2.
- Applicare unguento oftalmico sugli occhi per evitare secchezza durante l'intervento chirurgico.
- Utilizzando un batuffolo di cotone, disinfettare l'area chirurgica 3 volte con una soluzione disinfettante disponibile in commercio (vedi Tabella dei materiali).
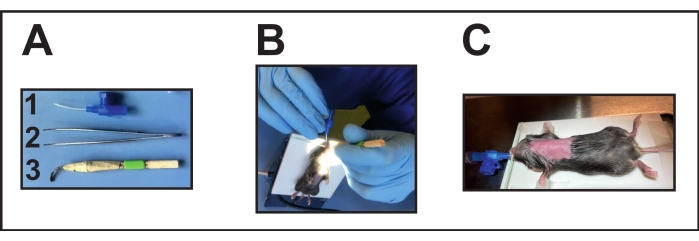
Figura 2: Intubazione del topo. (A) Strumenti per intubazione: (1) Una cannula e.v. da 22 G è utilizzata come tubo endotracheale (senza mandarino); (2) Forcipe; (3) Laringoscopio fatto a mano (cannula deformata / appiattita incollata con bastoncini di legno e nastro adesivo). (B) Esecuzione dell'intubazione sul termoforo posizionato. (C) Topo intubato collegato a un ventilatore. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Chirurgia e preparazione per il posizionamento dell'anello
NOTA: Utilizzare materiali e strumenti sterili per evitare infezioni.
- Utilizzare le forbici per eseguire un'incisione cutanea lunga 0,5-1 cm nel mezzo di una linea tra il processo xyphoid e l'ascella sinistra. Utilizzare una pinza per separare lo strato muscolare dalle costole sottostanti e posizionare due divaricatori (lunghezza 5 mm, vedi Tabella dei materiali) nell'incisione per esporre la gabbia toracica.
- Per iniziare la toracotomia sinistra, eseguire una piccola incisione (~ 1-2 mm) nei muscoli intercostali tra la seconda e la terza costola usando micro forbici a molla. Aprire la cavità toracica e diffondere l'incisione con una pinza angolata di 45°.
- Posizionare tre divaricatori toracici (lunghezza 1,0-2,5 mm) nell'incisione per aprire la cavità toracica per migliorare la visualizzazione.
- Per esporre l'arco aortico, provare a sollevare e separare delicatamente il timo e il tessuto adiposo dall'arco con una pinza angolata a 45 °.
6. Legatura dell'aorta trasversale con l'o-ring
- Esporre l'arco aortico con una pinza angolata di 45° in una mano. Posizionare, con l'altra mano, l'o-ring collegato con l'ausilio di legatura tramite i fili di un lato (punto 2).
- Passare i fili usando l'ausilio di legatura sotto l'arco aortico dal lato caudale al lato cranico dell'aorta trasversale tra le arterie carotidi brachiocefaliche e quelle comuni sinistre (Figura 3A).
- Prendi entrambi i fili tra l'aiuto di legatura e l'arco aortico con la pinza con attenzione. Ritrarre e rimuovere l'ausilio di legatura e posizionare delicatamente l'o-ring attorno all'arco tirando i fili su ciascun lato (Figura 3B).
- Dopo aver posizionato con successo, fissare l'o-ring con i fili e un nodo chirurgico. Fatene uno aggiuntivo per evitare di aprire il nodo su ciascun lato (Figura 3C).
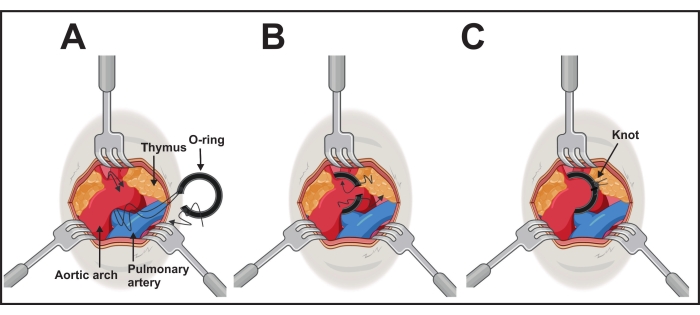
Figura 3: Esecuzione dell'impianto dell'o-ring . (A) L'arco aortico è esposto da tre divaricatori di 1,0-2,5 mm. Entrambi i lunghi fili di un lato dell'anello sono passati sotto l'aorta. (B) L'o-ring sarà posizionato spingendo delicatamente l'anello e tirando i fili. (C) L'o-ring è nella giusta posizione e un filo cranico è annodato con filo caudale su ciascun lato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
7. Sutura e recupero post-operatorio
- Rimuovere i tre divaricatori del torace (lunghezza 2,5 mm) dall'incisione.
- Se necessario, eliminare l'aria residua dal torace riempiendolo con una soluzione calda di sale isotonico allo 0,9%.
- Per esporre l'incisione del torace per la sutura, prendere di nuovo due divaricatori (lunghezza 5 mm) per tenere la pelle sul lato.
- Chiudere il torace con due o tre punti di sutura 6-0 non assorbibili (vedi Tabella dei materiali) e pizzicare il deflusso del ventilatore per 2 s per rigonfiare i polmoni.
- Rimuovere i due divaricatori e chiudere la pelle con tre o cinque suture assorbibili 4-0.
- Spegnere l'isoflurano e monitorare. Quando l'animale inizia a respirare autonomamente, i baffi si muovono e i riflessi del pizzicamento della punta possono essere attivati, estubare il topo. Appoggiare il mouse sul lato sinistro sotto la lampada di calore nella sua unità di cura e osservarlo fino a quando non è completamente sveglio.
- Non lasciare un animale incustodito fino a quando non ha riacquistato sufficiente coscienza.
NOTA: Un animale che ha subito un intervento chirurgico dovrebbe ottenere la propria unità di cura (gabbia) per un migliore recupero. - Eseguire la gestione del dolore con tramadolo (1 mg / ml) in acqua potabile per 7 giorni e buprenorfina (0,1 mg / kg, 3 volte al giorno) mediante iniezione intraperitoneale per 3 giorni dopo l'intervento chirurgico, se necessario.
NOTA: Seguire le raccomandazioni del comitato etico animale locale per l'analgesia postoperatoria. - Controlla i farmaci pesando le bottiglie d'acqua ogni giorno e osserva il comportamento dell'animale.
8. Conferma della costrizione riuscita e della giusta posizione dell'anello
- Un giorno dopo l'intervento chirurgico, verificare la stenosi utilizzando gli ultrasuoni misurando la velocità massima del flusso sulla stenosi.
- Per le misurazioni, utilizzare l'ecocardiografia con un sistema a ultrasuoni e una sonda trasduttore con una frequenza di 30 MHz (vedi Tabella dei materiali).
- Come descritto sopra, mantenere l'anestesia utilizzando una maschera all'1,5%-2% di isoflurano con 0,5-1,0 L/min di 100% di O2.
- Posizionare l'animale anestetizzato sulla piastra elettrica in posizione supina. Collegare la piastra riscaldante con una sonda rettale per mantenere la temperatura corporea a 37 °C ± 1 °C e monitorare la frequenza cardiaca con un ECG utilizzando quattro sensori a zampa di topo (vedere Tabella dei materiali).
- Per una migliore visualizzazione, utilizzare la crema depilazione.
- Un ORAB eseguito con successo determina un aumento della velocità del flusso sulla stenosi misurata dagli ultrasuoni (~ 2.400 mm / s) (Figura 4C). Per questa misurazione, posizionare la testa del trasduttore parasternalmente sul lato destro del torace per localizzare l'arco aortico mediante imaging bidimensionale (2D) ("B-mode").
- Utilizzare il color Doppler per visualizzare il flusso sanguigno nell'aorta e misurare con la velocità del flusso sanguigno Doppler a onda pulsata sulla stenosi.
NOTA: I topi operati da sham (chirurgia di controllo senza costrizione) mostrano una velocità del flusso sanguigno di ~ 600-900 mm / s. Inoltre, un ORAB di successo si traduce anche in un aumento del rapporto di flusso di velocità tra la carotide destra (~150 mm/s) (RC, Figura 4A) e la carotide sinistra (~300 mm/s) LC, Figura 4B) nel topo.
- Utilizzare il color Doppler per visualizzare il flusso sanguigno nell'aorta e misurare con la velocità del flusso sanguigno Doppler a onda pulsata sulla stenosi.
- Visualizza l'arteria carotis interna destra e sinistra mediante imaging bidimensionale (2D) (modalità B). Posizionare la testa del trasduttore orizzontalmente sui lati sinistro e destro del collo con un angolo di 45° e utilizzare il Doppler ad onda pulsata per determinare la velocità del flusso sanguigno.
NOTA: Nei topi operati da sham, il flusso di velocità in entrambe le arterie è simile.
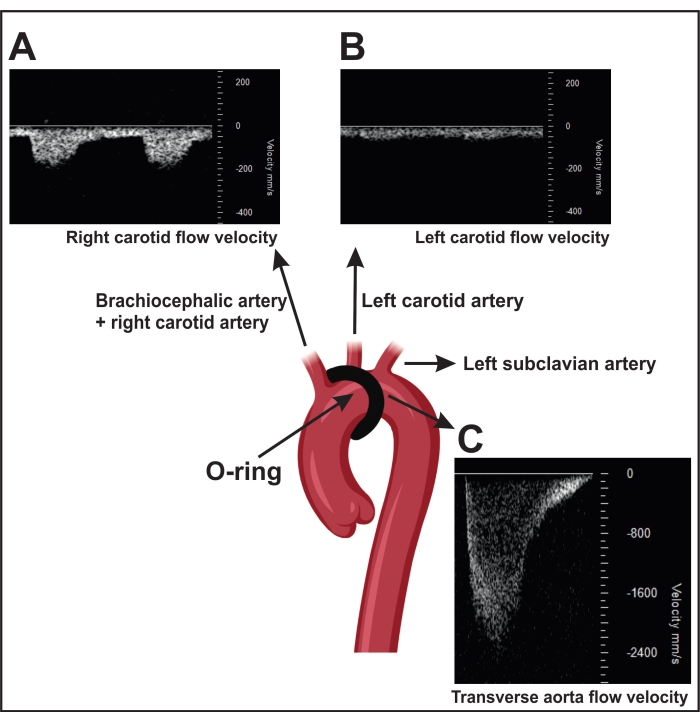
Figura 4: Conferma della legatura trasversale dell'aorta mediante la misurazione della velocità Doppler ad onda pulsata nelle arterie carotidi. (A) Segnali rappresentativi della velocità Doppler ad onda pulsata dell'arteria carotide destra. (B) La stenosi provoca una maggiore velocità di flusso nell'arteria carotide destra rispetto alla sinistra. (C) La stenosi indotta dalla costrizione determina una velocità di flusso nell'aorta discendente superiore a 2.400 mm/s. I topi fittizi mostrano una velocità di flusso di 600-900 mm/s. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Generalmente, il banding aortico imita la stenosi aortica umana e induce ipertrofia cardiaca nei topi. Una procedura di successo è caratterizzata dal rimodellamento del tessuto cardiaco riflesso dall'ipertrofia cardiaca e dalla ridotta funzionalità cardiaca 5,6.
Direttamente 1 giorno dopo l'operazione, l'effetto della costrizione dell'o-ring dell'aorta trasversale può essere determinato in vivo mediante ecocardiografia
Discussione
Il bendaggio aortico basato su thread / sutura è stato utilizzato per molti anni per indurre ipertrofia cardiaca da sovraccarico di pressione nei topi. È un metodo consolidato per studiare i meccanismi patologici del rimodellamento cardiaco e della progressione della malattia in vivo. I limiti sono la varianza relativamente elevata nel grado di stenosi e, di conseguenza, il rimodellamento. La tecnica ORAB recentemente introdotta descritta per la prima volta da Melleby et al.10 ottimizz...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Bundesministerium für Bildung und Forschung (BMBF) a L.L., N.F. e O.J.M. (IVOLADMT-HF; FKZ 01KC2006A).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 x long Fixators, 6 cm | 18200-01 | ||
| 2 x Blunt Retractors, 5 mm wide | 18200-11 | ||
| 2 x Short Fixators, 3 cm | 18200-02 | ||
| 2 x fine tip 45° angled forceps | FST (fine sience tools) | 11160-10 | |
| 3 x Blunt Retractors, 2.5 mm wide | 18200-10 | ||
| 3 x Retractor Wires | 18200-05 | ||
| 4-0 absorbable suture (Vicryl) | ETHICON | SABBKLT0 | Used to suture skin |
| 6-0 suture (Prolene), needle size:13 mm | ETHICON | JDP879 | Used to suture chest muscle |
| 8-0 suture (Prolene), needle size: 6.5 mm | ETHICON | RHBECH | Used to fast the Ring |
| Anesthetizing Box, Small | Havard apparatus | 50-0108 | |
| C57BL/6N mice | Charles River | ||
| Fluosorber Activated Charcoal Filter Canister | Havard apparatus | 34-0415 | Used to induce and maintain anesthesia |
| Handmade laryngsopcope | Intubationshelp | ||
| Harvard Apparatus Anesthetic Vaporizer | Havard apparatus | Used to induce and maintain anesthesia | |
| Heating pad + rectal probe (LSI Letica Scientific Instruments:Temperature control unit HB 101/2 ) | Panlab/ Havard apparatus | Used to control and maintain body temperature | |
| i.v. cannula blue 22-gauge (Vasofix Braunüle 0.9 x 25 mm) | B/Braunsharing Expertise | 4268091B | intubation |
| isofluran | Baxter | Anesthesia | |
| Kodan (betadine solution) | Schülke | 20003960-A | Desinfection |
| ligation aid | FST (fine sience tools) | 18062-12 | Used to perform liagtion with O-ring |
| Microscope Lighting: Schott VisiLED Set MC1500/S80-55 (+ controller) | SCHOTT | Ligth | |
| Microscope camera (Leica IC80 HD) | Leica | Used for visualiation operating field | |
| MiniVac Complete Anesthesia Systems for small rodents | Havard apparatus | 75-0233 | Used to induce and maintain anesthesia |
| Mouse Ventilator MiniVent Type 845 | Havard Apparatus | 73-0044 | Used to ventilation during surgery |
| Needle holder | FST (fine sience tools) | TE-10804 | |
| O-ring, non-slip rubber (0.0018 mm x 0.020 mm) | Apple Rubber Products | Liagtion of the aortic arch | |
| Scissors | FST (fine sience tools) | 14040-09 | Used to cut the skin and threads |
| Small Animal Retraction System (Kit for Animals up to 200 g) | FST (fine sience tools) | 18200-20 | |
| Small Base Plate, 20 x 30 cm | 18200-03 | ||
| Table intgerated with heating pad + rectal probe + ECG and transducer tripod | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Temgesic (Buprenorphin) | Indivior UK Limited | 997.00.00 | Pain pre-medication |
| three-way stop cock (blue) | |||
| Tramal (Tamadol) | Grünental | Pain post-medication | |
| transducer probe MS400 (Visual Sonics) | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Ultrasound system with cardioligy package | FujiFilm Visual Sonics Imaging System | Echocardiography | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST (fine sience tools) | 15000-08 | Used to cut intercostal chest muscle |
| vet ointment | Bepanten | Used to prevent eyes from drying out |
Riferimenti
- Frey, N., Olson, E. N. Cardiac hypertrophy: The good, the bad, and the ugly. Annual Review of Physiology. 65, 45-79 (2003).
- Bui, A. L., Horwich, T. B., Fonarow, G. C. Epidemiology and risk profile of heart failure. Nature Reviews Cardiology. 8 (1), 30-41 (2011).
- Bolli, R. New initiatives to improve the rigor and reproducibility of articles published in Circulation Research. Circulation Research. 121 (5), 472-479 (2017).
- Dunlay, S. M., Weston, S. A., Jacobsen, S. J., Roger, V. L. Risk factors for heart failure: A population-based case-control study. The American Journal of Medicine. 122 (11), 1023-1028 (2009).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Circulation Research. 115 (13), 1838-1849 (2019).
- Rockman, H. A., et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8277-8281 (1991).
- Hu, P., et al. Minimally invasive aortic banding in mice: effects of altered cardiomyocyte insulin signaling during pressure overload. American Journal of Physiology-Heart and Circulatory Physiology. 285 (3), 1261-1269 (2003).
- Mohammed, S. F., et al. Variable phenotype in murine transverse aortic constriction. Cardiovascular Pathology. 21 (3), 188-198 (2012).
- Nakao, Y., et al. O-ring-induced transverse aortic constriction (OTAC) is a new simple method to develop cardiac hypertrophy and heart failure in mice. Scientific Reports. 12, 85 (2022).
- Melleby, A. O., et al. A novel method for high precision aortic constriction that allows for generation of specific cardiac phenotypes in mice. Cardiovascular Research. 114 (12), 1680-1690 (2018).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Garcia-Menendez, L., Karamanlidis, G., Kolwicz, S., Tian, R. Substrain specific response to cardiac pressure overload in C57BL/6 mice. American Journal of Physiology-Heart and Circulatory Physiology. 305 (3), 397-402 (2013).
- deAlmeida, A. C., van Oort, R. J., Wehrens, X. H. Transverse aortic constriction in mice. Journal of Visualized Experiments. (38), e1729 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon