Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Eritrosit Sedimantasyon Hızı: Tıbbi Bağlamda Fizik Odaklı Bir Karakterizasyon
Bu Makalede
Özet
Eritrosit sedimantasyon hızı (ESR), rutin sağlık kontrollerinde ve tıbbi tanıda sıklıkla kullanılan fiziksel bir parametredir. Modern kolloidal bilgiye dayanarak, tüm sedimantasyon eğrisinden fiziksel olarak anlamlı parametrelerin çıkarılmasına izin veren teorik bir model yakın zamanda geliştirilmiştir. Burada, ESR'yi zaman içinde otomatik olarak toplamak ve bu son modelin parametrelerini bu otomatik veri koleksiyonundan çıkarmak için bir protokol sunuyoruz. Bu rafine parametrelerin tıbbi tanıklığı da iyileştirmesi muhtemeldir.
Özet
Eritrosit (veya kırmızı kan hücresi) sedimantasyon hızı (ESR), rutin sağlık kontrollerinde ve tıbbi tanıda sıklıkla kullanılan fiziksel olarak türetilmiş bir kan parametresidir. Örneğin, inflamasyon durumunda, fibrinojen ve diğer plazma proteinlerindeki ilişkili artış nedeniyle daha yüksek bir ESR gözlenir. Bu artışın, fibrinojen artışının neden olduğu daha büyük kırmızı kan hücreleri (RBC'ler) agregalarının oluşumundan kaynaklandığına inanılıyordu. Gerçekten de, fibrinojen, RBC'lerin ajan besleyici bir agregasyonudur ve Stokes rejiminde, kan-daha büyük agregalarda daha hızlı tortu gözlendiği varsayılmaktadır. Bununla birlikte, bu hipoteze dayanan tüm ESR ölçüm modelleri, başka hiçbir sistemde gerekli olmayan daha spesifik fiziksel varsayımlar gerektirir. Ayrıca, kolloidal süspansiyonlar alanındaki modern çalışmalar, çekici parçacıkların sızan agregalar (yani kap kadar geniş agregalar) oluşturduğunu ortaya koymuştur. Bu kolloidlerin çökelmesi daha sonra "kolloidal jel çökmesi" olarak adlandırılan bir şeyi takip eder. Son zamanlarda, RBC'lerin aslında aynı davranışı izlediği gösterilmiştir. Bu hipotez aynı zamanda, sağlam ve fiziksel olarak anlamlı tanımlayıcıların çıkarılabileceği RBC'lerin çökeltme eğrisini verimli ve analitik olarak modellemeye izin verir. Bu makalede, böyle bir analizin nasıl yapılacağı açıklanmakta ve bu yaklaşımın faydaları tartışılmaktadır.
Giriş
Eritrosit sedimantasyon hızı (ESR), yirminci yüzyılda kanıta dayalı tıpta resmen tanıtılan tıbbi bir in vitro klinik araçtır 1,2,3,4. Şu anda dünya çapında spesifik olmayan bir enflamatuar test olarak veya bazı spesifik koşulların evrimini izlemek için kullanılmaktadır 5,6,7,8. Bu esas olarak fibrinojen konsantrasyonundaki bir artıştan kaynaklanmaktadır, aynı zamanda IgM 1,9,10,11 gibi diğer plazma bileşenlerinde de bir artışa bağlıdır. Mevcut Westergren standart protokolüne göre, ESR değerleri, hücresiz plazma tabakasının belirli bir zaman noktasında (30 dakika veya 1 saat) tipik bir 20 cm'lik dikey bir tüpüistirahatte dikey olarak bıraktıktan sonra ölçümü olarak bildirilmektedir. Bununla birlikte, bu ölçüm yöntemi, maksimum çökelme hızı13'e ulaşmadan önce bir gecikme de dahil olmak üzere, çökeltme işleminde niteliksel olarak farklı aşamalar bildirildiği için eleştirilmiştir. Bu gecikme, sağlıklı örneklerin yaklaşık yarısında 1 saatten fazla sürer14. Bu fazdaki hız, çökeltme15'in ikinci, daha hızlı fazından farklı bir ölçeklemeye uyar. Okumayı ilk saat boyunca ortalama yerleşme hızıyla sınırlamak, daha sonra farklı bireyler arasındaki çeşitli kan özelliklerinin farklı bir karışımını karşılaştırır.
Dahası, son zamanlarda bu protokolün arkasındaki olağan teorik düşüncelerin hatalıolduğu gösterilmiştir 16,17,18. Fizyolojik hematokritte (yaklaşık% 25'in üzerinde), kırmızı kan hücreleri (RBC'ler) ayrı agregalar olarak değil, genellikle bahsedilen Stokes sedimantasyonu 16,17'den farklı bir fiziksel denklem kümesine uyan, sürekli, sözde sızan, RBC'ler 17,18 ağı olarak çökelir. Sedimantasyonun (tüm eğri) zaman çözümlü ölçümlerine dayanan fiziksel bir tanımlamanın göz önünde bulundurulmasının, bazı yeni tıbbi bağlamlarda daha sağlam olduğu gösterilmiştir19,20. Dahası, bu ölçümler, hücre şekillerinin değiştirildiği patolojilerde ESR'yi değiştiren fiziksel mekanizmalara ışık tutmak için kullanılabilir19,20. Ek olarak, yavaş bir ESR, nöroakantositoz sendromlu hastaların bir kohortunun ölçümlerinde belirtildiği gibi yararlı bir tıbbi yoruma sahip olabilir19,20. Bu makale, tüm ESR kinetiğine dayanarak, fiziksel olarak anlamlı parametrelerin ölçümünün pratik olarak nasıl uygulanacağını gözden geçirmektedir. Daha doğrusu, burada sunulan yöntem, donörün hematokritinin etkisini göz önünde bulundurmak için değeri düzeltilebilen maksimum sedimantasyon hızı Um'yi çıkarır16,17. Bu parametre geleneksel ölçüm 16,17,19,20'den daha doğru ve dolayısıyla daha güvenilirdir.
Ek olarak, bazı temel araştırmalarda, belirli bir hastanın inflamasyon durumunu izlemek yerine, hematokritin ESR 21,22,23 üzerindeki etkisini dışlamak veya RBC'lerin modifiye edilmiş bir ESR19,20,24,25'teki rolünü araştırmak ilginçtir farklı bağışçılar arasında. Hastalardan doğrudan tam kan örneği olmayan örnekleri karşılaştırmak yararlı olabilir. Bu nedenle, RBC'lerin otolog plazmada veya plazma ikame maddesinde kontrollü bir hematokrit ile yeniden askıya alınması, ESR ölçümünün ilk adımı olarak kullanılabilir. Örneğin, fosfat tamponlu salin (PBS) içinde 55 mg / mL konsantrasyona sahip Dextran 70 kDa çözeltileri, sağlıklı hücreler için kontrol aralığında bir çökeltme aralığı üretir19. Bu makale aynı zamanda bu tür adımların nasıl yürütülmesi gerektiğini ve sunulan analizin bu durumlarda da geçerli olduğunu göstermektedir.
Protokol
Kan örneği toplama ve deneyler "Ärztekammer des Saarlandes", etik votum 51/18 tarafından onaylandı ve Helsinki Deklarasyonu'na göre bilgilendirilmiş onam alındıktan sonra gerçekleştirildi. Westergren tüplerinde etilendiamintetraasetik asit (EDTA)-antikoagüle kan (standart EDTA konsantrasyonu 1.6 mg/mL kan, Avrupa normu NF EN ISO 6710) ile standart ölçümler yapılmalıdır. Westergren tüpünü doldurmak için gereken hacim üreticiye bağlıdır (alt parçalar bazen daha geniş bir rezervuar içerdiğinden); Hacim, Malzeme Tablosunda belirtilen tüpler için yaklaşık 1 mL tam kan ve 800 μL olmalıdır. Bununla birlikte, aşağıda açıklanan yöntem, spesifik süspansiyon ve kap şekli ne olursa olsun, incelenen numunelerin hematokriti %25'ten yüksek olduğu sürece geçerlidir16. Bu nedenle hacimler, kaplar, askı ortamı ve katkı maddeleri, yapılan araştırmanın özel amaçlarına göre seçilmelidir.
1. Deneyler ve ölçümler
NOT: Numunenin çökelme hızını her dakika kaydedin.
- Numune hazırlama (gerekirse): Bir kontrol hematokriti veya askıya alma sıvısı gerekiyorsa, hücreleri yıkayarak ve numuneleri hazırlayarak başlayın (örnek olarak, otolog serum ve plazmayı karıştırarak çeşitli fibrinojen seviyelerine sahip numunelerin nasıl hazırlanacağını gösteriyoruz). Serum gerçekten de fibrinojensiz plazma26,27 olarak yaklaştırılabilir ve aksi takdirde fizyolojik koşullarda RBC'lerin agregasyonunu azaltmak için kullanılabilir. Birkaç örnek hazırlamak için, kanı 9 mL'lik standart EDTA tüplerinde ve serumu standart serum tüplerinde (pıhtılaşma aktivatörleri olarak silika boncuklarla) 9 mL'lik toplayın.
- Paketlenmiş eritrositlerin optimum şekilde sıkıştırılması için kan örneklerini (yani, seçilen örnekte 9 mL standart EDTA ve serum tüpleri) en az 7 dakika boyunca 3.000 x g'de santrifüj edin. Yeterli miktarda mevcutsa, süpernatantı PBS veya istenen askıya alma sıvısı ile değiştirin. Otolog plazmada hematokriti kontrol etmek gerekiyorsa, doğrudan adım 1.1.3'e geçin. Aksi takdirde, süpernatantın yıkama için dahil edilmesinden sonra yavaşça karıştırın.
- Üç kez tekrarlayın. Her durumda istenen askıya alma sıvısı ile son yıkamayı yapın.
- Seçilen örnekte, otolog plazma ve serum karışımlarını belirlenen oranlarda hazırlayın (örneğin, plazma-serum hacim fraksiyonunun %25/%75'i, %50/%50'si veya %75/%25'i). Örneğin,% 25 / % 75 plazma-serum karışımının 2.5 mL'sini hazırlarken, 1.875 mL seruma 0.625 mL plazma ekleyin.
- Gerekli miktarda paketlenmiş hücreyi çıkarın ve istediğiniz sıvıda askıya alın. Paketlenmiş hücreleri yüksek viskoziteli bir sıvı olarak işleyin (standart ön pipetleme ve/veya ters pipetleme veya pozitif yer değiştirmeli pipet28 kullanarak). Seçilen örnekte,% 45'lik bir hematokritte 4 mL'lik bir numune için, plazma-serum karışımının 2.2 mL'si içinde 1.8 mL paketlenmiş hücreyi askıya alın.
- Numunenin hematokriti kontrol edilmezse, yüksek hızlı mikrosantrifüjleme ile belirleyin (diğer standart yöntemler de uygundur).
- Hematokrit tayini için gerekli miktarda numuneyi çıkarın: alt ucunu sıvıya batırarak mikro-hematokrit kılcal damarlarını doldurun. Kılcal emme ile tüpte gerekli miktarda numune yükseldiğinde üst açıklığı kapatarak durdurun.
- Kılcal damarları sızdırmazlık balmumu ile kapatın. Bunları mikro-hematokrit santrifüje yerleştirin ve 5 dakika boyunca veya üreticinin talimatlarına göre 15.000 x g'de (12.000 rpm) çalıştırın.
- Kılcal damardaki hematokrit seviyesini okuyun ve referans için yazın.
- Numunelerin çökelmesini kaydetmek için bir kamera kurun. Belleğin aşırı yüklenmesini veya pilin boşalmasını önlemek için, aygıtı şebekeden açın ve resimleri doğrudan bir bilgisayara veya harici sabit sürücüye kaydedin.
- ESR tüplerinin dinlenmeye bırakılacağı tutucunun önüne sabit bir kamera yerleştirin. Beyaz, ışıklı bir arka plan kullanın (arka plandaki beyaz kağıt sayfaları mükemmel çalışır).
- Tercihen işaretler olmadan boş Westergren tüpleri kullanarak, numunelerin yerleştirileceği en yüksek çözünürlüğü elde etmek için kameranın odağını ve görüş alanını ayarlayın. Tercihen, resimlerin kenarlıklarının dikey ve yatay yönde hizalandığından emin olun.
- Piksel çözünürlüğünü çıkarmak için ölçeklendirilmiş bir tüpün resmini çekin. RGB resimlerin kullanılması önerilir.
- Fotoğraf makinesinin ışığını ve pozlama süresini beyaz bir arka plana sahip olacak ancak doygunluk olmayacak şekilde ayarlayın. Şekil 1'deki örnek, 1/15s pozlama süresine, F8.0 diyafram açıklığına, Tungsten beyaz dengesine, manuel odaklamalı tek çekim modunda ve 1.000 ISO hızına sahip bir Canon EOS M50 kullanılarak elde edilmiştir.
- ESR tüplerini hazırlayın ve yerleştirin.
- Westergren tüpünün alt kabını, üreticinin talimatlarına karşılık gelen hacimle doldurun. Westergren tüpünü üretici tarafından belirtildiği gibi alt kaba yerleştirin.
- İlk tüp hazır olur olmaz, tutucuya yerleştirin ve kamera kaydını başlatın. Her dakika bir resim kaydetmek genellikle ESR kinetik eğrisinin iyi bir çözünürlüğünü verir.
- Sonraki örnekleri hazırlayın ve yerleştirin. Fotoğraf çekilirken herhangi bir numunenin önünde durmadığınızdan emin olun.
- 30 dakika, 1 saat ve 2 saatte standart ölçümlerle karşılaştırmak için ölçümlerin en az 2 saat çalışmasına izin verin. Bununla birlikte, tortunun doygunluğunu ve tutuklanmasını görmek de daha iyidir. Sağlıklı numuneler için veya iltihaplanma durumunda, numunelerin gece boyunca, 12 saat ile 24 saat arasında kaydedilmesi, en hızlı numunelerin eğriliği 3 saat içinde görülebildiğindenfazlasıyla yeterlidir 13,19. Bununla birlikte, fibrinojen konsantrasyonundaki bir azalmanın yaptığı gibi (yani, seçilen örnekte, yüksek serum hacim fraksiyonu) bir durum sedimantasyon hızını azaltırsa, en doğru bilgiyi elde etmek için 50 saat veya daha fazla kayıt gerekebilir16,19.
2. Görüntü analizi
NOT: Görüntüler kaydedildikten sonra, ESR eğrisini ayıklayın. Matlab kodunun bir örneği Ek Dosya 1 (MatlabCodeImageAnalysisSampled.m) olarak sağlanır.
- Yalnızca bir tüpün görülebildiği, alt sınırın eritrosit hücresiz plazma arayüzünün en düşük konumunun altında, ancak numunenin içinde bulunduğu bir ilgi alanı (ROI) seçin veya tanımlayın (bkz. Şekil 1A, B). Gerekirse, dikey yön resmin ilk bileşeni boyunca hizalanacak şekilde resmi döndürün.
- RGB resminin YG'sini gri tonlamalı bir resme veya matris Gr'ye dönüştürün. Genellikle, üç renkli kanalları (kırmızı [R], yeşil [G] ve mavi [B]) Gr = 2 * R - B - G olarak birleştirmek net bir arka planla çok verimlidir (bkz. Şekil 1C ve MatlabCodeImageAnalysisSampled.m satırları 121-128).
- Resmi ikili hale getirin. Sağlıklı bir örnek için, Otsu eşiği29'u kullanmak genellikle tutarlı bir sonuç verir (MatlabCodeImageAnalysisSampled.m'nin Şekil 1D ve satır 133'üne bakın). Yüksek hematokritli veya bazı hemolizli numuneler için, tüpün içindeki çeşitli fazlar arasında elde edilen tam kontrasta bağlı olarak, manuel olarak ayarlamak veya başka bir otomatik yöntem kullanmak (MatlabCodeImageAnalysisSampled.m'nin 129-131 satırlarında yapıldığı gibi) daha iyi olabilir.
- Yatay yön boyunca Gr'nin piksel (veya eleman) değerlerinin ortalamasını elde edin. Bu adım gürültüyü en aza indirir ve olası arabirim düzensizliklerinin ortalamasını verimli bir şekilde alır (bkz. Şekil 1E ve MatlabCodeImageAnalysisSampled.m satır 137).
- Varyasyonları hesaplamadan önce, özellikle tüpler bazı yatay işaretler içeriyorsa, eğriyi hareketli bir ortalamayla düzleştirin (bkz. Şekil 1F). Verilen örnekler için, bu işlem için ~ 2,5 mm'lik (50 piksel) hareketli bir pencere kullanılmıştır (MatlabCodeImageAnalysisSampled.m dosyasının 138. satırına bakın). Ardından, arayüz konumunu en yüksek yoğunluk değişimine sahip nokta olarak tanımlayın (bkz. Şekil 1G).
- Her resim ve her örnek için bu işlemi tekrarlayın. Her örnek için, arabirimin konumlarını, fiziksel modele uygun herhangi bir yazılımla uyacak şekilde zaman içinde uygun bir biçimde kaydedin.
3. Fiziksel modelin takılması
- Uygun şekilde uyan herhangi bir yazılımı kullanarak, hematokriti ve kan sütunu h 0'ın başlangıç yüksekliğini bilerek, fiziksel model17 için karesel artık sapmaların toplamını en aza indiren eritrositlerin gecikme süresi t0, boyutsuz zaman γ ve son paketlenmiş hacim fraksiyonu Φmdeğerlerini bulun. Bir Matlab kodu (ShapeAnalyzerIntegrated.m), böyle bir uyumun nasıl gerçekleştirileceğine örnek olarak Ek Dosya 2 olarak sağlanır. Daha fazla talimat için Ek Dosya 2'ye bakın. Başka bir yerde tarif edildiği gibi16,17, fizyolojik hematokrit tortusunda eritrositler yumuşak bir parçacık jeli olarak, burada önemli fiziksel parametreler donör Δρ'nın plazması ve RBC'leri arasındaki yoğunluk farkı, RBC karakteristik çapı rRBC, oda sıcaklığında plazma viskozitesi η ve donörün hematokriti Φ . Bu parametreleri kullanarak ve yerçekimi stresinin, plazmanın t0 gecikme süresinden sonra eritrositler tarafından oluşturulan gözenekli ağ boyunca yukarı doğru akması için ana itici süreç olduğunu varsayarsak, zamansal evrim16,17 elde edilir:
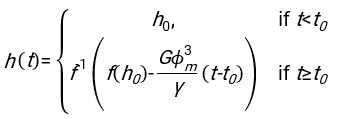
ile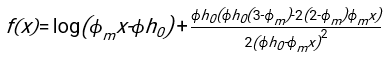 ,
, 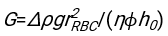 ve
ve 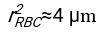 bir eritrositin ortalama disk yarıçapıdır. Bunu gerçekleştiren bir Matlab kodu örneği ek olarak sağlanır (ShapeAnalyzerIntegrated.m, SedimFit.m [Ek Dosya 3]'te tanımlanan işleve uyar). Alternatif olarak, G/γ doğrudan 1/t'lik birimlerle uygun bir parametre olarak da kullanılabilir.
bir eritrositin ortalama disk yarıçapıdır. Bunu gerçekleştiren bir Matlab kodu örneği ek olarak sağlanır (ShapeAnalyzerIntegrated.m, SedimFit.m [Ek Dosya 3]'te tanımlanan işleve uyar). Alternatif olarak, G/γ doğrudan 1/t'lik birimlerle uygun bir parametre olarak da kullanılabilir. - Kantitatif eğri resimden çıkarıldıktan sonra, numunenin fiziksel parametrelerini kaydedin. 30 dakika, 1 saat veya 2 saatteki geleneksel ESR değerleri referans için eğriden çıkarılabilir (bkz. ShapeAnalyzerIntegrated.m satır 123-132).
Sonuçlar
Doğru şekilde elde edilen bir görüntü dizisine örnek olarak Ek Film 1 (MovieS1.avi) verilebilir. Şekil 2'de çeşitli koşullar için modelin bir dizi karakteristik uyumu gösterilmiştir. Fibrinojen konsantrasyonu, serumda hiç fibrinojen olmadığı varsayılarak, plazma Fib0'daki fibrinojen konsantrasyonundan belirlendi. Bu nedenle, Fib = C Fib0, burada C, plazma-serum karışımındaki plazma hacim fraksiyonudur.
Tartışmalar
Otomatik protokolün verimli çalışması için, net bir arka plana ve uygun aydınlatmaya sahip olmak önemlidir. Koyu bir arka plan, verimli bir ikilileştirme eşiğinin varlığını engelleyebilir. Genellikle zamanla ortaya çıkan (artan) bazı hemolizli örnekler için, önce seçilen binarizasyon eşiğinin hem ilk hem de son resimler için uygun olduğunu doğrulamak önemlidir.
Resmin ikilileştirme süreci söz konusu olduğunda, YG ve ikilileştirme eşiğinin seçimi en hassas ad...
Açıklamalar
Yazarların bu makalenin içeriği ile ilgili beyanda bulunmak için çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Alman Araştırma Vakfı'nın FOR 2688 - Wa1336/12 araştırma birimi ve 860436-EVIDENCE sayılı Marie Skłodowska-Curie hibe anlaşması tarafından desteklenmiştir. T. J. ve C. W., Fransız Alman Üniversitesi'nden (DFH / UFA) fon aldığını kabul ediyor. A.D., Saarland Üniversitesi Genç Araştırmacı Bursu tarafından finanse edildiğini kabul ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anticoagulant (EDTA or Heparin) tube (for blood sample) | SARSTEDT | 267001 or 265 | Anticoagulated blood sample to characterize |
| Camera EOS M50 | Canon | Kit EF-M18-150 IS STM | Any camera should work, provided that sector alimentation, connection to computer for automated shooting and adapted objective are available |
| Centrifuge | HERMLE | 302.00 V03 - Z 36 HK | Requirements: at least 3000 x g ofr 7 min. |
| Micro-centrifuge | MLW | TH21 | or any other way to determine the hematocrit |
| Micro-hematocrit capilaries | Fisher scientific | 11884040 | or other capillaries/containers for hematocrit determination |
| Phosphate Buffered Saline (PBS) | ThermoFisher | 10010023 | 1x PBS, pH 7.4, 298 Osm |
| Pipettes (e.g. positive displacement pipette) | Gilson | FD10006 | Pipette required to manipulate blood and/or packed cells.Other models are of course suitable, but be careful to treat blood and pakced cells as highly viscous fluids. |
| Wax sealing plate | Hirschmann | 9120101 | Sealing wax for the micro-hematocrit capillaries |
| Westergren tubes | Praxindo | A9244560 | Any other standard Wetsergren tube should work too |
| White background with illumination | / | / | White sheet(s) of paper behind the samples, with usual room light is perfcetly sufficient. |
Referanslar
- Bedell, S. E., Bush, B. T. Erythrocyte sedimentation rate. From folklore to facts. The American Journal of Medicine. 78, 1001-1009 (1985).
- Grzybowski, A., Sak, J. Edmund Biernacki (1866-1911): Discoverer of the erythrocyte sedimentation rate. On the 100th anniversary of his death. Clinics in Dermatology. 29 (6), 697-703 (2011).
- Kushner, I., Mackiewicz, A. . The Acute Phase Response: An Overview. Acute Phase Proteins. , (1993).
- Tishkowski, K., Gupta, V. Erythrocyte Sedimentation Rate. StatPearls Publishing. , (2022).
- Menees, S. B., Powell, C., Kurlander, J., Goel, A., Chey, W. D. A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. The Americal Journal of Gastroenterology. 110 (3), 444-454 (2015).
- Brigden, M. L. Clinical utility of the erythrocyte sedimentation rate. Americal Family Physician. 60 (5), 1443-1450 (1999).
- Liu, S., et al. Preliminary case-control study to evaluate diagnostic values of C-reactive protein and erythrocyte sedimentation rate in differentiating active Crohn's disease from intestinal lymphoma, intestinal tuberculosis and Behcet's syndrome. The American Journal of the Medical Sciences. 346 (6), 467-472 (2013).
- Greidanus, N. V., et al. Use of erythrocyte sedimentation rate and C-reactive protein level to diagnose infection before revision total knee arthroplasty: A prospective evaluation. The Journal of Bone and Joint Surgery. 89 (7), 1409-1416 (2007).
- Flormann, D., Kuder, E., Lipp, P., Wagner, C., Kaestner, L. Is there a role of C-reactive protein in red blood cell aggregation. International Journal of Laboratory Hematology. 37 (4), 474-482 (2015).
- Brust, M., et al. The plasma protein fibrinogen stabilizes clusters of red blood cells in microcapillary flows. Scientific Reports. 4, 4348 (2014).
- Gray, S. J., Mitchell, E. B., Dick, G. F. Effect of purified protein fractions on sedimentation rate of erythrocytes. Proceedings of the Society for Experimental Biology and Medicine. 51 (3), 403-404 (1942).
- Kratz, A., et al. ICSH recommendations for modified and alternate methods measuring the erythrocyte sedimentation rate. International Journal of Laboratory Hematology. 39 (5), 448-457 (2017).
- Hung, W. T., Collings, A. F., Low, J. Erythrocyte sedimentation rate studies in whole human blood. Physics in Medicine and Biology. 39 (11), 1855-1873 (1994).
- Woodland, N. B., Cordatos, K., Hung, W. T., Reuben, A., Holley, L. Erythrocyte sedimentation in columns and the significance of ESR. Biorheology. 33 (6), 477-488 (1996).
- Holley, L., Woodland, N., Hung, W. T., Cordatos, K., Reuben, A. Influence of fibrinogen and haematocrit on erythrocyte sedimentation kinetics. Biorheology. 36 (4), 287-297 (1999).
- Dasanna, A. K., et al. Erythrocyte sedimentation: Effect of aggregation energy on gel structure during collapse. Physical Review. E. 105 (2-1), 024610 (2022).
- Darras, A., et al. Erythrocyte sedimentation: collapse of a high-volume-fraction soft-particle gel. Physical Review Letters. 128 (8), 088101 (2022).
- Darras, A., et al. Imaging erythrocyte sedimentation in whole blood. Frontiers in Physiology. 12, 729191 (2022).
- Darras, A., et al. Acanthocyte sedimentation rate as a diagnostic biomarker for neuroacanthocytosis syndromes: Experimental evidence and physical justification. Cells. 10 (4), 788 (2021).
- Rabe, A., et al. The erythrocyte sedimentation rate and its relation to cell shape and rigidity of red blood cells from chorea-acanthocytosis patients in an off-label treatment with dasatinib. Biomolecules. 11 (5), 727 (2021).
- Giavarina, D., Capuzzo, S., Pizzolato, U., Soffiati, G. Length of erythrocyte sedimentation rate (ESR) adjusted for the hematocrit: reference values for the TEST 1 method. Clinical Laboratory. 52 (5-6), 241-245 (2006).
- Bull, B. S. Is a standard ESR possible. Laboratory Medicine. 6 (11), 31-39 (1975).
- Bull, B. S., Brecher, G. An evaluation of the relative merits of the Wintrobe and Westergren sedimentation methods, including hematocrit correction. American Journal of Clinical Pathology. 62 (4), 502-510 (1974).
- Reinhart, W. H., Singh, A., Straub, P. W. Red blood cell aggregation and sedimentation: the role of the cell shape. British Journal of Haematology. 73 (4), 551-556 (1989).
- Jan, K., Usami, S., Smith, J. A. Influence of oxygen tension and hematocrit reading on ESRs of sickle cells: Role of RBC aggregation. Archives of Internal Medicine. 141 (13), 1815-1818 (1981).
- Issaq, H. J., Xiao, Z., Veenstra, T. D. Serum and plasma proteomics. Chemical Reviews. 107 (8), 3601-3620 (2007).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), 21230 (2011).
- . Proper Pipetting Techniques - DE Available from: https://www.thermofisher.com/de/de/home/life-science/lab-plasticware-supplies/lab-plasticware-supplies-learning-center/lab-plasticware-supplies-resource-library/fundamentals-of-pipetting/proper-pipetting-techniques.html (2023)
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Transaction on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Solomon, C., et al. A comparison of fibrinogen measurement methods with fibrin clot elasticity assessed by thromboelastometry, before and after administration of fibrinogen concentrate in cardiac surgery patients. Transfusion. 51 (8), 1695-1706 (2011).
- Norouzi, N., Bhakta, H. C., Grover, W. H. Sorting cells by their density. PLoS One. 12 (7), 0180520 (2017).
- Trudnowski, R. J., Rico, R. C. Specific gravity of blood and plasma at 4 and 37 degrees C. Clinical Chemistry. 20 (5), 615-616 (1974).
- Késmárky, G., Kenyeres, P., Rábai, M., Tóth, K. Plasma viscosity: A forgotten variable. Clinical Hemorheology and Microcirculation. 39 (1-4), 243-246 (2008).
- Teece, L. J., et al. Gels under stress: The origins of delayed collapse. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 458, 126-133 (2014).
- Lindström, S. B., Kodger, T. E., Sprakel, J., Weitz, D. A. Structures, stresses, and fluctuations in the delayed failure of colloidal gels. Soft Matter. 8 (13), 3657-3664 (2012).
- Bartlett, P., Teece, L. J., Faers, M. A. Sudden collapse of a colloidal gel. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 85, 021404 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır