Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Embriyonik ve Karaciğer Zebra Balığı Hücre Hatlarının Sferoidlerinin 3D Kültür Yöntemi
Bu Makalede
Özet
Burada, iki zebra balığı (Danio rerio) hücre hattının sferoidlerinin oluşumu için etkili, kolay ve hızlı bir 3D kültür protokolü sunuyoruz: ZEM2S (embriyo) ve ZFL (normal hepatosit).
Özet
Balık hücre hatları, ekotoksisite değerlendirmesi için in vitro modeller vaat etmektedir; Bununla birlikte, geleneksel tek katmanlı kültür sistemlerinin (2D kültür) iyi bilinen sınırlamaları vardır (örneğin, kültürün uzun ömürlülüğü ve bazı in vivo hücresel fonksiyonların bakımı). Bu nedenle, sferoidler gibi 3D kültürler önerilmiştir, çünkü bu modeller doku benzeri yapıları yeniden üretebilir ve in vivo koşulları daha iyi yeniden yakalayabilir. Bu makalede, iki zebra balığı (Danio rerio) hücre hattına sahip sferoidlerin oluşumu için etkili, kolay ve hızlı bir 3D kültür protokolü açıklanmaktadır: ZEM2S (embriyo) ve ZFL (normal hepatosit). Protokol, hücrelerin yuvarlak tabanlı, ultra düşük bir ataşman, 96 delikli bir plaka ile kaplanmasından oluşur. Orbital sarsıntı altında 5 gün sonra (70 rpm), kuyu başına tek bir sferoid oluşur. Oluşan sferoidler kararlı boyut ve şekil sunar ve bu yöntem bir kuyuda çoklu sferoidlerin oluşumunu önler; Bu nedenle, benzer boyutlardaki sferoidleri elle seçmek gerekli değildir. Bu sferoid yöntemin kolaylığı, hızı ve tekrarlanabilirliği, yüksek verimli in vitro testler için kullanışlı olmasını sağlar.
Giriş
Sferoidler, 3D kültürde hücreler yakın hücreden hücreye temasta kültürlendiğinde oluşan küçük hücre küreleridir. Sferoidlerin in vivo doku ortamını taklit etme kapasitesi, çeşitli hücre hatlarında ve birincil hücrelerde zaten incelenmiştir 1,2. Bununla birlikte, sferoidler memeli toksisitesi çalışmaları için iyi geliştirilmiş olmasına rağmen, memeli olmayan omurgalılarla (örneğin balık) toksisite çalışmaları için sferoidlerin geliştirilmesi hala devam etmektedir3. Balık hücre hatları için, sferoidler, farklı tipte kuyu plakaları 3,4,5,6,7 kullanan yörüngesel sallama (OS) ve manyetik nanopartiküller 8 kullanılarak manyetik kaldırma yöntemi gibi çeşitli farklı yöntemlerle geliştirilmiştir. Bununla birlikte, sferoidler için bu kültür yöntemlerinden bazıları diğerlerinden daha fazla dezavantaja sahip olabilir.
Örneğin, büyük mikroplakalardaki (24 kuyucuklu plakalar) girdat yöntemleri, boyut ve şekil bakımından farklılık gösteren çok sayıda sferoid üretebilir; Gerçekten de multi-sferoid yapı oluşumu gösterilmiştir7. Bu, bir deney için benzer boyut ve şekle sahip sferoidleri elle seçmek için yoğun çaba gerektirir. Asılı damla 3D kültür yöntemi, 1,2,9,10,11 memelihücre hatlarının sferoidlerini üretmek için yaygın olarak kullanılır, böylece damla başına tek küre üretilebilir ve yukarıda açıklanan sorunlardan kaçınılabilir. Bununla birlikte, modifiye edilmiş bir asılı damla yöntemi (asılı damla + yörüngesel sallama) ucuz bir yöntem kullanarak ZFL sferoidleri üretebilse de, dezavantajları vardır12. Oluşan hücresel agregalar damlalarda uzun süre muhafaza edilemez; Bu nedenle, kuyu plakalarına aktarılmaları gerekir. Bu işlem, laminer akış davlumbazında yoğun kullanım ve uzun süreli çalışma gerektirir, çünkü bir mikropipet12 kullanılarak damla damla gerçekleştirilir. Ek olarak, bu yöntem ZFL sferoidlerini tam olarak oluşturmak için 10 gün gerektirir (asılı damlada 5 gün + işletim sisteminde 5 gün)12. Bu dezavantajlar, özellikle kimyasal önceliklendirme ve ürün sürdürülebilirliği için potansiyel uygulamalar göz önüne alındığında, toksisite testi için 3D balık sferoidlerinin uygulanmasını sınırlayabilir.
Bu nedenle, bu makalede, 96 kuyulu, ultra düşük bağlantı plakalarının (ULA-plakaları) ve bir orbital çalkalayıcının (22 mm dönme çapı) kombine kullanımına dayanan ZFL (D. rerio normal hepatosit) ve ZEM2S (D. rerio blastula faz embriyosu) hücre hatlarının tek kürelerini üretebilen bir 3D kültür protokolü açıklanmaktadır. Uygulanan yöntem basit ve tekrarlanabilir ve kısa sürede (5 gün) benzer boyut ve şekilde çok sayıda sferoid üretebilir. Bu yöntemin avantajları, hem endüstride hem de akademide sucul toksisite çalışmaları için balık 3D modellerinin uygulanmasını ve ayrıca ekotoksisite testi için alternatif yöntemlerin uygulanmasındaki ilerlemeyi destekleyebilir.
Protokol
ZFL ve ZEM2S hücre hatlarının 3D sferoidlerini yuvarlak tabanlı 96 delikli bir plakada üretmek için temel adımlar Şekil 1'de sunulmuştur.
NOT: Bu protokolde kullanılan tüm malzemelerle ilgili ayrıntılar için Malzeme Tablosu'na ve bu protokolde kullanılan çözümler ve kültür ortamları için Tablo 1'e bakınız.
1. Hücre kültürü ortamı ve tek katmanlı kültürler
- Her iki hücre hattını da (ZFL, ZEM2S) CO2 olmadan 28 ° C'de bir inkübatörde tek katmanlı olarak büyütün ve ~% 80 birleşmeye ulaştıklarında 1: 3'lük bir alt yetiştirme oranında alt kültüre alın.
- Zebra balığı hücrelerinin T75 şişesi ile ~% 80 birleşimde, yukarıda tarif edildiği gibi kültürlenmiş olarak başlayın.
- Ortamın tamamını çıkarın ve bir pipet yardımıyla kültür şişesine 1x fosfat tamponlu salin (PBS) (0,01 M) ekleyerek hücreleri yıkayın.
- Bir pipet yardımıyla, kültür şişelerine 3 mL 1x tripsin-0,5 mM EDTA (% 0,05 [v / v]) ekleyin ve hücrelerin şişeden ayrılması için 3 dakika boyunca 28 ° C'de inkübe edin.
- Hücreleri serbest bırakmak için şişeye hafifçe dokunun ve ardından şişeye 3 mL tam kültür ortamı ekleyerek tripsin sindirimini durdurun.
- Bir pipet kullanarak, hücre süspansiyonunu 15 mL'lik bir konik santrifüj tüpüne aktarın ve 5 dakika boyunca 100 × g'da santrifüjleyin.
- Pelet oluşumundan sonra, süpernatanı dikkatlice çıkarın, kullanımdaki ilgili hücre hattı (ZFL veya ZEM2S) için 1 mL komple ortam ekleyin ve bir mikropipet kullanarak yeniden askıya alın. Hücre sayımı için bir aliquot alın.
2. Tripan mavisi boya dışlama testi ile hücre sayımı
- Hücreleri saymak ve canlılıklarını değerlendirmek için bir mikrotüpe 10 μL hücre süspansiyonu ve 10 μL tripan mavisi boya ekleyin. Hücre süspansiyonunu karıştırın ve bir pipet kullanarak boyayın.
- Daha sonra, bu karışımın 10 μL'sini (hücre süspansiyonu + tripan mavisi) bir Neubauer odasına aktarın ve tripan mavisini almayan hücreleri uygun olarak göz önünde bulundurarak, odanın köşelerine yerleştirilen dört büyük karedeki (kadran: Q) hücreleri sayın. Denklemi (1) kullanarak uygulanabilir hücrelerin sayısını hesaplayın:
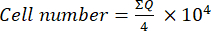 (1)
(1) - Hücre süspansiyonundaki son hücre sayısını hesaplamak için, denklem (1) kullanılarak belirlenen hücre numarasını 2 ile çarpın (tripan mavisi kullanımından kaynaklanan seyreltme faktörü).
NOT: Alternatif olarak, otomatik bir hücre sayma sistemi kullanılabilir.
3. Ula plakalarında hücre kaplaması
- Hücre numarasını hesapladıktan sonra, hücre süspansiyonunu, aşağıda belirtildiği gibi, her hücre hattı için gereken hücre sayısıyla, 96 delikli yuvarlak tabanlı bir Ula plakasının kuyucuğu başına bu süspansiyonun 200 μL'sini plakaya ayarlayın:
- Plaka 7.000 canlı ZFL hücresi / kuyusu; Bu nedenle, tüm Ula plakası için, 20 mL tam ortamda 700.000 hücre kullanın.
- Plaka 3.500 canlı ZEM2S hücresi / kuyusu; Bu nedenle, tüm Ula plakası için, 20 mL tam ortamda 350.000 hücre kullanın.
- Hücre süspansiyonunu, orta bir rezervuardaki ayarlanmış hücre konsantrasyonuyla hazırlayın ve köpük veya kabarcık oluşturmamaya dikkat ederek çok kanallı bir mikropipet kullanarak karıştırın. Çok kanallı mikropipeti kullanarak, Ula plakasının her bir kuyucuğuna 200 μL ayarlanmış hücre süspansiyonu ekleyin.
NOT: 96 delikli plakadan kültür ortamının buharlaşmasını önlemek için plaka parafilm veya yapışkan sızdırmazlık folyosu ile kapatılmalıdır.
4. Küresel oluşum
- Ula plakasını 28 ° C'lik bir inkübatörde 5 gün boyunca 70 rpm'de bir orbital çalkalayıcı üzerinde inkübe edin. Sferoidlerin 5 gün boyunca orbital sallanma oluşturmasına izin verin (Şekil 2), ortalama ~225 μm çapında (ZFL sferoidler) ve ~226 μm çapında (ZEM2S sferoidler)12 boyuta ulaşın.
NOT: 5 günlük inkübasyondan sonra (maksimum dairesellik), sferoidler kullanıma hazırdır. - Sferoidleri kültürde 5 günden fazla tutmak için, harcanan ortamın 100 μL'sini her 5 günde bir çıkarın ve çok kanallı bir mikropipet kullanarak 100 μL taze tam kültür ortamı ekleyin.
NOT: Bu işlem sırasında sferoidleri aspire etmemeye dikkat edin.
5. Sferoidlerin boyut (çap) ve şeklinin (dairesellik indeksi) ölçülmesi
- Görüntüleri alın.
- Bir görüntüleme yakalama sistemine sahip ters çevrilmiş bir ışık mikroskobu altında, tanımlanmış bir ölçekte bir görüntü elde edin.
NOT: Teraziyi elde etmek için mikroskop aşaması kalibrasyon slaydı veya Neubauer slaydını (kadran boyutlarının bilindiği) kullanın. - Mikroskop altında ve ölçeğin resmini elde etmek için kullanılan aynı objektif lensi kullanarak, tam olarak oluşturulmuş sferoidlerin (yani, 5 günlük sferoidlerin) görüntülerini elde edin.
NOT: Tüm görüntüler aynı görüntüleme yakalama sistemi kullanılarak çekilmelidir, çünkü görüntü çözünürlüğü sferoidlerin boyutunu ve şeklini belirlemek için önemlidir ve sistem türleri arasında farklılık gösterebilir.
- Bir görüntüleme yakalama sistemine sahip ters çevrilmiş bir ışık mikroskobu altında, tanımlanmış bir ölçekte bir görüntü elde edin.
- Ölçeği ayarlayın.
- ImageJ yazılımını kullanarak, tanımlanan ölçeğin görüntüsünü açın ( Dosya | aç'a tıklayın).
- Araç çubuğundan düz çizgi seçiciyi seçin ve fareyi kullanarak görüntüdeki tanımlı ölçeğin uzantısı boyunca bir çizgiyi sürükleyin.
- Analiz | Ölçeği ayarlayın ve Ölçeği Ayarla penceresinin açılmasını bekleyin.
- Ölçeği Ayarla penceresinde, Bilinen mesafe boşluğunu düz çizgiye karşılık gelen bilinen mesafe (μm) ile doldurun; μm için Uzunluk birimini um ile doldurun.
NOT: Piksel/μm cinsinden ölçek pencerenin alt kısmında görüntülenir.
- Ölçüm parametrelerini ayarlayın.
- ImageJ yazılımında Analiz | Ölçüleri ayarla penceresini açmak için ölçüleri ayarlayın .
- Ölçümleri ayarla penceresinde, istenen ölçümler için kutuları seçin (örneğin, Alan ve Şekil tanımlayıcıları). Tamam'ı tıklatın.
- Sferoidlerin çapını ve daireselliğini elde edin.
- Bir kürenin resmini açın (Dosya | Açık).
- Araç çubuğunda serbest seçim aracını seçin ve fareyi kullanarak Şekil 3A'da gösterildiği gibi kürenin dış tarafını seçin.
NOT: Görüntüyü yakınlaştırmak veya uzaklaştırmak için, Ctrl tuşuna basın ve fareyi kullanarak aşağı veya yukarı kaydırın veya Ctrl tuşuna basın ve klavyedeki yukarı veya aşağı ok tuşlarını kullanın. - Analiz Et'i seçin | Ölçü Ölçüm, ölçülen değerlerin görüntülendiği Sonuçlar penceresini açmak için kullanılır.
- Alan değerini kullanarak, denklemi (2) kullanarak kürelerin boyutunu (çapını) hesaplayın:
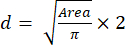 (2)
(2) - Dairesellik indeksi, Sonuçlar penceresinde "Dairesel" olarak verilir ve yazılım tarafından denklem (3) kullanılarak otomatik olarak hesaplanır:
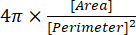 (3)
(3)
NOT: 1.0'ın dairesellik indeksi mükemmel bir küresel şekli temsil ederken, 0.0'a yakın bir değer uzatılmış bir şekil13'ü gösterir.
Sonuçlar
Bu yöntemle sabit bir boyut ve şekle sahip kuyu başına tek küre başı kullanılır. Şekil 2, ZFL ve ZEM2S hücrelerinin tek sferoidlerinin yörüngesel sarsıntı (70 rpm) altında bir Ula plakasının bir kuyucuğunda oluşum sürecini göstermektedir. ZFL ve ZEM2S hücre hatları 3D kültürde farklı davranışlara sahiptir. ZEM2S hücre hattı, orbital sarsıntının ilk gününden itibaren kolayca küresel bir şekil oluşturma yeteneği veren özellikler sunarken (Şekil
Tartışmalar
Bu, zebra balığı karaciğer ve embriyo hücre hatlarının kürelerini üretmek için basit, kolay ve hızlı bir yöntemdir. Bu yöntem, bu grup tarafından, küresel oluşum ile ilgili bilimsel çalışmalarda bildirilen sorunların üstesinden gelmek için mevcut 3D sferoid yöntemlerin modifikasyonlarına ve 3D sferoid tahlillerden elde edilen veri doğruluğundaki belirsizliklere dayanarak geliştirilmiştir. Örneğin, bildirilen sorunlar, sferoidlerin üretilmesinin zaman alıcı doğası, bir tahlil yapmak iç...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışmanın ortak yazarı Dr. Márcio Lorencini'nin anısına, kozmetik alanında mükemmel bir araştırmacı ve Brezilya'da kozmetik araştırmaları teşvik etmeye adanmıştır. Yazarlar, ekipman kullanılabilirliği ve Yüksek Öğrenim Personelinin İyileştirilmesi Koordinasyonu (CAPES, Brezilya) (Finans Kodu 001) ve Grupo Boticário'nun finansal desteği için Fizyoloji Bölümü'ndeki (UFPR) Çok Kullanıcılı Laboratuvara minnettardır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate, Individually Wrapped, with Lid, Sterile | Corning | 7007 | |
| DMEM, powder, high glucose, pyruvate | Gibco | 12800-017 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | |
| HEPES (1M) | Gibco | 15630080 | |
| Image Processing and analysis in Java (ImageJ) 1.52p software | National Institutes of Health, USA | Available at: https://imagej.nih.gov/ij/index.html | |
| Leibovitz's L-15 Medium, powder | Gibco | 41300021 | |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10x) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| RPMI 1640 Medium | Gibco | 31800-014 | |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate, powder, bioreagent for molecular biology | Sigma-Aldrich | S5761 | |
| Trypan blue stain (0,4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
Referanslar
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research. Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, N. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology and Bioengineering. 83 (2), 173-180 (2003).
- Baron, M. G., Purcell, W. M., Jackson, S. K., Owen, S. F., Jha, A. N. Towards a more representative in vitro method for fish ecotoxicology: morphological and biochemical characterisation of three-dimensional spheroidal hepatocytes. Ecotoxicology. 21 (8), 2419-2429 (2012).
- Alves, R. F., Rocha, E., Madureira, T. V. Fish hepatocyte spheroids - A powerful (though underexplored) alternative in vitro model to study hepatotoxicity. Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 262, 109470 (2022).
- Baron, M. G., et al. Pharmaceutical metabolism in fish: using a 3-D hepatic in vitro model to assess clearance. PloS One. 12 (1), 0168837 (2017).
- Langan, L. M., et al. Spheroid size does not impact metabolism of the β-blocker propranolol in 3D intestinal fish model. Frontiers in Pharmacology. 9, 947 (2018).
- Lammel, T., Tsoukatou, G., Jellinek, J., Sturve, J. Development of three-dimensional (3D) spheroid cultures of the continuous rainbow trout liver cell line RTL-W1. Ecotoxicology and Environmental Safety. 167, 250-258 (2019).
- Jeong, Y., et al. Differential effects of CBZ-induced catalysis and cytochrome gene expression in three dimensional zebrafish liver cellculture. Journal of Environmental and Analytical Toxicology. 6, 2161 (2016).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), e2720 (2011).
- Lee, W. G., Ortmann, D., Hancock, M. J., Bae, H., Khademhosseini, A. A hollow sphere soft lithography approach for long-term hanging drop methods. Tissue Engineering. Part C, Methods. 16 (2), 249-259 (2010).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods in Molecular Medicine. 140, 141-151 (2007).
- de Souza, I. R., et al. Development of 3D cultures of zebrafish liver and embryo cell lines: a comparison of different spheroid formation methods. Ecotoxicology. 30 (9), 1893-1909 (2021).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 151-161 (2012).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2022)
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Gajski, G., et al. Genotoxic potential of selected cytostatic drugs in human and zebrafish cells. Environmental Science and Pollution Research International. 23 (15), 14739-14750 (2016).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Mueller-Klieser, W. Method for the determination of oxygen consumption rates and diffusion coefficients in multicellular spheroids. Biophysical Journal. 46 (3), 343-348 (1984).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Ho, R. K., Kimmel, C. B. Commitment of cell fate in the early zebrafish embryo. Science. 261 (5117), 109-111 (1993).
- Biswas, S., Emond, M. R., Jontes, J. D. Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. The Journal of Cell Biology. 191 (5), 1029-1041 (2010).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır