Method Article
Rastreamento de limiar elétrico de circuito fechado em tempo fechado de código aberto para pesquisa translacional da dor
Neste Artigo
Resumo
APTrack é um plugin de software desenvolvido para a plataforma Open Ephys que permite a visualização de dados em tempo real e o rastreamento do limiar elétrico em malha fechada de potenciais de ação neuronais. Nós usamos isso com sucesso em microneurografia para nociceptores de fibra C humana e nociceptores de fibra C e fibra Aδ de camundongo.
Resumo
Nociceptores são uma classe de neurônios aferentes primários que sinalizam estímulos nocivos potencialmente nocivos. Um aumento na excitabilidade do nociceptor ocorre em condições de dor aguda e crônica. Isso produz atividade contínua anormal ou limiares de ativação reduzidos para estímulos nocivos. A identificação da causa desse aumento da excitabilidade é necessária para o desenvolvimento e validação de tratamentos baseados em mecanismos. O rastreamento do limiar elétrico de um único neurônio pode quantificar a excitabilidade do nociceptor. Por isso, desenvolvemos um aplicativo para permitir tais medições e demonstrar seu uso em humanos e roedores. O APTrack fornece visualização de dados em tempo real e identificação do potencial de ação usando um gráfico raster temporal. Algoritmos detectam potenciais de ação por cruzamento de limiares e monitoram sua latência após estimulação elétrica. O plugin então modula a amplitude da estimulação elétrica usando um método up-down para estimar o limiar elétrico dos nociceptores. O software foi construído sobre o sistema Open Ephys (V0.54) e codificado em C++ usando o framework JUCE. Ele roda em sistemas operacionais Windows, Linux e Mac. O código fonte aberto está disponível (https://github.com/
Introdução
Os nociceptores são neurônios aferentes primários do sistema nervoso periférico que são ativados por eventos evidentes ou potencialmente lesivos aos tecidos e desempenham um papel protetor crítico na dor aguda1. Registros eletrofisiológicos de nociceptores de fibra C e Aδ em modelos animais, voluntários humanos saudáveis e pacientes têm revelado sensibilização e atividade espontânea anormal em diversas condições de dor 2,3,4,5,6,7. A compreensão dos mecanismos subjacentes a essas alterações na excitabilidade do nociceptor em pacientes poderia possibilitar intervenções terapêuticas direcionadas8. No entanto, existem poucos instrumentos para avaliar diretamente a excitabilidade do nociceptor, particularmente em pacientes9, mas o potencial para a utilidade de tais ferramentas é bem reconhecido10,11.
O rastreamento do limiar elétrico do nervo inteiro pode ser usado para examinar a excitabilidade axonal em humanos12. Entretanto, como neurônios periféricos grandes e mielinizados contribuem desproporcionalmente para a amplitude do potencial de ação do composto sensorial, o rastreamento do limiar elétrico do nervo inteiro não permite a avaliação da função das fibras C11,13. De fato, em um estudo anterior, o rastreamento do limiar elétrico do nervo total em coortes de dor neuropática crônica com neuropatia diabética e polineuropatia induzida por quimioterapia não mostrou diferenças na excitabilidade axonal11.
Em um estudo anterior, o rastreamento do limiar elétrico no nível de um único neurônio foi usado para examinar a excitabilidade de nociceptores de fibra C durante registros de fibras provocadas em uma preparação ex vivo pele-nervo de rato14. Os autores demonstraram que o aumento da concentração de potássio, as condições ácidas e a bradicinina aumentaram a excitabilidade do nociceptor da fibra C, refletido por um limiar elétrico reduzido para a geração do potencial de ação. Além disso, o aquecimento do campo receptivo dos nociceptores sensíveis ao calor reduziu seu limiar elétrico, enquanto os nociceptores insensíveis ao calor exibiram um aumento em seu limiar elétrico14. Isso fornece uma prova importante de que o rastreamento do limiar elétrico de um único neurônio é possível e pode ser útil, mas atualmente não há soluções de software e/ou hardware disponíveis para permitir tais investigações, particularmente para estudos em humanos.
Em humanos, a microneurografia é o único método disponível para avaliar diretamente as propriedades eletrofisiológicas das fibras C15. Essa abordagem tem sido utilizada para demonstrar disfunção nociceptora em pacientes com dor crônica 2,3,4,5,6,7. A microneurografia pode detectar potenciais de ação de um único neurônio; no entanto, devido à baixa relação sinal-ruído, os pesquisadores utilizam a técnica de marcação para caracterizar a atividade da fibra C16. Na técnica de marcação, a estimulação elétrica supralimiar é aplicada aos campos receptivos de fibra C na pele. Essa estimulação elétrica gera um potencial de ação que ocorre em latência constante, determinada pela velocidade de condução da fibra C. As fibras C apresentam lentificação dependente da atividade, em que sua velocidade de condução diminui e, portanto, sua latência de condução aumenta durante os períodos de descarga do potencial de ação17. Em condições basais, as fibras C normalmente não geram potenciais de ação na ausência de estímulos nocivos e, portanto, sua latência de condução em resposta à estimulação elétrica de baixa frequência é constante. Estímulos mecânicos, térmicos ou farmacológicos, que evocam disparo, induzem lentificação dependente da atividade, o que aumenta a latência dos potenciais de ação evocados pela estimulação elétrica de baixa frequência concomitante. Isso permite a identificação objetiva das respostas aos estímulos não elétricos aplicados no contexto de uma baixa relação sinal-ruído. Portanto, a lentificação dependente da atividade pode ser usada para caracterizar funcionalmente as fibras C16. De fato, diferentes classes funcionais de fibras C exibem padrões distintos de lentificação dependente da atividade nos paradigmas de estimulação elétrica que envolvem a variação da frequência de estimulação18,19. Essa variabilidade na latência dos potenciais de ação da fibra C representa um desafio para algoritmos projetados para monitorá-los.
A atividade contínua em um nociceptor leva ao aumento da variabilidade em sua latência durante a estimulação elétrica de baixa frequência, e isso é novamente devido à lentificação dependente da atividade. Essa variabilidade aumentada, ou jitter, é uma medida proxy quantificável da excitabilidade2. Outras causas de variabilidade na latência do potencial de ação incluem o flip-flop, em que ramos terminais alternados de um único neurônio são estimulados, o que faz com que o potencial de ação evocado tenha duas (ou mais) latências basais mutuamenteexclusivas 20. Finalmente, mudanças na temperatura dos ramos terminais de um neurônio periférico também causam mudanças na latência do potencial de ação de forma termodinâmica, com o aquecimento aumentando a velocidade de condução e o resfriamento diminuindo a velocidade de condução19. Assim, qualquer software que busque realizar o rastreamento do limiar elétrico em malha fechada de fibras C nociceptivas deve permitir mudanças na latência dos potenciais de ação evocados eletricamente.
Para atingir nosso objetivo de rastreamento de limiar elétrico entre espécies de nociceptores de fibra C, desenvolvemos o APTrack, um plugin de software de código aberto para a plataforma Open Ephys21, para permitir rastreamento de limiar elétrico em tempo real, de malha fechada, e rastreamento de latência. Fornecemos dados de prova de conceito demonstrando que o rastreamento do limiar elétrico do nociceptor de fibra C durante a microneurografia humana é possível. Além disso, mostramos que esta ferramenta pode ser utilizada em eletrofisiologia ex vivo de roedores, possibilitando estudos translacionais entre humanos e roedores. Aqui, descreveremos em detalhes como os pesquisadores podem implementar e usar essa ferramenta para auxiliar seu estudo da função e excitabilidade do nociceptor.
Protocolo
Os experimentos de microneurografia humana foram aprovados pelo Comitê de Ética em Pesquisa da Faculdade de Ciências da Vida da Universidade de Bristol (número de referência: 51882). Todos os participantes do estudo assinaram o termo de consentimento livre e esclarecido. Os experimentos com animais foram realizados na Universidade de Bristol de acordo com o UK Animals (Scientific Procedures) Act 1986 após aprovação pelo Comitê de Bem-Estar Animal e Revisão Ética da Universidade de Bristol e foram cobertos por uma Licença de Projeto.
1. Instalando o Open Ephys GUI e APTrack
- Verifique a documentação do software para localizar a versão mais recente da interface gráfica do usuário (GUI) do Open Ephys que é suportada (https://github.com/Microneurography/APTrack#readme) e, em seguida, baixe e instale a GUI.
- Instale uma versão compatível da GUI a partir da seguinte URL: https://github.com/open-ephys/plugin-GUI/releases.
- Baixe a versão mais recente do GitHub: https://github.com/Microneurography/APTrack/releases. Para um computador Windows, copie o arquivo .dll para a pasta plug-ins, que geralmente é encontrada em C:\Program Files\Open Ephys\plugins. Para um computador MacOS, copie o arquivo .bundle para a pasta Contents/PlugIns do pacote.
2. Montagem do aparelho de gravação e estimulação
- Conecte a placa de aquisição ao computador usando o cabo fornecido pelo fabricante e ligue-a.
NOTA: Para a microneurografia humana, um isolador USB 3.0 foi usado para isolar eletricamente o participante do computador, e a placa de aquisição foi alimentada por uma bateria portátil, em oposição à fonte de alimentação de tensão de rede usada para estudos com roedores. Todas as conexões USB, excluindo a placa de controle do motor de passo, foram passadas através do isolador USB durante os estudos em humanos. - Conecte a placa de E/S à porta de entrada analógica na placa de aquisição. Conecte um headstage de gravação Intan RHD à placa de aquisição usando um cabo de interface serial-periférica (SPI).
NOTA: O headstage bipolar de 16 canais Intan foi usado aqui, mas outros headstages monopolares da série RHD2000 podem ser usados. - Conecte o PulsePal ao computador22. Para montagem com um estimulador analógico controlado por tensão (por exemplo, um DS4) usando um PulsePal, como acontece com as gravações de fibra provocada do mouse, siga as etapas 2.5.1-2.5.3; para montagem com um estimulador baseado em encoder rotativo (por exemplo, um DS7) usando um motor de passo, como com os registros de microneurografia humana, siga as etapas 2.6.1-2.6.8 (Figura 1).
- Crie a cadeia de sinais na GUI conforme descrito abaixo.
- Insira o plugin Rhythm FPGA na cadeia de sinais, clicando com o botão esquerdo do mouse e arrastando-o para a cadeia de sinais; isso conecta a GUI à placa de aquisição. Verifique se o botão ADC foi clicado para iniciar a gravação dos canais ADC a partir da placa de E/S. O botão ADC acenderá em laranja quando estiver ligado.
NOTA: Se você deseja reproduzir dados experimentais gravados anteriormente, o plugin File Reader pode ser usado no início em vez de Rhythm FPGA. O uso disso em combinação com o APTrack permitirá a visualização e o rastreamento de latência dos potenciais de ação em experimentos anteriores. - Insira um filtro passa-banda na cadeia de sinais; as configurações padrão de 300-6.000 Hz são adequadas para gravações humanas e de mouse. Além disso, insira um divisor após ele.
- Insira o plugin APTrack na cadeia de sinais de um lado do divisor e no LFP Viewer do outro lado. O LFP Viewer fornece uma visão tradicional de rastreamento de tensão semelhante a um osciloscópio, que é útil durante experimentos.
- Insira um nó de registro após o plug-in. No menu suspenso, altere o formato de salvamento de dados de binário para Open Ephys. Isso completa uma cadeia de sinais simples que funciona bem (Figura 2); no entanto, componentes adicionais podem ser adicionados conforme determinado por requisitos experimentais.
NOTA: Se o nó de registro for colocado antes do plug-in na cadeia de sinais, as informações de rastreamento de potencial de ação não serão salvas. - No canto superior direito da GUI, clique no botão play para começar a transmitir dados da placa de aquisição e visualizá-los. Para iniciar a gravação, clique no botão de gravação circular ao lado do botão de reprodução.
NOTA: É fácil esquecer de clicar no registro; registramos os dados desde o momento em que começamos a adquirir para evitar que isso aconteça.
- Insira o plugin Rhythm FPGA na cadeia de sinais, clicando com o botão esquerdo do mouse e arrastando-o para a cadeia de sinais; isso conecta a GUI à placa de aquisição. Verifique se o botão ADC foi clicado para iniciar a gravação dos canais ADC a partir da placa de E/S. O botão ADC acenderá em laranja quando estiver ligado.
- Para montagem com um estimulador analógico controlado por tensão, siga as etapas descritas abaixo.
- Ligue um estimulador de corrente constante que tem sua amplitude de estimulação controlada por uma entrada de tensão analógica. Neste caso, foi utilizado o DS4 (Figura 1).
- O canal de saída 1 do PulsePal é para o comando de tensão analógica. Divida esse sinal usando um divisor T BNC e, em seguida, conecte-o à entrada do estimulador de corrente constante e à placa de E/S para que a tensão de comando seja registrada.
- O canal de saída 2 do PulsePal é para o marcador de eventos TTL de estimulação elétrica. Conecte-o à placa de E/S para que os marcadores de eventos TTL de estimulação sejam gravados para o plugin a ser usado e para a análise post hoc.
- Para montagem com um estimulador analógico controlado por tensão, siga as etapas descritas abaixo.
- Ligue um estimulador de corrente constante que tem sua amplitude de estimulação controlada por um seletor codificador rotativo. Neste caso, foi utilizado o DS7 (Figura 1).
- Conecte a placa de controle do motor de passo ao motor de passo usando o cabo fornecido pelo fabricante e o suporte magnético.
- Conecte a placa de controle ao computador diretamente usando qualquer cabo USB A para USB micro-B padrão. Não conecte a placa de controle no lado participante do isolador USB, pois ela também está conectada a uma fonte de alimentação de 12 V.
- Se for a primeira vez usando a placa de controle, carregue o script do motor de passo do GitHub para a placa de controle; Isso só precisa ser feito uma vez, ou se alguma atualização de software para o script do motor de passo for lançada.
- Ajuste o seletor de amplitude de estimulação no estimulador de corrente constante para 0 mA. Use um suporte de montagem personalizado para fazer a interface entre o motor de passo e o mostrador de amplitude de estimulação. Eles podem ser impressos em 3D, o que permite soluções de montagem baratas, rápidas e personalizáveis. Consulte o GitHub para ver se uma montagem já foi projetada para o estimulador de escolha.
- Use um adaptador de barril personalizado para conectar o barril do motor de passo ao seletor de controle de amplitude de estimulação. Estes adaptadores devem ser construídos em metal por razões de resistência e durabilidade; no entanto, as peças impressas em 3D também seriam adequadas, embora possam precisar ser substituídas regularmente. Consulte o GitHub para ver se um adaptador de barril já foi projetado para o estimulador de escolha.
- Conecte livremente a placa de controle/o aparelho do motor de passo ao mostrador de controle do estimulador usando um adaptador de montagem e barril personalizados.
NOTA: O adaptador de montagem e barril será apertado mais tarde, uma vez que o software tenha sido iniciado e o motor de passo, automaticamente, definido para a posição zero. - Conecte o PulsePal conforme descrito nas etapas de protocolo 2.5.2-2.5.3 (menos conectar o canal de saída 1 a um estimulador), pois a geração de marcadores de eventos TTL ainda é necessária para a análise e para o plugin funcionar. Além disso, conecte o canal de saída 2 ao estimulador DS7 para acioná-lo.
- Prepare a preparação pele-nervo do rato conforme descrito abaixo.
- Fornecer alimento e água ad libitum a camundongos C57BL/6J (Charles River Laboratories, Reino Unido, neste estudo) de 2-4 meses de idade e de ambos os sexos.
- Após o abate por overdose de anestésico através de injeção intraperitoneal de pentobarbital sódico (≥200 mg/kg) e confirmação da cessação da circulação, dissecar a pele da face dorsal da pata posterior de camundongo e do nervo safeno, que inerva essa área, utilizando os métodos descritos por Zimmermann et al.23.
- Manter a preparação pele-nervo em líquido intersticial sintético carbogenado, (Tabela 1), a 30-32 °C em metade de um banho de acrílico de câmara dupla personalizado (taxa de perfusão de 15 mL/min, volume de 30 mL). Rosqueie o nervo através de um pequeno orifício na câmara cheia de óleo mineral e sele com vaselina. O óleo fornece um ambiente de gravação isolado.
- Retire dois filamentos finos do tronco do nervo usando pinças super finas e pendure um de cada lado de um eletrodo de gravação bipolar de prata/cloreto de prata.
- Digitalize e amplie o sinal neural usando um headstage bipolar RHD2216 de 16 canais e processe-o usando a placa de aquisição. Faça uma amostragem do sinal em 30 kHz, com um filtro passa-banda de 300-6.000 Hz, e visualize-o usando a GUI.
- Usando uma haste de vidro romba, acaricie a pele da preparação. Use a atividade de massa de baixa amplitude para confirmar que a preparação está viva.
- Realizar microneurografia de fibra C humana conforme descrito abaixo.
- Realizar microneurografia com os participantes que assinaram o termo de consentimento livre e esclarecido, conforme descrito anteriormente24.
- Com o participante sentado, reclinado confortavelmente em uma cama e apoiado com travesseiros, identifique o nervo fibular superficial por meio de um scanner de ultrassom e marque uma área alvo aproximadamente 5-10 cm proximal ao maléolo lateral, ao redor do nível médio da canela.
- Esterilizar a pele ao redor da área alvo usando uma clorexidina a 2% em lenço de álcool a 70% e inserir um eletrodo de referência estéril por via subcutânea perto do local de registro pretendido no nível médio da canela.
- Inserir um eletrodo de gravação estéril no nervo fibular superficial sob orientação ultrassonográfica dentro da área alvo.
- Digitalize e amplie o sinal neural usando um headstage bipolar RHD2216 de 16 canais e processe-o usando a placa de aquisição. Faça uma amostragem do sinal em 30 kHz, com um filtro passa-banda de 300-6.000 Hz, e visualize-o usando a GUI.
NOTA: O equipamento de aquisição foi isolado eletricamente do laptop por um isolador USB 3.0 com isolação de 5 kV RMS e alimentado através de uma fonte de alimentação de bateria personalizada de 12 V. - Confirme o posicionamento intraneural bem-sucedido acariciando suavemente a pele para revelar atividade de massa evocada mecanicamente. Além disso, os participantes geralmente relatam parestesia na face dorsolateral do pé após o posicionamento intraneural bem-sucedido.
3. Configuração do software e identificação e fenotipagem de neurônios periféricos
- Configure o software conforme descrito abaixo.
- Abra a GUI (Figura 3). Se a placa de controle do motor de passo estiver conectada ao seu PC, ela será detectada e configurada para a posição zero. Aperte o adaptador de montagem e barril personalizados descritos nas etapas 2.6.5-2.6.7, pois o mostrador de amplitude de estimulação e o motor de passo do estimulador estão ambos ajustados para zero.
NOTA: Se o motor de passo e o mostrador de amplitude de estimulação não estiverem ambos "zerados", isso pode resultar no motor de passo tentando desligar o seletor de controle de seu alcance, o que pode causar danos. - No menu de opções, selecione o Canal de disparo. Escolha o canal ADC que contém o marcador TTL de estimulação elétrica do canal de saída 2 do PulsePal.
- No menu de opções, selecione o Canal de Dados e escolha o canal que contém os dados eletrofisiológicos.
- No painel de controle de estimulação, defina as amplitudes de estimulação inicial, mínima e máxima usando o controle deslizante. Certifique-se de que a estimulação de corrente esteja definida acima de 0 para que os marcadores TTL sejam gerados.
Observação : alguns estimuladores têm uma relação de escala de entrada para saída que não é 1:1; Considere isso ao selecionar uma amplitude de estimulação apropriada. Por exemplo, uma relação de saída de 1:10 pode ser selecionada em alguns sistemas de estimulação para obter uma saída mais alta do estimulador de corrente constante. - No painel de controle de estimulação, clique em F para carregar um arquivo contendo as instruções de estimulação. Os protocolos de estimulação elétrica são armazenados como arquivos de valores separados por vírgulas (CSV) compostos pelas frequências e duração de estimulação desejadas, o que permite aos usuários criar paradigmas complexos de estimulação para seus experimentos. Um modelo de exemplo está disponível aqui: https://github.com/Microneurography/APTrack/blob/main/example_playlist.csv
- No painel de controle de estimulação, clique em > para iniciar o paradigma de estimulação carregada. Por padrão, o APTrack solicita que o PulsePal gere pulsos de onda quadrada positiva de 0,5 ms de duração de amplitudes variáveis para controlar a amplitude de estimulação do estimulador de corrente constante.
- O gráfico raster temporal começará a ser atualizado com a resposta à estimulação elétrica, com cada nova resposta de estimulação sendo exibida como uma nova coluna à direita.
- Abra a GUI (Figura 3). Se a placa de controle do motor de passo estiver conectada ao seu PC, ela será detectada e configurada para a posição zero. Aperte o adaptador de montagem e barril personalizados descritos nas etapas 2.6.5-2.6.7, pois o mostrador de amplitude de estimulação e o motor de passo do estimulador estão ambos ajustados para zero.
- Visualize e identifique potenciais de ação de um único neurônio.
- Para a detecção bem-sucedida de potenciais de ação de um único neurônio, é importante ter limiares de imagem adequados definidos. No painel de gráfico de raster temporal, ajuste os valores de limite de imagem baixo, detecção e alto.
- Selecione um esquema de cores no menu de opções. No modo WHOT (White Hot) (padrão), as tensões abaixo do limite baixo da imagem são codificadas em preto. As tensões entre a imagem baixa e os limiares de detecção são codificadas em escala de cinza. As tensões acima do limite de detecção são codificadas em verde e as tensões acima do limite de imagem alto são codificadas em vermelho.
- Os neurônios periféricos exibem respostas de latência constantes em baixas frequências de estimulação (<0,25 Hz), e essas respostas são determinadas pela velocidade de condução e pela distância entre os locais de estimulação e registro. Com os limites de imagem adequados, os eventos de cruzamento de limiar detectados pelos algoritmos serão codificados em verde (Figura 4).
- Mover sistematicamente o eletrodo estimulador ao redor da área da pele inervada pelo nervo que está sendo registrado, permitindo um mínimo de três eventos de estimulação em cada local. Monitorar o gráfico raster temporal para eventos de cruzamento de limiar (marcados em verde) que ocorrem no mesmo ponto de tempo após cada evento de estimulação elétrica.
OBS: Em camundongos, foi utilizado um estímulo de busca de 5 mA. Em humanos, a amplitude do estímulo de busca elétrica transcutânea foi titulada para uma classificação de dor verbal tal que nunca excedeu 7/10. - Verificar se há três eventos de cruzamento de limiar (barras verdes) que aparecem em uma linha na mesma latência e na mesma posição de estimulação; Isso indica a identificação de um potencial de ação do neurônio periférico.
- Otimize a posição do eletrodo estimulador identificando o ponto eletricamente mais sensível do campo receptivo do neurônio-alvo e, em seguida, fixe o eletrodo na posição. Neste ponto da microneurografia humana, passe a usar agulhas de eletroacupuntura intradérmica (0,2 mm de diâmetro) para estimulação elétrica bipolar, em camundongos, uma sonda estimulante transcutânea personalizada é usada para que a posição de estimulação seja constante.
- Para a detecção bem-sucedida de potenciais de ação de um único neurônio, é importante ter limiares de imagem adequados definidos. No painel de gráfico de raster temporal, ajuste os valores de limite de imagem baixo, detecção e alto.
- Realizar classificação e fenotipagem sensorial dos neurônios periféricos.
- Estimar o limiar elétrico do potencial de ação alvo ajustando a amplitude da simulação manualmente ou usando APTrack, se desejado (descrito nas etapas 4.1-4.2).
- Estimular o campo receptivo a 2x o limiar elétrico estimado a uma frequência de 0,25 Hz durante todo o protocolo de fenotipagem sensorial.
- Calcular a velocidade de condução do neurônio dividindo a distância de condução pela latência de condução. As fibras C podem ser identificadas por uma velocidade de condução de ≤2 m/s.
- Estimular mecanicamente o campo receptivo usando filamentos de von Frey para determinar o limiar mecânico de ativação. A mecanossensação pode ser identificada por potenciais de ação evocados visíveis no traço de voltagem e aumento da latência do neurônio, se for uma fibra C, com força suficiente.
- Aqueça o campo receptivo do neurônio, observando novamente potenciais de ação visíveis no traço de voltagem e um aumento na latência do neurônio, se for uma fibra C, mediante aplicação de calor suficiente. Neurônios insensíveis ao calor exibirão uma diminuição na latência devido ao efeito termodinâmico na propagação axonal.
NOTA: Na microneurografia humana, use um TSC-II para controle térmico rápido e preciso. Na preparação do rato, adicione fluido intersticial sintético aquecido ou refrigerado a uma câmara de isolamento de alumínio colocada sobre o campo receptivo para permitir o acesso aos terminais do neurónio, restringindo a rápida dissipação de calor no fluido circundante. Registre a temperatura usando um termopar. - Resfriar o campo receptivo, observando novamente os potenciais de ação visíveis no traço de tensão e um aumento acentuado na latência do neurônio, se for uma fibra C, mediante aplicação de frio suficiente. Todos os neurônios exibirão um aumento na latência devido ao efeito termodinâmico na propagação axonal, portanto, tenha cuidado ao rotular os neurônios como sensíveis ao frio com base em um aumento de latência sozinho.
4. Rastreamento de latência e limiar elétrico
- Execute o rastreamento de latência conforme descrito abaixo.
- Após a identificação do(s) potencial(es) de ação de neurônio único no gráfico de raster temporal, mova o controle deslizante linear cinza no lado direito do gráfico de raster temporal para ajustar a posição da caixa de pesquisa.
- Abaixo do gráfico de raster temporal, ajuste o controle deslizante rotativo de largura da caixa de pesquisa para uma largura apropriada. Reduza a largura da caixa de pesquisa para reduzir a chance de picos de ruído transitórios, potenciais de ação de disparo espontâneo ou outros potenciais de ação de latência constante próximos serem identificados erroneamente como o potencial de ação de interesse.
- Para começar a rastrear o potencial de ação direcionado, clique no + abaixo da tabela de rastreamento de várias unidades. Uma nova linha será adicionada à tabela contendo detalhes do potencial de ação alvo, incluindo o local de latência, a porcentagem de disparos sobre 2-10 estímulos (ajustada no menu de opções) e a amplitude de pico detectada.
- Uma vez que um potencial de ação é adicionado à tabela de rastreamento de várias unidades, o algoritmo de rastreamento de latência (Figura 5) será automaticamente executado sobre ela a cada estimulação elétrica subsequente.
- Se houver vários potenciais de ação discretos visíveis no gráfico de raster temporal, adicione-os à tabela de rastreamento de várias unidades, conforme descrito acima. O número máximo teórico de potenciais de ação que podem ser adicionados à tabela para controle simultâneo de latência é o valor inteiro máximo de 32 bits.
- Marque a caixa Controlar Pico na tabela de controle de várias unidades para mover a caixa de pesquisa para a posição apropriada para esse potencial de ação específico, conforme determinado pelo algoritmo de rastreamento de latência. Isso permitirá monitorar o rastreamento de latência em tempo real e garantir que o rastreamento esteja seguindo o potencial de ação conforme o esperado. O rastreamento de latência de outros picos continuará normalmente em segundo plano.
- Remova potenciais de ação rastreados da tabela de controle de várias unidades usando o botão excluir no final de cada linha.
- Execute o rastreamento de limite elétrico conforme descrito abaixo.
- Ajustar as taxas de incremento e decremento no painel de controle de estimulação entre 0,1 V e 0,5 V. Mantenha esses valores iguais e não os ajuste durante o experimento, a menos que isso faça parte do paradigma experimental.
- Certifique-se de que a frequência de estimulação seja ajustada para uma taxa apropriada, tipicamente 0,25-0,5 Hz, a menos que a modulação da frequência de estimulação faça parte do paradigma experimental. O aumento das taxas de disparo do nociceptor pode alterar o limiar elétrico do nociceptor.
- Quando um potencial de ação estiver sendo rastreado com êxito, marque a caixa Track Threshold na tabela de rastreamento de várias unidades, que iniciará o algoritmo de rastreamento de limite elétrico (Figura 6).
NOTA: O rastreamento de limite elétrico só é executado no potencial de ação direcionado; De fato, as taxas de disparo de outros potenciais de ação na tabela de rastreamento de várias unidades serão atualizadas de acordo com a mudança da amplitude de estimulação. - Ajustar manualmente a amplitude de estimulação à estimativa do limiar elétrico; Isso reduzirá o tempo de espera para determinar o limiar elétrico. O tempo necessário para estabelecer um limiar elétrico confiável é dependente da frequência de estimulação, das taxas de incremento e decremento e da diferença na amplitude da estimulação da estimulação inicial para o limiar elétrico do neurônio.
- O software utiliza um método ascendente para a estimativa do limiar elétrico dos neurônios. Na tabela de rastreamento de várias unidades, a taxa de disparo é determinada ao longo de 2-10 estímulos anteriores (selecionados no menu de opções). Selecionar o número de eventos de estimulação a serem considerados; Um número mais elevado aumentará a fiabilidade da estimativa do limiar, mas levará mais tempo a ser alcançado.
- Durante a microneurografia humana, é importante monitorar a dor dos estímulos elétricos para evitar o desconforto excessivo dos participantes; algum desconforto é inevitável durante o estudo de nociceptores, particularmente de fibras C silenciosas/adormecidas. Solicite regularmente avaliações de dor enquanto a amplitude de estimulação aumenta durante o rastreamento do limiar elétrico e permaneça próximo ao estimulador de corrente constante para desengatá-lo a pedido do participante.
NOTA: Alternativamente, a estimulação elétrica pode ser desligada através da interface do usuário, clicando no botão [ ] no painel de controle de estimulação. - Uma taxa de disparo de 50% indica que o limite elétrico aproximado foi determinado.
- Durante o rastreamento do limiar elétrico, aplique uma manipulação experimental ao campo receptivo, como manipulação de temperatura ou drogas. Os efeitos dessas manipulações sobre o limiar elétrico do nociceptor serão rastreados.
NOTA: Dar tempo suficiente para identificar um novo limiar nociceptor após a manipulação experimental.
Resultados
Um exemplo representativo do software que trabalha para controlar um experimento é mostrado na Figura 7. Ele ajusta iterativamente a amplitude de estimulação usando um método ascendente para baixo para encontrar efetivamente o limiar elétrico de nociceptores únicos. Pela primeira vez, demonstramos a viabilidade do rastreamento do limiar elétrico de um único neurônio em tempo real em humanos durante a microneurografia (Figura 7A). Além disso, mostramos o rastreamento do limiar elétrico em uma fibra Aδ de camundongo (Figura 7B). A identificação de potenciais de ação por cruzamento de limiares, como utilizado aqui, é suficiente para rastrear limiares elétricos ao longo do tempo. Recomendamos que os usuários tomem medidas para minimizar o ruído elétrico durante suas gravações, como o uso de uma gaiola de Faraday e filtros passa-banda para melhorar a relação sinal-ruído.
Para demonstrar que o rastreamento do limiar elétrico pode ser usado como uma medida de mudanças na excitabilidade do nociceptor em humanos, o rastreamento do limiar elétrico durante um paradigma de aquecimento escalonado foi realizado (Figura 8). O aumento da temperatura dos terminais nociceptores diminuiu a corrente de estimulação elétrica necessária para eliciar um potencial de ação, refletindo um aumento na excitabilidade do nociceptor (Figura 8C). Isso provavelmente foi causado pela geração de potenciais receptores pelos canais iônicos sensíveis ao calor expressos no nociceptor de fibra C14. No degrau de temperatura mais alta, 44 °C, foram eliciados, potenciais de ação evocados termicamente (Figura 8A, estímulo número 86-96). Isso causa um aumento no limiar elétrico, pois o nociceptor pode estar em um estado refratário após a descarga de alta frequência. Como esperado, a latência do potencial de ação rastreado diminuiu com o aumento da temperatura. Acredita-se que isso ocorra devido a um efeito termodinâmico na maquinaria de condução, que aumenta a velocidade de condução da fibra C. Essa fibra C também pode estar exibindo flip-flop (Figura 8B, estímulo número 47-54), o que pode resultar no aumento errôneo da amplitude da estimulação elétrica seguinte se o potencial de ação estiver fora da janela de busca do algoritmo.
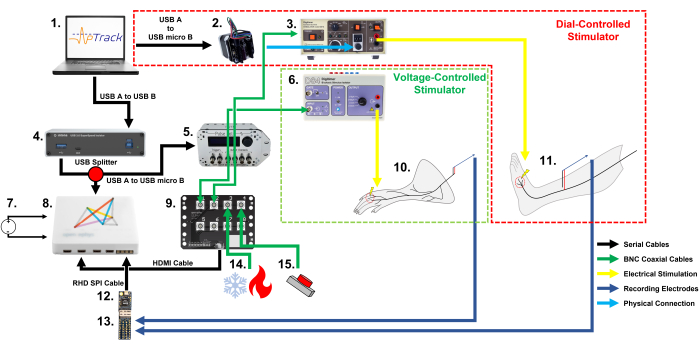
Figura 1: Esquema da configuração do equipamento e conexões de cabos necessários para o rastreamento de limiar elétrico nociceptor com APTrack em roedores e humanos. Observe os dois métodos diferentes de controles de amplitude de estimulação: um motor de passo para estimuladores ajustados manualmente em nossa configuração humana e um PulsePal para estimuladores controlados por tensão de entrada em nossa configuração de roedores. (1) Um PC (Windows, Mac ou Linux) executando o plugin para a plataforma Open Ephys. (2) Um motor de passo que opera o dial de amplitude de estimulação no DS7. (3) Um estimulador de corrente constante aprovado para uso em humanos; aqui usamos um DS7. (4) Um optoisolador USB 3.0, que isola o participante humano do PC (opcional, necessário apenas para pesquisa em humanos). (5) Gerador de Pulsos PulsePal V2, que gera timestamps TTL (canal de saída 2) e passos de tensão correspondentes à amplitude de estimulação solicitada (canal de saída 1). (6) Um estimulador de corrente constante para uso em animais; aqui, usamos um DS4. (7) Uma fonte de alimentação CC para o sistema (fonte de alimentação CC utilizada para a configuração dos roedores e fonte de alimentação CC da bateria utilizada para a configuração humana). (8) Um conselho de aquisição. (9) Uma placa de E/S para conectar os cabos coaxiais BNC que transportam os sinais a serem registrados, como as saídas do termopar e os marcadores TTL. (10) A preparação pele-nervo de camundongo submetida a registros eletrofisiológicos nociceptores. (11) Participante humano submetido a microneurografia com registro de fibras C no nervo fibular superficial. (12) Um headstage Intan RHD2216 para aquisição e digitalização das gravações. (13) Uma placa adaptadora de eléctrodos Intan, à qual os eléctrodos de gravação estão ligados e que permite que o sinal seja passado para a sede RHD2216. (14) Um sistema de estimulação térmica que pode produzir a temperatura através de uma conexão coaxial BNC. (15) Um pedal de botão/pedal alimentado por bateria de 3,3 V que é usado para marcar os eventos de estimulação mecânica e aplicações de medicamentos. Clique aqui para ver uma versão maior desta figura.
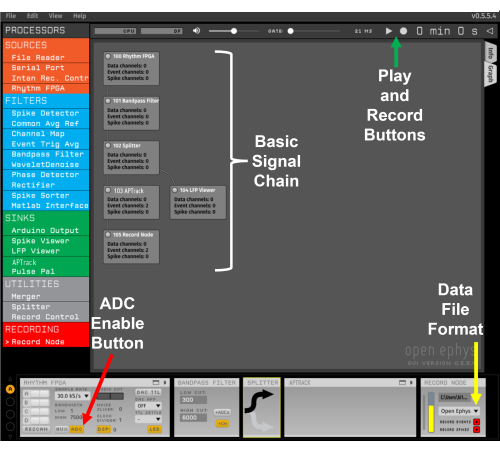
Figura 2: Cadeia de sinais do modelo. A seta vermelha aponta para o botão para ativar a entrada ADC da placa de E/S. A seta amarela indica o menu suspenso para selecionar o formato de arquivo Open Ephys. A seta verde indica os botões Reproduzir e Gravar. Clique aqui para ver uma versão maior desta figura.
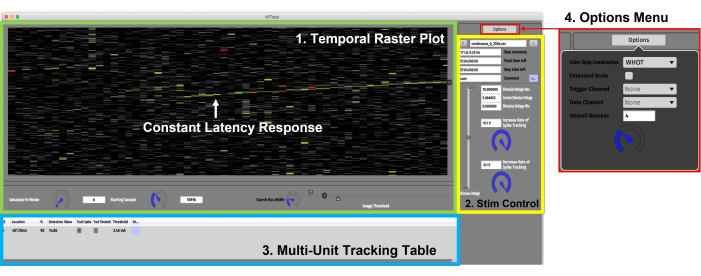
Figura 3: Interface gráfica do usuário. A GUI consiste em quatro componentes principais. (1) Painel Temporal Raster Plot (verde) para visualização dos dados e das configurações associadas ao controle do gráfico. Uma resposta de latência constante mostrando lentificação gradual dependente da atividade é indicada pela seta verde. (2) Painel de controle de estimulação (amarelo) para definição dos parâmetros de amplitude de estimulação e carregamento dos scripts paradigmáticos de estimulação. (3) Multi-Unit Tracking Table (azul) para adicionar os potenciais de ação para rastrear e ativar a latência e o rastreamento do limiar elétrico. (4) Menu de opções para selecionar os estilos de cores e o canal de entrada para os dados e gatilhos TTL. Clique aqui para ver uma versão maior desta figura.
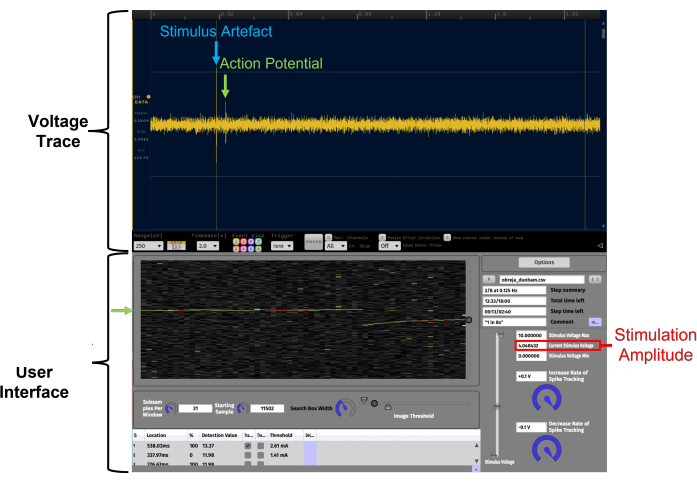
Figura 4: Facilitação da identificação de potenciais de ação de latência constante através da visualização de dados em tempo real em um gráfico raster temporal utilizando APTrack. Este é um exemplo de alta relação sinal-ruído. Os dados apresentados no gráfico raster temporal são de um registro de fibra C humana do nervo fibular superficial durante a microneurografia. Voltage Trace é o plugin LFP Viewer semelhante ao osciloscópio dentro do Open Ephys. A Interface do Usuário do APTrack é a interface gráfica do usuário do plugin. O potencial de ação rastreado é indicado por setas verdes, e o controle deslizante circular na borda do gráfico raster temporal é para controlar a posição da caixa de pesquisa, onde os algoritmos procurarão eventos de cruzamento de limiar. O artefato de estimulação elétrica é marcado em azul no traço de tensão. A amplitude de estimulação do comando de tensão analógica é indicada em vermelho; Note que isso pode não ser o mesmo que a amplitude da corrente de estimulação, dependendo do fator de escala definido no estimulador. Clique aqui para ver uma versão maior desta figura.
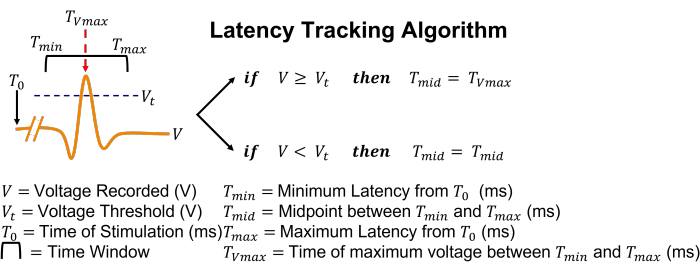
Figura 5: Representação gráfica do algoritmo de rastreamento de latência. Em termos simples, se um potencial de ação for detectado pelo cruzamento do limite, a caixa de pesquisa ajustará sua posição para centralizar-se no momento da tensão de pico. Clique aqui para ver uma versão maior desta figura.

Figura 6: Representação gráfica do algoritmo de rastreamento de limiar elétrico. Em termos simples, se um potencial de ação for detectado pelo cruzamento do limiar, a amplitude da estimulação será diminuída pela taxa de decremento. Se nenhum potencial de ação for detectado, a amplitude de estimulação será aumentada pela taxa de incremento. Clique aqui para ver uma versão maior desta figura.
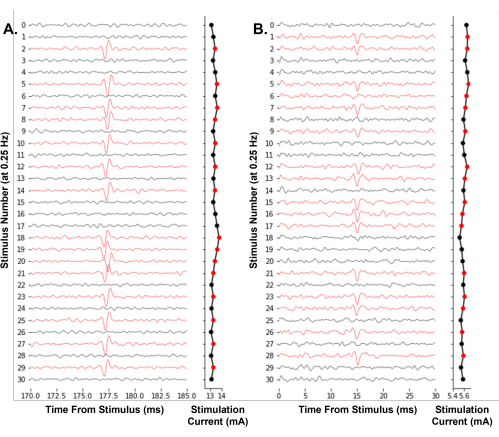
Figura 7: Rastreamento automatizado do limiar elétrico dos potenciais de ação de um único neurônio a uma frequência de estimulação de 0,25 Hz . (A) Traços sequenciais de uma fibra C humana do nervo fibular superficial durante um experimento de microneurografia. (B) Traços sequenciais de uma fibra Aδ de camundongo do nervo safeno durante o preparo pele-nervo provocaram eletrofisiologia da fibra. Os traços foram coloridos de vermelho quando um potencial de ação foi identificado, resultando em uma diminuição na amplitude do estímulo. O algoritmo do software efetivamente encontra a amplitude de estímulo necessária para uma probabilidade de 50% de disparo. Clique aqui para ver uma versão maior desta figura.
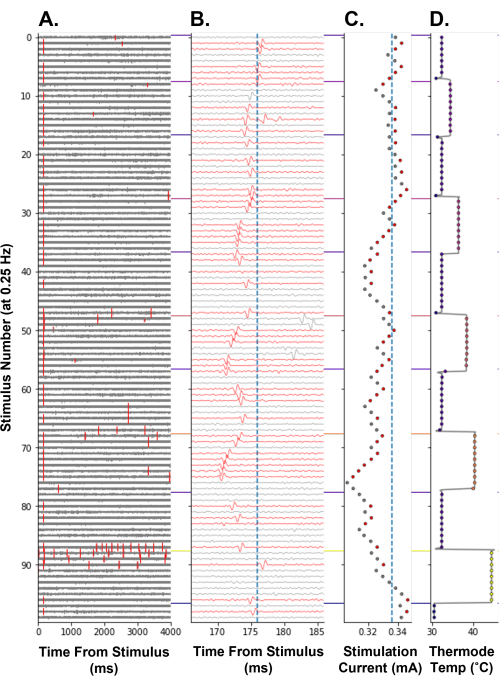
Figura 8: Rastreamento do limiar elétrico na frequência de estimulação de 0,25 Hz durante a estimulação térmica de um nociceptor humano de fibra C. O eixo y codifica o número de estimulação desde o início do paradigma. (A) Traço de tensão por 4.000 ms após estimulação elétrica, com eventos de cruzamento de limiar marcados em vermelho. (B) Traço de tensão de A ampliado em torno do potencial de ação rastreado. Os vestígios foram coloridos de vermelho quando o potencial de ação rastreado foi detectado. A linha azul vertical é a latência da linha de base da unidade rastreada. (C) Corrente de estimulação comandada pelo APTrack. A linha azul vertical é o limiar elétrico basal. (D) Campo receptivo TCS-II temperatura da sonda termoestimulante. Clique aqui para ver uma versão maior desta figura.
| Composto | Concentração |
| NaCl | 107,8 mM |
| NaHCO3 | 26,2 mM |
| Kcl | 3,5 mM |
| NaH2PO4 | 1,67 mM |
| CaCl2 | 1,53 mM |
| MgSO4 | 0,69 mM |
| Gluconato de Sódio | 9,64 mM |
| Sacarose | 7,6 mM |
| Glicose | 5,55 mM |
Tabela 1: Conteúdo do líquido intersticial sintético para o preparo pele-nervo de camundongos23.
Discussão
APTrack é um plugin de software para uso com a plataforma Open Ephys. Escolhemos esta plataforma por ser de código aberto, flexível e barata de implementar. Sem incluir o custo do estimulador de corrente constante, todo o equipamento necessário para começar a usar o plugin poderia ser comprado por cerca de US $ 5.000 USD no momento da escrita. Esperamos que isso permita aos pesquisadores implementar o APTrack em seus estudos de eletrofisiologia de nervos periféricos com mais facilidade. Além disso, os pesquisadores podem modificar livremente o software para atender às suas necessidades experimentais. É importante ressaltar que essa ferramenta permitiu o rastreamento do limiar elétrico de nociceptores únicos de fibra C, pela primeira vez, em humanos.
Quanto maior a relação sinal-ruído, melhor os algoritmos conseguem identificar potenciais de ação. A relação sinal-ruído durante a microneurografia foi suficiente na maioria dos nossos registros, mas os usuários devem estar atentos ao risco de degradação do sinal ao longo do tempo. Isso é particularmente importante para protocolos experimentais mais longos, pois se a amplitude do potencial de ação rastreado cair abaixo do limiar de detecção, a amplitude de estimulação será aumentada erroneamente; Isso pode ser atenuado por experimentadores monitorando o plug-in e, em seguida, ajustando as configurações, se necessário. A relação sinal-ruído é melhorada com a filtragem passa-banda, mas transientes maiores ainda podem ser identificados erroneamente como potenciais de ação se chegarem durante a janela de tempo da caixa de pesquisa. O risco de identificar erroneamente o ruído transitório como um potencial de ação pode ser reduzido estreitando a janela de tempo durante a qual o plugin procura potenciais de ação e otimizando as configurações de limite. No entanto, ainda existem situações que podem ser encontradas que impedem o desempenho do plugin. A atividade espontânea pode causar dificuldades se potenciais de ação de maior amplitude estiverem dentro da janela da caixa de pesquisa do algoritmo, pois eles serão erroneamente identificados como o potencial de ação alvo. Além disso, a atividade espontânea no neurônio de interesse pode significar que a estimulação elétrica cai durante seu período refratário, causando falha na geração de um potencial de ação. Dificuldades no uso do software também podem surgir quando neurônios aferentes primários exibem flip-flop, em que ramos terminais alternados de um único neurônio são estimulados, fazendo com que o potencial de ação evocado tenha duas (ou mais) latências basais mutuamenteexclusivas 20. Durante gravações de neurônios exibindo flip-flop com altas relações sinal-ruído, realizamos com sucesso o rastreamento de latência e limiar elétrico aumentando a largura da caixa de pesquisa para encapsular todas as velocidades de condução potenciais que o neurônio exibia. No entanto, o limiar elétrico pode variar dependendo do ramo terminal do neurônio que está sendo excitado, o que é provavelmente em parte devido a diferenças na distância do local da estimulação elétrica para os terminais nociceptores alternativos. Trabalho adicional sobre o processo de identificação do potencial de ação para incluir, por exemplo, a correspondência de modelos é viável e poderia ser integrado a este software. Os plugins GUI para parada de banda ou filtragem de ruído adaptável também podem ser usados a montante do APTrack na cadeia de sinais, caso sejam desenvolvidos.
Consideramos o limiar elétrico determinado como sendo a corrente necessária para eliciar um potencial de ação em 50% das vezes, sobre um número definido pelo usuário de estímulos elétricos, tipicamente 2-10. A morfologia da estimulação elétrica é de 0,5 ms e pulsos positivos de onda quadrada. Isso não é o mesmo que determinar a reobase, uma medida comumente usada de excitabilidade neuronal. O plugin poderia ser adaptado para determinar a reobase. No entanto, buscamos uma medida mais simples, pois mudanças dinâmicas na excitabilidade, como aquelas hipotetizadas para ocorrer durante o aquecimento, teriam sido mais difíceis de quantificar com mudanças de reobase do que nossa estimativa de limiar elétrico.
Este software pode ser usado em experimentos com humanos e roedores. Isso é possível graças ao suporte flexível para os sistemas de estimulação elétrica. O software funcionará com qualquer estimulador que aceite uma tensão de comando analógico ou possa ser interligado manualmente com um motor de passo. Para a microneurografia, foi utilizado um estimulador de corrente constante marcado com CE, projetado para uso em pesquisas humanas e cuja estimulação foi controlada por um mostrador. Estimuladores que aceitam comandos analógicos de tensão podem ser barulhentos, pois não desconectam o circuito entre os estímulos, ou seja, qualquer zumbido ou ruído de 50/60 Hz na entrada analógica será transmitido para a gravação. Um estimulador que requer um sinal de gatilho TLL adicional para conectar o circuito, permitindo que um estímulo em uma corrente análoga à entrada de tensão analógica seja gerado, é ideal para uso com o plugin. Isso evita que o ruído seja transmitido para a gravação entre os estímulos.
O software utiliza um método simples up-down para estimar o limiar elétrico. Isso tem sido usado em testes psicofísicos há muitas décadas25. De acordo com o método up-down, o algoritmo de rastreamento do limiar elétrico para modular a amplitude da estimulação considera apenas a amplitude e a resposta da estimulação anterior no cálculo da amplitude da estimulação seguinte. Isso significa que a amplitude de estimulação oscilará em torno do limiar elétrico verdadeiro, produzindo uma taxa de disparo de 50%, supondo que o limiar seja estável. O tamanho mínimo de um incremento ou decremento é de 0,01 V; isso é equivalente a 0,01 mA supondo que o estimulador tenha uma relação de entrada/saída de 1 V:1 mA e resolução suficiente para conseguir mudanças de passo tão pequenas. O plugin atualizará a estimativa ao vivo do limiar elétrico do potencial de ação alvo toda vez que ele atingir uma taxa de disparo de 50% sobre um número definido pelo usuário de estímulos anteriores (2-10). Post hoc, recomenda-se o uso de uma média móvel da amplitude de estimulação nos últimos 2-10 estímulos para estimar o limiar elétrico, e deve-se notar que essa estimativa só será precisa quando a taxa de disparo for relativamente estável em 50%. Tanto nas estimativas ao vivo quanto nas post-hoc do limiar elétrico, há um equilíbrio entre resolução, confiabilidade e tempo a ser considerado. O uso de etapas menores de incremento e decremento aumentará a precisão da estimativa do limiar elétrico, mas aumentará o tempo necessário para encontrar o novo limiar elétrico inicialmente e após a perturbação. O cálculo do limiar elétrico sobre um maior número de estímulos prévios proporcionará melhor confiabilidade, mas aumentará o tempo necessário para se chegar a uma estimativa precisa.
O APTrack foi projetado para uso em registros de nervos periféricos, especificamente para rastrear os limiares elétricos das fibras C durante perturbações experimentais e patológicas durante períodos em que a latência do potencial de ação pode variar dependendo da atividade neuronal subjacente. Este método permitirá o exame não só da excitabilidade axonal, mas também dos potenciais geradores de nociceptores em voluntários e pacientes saudáveis. Antecipamos que outras áreas da eletrofisiologia podem adotar e adaptar esta ferramenta para uso em qualquer experimento que necessite do rastreamento do limiar elétrico de uma atividade bloqueada por estímulo. Por exemplo, isso poderia ser facilmente adaptado para estimulação optogenética com pulsos de luz acionados a partir do APTrack. O plugin é de código aberto e está disponível para pesquisadores sob uma licença GPLv3. Ele é construído sobre a plataforma Open Ephys, que é um sistema de aquisição de dados adaptável, de baixo custo e de código aberto. O plugin fornece ganchos adicionais para plugins downstream para extrair as informações potenciais de ação e fornecer interfaces de usuário adicionais ou paradigmas adaptativos. O plugin fornece uma interface de usuário simples para a visualização e acompanhamento de latência de potenciais de ação em tempo real. Ele também pode reproduzir dados anteriores e visualizá-los usando o gráfico raster temporal. Além disso, ele também pode executar o rastreamento de latência durante a reprodução de dados anteriores. Embora existam outros pacotes de software disponíveis para rastreamento de latência em tempo real, eles não são de código aberto e não podem executar o rastreamento de limiar elétrico26,27. O APTrack tem uma vantagem sobre os métodos tradicionais de identificação de potenciais de ação de latência constante a partir de traços de tensão, pois usa um gráfico raster temporal para a visualização dos dados. Além disso, nossas experiências de uso em experimentos com baixas relações sinal-ruído indicaram que o método de visualização de gráficos raster temporais permite a identificação de potenciais de ação de latência constante que podem ter sido perdidos.
O rastreamento do limiar do nervo total é um método amplamente utilizado para avaliar a excitabilidade axonal13. O rastreamento do limiar elétrico de um único neurônio em fibras C de roedores tem sido usado anteriormente para quantificar a excitabilidade do nociceptor14, e sua utilidade em humanos é reconhecida10,11; No entanto, até agora, isso não era possível. Nós fornecemos uma nova ferramenta de código aberto para medir diretamente a excitabilidade de um único nociceptor em estudos eletrofisiológicos de nervos periféricos de roedores e humanos. O APTrack permite o rastreamento de limiar elétrico em tempo real, de código aberto, de potenciais de ação de neurônio único em humanos, pela primeira vez. Prevemos que facilitará estudos translacionais de nociceptores entre roedores e humanos.
Divulgações
G.W.T.N. é um Doutorando em Parceria de Treinamento Colaborativo BBSRC com a Universidade de Bristol e Eli Lilly and Company (BB/T508342/1). A.P.N. é um funcionário atual da Eli Lilly and Company e pode possuir ações nesta empresa.
Agradecimentos
Gostaríamos de agradecer aos nossos financiadores por seu apoio: Academia de Ciências Médicas (J.P.D., A.E.P.), Versus Arthritis (J.P.D., A.E.P.), Jean Golding Institute Seedcorn Grant (J.P.D., A.E.P., G.W., A.C.S., M.M.P.) e Biotechnology and Biological Sciences Research Council parceria de treinamento colaborativo doutorado com Eli Lilly (G.W.T.N.). Gostaríamos de estender nossos agradecimentos a todos os colaboradores para o desenvolvimento do APTrack. Também gostaríamos de agradecer aos nossos voluntários que participaram dos experimentos de microneurografia e aos nossos colaboradores do Envolvimento e Engajamento do Paciente e do Público por suas inestimáveis contribuições.
Materiais
| Name | Company | Catalog Number | Comments |
| 12V DC Power Supply | NA | NA | To power uStepper S-lite. Required for dial-controlled stimulators. |
| 36 Pin Electrode Adapter Board | Intan Technology | C3410 | APTrack Dependency. For connecting electrode input to headstage. $255 USD as of March 2021. |
| APTrack Plugin | NA | NA | https://github.com/Microneurography/APTrack |
| Bipolar Ag/AgCl Recording Electrode | Custom | NA | Recording electrode for the skin-nerve preparation. Or equivalent. |
| Bipolar Concentric Stimulating Electrode | World Precision Instruments | SNE-100 | For electrical stimulation in the mouse skin-nerve preparation. Or equivalent. |
| Bipolar Transcutaneous Stimulating Electrode | Custom | NA | For transcutaneous electrical stimulation while searching for single-neuron action potentials during microneurography. |
| BNC T Splitter (1+) | NA | NA | APTrack Dependency. Any standard BNC T splitter. |
| BNC to BNC cables (3+) | NA | NA | APTrack Dependency. Any standard BNC cables. |
| C6H11NaO7 | Merck | S2054 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| CaCl2 | Merck | C5670 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Digitimer DS4 Constant Current Stimulator | Digitimer | DS4 | Constant current stiulator for animal research. £1,695 GBP as of September 2022. |
| Digitimer DS7 Constant Current Stimulator | Digitimer | DS7A | Constant current stiulator for human research. £3,400 GBP as of September 2022. |
| Electroaccupuncture Classic Plus Stimulating Electrodes | Harmony Medical | NA | For fixed position intradermal electrical stimulation of the dorsal aspect of the foot during human microneurography. |
| Glucose | Fisher Scientific | G/0450/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| HDMI Cable | NA | NA | APTrack Dependency. Any standard passive HMDI cable. To connect OE I/O Board to OE Acquisition Board. |
| KCl | Merck | P9541 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| MgSO4 | Acros Organics | 213115000 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Mineral Oil | Merck | 330779 | Electrical insulation for nerve recordings in th skin-nerve preparation. Or equivalent. |
| NaCl | Merck | S9888 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S6014 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| NaHCO3 | Merck | S0751 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| Open Ephys Acquisition Board | Open Ephys | NA | APTrack Dependency. Includes USB cable to connect to computer and mains socket power supply. €2,955 EUR as of September 2022. |
| Open Ephys Graphical User Interface | Open Ephys | NA | https://github.com/open-ephys/plugin-GUI |
| Open Ephys I/O Board | Open Ephys | NA | APTrack Dependency. For ADC voltage inputs via BNC cables. €12.5 EUR without connectors, €85 EUR with connectors as of September 2022. |
| PulsePal V2 | Sanworks | 1102 | APTrack Dependency. Open-source DAC and train generator. $725 USD pre-assembled as of September 2022. Approx. $275 USD for self-assembly. |
| RHD 6ft SPI Cable | Intan Technology | C3206 | APTrack Dependency. For connecting headstage to OE Acquisition Board. $295 USD as of March 2021 |
| RHD2216 16ch Bipolar Headstage | Intan Technology | C3313 | APTrack Dependency. For data acquisition and digitization. $725 USD as of March 2021. Or equivalent RHD2000 series headstage. |
| Sucrose | Fisher Scientific | S/8560/60 | Skin-nerve preparation synthetic interstitial fluid constituent. Or equivalent. |
| TCS-II Thermal Stimulator | QST.Lab | NA | For thermal stimualtion of nociceptor receptive fields during human microneurography. |
| Tungsten Microelectrode Pair (Active + Reference) | FHC | 30085 | For microneurography recordings. 35mm. |
| Ultrasound Scanner iQ+ | Butterfly Network | NA | For ultrasound-guided electrode insertion during microneurography. |
| USB 3.0 5kV RMS Isolation | Inota Technology | 7055-D | For isolating human microneuroography participant from computer. €459 EUR as of September 2022. |
| USB-A to micro USB-B cable (2) | NA | NA | APTrack Dependency. To connect computer to PulsePal and to uStepper S-lite if using stepper-stimulator interfacing. |
| uStepper S-lite + NEMA17 motor | uStepper | NA | To interface with stimulators via a control dial. €50 EUR as of September 2022. |
| Von Frey Filaments | Ugo Basile | 37450-275 | For mechanical stimulation of receptive fields during sensory phenotyping of nociceptors. |
Referências
- Dubin, A. E., Patapoutian, A. Nociceptors: The sensors of the pain pathway. Journal of Clinical Investigation. 120 (11), 3760-3772 (2010).
- Serra, J., et al. Microneurographic identification of spontaneous activity in C-nociceptors in neuropathic pain states in humans and rats. Pain. 153 (1), 42-55 (2012).
- Serra, J., et al. Hyperexcitable C nociceptors in fibromyalgia. Annals of Neurology. 75 (2), 196-208 (2014).
- Namer, B., et al. Specific changes in conduction velocity recovery cycles of single nociceptors in a patient with erythromelalgia with the I848T gain-of-function mutation of Nav1.7. Pain. 156 (9), 1637-1646 (2015).
- Kleggetveit, I. P., et al. High spontaneous activity of C-nociceptors in painful polyneuropathy. Pain. 153 (10), 2040-2047 (2012).
- Orstavik, K., et al. Abnormal function of C-fibers in patients with diabetic neuropathy. Journal of Neuroscience. 26 (44), 11287-11294 (2006).
- Orstavik, K., et al. Pathological C-fibres in patients with a chronic painful condition. Brain. 126, 567-578 (2003).
- Raja, S. N., Ringkamp, M., Guan, Y., Campbell, J. N., John, J. Bonica Award Lecture: Peripheral neuronal hyperexcitability: The "low-hanging" target for safe therapeutic strategies in neuropathic pain. Pain. 161, S14-S26 (2020).
- Middleton, S. J., et al. Studying human nociceptors: From fundamentals to clinic. Brain. 144 (5), 1312-1335 (2021).
- Marshall, A., Alam, U., Themistocleous, A., Calcutt, N., Marshall, A. Novel and emerging electrophysiological biomarkers of diabetic neuropathy and painful diabetic neuropathy. Clinical Therapeutics. 43 (9), 1441-1456 (2021).
- Themistocleous, A. C., et al. Axonal excitability does not differ between painful and painless diabetic or chemotherapy-induced distal symmetrical polyneuropathy in a multicenter observational study. Annals of Neurology. 91 (4), 506-520 (2022).
- Bostock, H., Cikurel, K., Burke, D. Threshold tracking techniques in the study of human peripheral nerve. Muscle Nerve. 21 (2), 137-158 (1998).
- Kiernan, M. C., et al. Measurement of axonal excitability: Consensus guidelines. Clinical Neurophysiology. 131 (1), 308-323 (2020).
- Sauer, S. K., et al. Can receptor potentials be detected with threshold tracking in rat cutaneous nociceptive terminals. Journal of Neurophysiology. 94 (1), 219-225 (2005).
- Vallbo, A. B. Microneurography: How it started and how it works. Journal of Neurophysiology. 120 (3), 1415-1427 (2018).
- Torebjork, H., Hallin, R. A new method for classification of C-unit activity in intact human skin nerves. Advances in Pain Research and Therapy. 1, 29-34 (1976).
- Brown, G. L., Holmes, O. The effects of activity on mammalian nerve fibres of low conduction velocity. Proceedings of the Royal Society of London. Series B: Biological Sciences. 144 (918), 1-14 (1956).
- Obreja, O., et al. Patterns of activity-dependent conduction velocity changes differentiate classes of unmyelinated mechano-insensitive afferents including cold nociceptors, in pig and in human. Pain. 148 (1), 59-69 (2010).
- Serra, J., Campero, M., Ochoa, J., Bostock, H. Activity-dependent slowing of conduction differentiates functional subtypes of C fibres innervating human skin. Journal of Physiology. 515, 799-811 (1999).
- Weidner, C., Schmidt, R., Schmelz, M., Torebjork, H. E., Handwerker, H. O. Action potential conduction in the terminal arborisation of nociceptive C-fibre afferents. Journal of Physiology. 547, 931-940 (2003).
- Siegle, J. H., et al. Open Ephys: An open-source, plugin-based platform for multichannel electrophysiology. Journal of Neural Engineering. 14 (4), 045003 (2017).
- Sanders, J. I., Kepecs, A. A low-cost programmable pulse generator for physiology and behavior. Frontiers in Neuroengineering. 7, 43 (2014).
- Zimmermann, K., et al. Phenotyping sensory nerve endings in vitro in the mouse. Nature Protocols. 4 (2), 174-196 (2009).
- Dunham, J. P., Sales, A. C., Pickering, A. E. Ultrasound-guided, open-source microneurography: Approaches to improve recordings from peripheral nerves in man. Clinical Neurophysiology. 129 (11), 2475-2481 (2018).
- Levitt, H. Transformed up-down methods in psychoacoustics. Journal of the Acoustical Society of America. 49 (2), 467 (1971).
- Turnquist, B., RichardWebster, B., Namer, B. Automated detection of latency tracks in microneurography recordings using track correlation. Journal of Neuroscience Methods. 262, 133-141 (2016).
- Kiernan, M. C., Burke, D., Andersen, K. V., Bostock, H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 23 (3), 399-409 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados