A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידות מיקרו-קשיות על עצם השן והנאדית במודלים של מחלות פה של מכרסמים
In This Article
Summary
מיקרו-קשיות היא תכונה מכנית ופרמטר אינפורמטיבי להערכת פתופיזיולוגיה של רקמות קשות. כאן, אנו מדגימים פרוטוקול סטנדרטי (הכנת דגימה, ליטוש, משטח שטוח ואתרי הזחה) לניתוח מיקרו-קשיות בעצם השן והנאדית במודלים של מחלות פה מכרסמים, כלומר פלואורוזיס דנטלי, וספיגת עצם חניכיים הנגרמת על ידי ליגטורות.
Abstract
התכונה המכנית, מיקרו-קשיות, מוערכת באמייל השיניים, דנטין ועצם במודלים של מחלות פה, כולל פלואורוזיס דנטלי ודלקת חניכיים. מיקרו-CT (μCT) מספק מידע הדמיה תלת-ממדי (נפח וצפיפות מינרלים) ומיקרוסקופ אלקטרונים סורק (SEM) מפיק תמונות מיקרו-מבנה (מנסרת אמייל ולקונה של העצם). באופן משלים לניתוח מבני על ידי μCT ו- SEM, מיקרו-קשיות היא אחד הפרמטרים האינפורמטיביים להערכת האופן שבו שינויים מבניים משנים תכונות מכניות. למרות היותו פרמטר שימושי, מחקרים על microhardness של עצם alveolar במחלות הפה מוגבלים. עד כה דווחו שיטות מדידה שונות של מיקרו-קשיות. מכיוון שערכי המיקרו-קשיות משתנים בהתאם להכנת הדגימה (ליטוש ומשטח שטוח) ואתרי הזחה, פרוטוקולים מגוונים יכולים לגרום לפערים בין מחקרים. סטנדרטיזציה של פרוטוקול microhardness חיונית להערכה עקבית ומדויקת במודלים של מחלות הפה. במחקר הנוכחי אנו מדגימים פרוטוקול סטנדרטי לניתוח מיקרו-קשיות בשיניים ובעצם מכתשית. הדגימות המשמשות הן כדלקמן: עבור מודל פלואורוזיס דנטלי, חותכות נאספו מעכברים שטופלו עם/בלי מים המכילים פלואוריד במשך 6 שבועות; עבור מודל ספיגת עצם חניכיים (L-PBR) המושרה על ידי ליגטורה, עצמות מכתשית עם ספיגת עצם חניכיים נאספו מעכברים הקשורים על הטוחנתהשנייה המקסילרית . שבועיים לאחר הקשירה נאספה המקסילה. קשיות ויקרס נותחה בדגימות אלה על פי הפרוטוקול הסטנדרטי. הפרוטוקול מספק חומרים מפורטים ושיטות להטמעת שרף, ליטוש סדרתי ואתרי הזחה לשיניים חותכות ונאדיות. למיטב ידיעתנו, זהו פרוטוקול המיקרו-קשיות הסטנדרטי הראשון להערכת התכונות המכניות של עצם השן והנאדית במודלים של מחלות פה מכרסמים.
Introduction
קשיות היא אחת התכונות המכניות (למשל, גמישות, קשיות, צמיגות והתנהגות שבר) והיא משמשת בדרך כלל לאפיון היכולת להתנגד לעיוות דחיסה ושבר של אזור מקומי בחומר. בדיקת קשיות הכניסה הסטטית היא השיטה הנפוצה ביותר, כולל קשיות ויקרס וקשיות קנופ1. בדיקת הקשיות של ויקרס מיושמת על ידי לחיצה על אינדנדר יהלום לתוך המשטח תחת עומס בדיקה קבוע. האינדנטר הוא בצורת פירמידה, עם בסיס מרובע וזווית של 136° בין פאות מנוגדות. אורך שני האלכסונים שנוצרו על משטח הבדיקה נמדד, והממוצע משמש לחישוב הקשיות, הנקבעת על ידי היחס F/A (כאשר F הוא הכוח ו- A הוא שטח הפנים של הכניסה). מספר המיקרו-קשיות של ויקרס (HV=F/A) מבוטא בדרך כלל בכוח קילוגרמים (kgf) לכל כניסה למ"מ2 , עם 1 HV ≈ 0.1891 F/d2 (N/mm2). קשיות קנופ מורכבת גם מפירמידה מרובעת יהלום הנוצרת על ידי שתי זוויות מנוגדות לא שוות. מספר קשיות Knoop (HK) שווה ליחס בין העומס המופעל לאזור המגע הצפוי. בדיקות קשיות מסווגות לבדיקות מיקרו-הזחה (micro-hardness) ובדיקות מאקרו-הזחה, בהתאם לכוח המופעל על חומר הבדיקה. בדיקות מיקרו-הזחה משתמשות בדרך כלל בעומסים בטווח 0.01-2 N (בערך 1-203 gf); בינתיים, בדיקות כניסה מאקרו משתמשות ביותר מ- 10 N (10119 gf)1.
כדי להעריך תכונות של רקמות קשות דנטליות במחלות פה, כולל עצם השן והנאדיות, מיקרו-CT (μCT) ומיקרוסקופ אלקטרונים סורק (SEM) משמשים לניתוח מבני. μCT מספק מידע הדמיה תלת-ממדי (נפח וצפיפות מינרלים)2, ו-SEM מפיק תמונות מיקרו-מבנה (מנסרת אמייל ולקונה של עצמות)3. באופן משלים לניתוח מבני על ידי μCT ו- SEM, מיקרו-קשיות היא אחד הפרמטרים האינפורמטיביים להערכת האופן שבו שינויים מבניים משנים את התכונות המכניות של עצם השן והנאדית במחלות פה, למשל, מום באמייל וספיגת עצם חניכיים. ערך המיקרו-קשיות של אמייל האדם של ויקרס (HV = 283-374) גבוה בערך פי 4 עד 5 מזה של דנטין (HV = 53-63)4,5. במודלים של פלואורוזיס דנטלי של מכרסמים, מיקרו-קשיות האמייל יורדת באופן משמעותי בחותכות עכבר המטופלות בפלואוריד (HV = 136) בהשוואה לאמייל הבקרה (HV = 334)6,7. זה מצביע על כך שאמייל פלואורוז הוא רך וחלש יותר עם תכולת מינרלים נמוכה יותר ותכולת חלבון גבוהה יותר מאשר נמצא באמייל שאינו פלואורוז. Microhardness משמש להערכת תכונות מכניות העצם. מספר מחקרים קודמים בחנו את ההתנהגות המכנית של עצם אנושית מאתרים אנטומיים שונים, כולל מיקרו-קשיות עצם ארוכה 8,9,10. המיקרו-קשיות הממוצעת של עצם הירך הפלואורוזית האנושית הראתה ירידה משמעותית (HV = 222.4) בהשוואה לעצם הירך שאינה פלואורוזית (HV = 294.4)11. למרות היותו פרמטר שימושי, קיים מחסור בספרות המתארת מיקרו-קשיות (ויקרס12 או קנופ 13,14) של עצם מכתשית במחלות אוראליות.
עד כה דווחו שיטות מדידה שונות של מיקרו-קשיות. מכיוון שערכי המיקרו-קשיות משתניםב-15 בהתאם להכנת הדגימה (ליטוש ומשטח שטוח) ולאתר ההזחה, פרוטוקולים מגוונים עלולים לגרום לפערים בין מחקרים. סטנדרטיזציה של פרוטוקול בדיקת microhardness חיונית להערכה עקבית ומדויקת במודלים של מחלות הפה. במחקר הנוכחי אנו מדגימים פרוטוקול סטנדרטי לניתוח מיקרו-קשיות בעצם השן והנאדית במודל פלואורוזיס דנטלי של עכבר ובמודל ספיגת עצם חניכיים.
Protocol
כל ההליכים המתוארים בפרוטוקול זה בוצעו בהתאם להנחיות ולתקנות לשימוש בבעלי חוליות שאושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים (IACUC) באוניברסיטת אוגוסטה ובאוניברסיטת נובה סאות'איסטרן, המוסמכת על ידי האגודה להערכה והסמכה של טיפול בחיות מעבדה בינלאומיות (AAALAC). שימו לב שד"ר סוזוקי הועסק על ידי אוניברסיטת אוגוסטה, שם הושלמו ניסויי הפלואורוזיס הדנטלי של העכבר.
1. מיצוי שיניים חותכות מנדיבולאריות במודל פלואורוזיס דנטלי עכברי
- יש להאכיל עכברי C57BL/6 בדיאטות נטולות פלואוריד (בני 5 שבועות, זכר) משבוע לפני הפלואוריד ועד להפסקת הטיפול בפלואוריד.
- הכינו מי פלואוריד על ידי הוספת NaF במים מזוקקים ולאחר מכן סינון ואקום באמצעות מסנן 0.2 מיקרומטר. תן לבעלי חיים מים פלואוריד כמו NaF (0 ppm ו 125 ppm; N=5/group) ad libitum למשך 6 שבועות. החליפו את מי הפלואוריד באצווה טרייה שהוכנה כל יומיים.
- לאחר 6 שבועות של טיפול במי פלואוריד, יש להרדים בעלי חיים עםCO2 ולאחר מכן לערוף את ראשם.
- חלץ את hemi mandibular עם חותך מכל עכבר. כדי לאסוף את hemi mandibular עם incisor, לחתוך את השרירים סביב הלסת mandibular מבלי להפעיל כוח מוגזם.
- מניחים את המנדיבולרית ב-PBS ושומרים אותה בטמפרטורה של 4°C עד לניתוח μ-CT (אופציונלי). להפריד את החותכת מן הלסת באמצעות אזמל (#15) ומספריים מבלי לפגוע או לשבור את הדגימה.
- שטפו את החותכת המבודדת עם PBS ובצעו התייבשות על ידי טבילתה בחוזק מוגבר של אלכוהול (70% ו-100% אתנול) למשך 2-3 שעות.
הערה: אם הרקמה (למשל, מוך השן) אינה מיובשת מספיק, סביר להניח שספיגת השרף תעוכב וההערכה הבאה ככל הנראה לא תהיה מספקת. - לאחר התייבשות עם אתנול, להטביע את החותכת אופקית בשרף. המשך לשלב 3.
2. מיצוי עצמות מכתשית מקסילריות במודל ספיגת עצם חניכיים המושרה על ידי ליגטורת עכברים (L-PBR)
- מתן 0.8 מ"ל קטמין (100 מ"ג/מ"ל) + 0.1 מ"ל קסילזין (100 מ"ג/מ"ל) + 9.1 מ"ל PBS תוך צפקי (כלומר) לעכבר (C57BL/6, בן 8-12 שבועות, זכר) כחומר הרדמה. המינון הוא 0.01 מ"ל/גרם (משקל). יש למרוח משחה אופתלמית על שתי העיניים כדי למנוע יובש בהרדמה.
- הניחו את העכבר המרדים על כרית חימום למשך 5-10 דקות. להעריך תגובות לצביטות זנב/בוהן ואת תקינות רפלקס העין. ודא שהעכבר אינו מגיב לגירויים המזיקים והרפלקס נעדר.
- הניחו את העכבר על שולחן הטיפולים והשאירו את הפה פתוח באמצעות תפר משי 5-0 קשור לעמוד מגנטי על שולחן הטיפולים.
- תחת מיקרוסקופ כירורגי, סובבו את הרצועה (תפר משי קלוע 6-0) סביב צד אחד של הטוחנת השנייה המקסילרית (שכבה אחת) באמצעות מחזיקי מחטים מיקרו. מזער הבדלים אינדיבידואליים בניתוח על ידי שימוש בצד אחד כצד הטיפול ובצד השני כבקרה.
- קושרים את הרצועה ויוצרים קשר בצד החיך. לאחר ביצוע קשר, לחתוך את הרצועה הנותרת קצר ככל האפשר, כך ligature מוגזם לא להפריע לעיסה או אכילה. זה חשוב כדי להבטיח כי הרצועה לא תשתחרר על ידי לעיסה במהלך תקופת התצפית הבאה.
הערה: אין להשאיר את בעל החיים ללא השגחה עד שהוא חזר להכרה מספקת כדי לשמור על עצם החזה. אין להחזיר את בעל החיים שעבר ניתוח לחברתם של בעלי חיים אחרים עד להחלמה מלאה. לשמור על תנאים סטריליים במהלך הישרדות. - האכילו את העכברים בתזונה ובמים במשך שבועיים. לאחר שבועיים של קשירה, הרדימו עכברים עםCO2 ולאחר מכן ערפו את ראשם.
- חילוץ שני הצדדים maxillae (צד ligature וצד בקרה) עם טוחנות מכל עכבר. כדי לאסוף מקסילות עם טוחנות, לחתוך את השרירים ואת העצם סביב הלסת המקסילרית באמצעות מספריים מבלי להפעיל כוח מוגזם. מניחים כל מקסילה ב-PBS ושומרים אותה בטמפרטורה של 4°C עד לניתוח μCT (אופציונלי).
- להפריד את עצם alveolar עם טוחנות (1st עד 3rd) מן המקסילה באמצעות אזמל (#15) מספריים מבלי לפגוע או לשבור את הדגימה.
- שטפו את עצם הנאדית המבודדת עם PBS ולאחר מכן התייבשו והורידו שומן על ידי טבילה בחוזק מוגבר של אלכוהול (70% ו-100% אתנול) למשך 2-3 שעות.
הערה: אם הרקמה (למשל, מוך השן והעצם) אינה מיובשת מספיק, סביר להניח שספיגת השרף תעוכב וההערכה הבאה ככל הנראה לא תהיה מספקת. - לאחר התייבשות עם אתנול, להטביע את עצם alveolar אופקית בשרף. המשך לשלב 3.
- אופציונלי: בצע הערכת μCT לפני בדיקת מיקרו-קשיות.
- לפני בדיקת מיקרו-קשיות, בצעו אנליזה מבנית אל-הרסנית (למשל, μCT) תוך שימוש באותה דגימה לבדיקת מיקרו-קשיות כהערכה משלימה (איור 1). מידע מבני (תמונה תלת-ממדית, צפיפות מינרלים, נפח) על ידי μCT יכול לתמוך בהערכת תכונות מכניות ואיכות של דגימות שעשויות להשפיע על תוצאות המיקרו-קשיות.
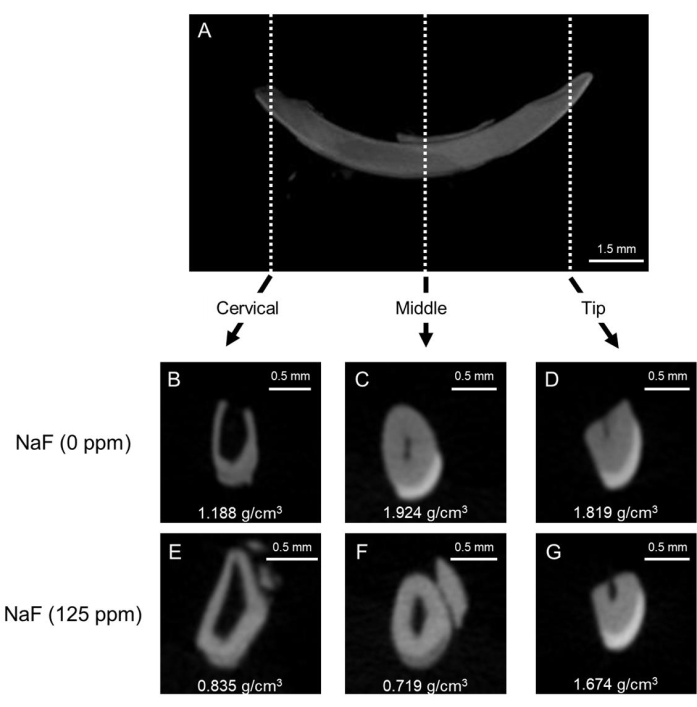
איור 1: תמונות μCT מייצגות של אמייל בבקרה וחותכות עכברים שטופלו בפלואוריד. (A) תמונה מייצגת μCT sagittal של חתך מנדיבולרי. (B-D) μCT coronal images of control incisor (NaF 0 ppm). (E-G) μCT coronal images of incisor treated with NaF (125 ppm). צפיפות מינרלים מייצגת באמייל (EMD) מוצגת (גר'/ס"מ3). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הטמעת דגימות בשרף
- המשך משלב 1.7 (מודל פלואורוזיס דנטלי) או שלב 2.10 (מודל L-PBR).
- מצפים את המשטח הפנימי של ההרכבה (1 אינץ ') בשכבה דקה של פטרולאטום. מערבבים שרף (שרף הטבעה בהגדרה קרה) בהתאם להוראות. יוצקים את השרף והקשיח לכוס הפלסטיק המסופקת ביחס נפח של 15:2 ומערבבים בזהירות עם מרית עץ למשך 2 דקות לפחות. הימנעו מבועות אוויר.
- הניחו חותכת מיובשת ונטולת שומן (איור 2A) או עצם מכתשית עם שיניים טוחנות (איור 2B) בכיוון אופקי ובמקביל לתחתית ההרכבה (דגימה אחת בכל).
- יוצקים את השרף המעורב (מספיק שרף, בערך 1.5 מ"ל) לתוך ההרכבה כדי לכסות לחלוטין את הדגימה. הימנעו מהוספת יותר שרף מהנדרש, שכן עודף שרף יעכב את תהליך הליטוש (איור 2C,D). הניחו את ההרכבה המכילה דגימה על צלחת חמה בטמפרטורה של 50°C למשך 8 שעות לפחות כדי לקדם פילמור שרף. הליך זה תורם להחזקת הדגימה במצב יציב.
הערה: בהתאם לגודל הדגימה, התאם את כמות השרף כדי לכסות לחלוטין את הדגימה. אין למלא יותר מדי שרף, אחרת יידרש זמן רב יותר כדי להסיר שרף מיותר. - לאחר הריפוי, הסר את השרף המכיל את הדגימה מכוס ההרכבה. הסירו קוצים וסדרו את מישור הדגימה ואת מישור הצד הנגדי כמקבילים ושטוחים באמצעות מטחנה-מלטשת מתקדמת עם נייר שוחק גס ועמיד במים (Grit 60/P60 ו-120/P120) תחת הצפות מים. שמרו על גובה הדגימה על כ-3 מ"מ עבור החותכת והעצם בנאדיות (איור 2E,F).
הערה: כאשר הדגימה מנותחת על ידי SEM לאחר מדידת המיקרו-קשיות, עובי הדגימה צריך להיות כ-3 מ"מ, כך שתצפית SEM הבאה לא תושפע. דגימות קטנות יותר קשה יותר לתפעל עם המטחנה. עבור הדגימות המיועדות למיקרו-קשיות בלבד, גובה הדגימה יכול לעלות לכ-10-20 מ"מ. - חתוך את הצורה החיצונית ליצירת גוש שרף מוצק מלבני ופינות מעוגלות (בקירוב, רוחב 30 מ"מ, אורך 10 מ"מ עבור חותכת (איור 2G) ורוחב 10 מ"מ, אורך 5 מ"מ, עבור עצם מכתשית (איור 2H)) באמצעות מסור חתך מדויק.
- לאחר השלמת תיקון הצורה הגסה, הסירו לכלוך וחלקיקים מגוש השרף באמצעות חומר ניקוי על-קולי (כדקה). המשך לשלב 4.

איור 2: זרימה של תהליך שיבוץ וליטוש שרף. (A) חתך מיובש ושומנים. (B) עצם מכתשית מיובשת ומסומנת ב-L-PBR. (ג, ד) חותכות ועצם מכתשית שקועה בשרף. (ה, ו) על ידי חיתוך השרף, קל יותר ללטש את פני רקמת המטרה. (ז, ח) פינות שרף מעוגלות לתהליך הליטוש. קיצורים: L-PBR = ספיגת עצם חניכיים הנגרמת על ידי ליגטורה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. ליטוש דגימות
הערה: ליטוש הדגימות נעשה באופן ידני באמצעות ניירות שוחקים עמידים למים (מגולסים לעדינים יותר) על מטחנה-מלטשת מתקדמת תחת הצפה במים.
- הניחו נייר שוחק גס ועמיד במים (Grit 600/P1200) על המטחנה. הניחו את גוש השרף החתוך והנקי (משלב 3.7) על נייר שוחק גס ועמיד במים.
- בזמן מזיגת המים, החזיקו את גוש השרף ולטשו את משטח ההערכה של הדגימה על מלטש המטחנה (מהירות 1-10 x גרם). בשלב זה, יש להקפיד להחזיק את גוש השרף כך שמשטח ההערכה יהיה מקביל לקרקע. כדי לשמור על שלמות משטח ההערכה, בדוק את פני השטח בעין בלתי או מתחת למיקרוסקופ.
הערה: שים לב שהמטחנה מסתובבת בכיוון השעון, ולחץ אחיד יכול להוביל למשטח לא מקביל. כדי לקבל משטח מקביל, שמור על מהירות סיבוב הדאון קבועה ולחץ על הדגימה בזהירות למשך מספר שניות, ולאחר מכן סובב את הדגימה 180° כדי ללחוץ במשך אותה כמות זמן. נייר שוחק גס עשוי להסיר לא רק שרף אלא גם דגימה. - החליפו את הנייר השוחק ל-Grit 800/P2400 והניחו עליו את גוש השרף. חזור על שלב 4.2.
- הסר פסולת וחלקיקים מגוש השרף באמצעות שואב קולי (כדקה).
הערה: לפני שתמשיך, מומלץ להשתמש בחומר ניקוי על-קולי כדי להסיר לכלוך פני השטח כדי למנוע סתימה. - לאחר מכן, בצע ליטוש סדרתי באמצעות ניירות שוחקים עדינים יותר; סדר הליטוש הוא 12 מיקרומטר, 9 מיקרומטר, 3 מיקרומטר, 1 מיקרומטר ו-0.3 מיקרומטר.
- הניחו סרט דש (12 מיקרומטר) על שולחן המטחנה-ליטוש ללא סיבוב והניחו את גוש השרף על סרט ההרכה.
הערה: בניסוי זה, שולחן המטחנה מתאים לקבלת מצב משטח שטוח תחת הצפת מים. לחלופין, ניתן להשתמש גם במראה מישורית גדולה (או דומה) המספקת מקביליות. - מתחת לקירור במים, יש ללטש בזהירות את משטח ההערכה של הדגימה על סרט הדש ביד. הזז את הדגימה אנכית, אופקית ואלכסונית למשך אותו מספר שניות תחת הזרקת מים במשיכות של 2 עד 3 ס"מ (1 אינץ'). כאשר הליך הליטוש מושג כראוי, דגימת השרף תידבק לסרט הדש.
- הסר פסולת וחלקיקים כמו בשלב 4.4. שנו את הנייר השוחק לגודל הבא בהתאם לסדר הליטוש הטורי (מ-12 מיקרומטר ל-0.3 מיקרומטר) והניחו עליו את גוש השרף.
- בזמן מזיגת המים, החזיקו את גוש השרף ולטשו בזהירות את פני השטח של הדגימה על סרט ההקפה ביד. הסר פסולת וחלקיקים כמו בשלב 4.4.
- חזור על שלבים 4.5 - 4.8 כדי להשלים את הליטוש הסופי (0.3 מיקרומטר). לאחר השלמת הליטוש הסופי (0.3 מיקרומטר), הדגימה צריכה להיות בעלת משטח גימור מראה (איור 3A).
- נקו את פני השטח של הדגימה עם אתנול (100%) כדי להוריד שומן ולייבש ולאחסן בלוקים של שרף בטמפרטורת החדר עד לבדיקת קשיות מיקרו. במהלך האחסון, הימנעו מלחות ואבק מוגזמים. המשך לשלב 5.
5. בדיקת מיקרו-קשיות ויקרס
הערה: הזחה של דגימת משטח גימור מראה מתבצעת באמצעות בודק קשיות מיקרו. הבדיקה מבוצעת עם עומס של 25 גרם במשך 10 שניות עם קצה ויקרס.
- בדיקת מיקרו-קשיות ויקרס לשיניים חותכות (מודל פלואורוזיס דנטלי)
הערה: ניתן לחלק את האמייל לשלוש שכבות מבחוץ (צד חלל הפה) ועד מבפנים (צד עיסת השן); כלומר, השכבה השטחית, השכבה האמצעית והשכבה העמוקה (צומת דנטין-אמייל, DEJ) (איור 3B)16. בפרוטוקול זה נבדקות שלוש שכבות אמייל.- הגדר את כוח ההעמסה ל- 25 גרם ואת משך הטעינה ל- 10 שניות. מניחים את גוש השרף על הבמה.
- כניסה 6 נקודות בכל שכבת אמייל (שטחית, אמצעית ו- DEJ) ודנטין בכל אזור (צוואר הרחם, אמצע וקצה; איור 3B).
- מדוד את אורך שני האלכסונים (d1 ו- d2; איור 3B) כדי לחשב את ערך המיקרו-קשיות של ויקרס (HV; איור 4).
- בדיקת מיקרו-קשיות של ויקרס לעצם מכתשית (דגם L-PBR)
- הגדר את כוח ההעמסה ל- 25 גרם ואת משך הטעינה ל- 10 שניות. מניחים את גוש השרף על הבמה.
- כניסה 3-6 נקודות בכל צד מזיאלי ודיסטלי של עצם הנאדית מפסגת הנאדית. כניסת עצמות מכתשית בין1 st ו2 nd טוחנת (ריבוע לבן), ו 2nd ו3 rd טוחן.
הערה: בפרוטוקול זה, 6 נקודות בכל צד מזיאלי ודיסטלי (סה"כ 12 נקודות) הוערכו עבור עצם הבקרה (שלמה), ו -3 נקודות בכל צד (סה"כ 6 נקודות) הוערכו עבור L-PBR. מספר נקודות ההזחה תלוי בתנאי הנגע (למשל, אובדן עצם רב מדי מגביל את אזור ההזחה).
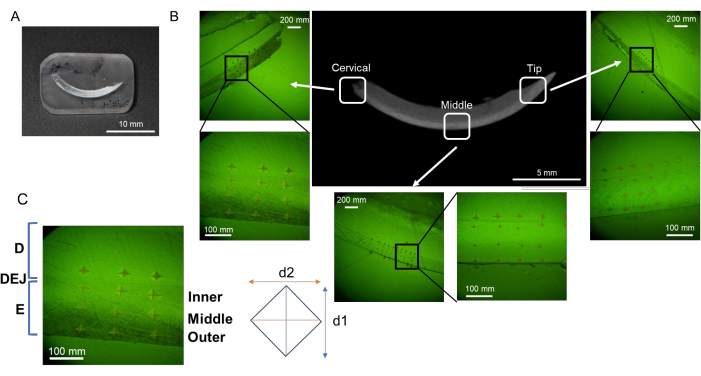
איור 3: אזורי הערכה של מיקרו-קשיות בחתך מנדיבולרי. (A) דגימת משטח גימור מראה המכילה חתך מנדיבולרי. (ב) כניסות בכל אזור; צוואר הרחם, האמצע והקצה (NaF 0 ppm). (ג) שלוש שכבות אמייל; מהאמייל הפנימי, האמצעי, האמצעי והחיצוני. קיצורים: D = דנטין, E = אמייל, DEJ = צומת אמייל דנטין אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
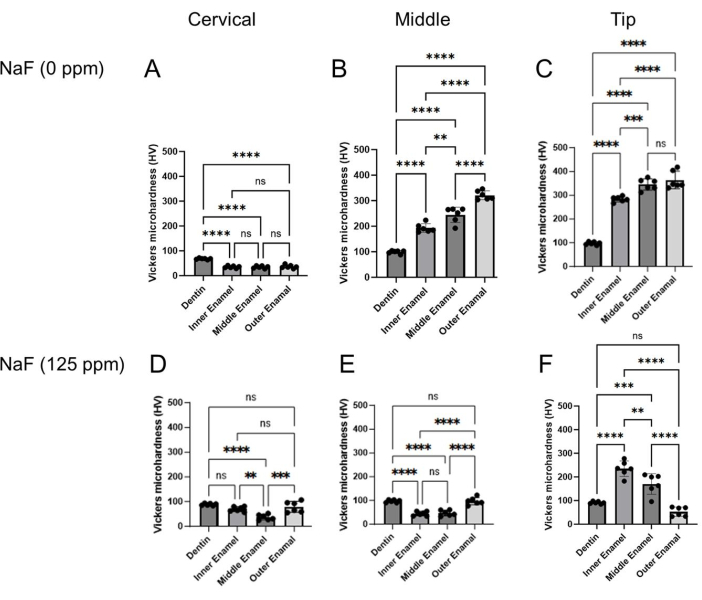
איור 4: מיקרו-קשיות ויקרס של אמייל שטופלה עם או בלי NaF. המיקרו-קשיות של דנטין ושלוש שכבות אמייל הוערכו בכל אזור, צוואר הרחם, האמצע ואזור הקצה. (א-ג) בקרה וטיפול (D-F) NaF (125 ppm). הנתונים מוצגים כממוצע ± SD. הבדלים משמעותיים הוערכו על ידי ANOVA חד-כיווני עם מבחן פוסט-הוק של Tukey. ערכי p < 0.05 נחשבו מובהקים סטטיסטית. **p < 0.005, ***p < 0.0005, ****p < 0.0001 לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאות
מודל פלואורוזיס דנטלי: איור 1 מראה תמונות μCT מייצגות של חותכות בבקרה ועכברים שטופלו בפלואוריד. בביקורת (איור 1B-D), אזור צוואר הרחם הראה צפיפות מינרלית אמייל נמוכה יותר (EMD) של 1.188 גרם/ס"מ3 (איור 1B) בהשוואה לאמצע (1.924 גרם/ס"מ3) ו?...
Discussion
מיקרו-קשיות מבוצעת כדי להעריך תכונות מכניות של רקמות קשות כמו שן ועצם. עד כה דווחו שיטות מדידה שונות של מיקרו-קשיות. רוב מידע המדידה, במיוחד הכנות הדגימה ואתרי ההזחה עשויים להיות לא מספיקים. מחקר זה התמקד בפרוטוקול מיקרו-קשיות עבור אמייל ועצם מכתשית במודלים של פלואורוזיס דנטלי ומחלות חניכ?...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
המחקר שדווח בפרסום זה נתמך על ידי JSPS KAKENHI JP21K09915 (MO) והמכון הלאומי למדעי הרפואה הכלליים; T34GM145509 (MM) והמכון הלאומי למחקר שיניים וקרניופציאליות; R01DE025255 R21DE032156 (XH); R01DE029709, R21DE028715 R15DE027851 (TK); R01DE027648 ו K02DE029531 (MS).
Materials
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
References
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved