Method Article
Methyltransferases, profilleme ve Diğer S Adenosil- L homosistein bağlayıcı Proteinler
Bu Makalede
Özet
Yakalama Bileşikler fotoğraf crosslinking ve saflaştırma takip fonksiyonel geri dönüşümlü küçük molekül-protein etkileşim proteom karmaşıklığını azaltmak için trifunctional küçük moleküllerdir. Burada Yakalama Bileşik S Adenosil- L seçicilik fonksiyonu olarak homosistein bağlayıcı Escherichia coli Tüm hücre lizat ve MS bunları tanımlamak.
Özet
Afinite kromatografisi 1 veya Aktivite Bazlı Protein Profil 2 gibi fonksiyonel küçük molekül-protein etkileşimleri temelinde proteom karmaşıklığını azaltmak için çeşitli yaklaşımlar vardır. Trifunctional Yakalama Bileşikler (Aday, Şekil 1A) 3, genel bir yaklaşım için temel olan ilk denge odaklı bir küçük molekül prob (Burada seçicilik fonksiyonu, S-adenosil-L-homosistein, SAK, Şekil 1A) arasındaki etkileşimi ve hedef proteinler geri dönüşümsüz CC bağımsız bir fotoğraf activable reaktivite fonksiyonu (bir phenylazide) ve hedef proteinlerin yüzey arasında fotoğraf crosslinking üzerine sabitlenir. (Burada streptavidin manyetik boncuk gibi) bir katı faz yardımı ile karmaşık biyolojik karışımlar protein konjugatları - sıralama fonksiyonu (burada biyotin) CC izole etmek için hizmet vermektedir. Deneylerde iki konfigürasyonlar mümkündür: "off-boncuk" 4 veya şu anda açıklanan "boncuk" yapılandırma (Şekil 1B). Seçicilik fonksiyonu ilgi hemen hemen her küçük molekül (substratı, inhibitörü, ilaç molekülleri) olabilir.
S-adenosil-L-metionin (SAM, Şekil 1A), muhtemelen, ATP, doğa 5, 6, en yaygın olarak kullanılan kofaktör ikinci . Bu DNA 7 8, RNA, proteinler, 9 veya küçük moleküller 10 methylate SAM-bağımlı methyltransferases (MTases), kimyasal reaksiyon tarafından katalize olan tüm canlı organizmalarda önemli metil grubu vericisi olarak kullanılır. (Gen regülasyonu, epigenetik, metabolizma) çeşitli fizyolojik senaryolarda metilasyon reaksiyonları önemli rol göz önüne alındığında, MTases profil kinazlar profil olarak fonksiyonel proteomik benzer bir öneme sahip olmaya beklenebilir. Ancak, kendi profil için analitik araçlar mevcut değildir. Yakın zamanda bu teknolojik boşluğu doldurmak için (Şekil 1A) SAK ile seçicilik grup olarak bir CC tanıttı.
SAK, metil transferinden sonra SAM, ürünün bilinen bir genel MTase ürün inhibitörü 11. Bu nedenle ve doğal kofaktör SAM 12, kimyasal istikrarsızlık nedeniyle, SAK, MTases hedef CC için ideal bir seçicilik fonksiyonu kofaktör diğer bölgelerine aktarılması ya da radikal reaksiyonların yanı sıra başlatılması daha fazla enzimler tarafından kullanılır. Burada tercih edilen model olarak hizmet vermiştir Escherichia coli (E. coli), en iyi karakterize prokaryotlar biri, gerginlik DH5α profil MTases ve diğer ŞAH-bağlayıcı proteinler tarafından ŞAH-CC ve CCMS yardımcı programı rapor sayısız, biyokimyasal, biyolojik ve biyoteknolojik çalışmalarda organizma. Foto-aktive crosslinking deney verim ve hassasiyeti artırır ve özgüllüğü kolayca ücretsiz SAK bir fazla kullanarak rekabet deneylerde test edilebilir.
Protokol
1) E. hazırlığı coli DH5α Hücre Lizat
- E. ile 2mL kültür (lb ortamdır bir tüp) İnokülasyon coli 37 gliserol stok ve inkübe doğrudan DH5α gerginlik ° C ve 8 saat için 250 rpm Otoklavlanmış LB medya (10 g / l Bacto-Tripton, 5 g / L, maya özü, 10 g / L NaCl, pH 7.5) kullanın.
- 37 gece boyunca 2 mL kültür ve inkübe Baffles 1 L Shaker şişesi 250 ml LB medya İnokülasyon ° C ve 166 rpm bir kuluçka orbital çalkalayıcı.
- Baffles dört 5 L çalkalayıcı matara 250 ml kültür (Her balona 50 ml) ve 37 ° C ve 0.8 kadar bir OD 600 166 rpm ulaşıldığında az kültürlerin inkübe 2.5 L LB medya içeren her İnokülasyon
- 20 dakika için 4 ° C, 3000x g santrifüj hücreleri Hasat. 0-4 ° C'de veya buz üzerinde daha fazla kullanım gerçekleştirin.
- Milli-Q su hasat hücre malzeme yeniden askıya alma, bir başka 6000x g 30 dakika ve 4 ° C için bir santrifüj kova ve santrifüj birleştirmek
- -20 ° C veya -78 ° C 20 g hücre malzemesi Mağaza
- 100 ml buz gibi hücre açılış tamponu (6.7 mM (MES), 6.7 mM NaOAc, 6.7 mM Hepes, 1 mM EDTA, 10 mM β-mercaptoethanol, 200 mM NaCl, pH 7.5,% 10 (w / v) hücreleri yeniden askıya gliserol, 0.2 mM PMSF) ve bir sonifier (örneğin Bandelin Electronic GmbH & Co KG, maksimum genlik, sürekli çıkış SONOPULS HD 2070) ile 25 ml buz üzerinde dört porsiyon 1 dakika boyunca üç kez sonikasyon.
- 2370x g ve 2 ° C, gece boyunca lizat Santrifüj
- 2370x g ve 2 ° C ultrafiltrasyon (örneğin Pierce iCON Konsantratörleri, 7 mL/9K kullanarak) tarafından 14 ml Konsantre süpernatantı
- Viskoz jel filtrasyon SAM veya SAK 2 gibi küçük moleküllerden konsantre İncelten ° C (örneğin Pierce gelen Zeba Desalt Spin sütunlar, 10 ml, dört sütunlu, dört kez 5 ml dengeleme, depolama tampon 2 dakika süreyle 1000x g kaldırıldı buz gibi hücre açılış tampon ve tampon sırasıyla, 2 dakika süreyle 1000x g kaldırıldı; 3.5 mL her sütun uygulanan konsantre; 24x g de 45 dakika santrifüj, 1000x g sonra iki kez 2 dakika)
- 13 ml buz gibi gliserol ve Roche mini proteaz inhibitörü kokteyl tablet, EDTA ücretsiz elde edilen 13 ml lizat tamamlayın. Mix ve tablet çözülür.
- Lizat -20 ° C'de saklayın
- Bradford assay (21 mg / ml davada), toplam protein konsantrasyonu belirleyin. Bradford reaktifi: 100 mg Coomassie Brillant Blue G-250 ml% 95 etanol 50, Whatman # 1 kağıt yoluyla 100 ml% 85 (w / v), fosforik asit, boya tamamen çözülmüş 1 L ye tamamlanır ve filtre eklemek sadece Kullanmadan önce.
2) Yakalama Testi (A), Rekabet Kontrol (C), Pulldown (PD), Pulldown Rekabet Kontrolü (CPD) ve Kombine Yakalama Testi artı Pulldown (A + PD)
- Yakalama deneyler için, SAK caproKit (caprotec bioanalytics GmbH), SAK-CC, rakip olarak ücretsiz SAK, 1 mikron çaplı (Dynabeads MyOne Streptavidin C1, Invitrogen Dynal), 5X yakalama tampon ile streptavidin kaplı manyetik boncuk, kullanılan (5X CB, 100 mM HEPES, 250 mM potasyum asetat, 50 mM magnezyum asetat ve% 50 gliserol içeren) ve 5X yıkama tamponu (5X WB, 250 mM Tris HCl, pH 7.5, 5 mM EDTA, 5 M NaCl, 42.5 içeren mcM oktil-β-D-glucopyranoside).
- Birkaç paralel deneyler için bir ana su karışımı hazırlamak için tavsiye edilir, tampon ve E. yakalamak . coli lizat ve 200 mcL-PCR tüp şerit farklı tüpler içinde reaksiyonları gerçekleştirmek için (önerilen 0.2 mL Termo-Şeridi, Thermo Scientific, AB-1114). Burada, tek bir reaksiyon tüpü için miktarlar verilmiştir. Sonuçlar beş farklı deneyler için yakalama assay (A), rekabet kontrolü (C), açılan (PD), açılan rekabet kontrolü (CPD), ve kombine yakalama tahlil artı açılan (A + PD) sunulacak.
- Her reaksiyon için, 1.5 ml 1X WB, 0.3 ml 5X WB 1.2 ml Milli-Q su ekleyerek hazırlayın.
- ŞAH-CC yüklü streptavidin kaplı manyetik bilye (caproBeads -) 200 mcL PCR tüp şeritler halinde hazırlayın. Bu nedenle, her kısım için 10 mg / ml streptavidin kaplı manyetik boncuk 50 mcL 100 mcM ŞAH-CC 25 mcL karıştırın, şiddetle biotin kısmın bağlayıcı izin vermek için 2 dakika süreyle oda sıcaklığında süspansiyonlar sallamak SAK manyetik boncuk yüzeyinde streptavidin ve (caproMagTM manyetik cihaz, caprotec bioanalytics GmbH kullanarak PCR tüp şeritler kapakları gibi) güçlü bir mıknatıs kullanarak boncuk toplamak CC. Süpernatantlar atın, 200 mcL WB sonucu caproBeads yeniden askıya manyetik caproBeads (PCR tüp şeritler kapakları) toplamak ve supernating WB atın. Kapat tüpler boncuk kurumasını önlemek için.
- E.coli DH5α bütün hacimde hazırlayın0-4 yeni PCR tüpleri hücre lizat ° C usta bir karışımını kullanarak (2.2). Bir reaksiyon için Milli-Q su hacmi, son bir reaksiyon karışımı hacmi 20 mcL 5X CB 100 mcL tamamlar. Mix, 0.26 mg E. eklemek coli lizat ve yavaşça tersine çevirerek karıştırın. Sadece C ve CPD, 20 mcL 10 mM SAK rakip çözüm ekleyin ve hafifçe çevirerek karıştırın (A, PD, ve A + PD Milli-Q SAK çözüm yerine su ekleyin). Daha fazla analiz (aşağıya bakın) A dan 1 mcL örnek çizin.
- 4 3 saat için ilgili lizat ve inkübe caproBeads Askıya Alma ° C, SAK bağlayıcı proteinlerin SAK SAK-CC seçicilik fonksiyonu reversibl bağlanma izin dönüşü ile süspansiyon boncuk tutmak.
- Süspansiyonlar, A, C ve A + PD caproBoxTM (UV ışık ve aynı anda soğutma, caprotec bioanalytics GmbH ile biyokimyasal örnekleri aydınlatarak için cihaz) ve ışın tedavisi için 0-4 arasında kapalı tüplerde toplam süre 30 dakika yerleştirin ° C ŞAH-CC SAK bağlayıcı proteinlerin reaktivite fonksiyonu arasında bir kovalent çapraz bağ oluşturur. Bu nedenle, çok kısa bir süre (yaklaşık 2 sn), kalan süspansiyon kaldırmak için santrifüj ~ 15 s (özellikle kapakları) buzlu su, caproBoxTM, sırasıyla, 2.5 dakika ışınlama aralıklarla sonra serin süspansiyonlar kaldırmak tersine çevirerek birkaç kez bir arada kapaklar, ve sonraki ışınlama aralığı için caproBoxTM geri.
- , C, PD, CPD ve A + PD 20 mcL 10 mM SAK çözümü için bir ya da 20 mcL Milli-Q su ekleyin ve 10 dakika süspansiyon 4 ° C, A, çapraz değil SAK bağlayıcı proteinlerin yerini inkübe ŞAH-CC. Rotasyon veya aralıklı manuel yeniden süspansiyon süspansiyon boncuk tutun.
- Güçlü bir mıknatıs (örneğin caproMagTM) kullanarak süspansiyonları caproBeads toplayın, süpernatantlar atmak ve boncuk altı kez yeniden süspansiyon ve toplama - 200 mcL 1X WB ve 200 kez ile mcL Milli-Q su ile yıkayın.
- Boncuk, 4 ° C'de birkaç hafta, Milli-Q su saklanabilir Alternatif protokolleri (tartışma) yakalanan proteinler ve kimlik işlenmesi için mevcut.
- 200 mcL% 60 asetonitril (ACN) boncuk üç kez yıkayın ve 200 mcL% 60% ACN/0.2 trifloroasetik asit (TFA) ile sallayarak dinç altındaki oda sıcaklığında 10 dakika inkübasyon boncuk yakalanan proteinler serbest (taze hazırlamak) . LC-MS-sınıf reaktifler ve su kullanın.
- Manyetik boncuk toplamak ayrı ve santrifüj evaporatör (GeneVac, Inc UK örneğin MiVac DNA konsantratör) kullanarak kuruluk süpernatantı buharlaşması. Boncuk atın.
3) Yakalanan Proteinler SDS-PAGE
- SDS-PAGE, manyetik 20 mcL SDS örnek tamponu (50 mM Tris HCl, 320 mM β-mercaptoethanol,% 2.5,% 0.05 SDS Bromophenol Mavi boncuk (ACN / TFA çözümleri buharlaşmış adım 2.12) yayımlanan yakalanan proteinler çözülür % 10 gliserol, pH 6.8). (2.5 adım) 19 mcL SDS numune tamponu çizilen 1 mcL örnek karıştırın; (testin% 0,25), SDS-PAGE analizi için bu çözüm 5 mcL kullanabilirsiniz. SDS numune tamponu 10 dakika örnekleri 95 ° C'ye ısıtılır ve oda sıcaklığına kadar soğumasını bekleyin.
- 25 mM Tris tabanı, 200 mM glisin,% 0,1 SDS, pH 8.3:; EKK OmniPage mini jel elektroforez sistemi SDS çalışan tampon EKK ® ProPage 4-20% Tris / glisin prekast jeller: SDS-PAGE (genel kurulum Analiz ;) SDS çalışan tampon buz soğutma sabit bir gerilim altında 180 V süresi 90 dakika çalıştırın.
- Gümüş bir MS uyumlu gümüş leke yöntemi (örneğin Sigma ProteoSilver Gümüş Stain Kit) kullanarak jel leke. Bir temsilci sonucu Şekil 2'de gösterilmiştir.
Jel Bantları Proteinler ve Peptid çıkarımı 4) jel Triptik Digest
- Gümüş leke durak çözüm çıkarıldıktan sonra gümüş lekeli jel en az üç kez 10 dakika süreyle 100 ml Milli-Q su ile yıkayın.
- Jel bantları (örneğin 0.5 ml Eppendorf tüp içine temiz bir neşter ve transfer kullanarak) ve -20 ° C'de saklayın veya doğrudan süreci kesip. 100 mcL su, 100 mcL% 50 etanol, 100 mcL su, 100 mcL% 50 etanol ve saf etanol ile 5 dakika için, sırasıyla, 15 dakika için jel bantları yıkayın. Bu yıkama işlemi bir kez daha tekrarlayın.
- 10 mcL jel sindirim çözüm ile Re-hidrat jel bandı (12.5 ng / mcL 50 mM amonyum bikarbonat derece tripsin sıralama, 1 mM HCl 7.5 mcL 0.5 mikrogram / mcL tripsin çözümü 292,5 mcL 50 mM amonyum bikarbonat ekleyerek hazırlamak 4 ° C'de 45 dakika) Süpernatantı ve 20 ° C'nin üzerinde sallayarak ise gece 37 inkübasyon tarafından takip mcL 50 mM amonyum bikarbonat (tripsin olmadan) değiştirin.
- Süpernatantı toplayın. Sallayarak ise peptid ekstraksiyonu için ekleyin, 15 dakika süreyle 20 mcL% 5 formik asit (FA) ile jel bandı inkübe20 mcL ACN ve sallayarak, başka bir 15 dakika inkübe. Önceki süpernatant ile süpernatantı birleştirin ve bir kez daha peptid çıkarma prosedürü tekrarlayın.
- Ultrason sallayarak ve uygulama sırasında 10 mcL% 5 FA erimesi (ultrason hamamı, örneğin Sonorex Bandelin, Almanya) ve (adım 5.2 ve daha fazla) tuzsuzlaştırma ile devam kombine üç süpernatantlar, kuruluk buharlaşır.
5) Yakalanan Proteinler Triptik Digest ve Peptitler LC-MS/MS için hazırlanması
- Ultrason banyo ve vorteks kullanarak 10 mcL 50 mM amonyum bikarbonat manyetik boncuk (ACN / TFA çözümleri adım 2.12 buharlaşmış) yayımlanan yakalanan proteinler çözülür, 1 mM HCl 1 mcL 0.5 mikrogram / mcL tripsin eklemek ve çözüm inkübe 37 ° C gece boyunca.
- 10 mcL% 50 metanol / 5 ile ön koşul: C18 malzeme kullanılarak yakalanan proteinler triptik peptidler (örneğin 2-10 mcL StageTips, 20 mcL ucu, Proxeon Biosystems A / S, Odense, Danimarka, üretici prosedürü içeren çözüm Desalt % FA, yakalanan proteinler, peptidler, 10 mcL% 5 FA ile yük dengelenmesi 10 mcL% 5 FA ile yıkayın, 10 mcL% 50 /% 5 metanol FA) ile iki kez Zehir.
- % 50 metanol / kuruyacak kadar% 5 FA desalted peptidler buharlaşması sallayarak, ultrason (ultrason banyo) ve uygulama sırasında 5.5 mcL% 0.1 FA çözülür ve nanoLC-MS/MS tarafından analiz.
6) NanoLC-MS/MS Analizi
- Akış nano-sıvı kromatografisi (nanoLC) sistemi (Proxeon Biosystems A / S, Danimarka örneğin Kolay LC sıvı kromatografi sistemi) örnek yer plaka ve plaka örnek aktarın.
- Ve mobil faz B. Sadece LC-MS dereceli solventler gibi ACN% 0.1 FA mobil faz olarak su içinde% 0.1 FA kullanın.
- Öncesi bir sütun üzerine doğrudan peptid çözüm 5 mcL yükleyin (C18 örneğin nanoflow Biyosfer, 5 mm, 120 x 0.1 mm Å, 20; NanoSeparations, Hollanda) analitik bir sütun (örneğin C18 nanoflow Biyosfer, 5 mm, 120 Å birleştiğinde , 100 x 0.075 mm; NanoSeparations, Hollanda)% 5 ACN/0.1% FA kullanarak.
- ACN/0.1% FA% 5,% 100 ACN/0.1% ek bir 2 dakika için% 100% ACN/0.1 FA ve kalan 40% ACN/0.1% FA 80 dk doğrusal bir degrade sırasında LC Zehir peptidler sırasında FA 400 nL / dak kontrollü bir debi ile başka bir 8 dk.
- Thermo FisherScientific, Almanya, elektrosprey iyonizasyon (ESI) nanoelectrospray iyon kaynağı ile donatılmış; Proxeon yüksek bir doğruluk state-of-the-art kütle spektrometresi (örneğin LTQ Orbitrap XL kütle spektrometresi yıkandı, peptidlerin kütle spektroskopisi (MS) analizi yapın Biyosistem A / S, Danimarka).
- Orbitrap-MS (profil modu) ve LTQ-MS/MS (centroid modu) satın alma arasında otomatik olarak geçiş yapmak için veri-bağımlı modunda kitle spektrometrik analizi yapın.
- Kütle spektrometresi görev döngüsü enjeksiyon zaman otomatik kazanç kontrol ayarı kontrol edin.
- Anket Edinme tam tarama MS spektrumları (m / z 300 2000) m / z 400 çözünürlükte r = 60,000 (doğrusal iyon tuzağı 500.000 suçlamaların bir hedef değer birikimi sonra) orbitrap.
- Sırayla bir hedef değeri 10.000 ücretleri çarpışma bağlı disosiasyon (CID) kullanarak lineer iyon tuzağı parçalanması için en yoğun iyonları (beş adede kadar, sinyal yoğunluğuna bağlı olarak) izole etmek için araç olarak ayarlayın. Parçası iyonları LTQ kaydedilir.
- MS modunda hassas kitle ölçümleri için, gerçek zamanlı iç ortam hava elektrosprey işlemi sırasında kilit kitlesel olarak üretilen tek başına ücret polydimethylcyclosiloxane arka plan iyon (Si (CH 3) 2 O) 6 H + (m / z 445,120025) kalibrasyonu gerektirir.
- Dinamik olarak zaten hedef iyonları dışarıda süresi 60 s CID için kitle seçilmiş
- Sorumlu devlet tarama ve atanmamış şarj ile CID iyonlarının reddi ayarlayın.
- Ayrıca kitle spektrometrik ayarları aşağıdaki gibidir: 1,6 kV, 200 kılcal ısıtmalı transfer ayarlanan sıcaklık ° C, ve normalize çarpışma enerjisi MS 2.% 35 sprey gerilimini ayarlamak MS 2. için gerekli minimum sinyal 500 paradır. Bir etkinleştirme q = 0.25 ve MS 2. satın almalar için bir aktivasyon süresi 30 ms uygulayın.
- LC sistemi temizlemek için, iki ardışık CCMS ölçümleri arasındaki bir boş vadede gerçekleştirmek.
7) Otomatik Sıra Veritabanı Search üzerinden Peptit ve Proteinlerin tanımlanması
- Sürümü, MS / MS verileri (ham dosyalarında saklanan davada), BioworksBrowser 3.3.1 SP1 (FisherScientific Termo, Almanya) ve X! Tandem (Küresel Proteom Makine Örgütü uygulanan örneğin SEQUEST analiz etmek için bir protein tanımlama algoritması kullanın. Sc 2007.01.01.1) uygulanacakaffold 3 yazılımı (sürüm Scaffold_3_00_03, Proteom Software Inc, ABD).
- (Escherichia coli K12 suşu, serbest 57-11 Bu çalışmada kullanılan veritabanı) incelenen organizmanın en son UniProtKB / İsviçre-Prot veritabanı sürümü www.expasy.org karşı otomatik veritabanı arama yapın.
- 5 ppm habercisi hoşgörü, 1 amu parçası iyon hoşgörü, ve iki cevapsız bölünmelere izin veren tam tripsin özgüllük: SEQUEST içinde arama otomatik veritabanı için aşağıdaki ayarları kullanın. Methionines, oksidasyonu; ve glutamin asparagines az deamidation, lisin ve serin az asetilasyon lisin az formylation ve arginin, lisin, serin, treonin metilasyon ve asparajin değişken değişiklikler serin, treonin ve tirozin fosforilasyon olarak izin verin. Veritabanı arama sabit değişiklikler kullanmayın.
- BAV veya DTA ve SEQUEST ve X! Tandem veritabanı arar birleştirerek peptid atamaları ve protein tanımlamalar olasılık değerlendirmesi yapar İskele 3, içine SEQUEST tarafından oluşturulan dışarı dosyaları yükleyin. İskele kolayca birkaç örnek protein listeleri karşılaştırma ve görselleştirmek için yararlıdır (davada, A, C, PD, CPD ve A + PD).
- ≥% 95 olasılık Peptide Peygamber algoritma (ref.13) tarafından belirtildiği gibi sadece peptidler dikkate İskele 3 yazılım içinde parametreleri ayarlayın. Protein Peygamber algoritması 13 göre ≥% 95 birden fazla peptid atamaları için protein tanımlanması olasılıklar ayarlayın. Tek bir peptit protein tanımlamalar için, keyfi ≥% 50 protein olasılık ve ilgili peptid MS / MS spektrumları elle kontrol edin. Cimrilik ilkeleri karşılamak için yazılım tarafından benzer peptidler oluşur ve tek başına MS / MS analizleri dayalı farklılaşmış olamazdı Proteinler gruplandırılmıştır. Veritabanı yaklaşımı kullanılarak ters protein ve <% 1 olmalıdır peptid tanımlamalar tahmini yanlış keşif oranı tespit edilebilir.
- CCMS deneyler Temsilcisi sonuçlar Tablo 1, 2 ve Ek Tablo S1 (bazı proteinler için protein veritabanı güncel olmadığı akılda, örneğin PrmB (aka YfcB) veya RsmH (aka MraW)) yanı sıra, Şekil 3 gibi.
8) Temsilcisi Sonuçlar
Tablo 1:
| Protein | ORF | MW / kDa | Tanım | Yüzey | A | C | PD | CPD | A + PD |
| DCM | b1961 | 53,5 | DNA sitozin MTase | DNA (m5C) | 1 | 0 | 0 | 0 | 1 |
| RlmI | b0967 | 44,4 | 23S rRNA m5C1962 MTase | rRNA (m5C) | 17 | 0 | 17 | 0 | 20 |
| RlmL | b0948 | 78,9 | 23S rRNA m2G2445 MTase | rRNA (m2G) | 12 | 0 | 0 | 0 | 10 |
| TrmB | b2960 | 27,3 | tRNA (guanin-N (7) -)-MTase | tRNA (m7G) | 11 | 0 | 0 | 0 | 13 |
| CmoA | b1870 | 27,8 | tRNA (cmo5U34)-MTase | tRNA (mcmo5U) | 7 | 0 | 0 | 0 | 4 |
| RsmG | b3740 | 23,4 | 16S rRNA m7G MTase | rRNA (m7G) | 6 | 0 | 1 | 0 | 5 |
| RsmH | b0082 | 34,9 | 16S rRNA m4C1402 MTase | rRNA (M4C) | 5 | 0 | 0 | 0 | 7 |
| RsmD | b3465 | 21,7 | 16S rRNA m2G966 MTase | rRNA (m2G) | 2 | 0 | 0 | 0 | 2 |
| RsmB | b3289 | 48,3 | 16S rRNA m5C967 MTase | rRNA (m5C) | 1 | 0 | 0 | 0 | 0 |
| MnmC | b2324 | 74,4 | Çift fonksiyonlu protein tRNA (mnm (5) (2) U34)-MTase | tRNA (mnm5s2U) | 1 | 0 | 0 | 0 | 0 |
| PrmB | b2330 | 35,0 | 50S ribozomal protein L3 Gln150 MTase | protein (Gln) | 13 | 0 | 0 | 0 | 15 |
| Cher | b1884 | 32,8 | Kemotaksis protein MTase | protein (Glu) | 0 | 0 | 0 | 0 | 1 |
| Cfa | b1661 | 44,9 | Siklopropanın-yağ açil-fosfolipid sentaz | küçük molekül | 15 | 0 | 0 | 0 | 14 |
| Tam | b1519 | 29,0 | Trans-aconitate 2-MTase | küçük molekül | 2 | 0 | 0 | 0 | 3 |
| CysG | b3368 | 50,0 | Siroheme sentaz üroporfirinojen-III C-MTase | küçük molekül | 1 | 0 | 0 | 0 | 2 |
| SmtA | b0921 | 29,8 | Protein smtA | (A) | 7 | 1 | 0 | 0 | 8 |
| MtnN | b0159 | 24,4 | 5'-Methylthioadenosine / SAK nucleosidase | küçük molekül b | 36 | 0 | 0 | 0 | 39 |
| GlnA | b3870 | 51,9 | Glutamin sentetaz | küçük molekül c | 90 | 0 | 0 | 0 | 97 |
| RplK | b3983 | 14,9 | 50S ribozomal protein L11 | protein MTase PrmA d | 2 | 0 | 0 | 0 | 2 |
(tam) karakterize
B SAK glikozidik bağ yok, ancak bölünme metilasyon
c yok metilasyon ama rakip olarak ATP CCMS deneyler (veriler gösterilmemiştir) tarafından gösterildiği gibi ATP bağlayıcı siteye SAK bağlayıcı
50S ribozomal protein L11 MTase PrmA d Yüzey; CCMS (veriler gösterilmemiştir) tarafından tekrarlanabilir özel kimlik
Tablo 1: MTases ve CCMS deneyleri ile tespit edilen diğer seçilmiş proteinler. Verilen rakamlar başına protein ağırlıksız peptid spektral sayısı göstermektedir. Örnekler SDS-PAGE/silver tarafından analiz çiftleri Şekil 2 leke vardır. Çok daha MTases ve diğer SAK bağlayıcı proteinlerin açılan (PD) ve SAK özgüllük rekabet kontrolü bu proteinlerin neredeyse tam yokluğu (C) ile gösterilir kıyasla CCMS assay (A) olarak tanımlanır.
Tablo 2:
| A | C | PD | CPD | A + PD | |
| A | 111 (64) | ||||
| C | 65 (41) | 107 (46) | |||
| PD | 25 (15) | 23 (13) | 61 (17) | ||
| CPD | 23 (13) | 22 (12) | 20 (14) | 47 (14) | |
| A + PD | 87 (61) | 64 (41) | 23 (14) | 22 (12) | 124 (67) |
Tablo 2: Toplam çalışan arasındaki CCMS çalışır ve protein örtüşüyor tespit proteinlerin sayısı. En az 2 peptitler ile tespit edilen proteinlerin sayısı parantez içinde verilmiştir. Yöntemin yüksek tekrarlanabilirlik (A vs C ve özellikle A vs A + PD aynı zamanda PD vs CPD), özellikle sağlam tespit proteinler ile karşılaştırılabilir deneyler arasında yüksek protein örtüşme sonucuna varılabilir (esas belirsiz proteinlerin ) en az 2 peptidler. Şekil 3 de belirlenen tüm proteinlerin listesi için Venn diyagramları ve Ek Tablo S1 bakın.
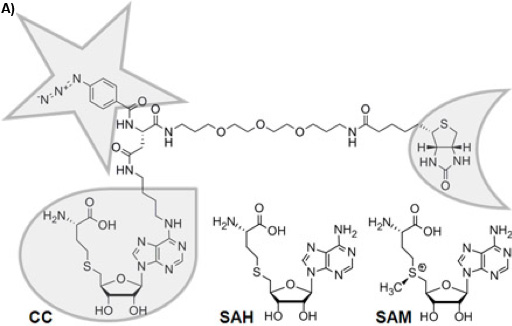
Şekil 1A: trifunctional Yakalama Bileşik (CC) Kimyasal yapısı. Seçicilik fonksiyonu, bir damla, bir yıldız ile reaktivite fonksiyonu ve bir buçuk-moon ile sıralama fonksiyonu ile çerçevelenmiş. Kimyasal olarak stabil G-adenosil-L-homosistein (SAK) tarafından metil grubunun transferi SAK bir ürün inhibitörü olarak üstlendiği SAM-bağımlı MTases sonra S-adenosil-L-metionin (SAM) kofaktör ürün.
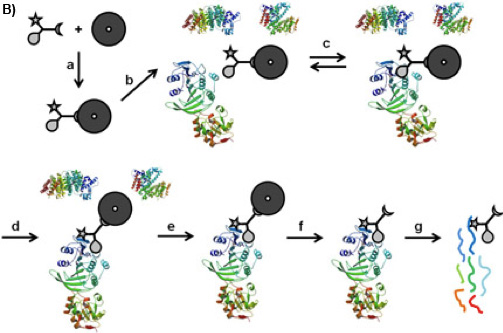
Şekil 1B: CCMS "on-boncuk "iş akışı CC sıralama fonksiyonu (a) manyetik boncuklar bağlıdır, bu nedenle oluşan caproBeads seçicilik fonksiyonu geri dönüşümlü bağlayıcı bir denge (c) arasında kurulan karmaşık protein karışımı (b) ile inkübe UV radyasyona sonra CC ve hedef proteinleri (d), reaktivite fonksiyonu kovalent çapraz bağ oluşturur. yıkadıktan sonra yakalanan proteinler (e), manyetik boncuk çapraz CC-protein kompleksleri bölünme (f) taşıyan manyetik boncuk ve triptik sindirmek (g), yakalanan proteinler triptik peptidler MS analizi ile tespit edilebilir.
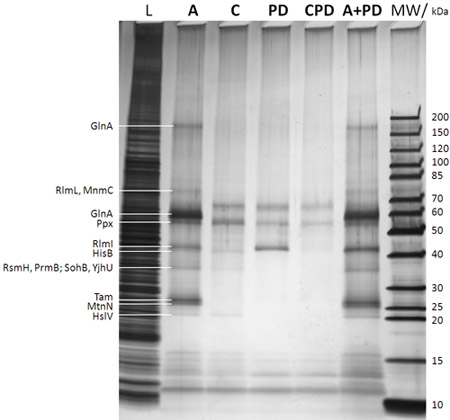
Şekil 2: SDS-PAGE/silver leke Yakalanan proteinlerin analizi (Şekil 1B adım f sonra). : 0.25% örnek caproBeads eklemeden önce E. coli DH5a tüm hücre lizat çizilmiş; L, çok doğru verilen marker bantları ilgili molekül ağırlıkları ile moleküler ağırlık belirteci: şeritli açıklamalar jel (MW verilir Şekil 1B adım b Şekil 1B UV ışınlama adım d sonra serbest SAK aşırı ilavesi ile tahlil; C:: tahlil kontrolü Şekil 1B, c ve d adımlarını sırasında rakip olarak serbest SAK (esansiyel bir fazlalığı da dahil olmak üzere; herhangi bir non-spesifik olarak yakalanan proteinler belirlemek için); PD: açılan anlamı Şekil 1B UV ışınlama adım d ve ücretsiz SAK hiçbir yanı sıra; CPD: SAK kullanılarak açılan rakip olarak kontrol; A + PD: hiçbir Ayrıca anlam kombine tahlil artı açılan iş akışı sırasında ücretsiz SAK). MS-jel triptik sindirmek sonra cut-out protein jel bantları tarafından belirlenen Proteinler çok leftt verilmiştir. Bu foto-crosslinking deney verim ve hassasiyeti artırır ve özgüllüğü kolayca ücretsiz SAK bir fazla kullanarak rekabet deneylerde test edilebileceği açıktır. MTases ve diğer seçilmiş proteinler Bu resimde gösterilen bu yinelenen örnekleri CCMS deneyler tarafından belirlenen Tablo 1'e bakınız.

Şekil 3: (A) CCMS tahlil rekabet kontrolü (C) ve (PD) açılan tespit edilen proteinlerin örtüşme anlatıldığı Venn diyagramları . Sol: MTases sayısı ve SAK nucleosidase, sadece Tablo 1 atıfta. Sağ: Tablo-2 ve Ek Tablo S1 atıfta belirlenen tüm proteinlerin sayısı. En az 2 peptitler ile tespit edilen proteinlerin sayısı parantez içinde verilmiştir.
Tartışmalar
Açıklanan protokol takip ederken aşağıdaki önlemleri ve yorumlar yararlı olabilir: a) Aday, en büyük avantajı, bu daha sonraki sıkı yıkama koşulları izin verdiği, CC ve MTase arasında bir kovalent bağ oluşumu yatıyor. Kovalent çapraz UV ışık (310 nm max.) Tarafından tetiklenen bir photoreaction elde edilir. Normal havai UV ışık yalnızca küçük bir bölümünü içerir, ancak kontrollü ve soğutmalı ışınlama caproBox kadar yükü uzun süre maruz kalmanın, hatta güneş ışığı ŞAH-CC korumak. b) MTases izole edilmesi için biyolojik örnekler denatürasyon eğilimli protein içerebilir, dolayısıyla bu örnekleri serin tutmak ve her zaman Köpüklenmemesine önlemek için zorunludur. c) caproBox 0-4 örnekleri soğutur ° C, UV ışık yayan lambalar, ancak, aynı zamanda ısı yayarlar. Bu nedenle, kısa bir süre ışınlama önce şişeleri santrifüj gerekli, bu nedenle büyük harf veya flakon duvarlara yapışmış proteinler yağış tohum oluşturamazlar. d) manyetik boncuk yeniden süspansiyon (yıkama çözümler), el ile mümkün değilse, kısa bir süre numunelerin ultrason banyosu içine koyarak ultrason geçerlidir. e) Taze% 0.2 TFA/60% ACN çözüm hazırlamak. Biz aksi yakalanan proteinler boncuklar bölünmüş olmayabilir bulundu. f) Yakalanan proteinlerin son tahlilde LC-MS/MS tarafından yürütülmektedir. Kütle spektrometresi, son derece hassas bir yöntemdir. Bu son adımları (adım 2.11 ve daha fazla) sadece LC-MS sınıf reaktifler kullanmak için gereklidir. Dış protein kaynakları, toz veya deneyci kaynaklanan örneğin keratin deneyler kirletil. Özellikle son sindirim adımları sırasında, eldiven ve bir laboratuvar önlüğü ve büyük olasılıkla bir saç net giymek ya da ideal temiz bir tezgah altında son adımları gerçekleştirmek için, temiz bir çalışma alanı dikkat etmek tavsiye edilir. LC MS sınıf su triptik sindirmek için kullanılan 50 mM amonyum bikarbonat tampon, -20 ° C'de 0.22 mikron filtre, kısım, mağaza süzülmeye hazırlayın ve her bir kısım Bulaşmayı önlemek için sadece bir kez kullanabilirsiniz. Tripsin çözüm (sıralama notu, Roche, 1 mM HCl liyofilize tripsin ekleyerek 0,5 mg / ml çözüm hazırlamak) 4 ° C'de birkaç hafta saklanabilir. g) güvenilir kitle spektrumu elde etmek için ESI-MS/MS analiz istikrarlı bir sprey olması esastır. h), bu çalışmada kullanılan bir başka LC-MS/MS sistemler için, ölçüm parametreleri ve peptid tanıma algoritmaları ayrı ayrı ayarlanabilir olmalıdır.
Açıklanan protokole göre aşağıdaki değişiklikler mümkündür: a)% 60 ACN/0.2% TFA (adım 2.11) Alternatif boncuklar proteinlerin bırakmadan, proteinler doğrudan tryptically bir boncuk süspansiyon (içinde sindirilir olabilir aynı birimler olarak adım 5.1) ya da SDS-PAGE, proteinler, 95 adım 2.9 sonra toplanan boncuk askıya ısıtma ve piyasaya olabilir ° C SDS numune tamponu 10 dakika (her ikisi de, bütün askıya alınması veya sadece süpernatantı yüklenebilir jel cebine). Biz boncuklar, boncuk triptik sindirimi sırasında yavaş yavaş, hatta birkaç sulu yıkama adımdan sonra sulu triptik özet çözüm içine küçük miktarlarda polimer yayımı bulundu. MS peptid kimlik polimer kontaminasyonu engelleyen ve% 80 ACN (en az üç kez) kullanarak boncuk kapalı yıkanabilir. % 80 ACN yıkama adımından sonra, boncuk boncuk triptik sindirmek için önce bir kez su ile yıkanmış olmalıdır. b) streptavidin horseraddish peroksidaz ve ECL substrat kullanılarak Western blot proteinler biotin içeren CC başarılı crosslinking görselleştirmek için kullanılabilir. Hassasiyet jellerin gümüş boyama daha yaklaşık 10 kat daha yüksek, çünkü Bu nedenle, bir adım 3.2 sonra elde edilen jel, lekelenen veya olabilir ya, 10 ul örnekleri adım, 2.7 sonra da western blot ile analiz edilebilir. Ikinci durumda endogeneously biotinlenmiş proteinler da yapay ŞAH-BİDB tarafından biotinlenmiş proteinlerin yanı sıra tespit olacaktır akılda. c) Biz, özel bir sistem (lizat, hedef proteinler, seçicilik ve o CC reaktivitesi fonksiyonu hitaben) bağlıdır bulundu olmadığını crosslinking reaksiyon ücretsiz CC ve solüsyon 4 protein arasında yer alan "off-boncuk" yapılandırma ya da şu anda açıklanan "on-boncuk" yapılandırma (Şekil 1B) iyi yapar.
Genel olarak, bu yöntem de uyumlu olmalıdır herhangi bir state-of-sanat stabil izotop protein ya da peptid etiketleme teknolojisi, veya 2D jel elektroforezi yakalama örnek değerlendirme. "Off-boncuk" yapılandırma, tüm hücreleri (yayınlanmamış) içinde protein yakalamak da mümkün. Ayrıca, ilaç veya bir protein kofaktör bağlayıcı site MS peptid sıralama protein dizisi içinde CC yakın-by crosslinking konumunu belirleyerek değerlendirilebilir. Küçük bir molekül bir protein bağlayıcı modu farklı c kullanılarak araştırılmalıdır.seçicilik fonksiyonu ve farklı linker uzunlukları hemical eklenti pozisyonları. Bu çalışmada gösterildiği gibi, proteinler ayrıca protein bağlama ortakları tarafından ele seçicilik fonksiyonu (PrmA, substrat olarak RplK) veya bilinmeyen küçük molekül protein etkileşimleri (GlnA için SAK) tespit edilebilir. Aday, fotoğraf crosslinking reaktivite ek özellik özetle, yüksek hassasiyet ile kompleks protein karışımları düşük bol protein ya da işlevsel protein aileleri izolasyonu ve tanımlanması için izin verir ve küçük molekül eğitimi için ek bir araç ile bilim adamları sağlar protein etkileşimleri .
Açıklamalar
Teşekkürler
Bu çalışma, İnsan Frontier Lisans Programı Örgütü (HFSP Ödülü 2007, RGP0058/2007-C) tarafından desteklenmiştir. Biz proje başlatmak için Prof. Richard Roberts ve verimli tartışmalar için teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| SAH caproKit™ | caprotec bioanalytics GmbH | 1-1010-050 (50 reactions) 1-1010-010 (10 reactions) | Includes the SAH-CC, SAH competitor, streptavidin coated magnetic beads, capture buffer, and wash buffer |
| caproBox™ | caprotec bioanalytics GmbH | 1-5010-003 (110 V) 1-5010-004 (230 V) | For reproducible photo-activation while cooling the samples |
| caproMag™ | caprotec bioanalytics GmbH | 1-5100-001 | For easy handling of magnetic particles without pipetting |
Referanslar
- Katayama, H., Oda, Y. Chemical proteomics for drug discovery based on compound-immobilized affinity chromatography. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 855, 21-27 (2007).
- Barglow, K. T., Cravatt, B. F. Activity-based protein profiling for the functional annotation of enzymes. Nat. Methods. 4, 822-827 (2007).
- Koster, H., Little, D. P., Luan, P., Muller, R., Siddiqi, S. M., Marappan, S., Yip, P. Capture compound mass spectrometry: a technology for the investigation of small molecule protein interactions. Assay Drug Dev. Technol. 5, 381-390 (2007).
- Dalhoff, C., Hueben, M., Lenz, T., Poot, P., Nordhoff, E., Koster, H., Weinhold, E. Synthesis of S-Adenosyl-L-homocysteine Capture Compounds for Selective Photoinduced Isolation of Methyltransferases. ChemBioChem. 11, 256-265 (2010).
- Lu, S. C. S-Adenosylmethionine. Int. J. Biochem. Cell. Biol. 32, 391-3952 (2000).
- Cantoni, G. L. Biological methylation: selected aspects. Annu. Rev. Biochem. 44, 435-451 (1975).
- Jeltsch, A. Beyond Watson and Crick: DNA methylation and molecular enzymology of DNA methyltransferases. ChemBioChem. 3, 274-293 (2002).
- Chow, C. S., Lamichhane, T. N., Mahto, S. K. Expanding the nucleotide repertoire of the ribosome with post-transcriptional modifications. ACS Chem. Biol. 2, 610-619 (2007).
- Grillo, M. A., Colombatto, S. S-Adenosylmethionine and protein methylation. Amino Acids. 28, 357-362 (2005).
- Fujioka, M. Mammalian small molecule methyltransferases: their structural and functional features. Int. J. Biochem. 24, 1917-1924 (1992).
- Borchardt, R. T., Salvatore, F., Borek, E., Zappia, V., Williams-Ashman, H. G., Schlenk, F. . The Biochemistry of S-Adenosylmethionine. , 151-171 (1977).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S-adenosyl-l-methionine. Biochemistry. 25, 4444-4449 (1986).
- Keller, A., Nesvizhskii, A. I., Kolker, E., Aebersold, R. Empirical statistical model to estimate the accuracy of peptide identifications made by MS/MS and database search. Anal. Chem. 74, 5383-5392 (2002).
- Nesvizhskii, A. I., Keller, A., Kolker, E., Aebersold, R. A statistical model for identifying proteins by tandem mass spectrometry. Anal. Chem. 75, 4646-4658 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır