Method Article
Fare Tükürük Bezi Kök Hücre İzolasyonu
Özet
Farenin tükürük bezi kök hücrelerin izolasyonu için optimize edilmiş bir protokol açıklanmıştır. Yöntemi, enzimatik ve mekanik sindirim istihdam ve hücrelerin kök hücre özelliklerini içeren salispheres izolasyonu izin verir.
Özet
Olgun insan ve fare kökenli tükürük bezleri, ağız boşluğuna tükürük üretimi ve atılımını kolaylaştırır, her biri beş hücre tipleri, en az oluşmaktadır. Seröz ve mukoza asiner hücrelerinin sırasıyla protein ve mukoz bezi üreten fabrikalar ve tükürük üretimi kökeni temsil eder. Sentezlenmiş, tükürük çeşitli enzimatik ve diğer protein bileşenleri, tükürüğün ağız boşluğuna önemli bir kanal vasıtasıyla nihai uzaklaştırma kadar duktal hücrelerin epitel-tipi morfolojisi taşıyan bir dizi aracılığıyla salgılanan. Tükürüğün bileşimi de bu işlem sırasında duktal hücreler tarafından değiştirilir.
Sjögren sendromu gibi hastalıkların belirtisi ve bezleri tarafından baş ve boyun kanserleri, tükürük üretimi için radyoterapi gibi bazı klinik durumlarda, dramatik bir şekilde 1,2 azalır . Ağız kuruluğu, ağız kuruluğu öznel bir duygu, yutmak ve konuşma yeteneği hastanın sadece etkiler, ama aynı zamanda diş çürüğü gelişmesine teşvik eder ve dertli sosyal zayıflatıcı olabilir.
Bu nedenle tükürük üretimi yukarıda bahsedilen klinik koşullarda restorasyon karşılanmamış bir klinik ihtiyaç temsil eder ve tükürük bezleri 3-5 rejeneratif kapasitesi gibi çeşitli çalışmalar göstermiştir . Izolasyon, fare ve insan bedenleri 6-8 içinde çeşitli dokulardan hücrelerinin, kök hücre benzeri popülasyonlarının Ayrıca, fare tükürük bezleri izole edilen kök hücreleri, ışınlanmış tükürük tükürük üretimini kurtarmak için kullanılabilir olması açıklanan yöntemi kullanarak göstermiştir bezleri 9,10. Bu keşif, kendini yenileyen multipotent yetenekleri ile hücreler içeren bir mikro olarak tükürük bezi keşfi için de insanlarda xerostomic koşulların tedavisi için kök hücre tabanlı tedavilerin geliştirilmesi için önünü açıyor.
Protokol
1. Regent Hazırlık
- Tampon:% 1 (w / v) Hank dengeli tuz solüsyonu sığır serum albumin
- Sulandırın enzimler. Hyaluronidase enzim: 40 mg / mL tampon içinde çözünmüş. Kollajenaz II: 23mg / mL tampon içinde çözünmüş. Her izolasyonu için taze taze hazırlanan enzim çözümleri kullanın. çözünmüş, mağaza, 4 ° C sindirimi için kullanmak kadar.
- Distile su ile 50 mM kalsiyum klorür. Filtre 0.2 um gözenek boyutu filtre ile sterilize.
- Fare tükürük bezi (MSG) kültür ortamı: DMEM: penisilin ile F12 (100 IU / ml), streptomisin (100 mg / ml), glutamax (2 mM), epidermal büyüme faktörü-2 (20 ng / ml), fibroblast büyüme faktörü -2 (20 ng / ml), N2 takviyesi (% 1), insülin (10 mg / ml) ve deksametazon (1 mcM).
2. Mekanik ve enzimatik Doku Sindirim
- Tükürük bezleri diseke tartılır.
- Bezleri, küçük bir petri steril kavisli diseksiyonu makas kullanarak homojen bir hamuru içine doğrayın.
- 80mg submandibular doku başına 1 ml tampon kullanarak, 14 mL tüplerde kıyılmış doku toplayın. Tampon kullanarak bazı doku temiz petri kaplarına durulayın.
- 25 mcL kollajenaz II enzim çözeltisi, 25 mcL hiyalüronidaz enzim çözeltisi, 80 mg doku başına 250 mcL kalsiyum klorür çözeltisi ile 80 mg doku başına tampon başka bir 1 ml ekleyin. 2.9 T25 kolaylık sağlamak için doku kültürü şişeleri yapılabilir büyük miktarda doku ile çalışıyorsanız, 2.4 adım.
- 20 dakika boyunca 37 ° C sallayarak su banyosunda inkübe edin. Tüpleri çıkarın ve tekrar doku ile iyice enzim karışımı pipet ile çiğnemek.
- 20 dakika su banyosunda değiştirin.
- 8 dakika boyunca, 400 xg'de santrifüj yoluyla doku toplayın. Süpernatant atın.
- Her biri 80 mg doku için 2 mL tampon içinde süspanse edin ve yukarıdaki gibi enzim ve kalsiyum klorür yanı sıra tekrarlayın. , Su banyosunda sallayarak 20 dakika inkübe edin. Tüpleri çıkarın ve iyice karıştırın enzimler pipet ile çiğnemek.
- Su banyosu sallayarak son 20 dakika inkübe edin. Yukarıdaki gibi santrifüj hücreleri toplayın supernatant atın.
3. Yıkama Adımlar
- 2 mL tampon ve enzimler serbest doku yıkamak için pipet her biri 80 mg doku tekrar
- Toplamak için önceden santrifüjleyin. Süpernatant atın.
- 80 mg doku başına 1 ml tampon kullanarak yıkayın tekrarlayın. Santrifüj toplamak supernatant atmak için.
4. Süzme
- 80 mg doku başına 1 ml tampon içinde süspanse edin doku çözüm.
- 50 ml Falcon tüp üzerine yerleştirilen 100 mikron gözenek boyutlu filtre çözüm ekleyin. Filtreler bloke olabilir, kıyılmış doku çözüm kolon başına en fazla 3 mL uygulanır. Yoluyla sızmasına izin verin. Pipet filtre alt asılı filtre malzemelerini çıkarın ve süzüntü eklemek.
- 50ml tüpler süzüntü 5 ml tüpler 50 mikron gözenek boyutu filtreleri almak ve uygulamak, 26 gauge iğne ile şırınga kullanın. Gerekirse kapaklarının gevşemesine yardımcı olmak, süzülmeye bırakın.
- Santrifüj tüpleri önceden toplamak için. Süpernatant atın.
5. Kaplama ve Ortam
- Bir hacim içine tüm pelet birleştirin. Otomatik Hücre sayıcı veya haemocytometer kullanarak güvenin.
- Plaka hücrelerinin yoğunluğu 0.4 x 10 6 12 plaka her hücre, ya da 2.67 x 10 6 hücre T25 doku kültürü şişesi başına. Her T25 şişeyi her iyi veya 6 ml 1 ml MSG orta ekleyin.
- 37 inkübe ° C Küreler 2 gün açıkça görünür olmalıdır.
6. Temsilcisi Sonuçlar:
2-3 gün sonra kültür hücreleri (salispheres) küçük agrega kültürlerin belirgin olacaktır. Salispheres kültür on gün bir süre içinde boyut olarak büyümeye devam edecektir. Salispheres Temsilcisi faz kontrast mikroskobu görüntüleri Şekil 1'de gösterilmiştir. Proliferatif hücreler kök hücre ile ilişkili protein işaretleyicileri ifade, bu alanlarda en iyi günde 3-5 yazılan izolasyon arasında izole edilmiş, ve fonksiyonel, tükürük üreten asiner hücreleri farklılaşma kapasitesine sahip olabilir.
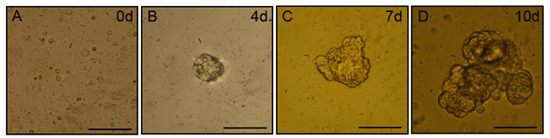
Şekil 1 in vitro Salisphere oluşum. Bugünkü protokolünü kullanarak mekanik ve enzimatik sindirim ardından, artan büyüklükte küreler yüzer kültürlerde bulunabilir. Paneller gün 0 (A), 4 küre temsilcisi faz kontrast mikroskobu görüntüleri (B), 7 (C) ve 10 (D). Ölçek çubuğu = 50 mm.
Tartışmalar
Burada anlatılan doku kültürü yöntemi kök hücre içeren farelerin tükürük bezleri salispheres izolasyonu için tekrarlanabilir bir protokol temsil. Bu şekilde izole hücreler kullanılarak yapılan çalışmalar, tükürük bezi kök hücreler 9 rejeneratif kapasitesi sermiştir . Salispheres türetilen c-Kit + hücreler yüz Nakli ışınlanmış fare tükürük bezlerinin fonksiyonel iyileşmeye neden olmuştur. Bu veriler, heyecan verici ve kserostomi için kök hücre tabanlı tedavi soruşturulması için bir başlangıç noktası sağlamak. Birçok caddeler, ancak kök hücrelerin tam işaretleyici protein ekspresyon profili, ışınlanmış tükürük bezleri parotis ve tersi işlevi kurtarmak için submandibular bezleri yeteneği ve in vivo kök hücre niş varsayılan karakterizasyonu da dahil olmak üzere keşfedilmeyi beklemektedir hücreler. Sonuçta, bu protokolün, insan doku örnekleri ve izole hücreler kullanarak insan hastalarda kserostomi tedavisi için sonraki potansiyel çeviri açıklanan yöntemin en heyecan verici bir uygulamadır.
Açıklamalar
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | Sigma-Aldrich | H3506 | Store at – 20 °C |
| Collagenase II | GIBCO, by Life Technologies | 17101-015 | Store at 4 °C |
| Epidermal Growth Factor-2 | Sigma-Aldrich | E9644 | Make a stock of 10 μg / mL in phosphate buffered saline (PBS). Store at – 20 °C in single use aliquots. |
| Fibroblast Growth Factor-2 | Sigma-Aldrich | F0291 | Make stock of 25 μg / mL in PBS. Store at – 20 °C in single use aliquots. |
| N2 supplement | GIBCO, by Life Technologies | 17502-048 | As manufacturer instructions. |
| Insulin | Sigma-Aldrich | I6634 | Make stock of 2 mg / mL in tap water. Adjust water to pH 2-3 using glacial acetic acid prior to dissolving. |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| 100 μM pore-size sterile cell strainers | BD Biosciences | 352360 | |
| Polystyrene round-bottomed tubes with cell strainer caps (50 μM pore size) | BD Biosciences | 352235 |
Referanslar
- Vissink, A. Oral Sequelae of Head and Neck Radiotherapy. Crit Rev Oral Biol Med. 14, 199-212 (2003).
- Napeñ, a. s., J, J., Brennan, M. T., Fox, P. C. Diagnosis and treatment of xerostomia (dry mouth). Odontology. 97, 76-83 (2009).
- Denny, P. C. Parenchymal cell proliferation and mechanisms for maintenance of granular duct and acinar cell populations in adult male mouse submandibular gland. 235, 475-485 (2005).
- Man, Y. G. Persistence of a perinatal cellular phenotype in submandibular glands of adult rat. J. Histochem. Cytochem. 43, 1203-1215 (1995).
- Cotroneo, E., Proctor, G. B., Carpenter, G. H. Regeneration of acinar cells following ligation of rat submandibular gland retraces the embryonic-perinatal pathway of cytodifferentiation. Differentiation. 79, 120-130 (2010).
- Eirew, P. A method for quantifying normal human mammary epithelial stem cells with in vivo regenerative ability. Nat Med. 14, 1384-1389 (2008).
- Gorjup, E. Glandular tissue from human pancreas and salivary gland yields similar stem cell populations. European Journal of Cell Biology. 88, 409-421 (2009).
- Alonso, L., Fuchs, E. Stem cells of the skin epithelium. Proc Natl Acad Sci U S A. 100, 11830-11835 (2003).
- Lombaert, I. M. Rescue of salivary gland function after stem cell transplantation in irradiated glands. Plos One. 3, e2063-e2063 (2008).
- Coppes, R. P., Goot, A. v. a. n. d. e. r., Lombaert, I. M. A. Stem Cell Therapy to Reduce Radiation-Induced Normal Tissue Damage. Seminars in Radiation Oncology. 19, 112-121 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır