Method Article
L'isolement des cellules souches de la souris salivaires Gland
Dans cet article
Résumé
Un protocole optimisé pour l'isolement des cellules souches de la glande salivaire de souris est décrite. La méthode emploie digestion enzymatique et mécanique, et permet d'isoler les cellules contenant salispheres avec des caractéristiques de cellules souches.
Résumé
Mature glandes salivaires d'origine à la fois humains et de souris comprendre un minimum de cinq types de cellules, chacune d'elles facilite la production et l'excrétion de salive dans la cavité buccale. Cellules acineuses séreuses et muqueuses sont les protéines et les muqueuses des usines produisant de la glande, respectivement, et de représenter l'origine de la production de salive. Une fois synthétisés, les différentes enzymatiques et d'autres composants protéiques de la salive sont sécrétées par une série de cellules canalaires portant épithéliales de type morphologique, jusqu'à l'expulsion éventuelle de la salive à travers un conduit d'importants dans la cavité de la bouche. La composition de la salive est également modifié par les cellules canalaires pendant ce processus.
Dans la manifestation de maladies telles que le syndrome de Sjögren, et dans certaines situations cliniques telles que la radiothérapie pour les cancers de la tête et du cou, la production de salive par les glandes est considérablement réduite 1,2. La xérostomie qui en résulte, une sensation subjective de bouche sèche, affecte non seulement la capacité du patient à avaler et à parler, mais encourage également le développement de la carie dentaire et peut être socialement invalidante pour celui qui souffre.
La restauration de la production de salive dans les conditions ci-dessus cliniques représente donc un besoin clinique non satisfait, et comme tel, plusieurs études ont démontré la capacité de régénération des glandes salivaires 3-5. Suite à l'isolement des cellules souches, comme les populations de cellules de différents tissus au sein de la souris et le corps humains 6-8, nous avons montré en utilisant la méthode décrite que les cellules souches isolées à partir de glandes salivaires de souris peut être utilisée pour sauver la production de salive dans salivaires irradiées glandes 9,10. Cette découverte ouvre la voie pour le développement de base de cellules souches thérapies pour le traitement de la xérostomie conditions chez les humains, et aussi pour l'exploration de la glande salivaire comme un microenvironnement des cellules contenant des multipotentes auto-renouvellement des capacités.
Protocole
1. Préparation Régent
- Tampon: 1% (p / v) de sérum albumine bovine dans une solution saline équilibrée de Hank
- Reconstituer les enzymes. L'enzyme hyaluronidase: 40mg / ml, dissous dans du tampon. Collagénase II: 23 mg / mL, dissous dans du tampon. Utiliser des solutions fraîchement préparées enzyme fraîche pour chaque isolement. Une fois dissous, conserver à 4 ° C jusqu'à leur utilisation pour la digestion.
- 50 mM de chlorure de calcium dans l'eau distillée. Stériliser par filtration à travers un filtre de 0,2 uM taille des pores.
- Souris moyennes salivaires des glandes de la culture (MSG): DMEM: F12 avec de la pénicilline (100 UI / ml), streptomycine (100 ug / ml), glutamax (2 mM), facteur de croissance épidermique-2 (20 ng / ml), facteur de croissance des fibroblastes l'insuline -2 (20 ng / ml), N2 complément (1%), (10 pg / ml) et la dexaméthasone (1 uM).
2. Digestion des tissus mécanique et enzymatique
- Peser les glandes salivaires disséquées.
- Hacher les glandes en une pâte homogène à l'aide des ciseaux de dissection stériles courbes dans une petite boîte de Petri.
- Recueillir tissus hachés dans 14 ml tubes, en utilisant 1 ml de tampon par les tissus sous-maxillaire 80mg. Rincez les boîtes de Pétri nettoyage de tissus en utilisant certains des tampons.
- Ajouter un autre 1 mL de tampon par 80 mg de tissu, suivis de 25 uL solution de collagénase enzyme II, 25 uL solution enzyme hyaluronidase et 250 uL solution de chlorure de calcium par 80 mg de tissu. Si vous travaillez avec de grandes quantités de tissu, les étapes 2.4 à 2.9 peuvent être effectuées dans des flacons T25 culture de tissu pour plus de commodité.
- Incuber dans un bain-marie secouant fixée à 37 ° C pendant 20 minutes. Retirer les tubes et les triturent à la pipette pour mélanger soigneusement l'enzyme à travers le tissu nouveau.
- Remplacer dans un autre bain-marie pendant 20 min.
- Recueillir les tissus par centrifugation à 400 xg, pendant 8 minutes. Rejeter le surnageant.
- Remettre en suspension dans 2 mL de tampon pour chaque tissu de 80 mg, et répétez l'enzyme et l'ajout de chlorure de calcium comme ci-dessus. Incuber 20 minutes en secouant bain-marie. Retirer les tubes et les triturent à la pipette pour mélanger soigneusement les enzymes.
- Incuber pour la finale de 20 min en secouant bain-marie. Recueillir les cellules par centrifugation comme ci-dessus, éliminer le surnageant.
3. Étapes de lavage
- Resuspendre chaque 80 mg de tissu en 2 mL de tampon et une pipette de laver le tissu sans enzymes.
- Centrifuger comme précédemment à collecter. Rejeter le surnageant.
- Répétez les laver en utilisant une mémoire tampon mL par 80 mg de tissu. Centrifugeuse à recueillir, éliminer le surnageant.
4. Filtrage
- Solution de tissus Remettre en suspension dans 1 ml de tampon par 80 mg de tissu.
- Ajouter la solution à 100 um taille des pores du filtre placé sur le tube Falcon de 50 ml. Ne pas appliquer plus de 3 ml de solution tissus hachés par colonne, comme des filtres peuvent être bloquées. Laisser s'infiltrer à travers. Enlever la matière filtrée accroché sur le dessous du filtre à la pipette, et ajouter à filtrat.
- Utilisez une seringue avec une aiguille de calibre 26 pour prendre filtrat de 50 ml tubes et d'appliquer des filtres à 50 um taille des pores sur les tubes de 5 ml. Laisser filtrer à travers, en aidant en desserrant les couvercles si nécessaire.
- Tubes à centrifuger comme précédemment à collecter. Rejeter le surnageant.
5. Placage et moyennes
- Combiner tous les pastilles dans un seul volume. Comptez utilisant compteur de cellules automatisé ou hémocytomètre.
- Cellules de la plaque à une densité de 0,4 x 10 6 cellules par puits de 12 puits plaque, ou 2,67 x 10 6 cellules par flacon de culture tissulaire T25. Ajouter une moyenne MSG ml à chaque puits ou 6 ml dans chaque flacon T25.
- Incuber à 37 ° C. Sphères doit être clairement visible par jour 2.
6. Les résultats représentatifs:
Après deux à trois jours de culture, de petits agrégats de cellules (salispheres) sera apparente dans les cultures. Salispheres va continuer à croître en taille, sur une période de dix jours dans la culture. Représentant des images de microscopie à contraste de phase d'salispheres sont présentés dans la figure 1. Les cellules en prolifération exprimant des protéines marqueurs de cellules souches associées peuvent être isolés à partir de ces sphères, de manière optimale entre l'isolement jours après 3-5, et sont capables de différenciation en cellules fonctionnelles salive, acineuses produisant.
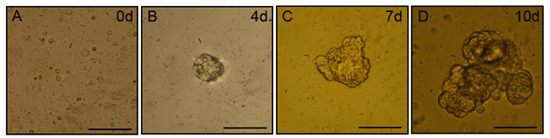
Figure 1. Salisphere la formation in vitro. Après la digestion mécanique et enzymatique en utilisant le protocole actuel, les sphères de la taille croissante peut être trouvé dans les cultures flottant. Les panneaux sont représentatives d'images de microscopie à contraste de phase de sphères de quelques jours 0 (A), 4 (B), 7 (C) et 10 (D). Barre d'échelle = 50 microns.
Discussion
La méthode de culture de tissus décrit ici représente un protocole reproductible pour l'isolement des cellules souches contenant salispheres des glandes salivaires de souris. Les études utilisant des cellules isolées de cette manière ont mis en évidence la capacité de régénération de la glande salivaire cellules souches 9. La transplantation d'une centaine de c-kit + cellules dérivées de la salispheres induite récupération fonctionnelle des glandes salivaires de souris irradiées. Ces données sont intéressantes et fournissent un point de départ pour l'enquête sur les cellules souches pour la thérapie basée xérostomie. Beaucoup de pistes restent à explorer cependant, y compris le profil d'expression marqueur protéique complète des cellules souches, la capacité des glandes sous-maxillaires pour sauver la fonction des glandes parotides irradiés salivaires et vice versa, et la caractérisation de la putatifs dans une niche de cellules souches in vivo des les cellules. Finalement, la traduction de ce protocole d'échantillons de tissus humains et le potentiel ultérieur pour le traitement de la xérostomie chez les patients humains en utilisant des cellules isolées est l'application la plus excitante de la méthode décrite.
Déclarations de divulgation
matériels
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | Sigma-Aldrich | H3506 | Store at – 20 °C |
| Collagenase II | GIBCO, by Life Technologies | 17101-015 | Store at 4 °C |
| Epidermal Growth Factor-2 | Sigma-Aldrich | E9644 | Make a stock of 10 μg / mL in phosphate buffered saline (PBS). Store at – 20 °C in single use aliquots. |
| Fibroblast Growth Factor-2 | Sigma-Aldrich | F0291 | Make stock of 25 μg / mL in PBS. Store at – 20 °C in single use aliquots. |
| N2 supplement | GIBCO, by Life Technologies | 17502-048 | As manufacturer instructions. |
| Insulin | Sigma-Aldrich | I6634 | Make stock of 2 mg / mL in tap water. Adjust water to pH 2-3 using glacial acetic acid prior to dissolving. |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| 100 μM pore-size sterile cell strainers | BD Biosciences | 352360 | |
| Polystyrene round-bottomed tubes with cell strainer caps (50 μM pore size) | BD Biosciences | 352235 |
Références
- Vissink, A. Oral Sequelae of Head and Neck Radiotherapy. Crit Rev Oral Biol Med. 14, 199-212 (2003).
- Napeñ, a. s., J, J., Brennan, M. T., Fox, P. C. Diagnosis and treatment of xerostomia (dry mouth). Odontology. 97, 76-83 (2009).
- Denny, P. C. Parenchymal cell proliferation and mechanisms for maintenance of granular duct and acinar cell populations in adult male mouse submandibular gland. 235, 475-485 (2005).
- Man, Y. G. Persistence of a perinatal cellular phenotype in submandibular glands of adult rat. J. Histochem. Cytochem. 43, 1203-1215 (1995).
- Cotroneo, E., Proctor, G. B., Carpenter, G. H. Regeneration of acinar cells following ligation of rat submandibular gland retraces the embryonic-perinatal pathway of cytodifferentiation. Differentiation. 79, 120-130 (2010).
- Eirew, P. A method for quantifying normal human mammary epithelial stem cells with in vivo regenerative ability. Nat Med. 14, 1384-1389 (2008).
- Gorjup, E. Glandular tissue from human pancreas and salivary gland yields similar stem cell populations. European Journal of Cell Biology. 88, 409-421 (2009).
- Alonso, L., Fuchs, E. Stem cells of the skin epithelium. Proc Natl Acad Sci U S A. 100, 11830-11835 (2003).
- Lombaert, I. M. Rescue of salivary gland function after stem cell transplantation in irradiated glands. Plos One. 3, e2063-e2063 (2008).
- Coppes, R. P., Goot, A. v. a. n. d. e. r., Lombaert, I. M. A. Stem Cell Therapy to Reduce Radiation-Induced Normal Tissue Damage. Seminars in Radiation Oncology. 19, 112-121 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon