Method Article
Выделение мышью слюнных желез стволовых клеток
В этой статье
Резюме
Оптимизированный протокол для выделения стволовых клеток из мыши слюнной железы описана. Метод использует ферментативной и механической пищеварение, и позволяет изоляции salispheres содержащие клетки с характеристиками стволовых клеток.
Аннотация
Зрелые слюнных желез как человеческие, так и мышь происхождения составляют менее пяти типов клеток, каждый из которых обеспечивает производство и выделение слюны в полости рта. Серозный и клеток слизистой ацинарных являются белков и слизистых заводы железы, соответственно, и представляют происхождение выработку слюны. Как только синтезируется, различные ферментативные и другие белковые компоненты слюны выделяются через ряд протоков эпителиальных клеток, несущих типа морфологии, до возможной высылке слюной через один крупный канал в полость рта. Состав слюны также влияет протоков клеток во время этого процесса.
В проявлением таких заболеваний, как синдром Шегрена, а в некоторых клинических ситуациях, таких как лучевая терапия для лечения рака головы и шеи, слюны производства желез резко сокращается 1,2. В результате сухость во рту, субъективное ощущение сухости во рту, влияет не только на способности пациента глотать и говорить, но и способствует развитию кариеса зубов и может быть социально изнурительных для больного.
Восстановление выработку слюны в вышеупомянутых клинических состояний, следовательно, представляет неудовлетворенных клинической необходимости, и в этом качестве несколько исследований показали, регенеративная способность слюнных желез 3-5. В дополнение к изоляции стволовых клеток, как популяций клеток из различных тканей в мыши и человеческих тел, 6-8, мы показали, описанным способом, что стволовые клетки, выделенные из мыши слюнных желез могут быть использованы, чтобы спасти производство слюны при облучении слюнных желез 9,10. Это открытие открывает путь к развитию на основе стволовых клеток терапий для лечения xerostomic условиях в организме человека, а также для исследования слюнных желез, как микросреда, содержащих клетки с мультипотентные самообновлению возможностей.
протокол
1. Регент подготовка
- Буфер: 1% (м / о) бычьего сывороточного альбумина в сбалансированном солевом растворе Хэнка
- Развести ферментов. Гиалуронидаза фермента: 40 мг / мл, растворяют в буфере. Коллагеназы II: 23mg / мл, растворяют в буфере. Используйте свежеприготовленные фермента решения свежей для каждого изоляции. При растворении, хранить при 4 ° С до использования для пищеварения.
- 50 мМ хлорида кальция в дистиллированной воде. Фильтры стерилизовать через 0,2 мкм поры фильтра размера.
- Мышь слюнной железы (MSG) культуральная среда: DMEM: F12 с пенициллином (100 МЕ / мл), стрептомицин (100 мкг / мл), glutamax (2 мМ), эпидермальный фактор роста-2 (20 нг / мл), фактор роста фибробластов -2 (20 нг / мл), N2 дополнение (1%), инсулин (10 мкг / мл) и дексаметазоном (1 мкМ).
2. Механические и ферментативной тканей Пищеварение
- Взвесьте расчлененный слюнных желез.
- Чоп желез в однородную целлюлозы с использованием стерильных изогнутые ножницы рассечение в маленькой чашке Петри.
- Сбор измельченной ткани в 14 мл трубы, с помощью 1 мл буфера в 80 мг подчелюстной ткани. Полоскание чашки Петри чистой ткани, используя некоторые из буфера.
- Добавьте еще 1 мл буфера на 80 мг ткани, а затем 25 мкл коллагеназа II раствора фермента, 25 мкл раствора фермента гиалуронидазы и 250 мкл раствора хлорида кальция на 80 мг ткани. При работе с большим количеством ткани, шаги 2,4 - 2,9 может быть выполнена в культуре ткани T25 Колбы для удобства.
- Инкубируйте в пожимая водяной бане установлена на уровне 37 ° С в течение 20 минут. Удалить труб и растирают пипеткой для смешивания ферментов тщательно через ткани снова.
- Заменить в водяной бане в течение еще 20 минут.
- Сбор ткани с помощью центрифугирования при 400 мкг, в течение 8 минут. Удалите супернатант.
- Ресуспендируют в 2 мл буфера для каждого 80 мг ткани, и повторить фермента и помимо хлорида кальция, что и выше. Инкубируйте 20 минут тряски в водяной бане. Удалить труб и растирают пипеткой для смешивания ферментов тщательно.
- Инкубировать последние 20 минут тряски в водяной бане. Сбор клетки центрифугированием, как выше, отбросить супернатант.
3. Стиральная шаги
- Ресуспендируют каждые 80 мг ткани в 2 мл буфера и пипетки для мытья ткани свободных ферментов.
- Центрифуга, как ранее, чтобы собраться. Удалите супернатант.
- Повторите мыть с использованием 1 мл буфера на 80 мг ткани. Центрифуга для сбора, отбросить супернатант.
4. Фильтрация
- Ресуспендируют ткани раствор в 1 мл буфера на 80 мг ткани.
- Добавить решение до 100 мкм пор по размерам фильтре, расположенном более чем в 50 мл трубки Falcon. Не применять более 3 мл рубленого решение ткани на колонке, а фильтры могут быть заблокированы. Разрешить просачиваться. Удалить фильтруется материал висит на нижней фильтра пипеткой, и добавить к фильтрату.
- Используйте шприц с иглой 26 взять 50 мл фильтрата из труб и применяются до 50 мкм поры фильтров размером по 5 мл пробирок. Позвольте фильтр, помощь, ослабив крышками, если необходимо.
- Пробирки центрифужные, как ранее, чтобы собраться. Удалите супернатант.
5. Покрытие и среднего
- Смешайте все гранулы в одном томе. Граф с помощью автоматизированных счетчик ячейки или гемоцитометра.
- Пластина клетки при плотности 0,4 х 10 6 клеток на лунку 12-луночного планшета, или 2,67 х 10 6 клеток на T25 колбу культуры ткани. Добавьте 1 мл MSG среду в каждую лунку или 6 мл на каждый T25 колбу.
- Инкубировать при 37 ° C. Сферы, должны быть четко видимые днем 2.
6. Представитель Результаты:
Через два-три дня в области культуры, малые агрегаты клеток (salispheres) будет очевидным в культурах. Salispheres будет продолжать увеличиваться в размерах в течение десяти дней в культуре. Представитель микроскопии фазового контраста изображения salispheres показаны на рисунке 1. Пролиферирующих клеток, экспрессирующих стволовых клеток, белков, связанных с маркером может быть изолирована от этих сфер, оптимально 3-5 дней между сообщению изоляции, и способны к дифференцировке в функциональные, слюна ацинарных клеток.
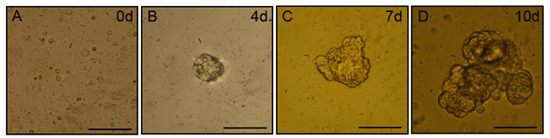
Рисунок 1. Salisphere образование в пробирке. После механического и ферментативного пищеварения использовании настоящего протокола, сферы увеличением размера можно найти в плавучий культурами. Панели представитель фазового контраста изображения микроскопии сфер от нескольких дней 0 (), 4 (B), 7 (C) и 10 (D). Шкала бар = 50 мкм.
Обсуждение
Метод культуры тканей, описанные здесь представляет воспроизводимый протокол для выделения стволовых клеток, содержащих salispheres из слюнных желез мышей. Исследования с использованием клеток, выделенных таким образом выявили регенеративная способность слюнной железы стволовыми клетками 9. Трансплантация сто с-Kit + клетки, полученные из индуцированных salispheres функционального восстановления облученных мышей слюнных желез. Эти данные являются захватывающими и обеспечить отправную точку для исследования стволовых клеток для терапии, основанной на сухость во рту. Многие пути еще предстоит исследовать однако, в том числе полного маркера экспрессии белка профиля стволовых клеток, способность подчелюстной желез, чтобы спасти функции облученных околоушной слюнной железы, и наоборот, и характеристика предполагаемых в естественных условиях стволовые клетки ниши клеток. В конечном счете, перевод этот протокол для образцов человеческой ткани и последующем потенциал для лечения ксеростомии в человеческом пациентов с использованием изолированных клеток является самым захватывающим применения описанного метода.
Раскрытие информации
Материалы
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | Sigma-Aldrich | H3506 | Store at – 20 °C |
| Collagenase II | GIBCO, by Life Technologies | 17101-015 | Store at 4 °C |
| Epidermal Growth Factor-2 | Sigma-Aldrich | E9644 | Make a stock of 10 μg / mL in phosphate buffered saline (PBS). Store at – 20 °C in single use aliquots. |
| Fibroblast Growth Factor-2 | Sigma-Aldrich | F0291 | Make stock of 25 μg / mL in PBS. Store at – 20 °C in single use aliquots. |
| N2 supplement | GIBCO, by Life Technologies | 17502-048 | As manufacturer instructions. |
| Insulin | Sigma-Aldrich | I6634 | Make stock of 2 mg / mL in tap water. Adjust water to pH 2-3 using glacial acetic acid prior to dissolving. |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| 100 μM pore-size sterile cell strainers | BD Biosciences | 352360 | |
| Polystyrene round-bottomed tubes with cell strainer caps (50 μM pore size) | BD Biosciences | 352235 |
Ссылки
- Vissink, A. Oral Sequelae of Head and Neck Radiotherapy. Crit Rev Oral Biol Med. 14, 199-212 (2003).
- Napeñ, a. s., J, J., Brennan, M. T., Fox, P. C. Diagnosis and treatment of xerostomia (dry mouth). Odontology. 97, 76-83 (2009).
- Denny, P. C. Parenchymal cell proliferation and mechanisms for maintenance of granular duct and acinar cell populations in adult male mouse submandibular gland. 235, 475-485 (2005).
- Man, Y. G. Persistence of a perinatal cellular phenotype in submandibular glands of adult rat. J. Histochem. Cytochem. 43, 1203-1215 (1995).
- Cotroneo, E., Proctor, G. B., Carpenter, G. H. Regeneration of acinar cells following ligation of rat submandibular gland retraces the embryonic-perinatal pathway of cytodifferentiation. Differentiation. 79, 120-130 (2010).
- Eirew, P. A method for quantifying normal human mammary epithelial stem cells with in vivo regenerative ability. Nat Med. 14, 1384-1389 (2008).
- Gorjup, E. Glandular tissue from human pancreas and salivary gland yields similar stem cell populations. European Journal of Cell Biology. 88, 409-421 (2009).
- Alonso, L., Fuchs, E. Stem cells of the skin epithelium. Proc Natl Acad Sci U S A. 100, 11830-11835 (2003).
- Lombaert, I. M. Rescue of salivary gland function after stem cell transplantation in irradiated glands. Plos One. 3, e2063-e2063 (2008).
- Coppes, R. P., Goot, A. v. a. n. d. e. r., Lombaert, I. M. A. Stem Cell Therapy to Reduce Radiation-Induced Normal Tissue Damage. Seminars in Radiation Oncology. 19, 112-121 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены