Method Article
鼠标涎腺干细胞的分离
摘要
分离干细胞从小鼠唾液腺的优化协议描述。该方法采用酶法和机械消化,并允许包含干细胞的特征细胞salispheres的隔离。
摘要
成熟的人类和小鼠出身的唾液腺包括至少5个细胞类型,其中每一个有利于口腔唾液的生产和排泄。浆液性和粘液性腺泡细胞蛋白和腺体的粘液生产工厂,分别代表唾液分泌的起源。一旦合成,通过一系列的乳腺导管上皮型形态细胞分泌的各种酶和其他唾液中的蛋白质成分,直到最终被驱逐的唾液通过进入腔口的主要管。唾液的组成是由导管上皮细胞在此过程中也修改了。
在疾病,如干燥综合征的表现,并在一些临床情况,如放射治疗头部和颈部癌症,唾液分泌的腺体是大大降低了 1,2。由此产生的口干,口干的主观感觉,不仅影响病人的吞咽和说话的能力,但还鼓励龋齿的发展,并能得到社会的衰弱的患者。
唾液生产的恢复,在上述的临床条件,因此未满足临床需要, 如一些研究表明3-5唾液腺的再生能力。继鼠标和人体6-8内的各种组织细胞的干细胞样的人群隔离,我们已经证明使用的描述方法,从老鼠的唾液腺中分离出干细胞,可用于抢救照射唾液唾液生产腺体9,10。这一发现的干细胞疗法治疗人类xerostomic条件的发展铺平了道路的方式,也唾液腺含有与多能自我更新能力的细胞微环境的探索。
研究方案
1。摄政的制备
- 缓冲液:1%(W / V)牛血清白蛋白在汉克的平衡盐溶液
- 重组酶。透明质酸酶:40毫克/毫升,在缓冲液溶解。胶原酶II:23mg /毫升,在缓冲液溶解。使用每个隔离新鲜新鲜准备的酶的解决方案。当溶解,储存于4℃直至使用的消化。
- 50毫米氯化钙蒸馏水。通过0.2微米孔径过滤器过滤消毒。
- 小鼠唾液腺(MSG)的培养基:DMEM:F12(100国际单位/毫升)与青霉素,链霉素(100微克/毫升),glutamax(2毫米),表皮生长因子- 2(20毫微克/毫升),成纤维细胞生长因子-2(20毫微克/毫升),N2补充(1%),胰岛素(10微克/毫升)和地塞米松(1μM)。
2。机械及酶组织消化
- 称量唾液腺解剖。
- 切成一个均匀的纸浆使用无菌弯夹层剪刀在小培养皿中的腺体。
- 收集在14毫升管的肉末组织,使用每80毫克颌下腺组织的缓冲液1ml。冲洗干净的培养皿中使用的缓冲区的一些组织。
- 添加1毫升,每80毫克组织的缓冲区的另一个25μL,胶原酶II酶液,25μL透明质酸酶液和250μL钙氯化物溶液每80毫克组织。如果大量的组织工作,步骤可以在2.4 - 2.9的T25为方便起见,组织培养瓶中进行。
- 在37 ° C时为20分钟摇晃水浴中孵育。删除管和吸管磨碎通过组织混合酶彻底再次。
- 再过20分钟替换水浴。
- 离心收集,组织400 XG,8分钟。弃上清。
- 重悬于2 mL缓冲液中,每80毫克组织,并重复上述酶和氯化钙此外。在摇晃水浴孵育20分钟。删除管和吸管磨碎混合酶彻底。
- 最后20分钟摇动水浴孵育。离心收集细胞,如上,弃上清。
3。洗涤步骤
- 重悬于2 mL缓冲液和吸液管组织的酶洗中的每一个组织的80毫克。
- 以前离心分离收集。弃上清。
- 重复清洗使用1 mL缓冲液,每80毫克组织。离心收集,弃上清。
4。过滤
- 悬浮在1 mL缓冲液每80毫克组织组织的解决方案。
- 添加的解决方案,以100微米孔径的过滤器放置超过50毫升猎鹰管。不要申请超过3 MLS剁碎组织解决方案,每列,如过滤器可能会成为阻止。允许渗入。取下挂吸管过滤器底部的过滤材料,并添加到滤液。
- 使用26号针头的注射器,取滤液50毫升管,适用于50微米孔径过滤器5 mL管。允许通过过滤器,松开盖子,如果有必要协助。
- 离心管,以前收集。弃上清。
5。电镀和中
- 组合成一个卷的所有颗粒。计数使用自动细胞计数或血球。
- 细胞密度板0.4 × 10 6细胞,每孔12孔板,或2.67 × 10 6%的T25组织培养瓶中细胞。添加1毫升,味精中每口井或6毫升每个T25烧瓶。
- 在37 ° C。球应清晰可见第2天。
6。代表性的成果:
经过2至3天的文化,小聚集的细胞(salispheres)将会明显的文化。 Salispheres将继续在规模增长超过10天的文化期间。代表的salispheres相衬显微镜图像如图1所示。增殖细胞表达干细胞相关的标志蛋白,可从这些领域中分离出,优化之间的天3-5后隔离,并进入功能,唾液生产腺泡细胞的分化能力。
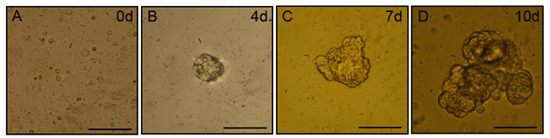
图1。Salisphere 在体外形成。使用本议定书的机械和酶消化后,规模日益扩大的领域中可以找到浮动文化。面板代表的领域相衬显微镜图像从天0(一),4(B)7(C)和10(四)。比例尺= 50微米。
讨论
这里描述的组织培养方法代表一个隔离的干细胞从老鼠的唾液腺含有salispheres重现协议。使用这种方式分离出的细胞的研究都强调了 9涎腺干细胞的再生能力。一个100 c - Kit的+从salispheres源性细胞移植诱导照射小鼠唾液腺的功能恢复。这些数据是令人振奋的,并提供了一个干细胞为基础的治疗口干症调查的起点。许多途径仍有待探讨,包括完整的干细胞标记蛋白表达谱,颌下腺救援照射腮腺唾液腺,反之亦然功能的能力, 并在体内的干细胞小生境的假定表征细胞。最终,人体组织样本,并随后口干在治疗人类患者使用分离的细胞的潜力,这一协议的翻译是最令人兴奋的应用程序所描述的方法。
披露声明
材料
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | Sigma-Aldrich | H3506 | Store at – 20 °C |
| Collagenase II | GIBCO, by Life Technologies | 17101-015 | Store at 4 °C |
| Epidermal Growth Factor-2 | Sigma-Aldrich | E9644 | Make a stock of 10 μg / mL in phosphate buffered saline (PBS). Store at – 20 °C in single use aliquots. |
| Fibroblast Growth Factor-2 | Sigma-Aldrich | F0291 | Make stock of 25 μg / mL in PBS. Store at – 20 °C in single use aliquots. |
| N2 supplement | GIBCO, by Life Technologies | 17502-048 | As manufacturer instructions. |
| Insulin | Sigma-Aldrich | I6634 | Make stock of 2 mg / mL in tap water. Adjust water to pH 2-3 using glacial acetic acid prior to dissolving. |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| 100 μM pore-size sterile cell strainers | BD Biosciences | 352360 | |
| Polystyrene round-bottomed tubes with cell strainer caps (50 μM pore size) | BD Biosciences | 352235 |
参考文献
- Vissink, A. Oral Sequelae of Head and Neck Radiotherapy. Crit Rev Oral Biol Med. 14, 199-212 (2003).
- Napeñ, a. s., J, J., Brennan, M. T., Fox, P. C. Diagnosis and treatment of xerostomia (dry mouth). Odontology. 97, 76-83 (2009).
- Denny, P. C. Parenchymal cell proliferation and mechanisms for maintenance of granular duct and acinar cell populations in adult male mouse submandibular gland. 235, 475-485 (2005).
- Man, Y. G. Persistence of a perinatal cellular phenotype in submandibular glands of adult rat. J. Histochem. Cytochem. 43, 1203-1215 (1995).
- Cotroneo, E., Proctor, G. B., Carpenter, G. H. Regeneration of acinar cells following ligation of rat submandibular gland retraces the embryonic-perinatal pathway of cytodifferentiation. Differentiation. 79, 120-130 (2010).
- Eirew, P. A method for quantifying normal human mammary epithelial stem cells with in vivo regenerative ability. Nat Med. 14, 1384-1389 (2008).
- Gorjup, E. Glandular tissue from human pancreas and salivary gland yields similar stem cell populations. European Journal of Cell Biology. 88, 409-421 (2009).
- Alonso, L., Fuchs, E. Stem cells of the skin epithelium. Proc Natl Acad Sci U S A. 100, 11830-11835 (2003).
- Lombaert, I. M. Rescue of salivary gland function after stem cell transplantation in irradiated glands. Plos One. 3, e2063-e2063 (2008).
- Coppes, R. P., Goot, A. v. a. n. d. e. r., Lombaert, I. M. A. Stem Cell Therapy to Reduce Radiation-Induced Normal Tissue Damage. Seminars in Radiation Oncology. 19, 112-121 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。