Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Germ-free Mouse Aşamalı Kolonizasyon sırasında Karaciğer metabolik değişiklikler Değerlendirilmesi 1 H-NMR Spektroskopi
Bu Makalede
Özet
İlerici bir kolonizasyon prosedürü daha ev sahipliği karaciğer metabolizması üzerine olan etkisini değerlendirmek için tarif edilir. Yüksek Çözünürlüklü Magic Angle İplik (İK MAS) bozulmamış biyopsi NMR profil hepatik metabolizma tarafından değerlendirilir Kolonizasyon NMR tabanlı metabolik profil mikrobiyal co-metabolitleri idrar atılımı değerlendirerek invazif olmayan izlenir.
Özet
Bağırsak bakterileri bağışıklık koruma ve vitamin sentezi olarak bir dizi faydalar sağlayarak, ev sahibi homeostazı önemli ölçüde katkıda bulunduğunu çok iyi bilinmektedir. Ayrıca bu ekosistemin önemli bir metabolik organı ile ev sahipliği yaparak, hatırı sayılır bir miktarda besin kaynağı. Bağırsak florası ve metabolik sendrom arasındaki bağlantı, konak ve gut Mikrobiyota arasındaki metabolik etkileşimi anlamaya artan kanıtlar çerçevesinde modern biyolojinin önemli bir sorun haline geliyor. 1-4
Kolonizasyon (normalleşme süreci olarak anılacaktır), eski bir germ-free hayvan mikro-organizmaların kurulması atar. Doğumda meydana gelen doğal bir süreç olmakla birlikte, aynı zamanda bağırsak çiçek ekosistem kontrolü ve daha fazla ana metabolizması üzerindeki etkisini belirlemek için, yetişkin germ-free hayvanlarda kullanılmaktadır. Sömürgeleştirme sürecini kontrol etmek için yaygın bir yöntemdir, bir singl sonda yöntemi kullanmak içine veya mikro-organizmaların bir karışımı. Bu yöntem, çok hızlı bir kolonizasyon sonuçları ve 5 derece stresli olma dezavantajı sunar . Bu nedenle, stresi en aza indirmek için ve bakteriyel kurulması yavaş yavaş ev sahibi metabolizması üzerine etkisini gözlemlemek için daha yavaş bir kolonizasyon süreci elde etmek için yararlıdır.
Bu yazıda, bir tahribatsız metabolik profil tekniği kullanılarak kademeli bir kolonizasyon süreci sırasında hepatik metabolizma değişiklik değerlendirmek için bir prosedür açıklanmaktadır. Biz, 1 H-NMR tabanlı metabolik profil mikrobiyal co-metabolitleri idrar atılımı tarafından yansıtılan bağırsak mikrobiyal metabolik aktivite değerlendirerek bağırsak mikrobiyal kolonizasyon izlemek için öneriyoruz . Bu bağırsak mikrobiyal aktivite, genellikle DGGE (denatüre edici gradient jel elektroforezi) fekal bakteri izlenmesi ile değerlendirildi bağırsak mikrobiyal ekosistem kararlı kurulması ötesinde istikrar takdir sağlar. 6kolonizasyonu konvansiyonel açık bir ortamda gerçekleşir ve kontrol grubu olarak hizmet verecek geleneksel hayvanlar, kirli kirli bir çöp tarafından başlatılan. Kemirgenler coprophagous hayvanlar olmak, bu, daha önce açıklandığı gibi, homojen bir kolonizasyon sağlar. 7
Karaciğer metabolik profil, 1 H NMR spektroskopisi İplik Yüksek Çözünürlüklü Magic Angle kullanarak sağlam bir karaciğer biyopsisi doğrudan ölçülür . Bu yarı-kantitatif bir tekniktir hücre yapısına zarar vermeden, hızlı bir şekilde değerlendirmek için, trigliserit, glikoz ve glikojen gibi önemli metabolitleri daha da ilerletmek için kolonizasyon süreci ve karaciğer metabolizmasını 7-10 arasındaki karmaşık bir etkileşim tahmin ediyoruz . Bu yöntem, herhangi bir doku biyopsisi 11,12 için de uygulanabilir .
Protokol
1. Germ-free hayvan ve örnek toplama kolonizasyonu
- Mikrop ücretsiz hayvanlar kafeslerde denetimleri (Şekil 1) olarak görev yapacak konvansiyonel hayvanların ön filtresi ile donatılmış bir geleneksel hayvancılık oda izolatörler ve ev onları çıkarın.
- Germ-free hayvanların çöp kontrolü geleneksel kafes alınan çöp Mix yarısı (eski 3 gün). Her zaman kirli geleneksel çöp 1 / 3, bir bakteri düzeyi (en az 3 gün için saklayın) korumak için, yenilemek için gerekli olan her zaman tutmak.
- Tüp üzerinde fare işleme 1,5 mL mikrotüp idrar toplamak ve barsak nazikçe masaj işeme yardımcı. Snap-dondurma, sıvı azot hemen. NMR analizi kadar, en az -40 ° C'de saklayın. En az 20 mcL hacmi 5 mm NMR probu ile satın alma için gerekli, ancak metabolik profil kalitesini artırmak için 30 mcL kullanılması tavsiye edilir.
- Hayvanlar b olmalıdıre anestezi bileşikler (örneğin, exsanguination ölüm onayı takiben servikal dislokasyon kullanın) karaciğer metabolizması nedeniyle karıştırıcı NMR rezonanslar önlemek için herhangi bir anestezi kullanımı olmadan ötenazi
2. Karaciğer biyopsisi toplanması için öneriler
- Kontaminasyonu önlemek için alkol içeren herhangi bir ürün kullanmayın. Araçları sadece su veya tuzlu solüsyon kullanarak yıkayın.
- Safra kesesi perfore etmeyin. Safra kaçağı durumunda, su ya da tuzlu su çözeltisi ile hemen doku yıkayın.
- Şekil 2'de gösterildiği gibi sol lob karaciğer biyopsisi (15-50 mg) toplayın. Tekrarlanabilir biyopsiler için, sol lob dokusu incedir periferik alanlarda kaçınarak merkezinde sürekli toplamak.
- Hemen sıvı nitrojen içinde dondurarak biyopsileri çekin ve saklayın -80 ° C NMR analizi kadar.
Idrar microvolume 3 1 H-NMR edinimi
- D2O (99.8%), pH 7.4, 1 mM 3 içeren 0,2 M sodyum fosfat tampon çözeltisi hazırlayın - (trimethylsilyl) propiyonik asit-d 4 (TSP) .
- 30 mcL idrar sodyum fosfat tamponunda 30 mcL ile karıştırın.
- Metal bir iğne (OD 0,5 mm) ile donatılmış 50 mcL cam şırınga kullanılarak 1.7 mm NMR kapiller tüp (Şekil 3 (2)) 50 mcL karma çözüm aktarın. Kabarcıkları önlemek için dikkatli olun.
- Kılcal içeren idrar örneği üst Fit kapiller adaptörü (Şekil 3 (3)) ve 2.5 mm NMR mikrotüp, 5 mm NMR prob (Şekil 3 (1)) içine yerleştirin. Spektral elde etmek için düzenli olarak 5 mm NMR tüpü gibi tüplerin bu kombinasyon kullanın.
- 2,5 mm NMR tüpü yavaşça çekin kapiller adaptörü vidalanarak kılcal kaldırmak için ekstraksiyon çubuk (Şekil 3 (4)) kullanın.
4. 1 H İK karaciğer dokusunda MAS NMR biyopsisi: numune hazırlama
- Rotor bileşenlerini ve araçları olan MASŞekil 4'te açıklanmıştır.
- Ekle zirkonyum rotor içine biyopsi (15-50 mg) (Şekil 4 (1)) ve NMR kilidi için saf D 2 O hacmi geri kalanını doldurun. Bu, veri toplama sonraki layneri ve kalite kalitesini değiştirmez, çünkü herhangi bir baloncuklar yapmak için dikkatli olun.
- Silindirik vida (Şekil 4 (5)) kullanılarak 50 mcL Teflon ayırıcı (Şekil 4 (2)) takın. Sökün onu ve kısa kenarı (Şekil 4 (8)), derinlik ölçer kullanarak kalibre. Bu aşamada, bunun bir parçası ara delikten sızıntı olabilir çünkü örnek için özel bir dikkat etmek önemlidir. Bu durumda biyopsi parçası, daha sonra imha edilir ve numune ağırlığı güvenilir artık. Bu yüzden başından numune hazırlama tekrar başlatmak için gerekli.
- Tarih katılın pin (Şekil 4 (3)) (Şekil 4 (6)) tornavida ile hafifçe yerleştirin ve vida. Bir doku parçası ile herhangi bir kalıntı su kurulayın.
- Kap yerleştirin (Şekil 4 (4))rotor ve rotor packer (Şekil 4 (6)) takın. Kapağı yerine gelene kadar sıkıca bastırın. Rotor ve onun kapağı arasında kalan herhangi bir boşluk olmamalıdır.
- Optik dönüş hızı algılama izin siyah bir işaretleme kalemi kullanarak rotor alt yarısı işaretleyin.
- NMR spektrometresi içindeki rotor koyun ve 5 kHz dönmeye başlar. 1 H-NMR spektrumunda üreticinin kurallarına göre CPMG darbe dizisi 13 kazanırlar.
- 5.22 ppm (giyilen erkek yeleği) α anomerik glikoz rezonans NMR spektrumları kalibre etmek için kullanın.
- Rotor açmak için kapağını sökücü (Şekil 4 (9)) kullanarak kapağı kaldırarak geçin. Tarih katılın pin ve silindirik vida kullanarak kaldır Teflon spacer sökün. Iyice su ve deterjan kullanarak yıkayın.
5. Temsilcisi Sonuçlar
Gut mikrobiyal aktivite idrar metabolik profil kullanılarak izlenebilir. Idrar mikrobiyal çok sayıda1 H NMR ile tanımlanabilir co-metabolitleri 7,14-17 literatürde tarif edilmiştir. Bu co-mikrobiyal metabolitler onlar yeni kurulan ekosistem kararlı tahmin etmek için non-invaziv ve hızlı bir şekilde sağlamak olarak sömürgeleştirilmesi sürecini izlemek için özellikle yararlıdır. Şekil 5A, co-metabolitleri bağırsak mikrobiyal kolonizasyon süreci üzerinde açıkça göstermektedir. Bu rakam, bir hayvan için Adım 2 açıklanan prosedürü takip ederek elde edilen bir idrar metabolik profil Adım 1 açıklanan yordamı kullanarak 20 gün kolonize gösterir. Bu hayvan, herhangi bir indoxyl sülfat ifraz ve phenylacetylglycine (PAG) ve germ-free p-kresol sülfat (günde 0-mavi) çok az miktarda vermedi. Kolonizasyon ilerledikçe, bağırsak Mikrobiyota tarafından protein metabolizması bu 3 belirteçler gün 20 (kırmızı) bir dengeye ulaşması için önemli oranda artması beklenmektedir. Bu PAG kullanarak Şekil 5B gösterildiği gibi hayvanların bir grup izlemek için özellikle kolayrezonans. Bu diyagram 7 hayvanların bir grup için PAG belirli bir rezonans (üçlü) karşılık gelen gri Şekil 5A (δ 7,40-7,43) vurgulanan rezonanslar altında kalan alan entegre ederek elde edilmiştir.
1 H Yüksek Çözünürlüklü Magic Angle İplik (İK MAS) NMR spektroskopisi 18 biyopsi her türlü metabolik profiller hızlı ve tekrarlanabilir satın almalar sağlar yıkıcı olmayan bir tekniktir. Bu protokol, önce (mavi) ve (kırmızı) kolonizasyonu (Şekil 6) sonra, 2 farelerin karaciğer metabolik profil elde etmek için bu güçlü bir tekniği kullanılmıştır. Bu rakam, iyi bir MAS NMR tabanlı metabolik profil elde edilebilir bilgiler göstermektedir. Çok sayıda amino asitlerin yanı sıra, glukoz, glikojen, laktat, trigliserid, (D)-3-hidroksi ve nicotinurate gibi enerji metabolizmasını elde edilen metabolitleri görüntülenebilir. Bu profiller aynı zamanda oksidatif stres ile ilgili bilgileri içeren (yani askorbik acid, glutatyon), (yani inozin, üridin) nükleotid metabolizması ve Methylamine metabolizma (yani kolin, trimetilamin-N-oksit). Bu örnekte, mikrop ücretsiz fare neredeyse hiç glikojen ve çok düşük miktarlarda glikoz ve trigliserid gibi daha önce 7 yayımlandı görüntüler çok açıktır.
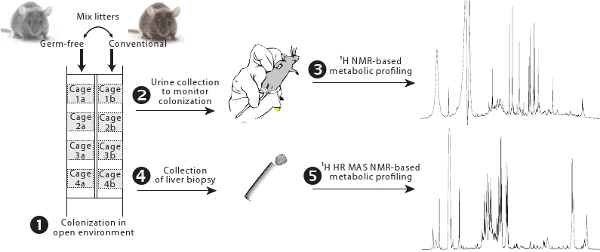
Şekil 1 kolonizasyon protokol Bakış. Germ-free ve konvansiyonel hayvanların yan ve kendi yavrularına geleneksel gut Mikrobiyota (1) aşamalı kolonizasyon izin alışverişinde yan filtreleri ile donatılmıştır kafeslerde ev sahipliği yapmaktadır. Gut mikrobiyal aktivite, 1 H-NMR tabanlı metabolik profil (2-3) kullanılarak izlenir . Karaciğer metabolizması 1 H İK MAS NMR tabanlı metabolik profil (4-5) ile değerlendirildi.
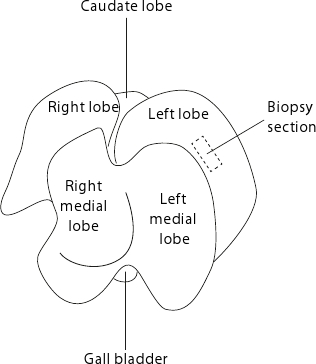
Şekil 2: Fare canlır anatomisi. Karaciğer gibi organ düz tarafı masaya yüzleri olarak görüntülenir. Tekrarlanabilir biyopsiler için, her zaman, kesik dikdörtgen ile gösterilir sol lob merkezinde örnekler toplamak için tavsiye edilir.

Şekil 3 microvolumes çalışmak için 1.7 mm NMR kılcal kiti tuşuna: 1: 2,5 mm NMR mikrotüp, 2: 1.7 mm NMR kılcal tüp, 3: Kılcal adaptörü, 4: Ekstraksiyon çubuk.

Şekil 4 MAS rotor ekipman Anahtar: 1: MAS rotor, 2: 50 mcL teflon ayırıcı, 3: pin, 4: kap, 5: silindirik vida, 6: tornavida, 7: rotor Packer, 8: derinlik göstergesi.
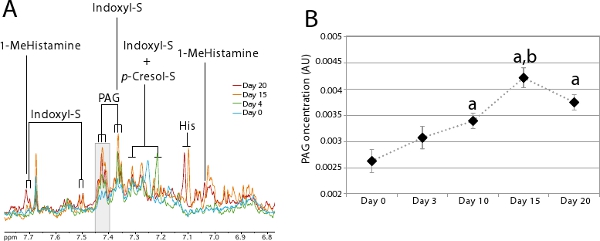
Şekil 5 colonizatio sırasında idrar metabolik profiller Evrimin.
- 0. günde tek bir kişi (mavi), 4 (yeşil), 15 (turuncu) ve 20 co-metabolitleri görüntülenmiştir 1 H NMR mikrobiyal 6,8-7,8 ppm arasında spektrumları aromatik bölge üzerinde Zoom elde edildi (kırmızı) post-kolonizasyon. Indoxyl sülfat eserleri şunlardır: Histidin, p-Kresol-S:;: 1-MeHistamine: Indoxyl-S 1-methylhistamine gri bölge B. Key şeması yapmak için entegre alana karşılık p-Kresol sülfat; PAG : Phenylacetylglycine.
- Ortalama kolonizasyon sırasında PAG konsantrasyonu (n = 7). Student t-testi, çeşitli zaman noktalarında PAG konsantrasyon farkı karşılaştırmak için kullanılır: a: p <0. günde karşılaştırıldığında 0.05; b: p <0.01 günde 10 ile karşılaştırıldığında.
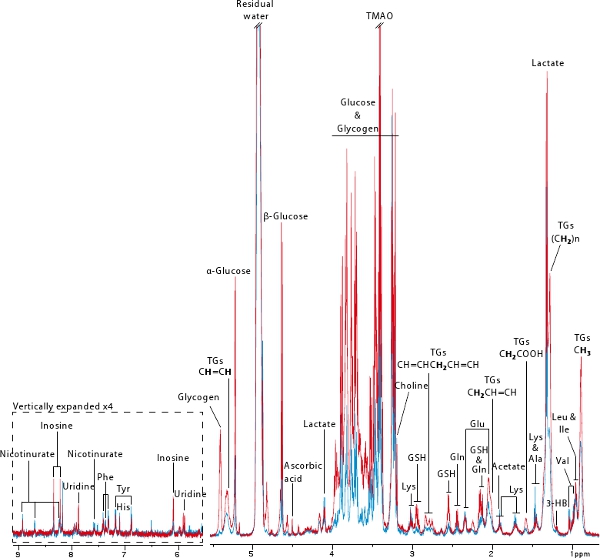
Şekil 6: Tipik germ-free (mavi) ve eski-germ-free (yeniden türetilmiş karaciğer biyopsisi 600 MHz, 1 H İK MAS NMR spektrumlarıd) fareler. Kalın proton trigliserid rezonans sorumlu Anahtarı: 3-HB: 3-hidroksi, GSH: indirgenmiş glutatyon, TG: Trigliserid, TMAO: trimetilamin-N-oksit.
Tartışmalar
Bu protokol, daha sağlam biyopsi 1 H İK MAS NMR profil ile değerlendirildi, gut Mikrobiyota, karaciğer metabolizması üzerine etkisini araştırmak için açık bir ortamda ilerici bir kolonizasyon usulü nitelendirdi . Kolonizasyonu literatürde çeşitli yöntemler tarif edilmiştir. Tanımlanmış bir Mikrobiyota hayvanlar kolonize için en yaygın yöntemlerden ağızdan sonda ile veya kontamine içme suyu 19,20. Fekal aşılama, daha önce 21 açıklandığı gibi de kullanıla...
Açıklamalar
Biz ifşa etmek başka bir şey var.
Teşekkürler
Açıklayıcı örnekler olarak kullanılan tüm NMR spektrumları, Nestlé tarafından mali olarak desteklenen bir daha önce yayımlanan bir çalışmada 7 türetilmiştir .
Malzemeler
Özel reaktifler ve ekipman Tablo:
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar |
|---|---|---|---|
| 2.5 mm mikrotüp | New Era | NE-H5/2.5-V-Br | |
| 1,7 mm kılcal tüp | Sigma-Aldrich | NORS175001 | |
| Kılcal adaptörü | New Era | NE-325-5/1.7 | |
| Ekstraksiyon çubuk | New Era | KD-341-5 | |
| HR-50 mcL MAS rotor BL4 küresel teflon ayırıcı kiti | Bruker | HZ07213 | |
| 50 mcL uçlar için araç kiti | Bruker | B2950 | |
| Peşin III 600MHz NMR | Bruker | ||
| 1 H İK MAS NMR katı prob | Bruker | ||
| Döteryum oksit% 99,9 | Sigma-Aldrich | 530.867-1L | |
| 3 - (trimethylsilyl) propiyonik asit-d 4 (TSP) | Sigma-Aldrich | 269913 |
Referanslar
- Cani, P. D., Delzenne, N. M. Gut microflora as a target for energy and metabolic. Curr. Opin. Clin. Nutr. Metab. Care. 10, 729-734 (2007).
- Ley, R. E., Turnbaugh, P. J., Klein, S., Gordon, J. I. Microbial ecology: human gut microbes associated with obesity. Nature. 444, 1022-1023 (2006).
- Raoult, D. Obesity pandemics and the modification of digestive bacterial flora. Eur. J. Clin. Microbiol. Infect. Dis. 27, 631-634 (2008).
- Turnbaugh, P. J., Backhed, F., Fulton, L., Gordon, J. I. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell. Host. Microbe. 3, 213-223 (2008).
- Balcombe, J. P., Barnard, N. D., Sandusky, C. Laboratory routines cause animal stress. Contemp. Top. Lab. Anim. Sci. 43, 42-51 (2004).
- Muyzer, G., Smalla, K. Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology. Antonie van Leeuwenhoek. 73, 127-141 (1998).
- Claus, S. P. Colonization-induced host-gut microbial metabolic interaction. MBio. 2, (2011).
- Waters, N. J. High-resolution magic angle spinning 1H NMR spectroscopy of intact liver and kidney: optimization of sample preparation procedures and biochemical stability of tissue during spectral acquisition. Anal. Biochem. 282, 16-23 (2000).
- Bollard, M. E. High-resolution 1H and 1H-13C magic angle spinning NMR spectroscopy of rat liver. Magnetic resonance in medicine. 44, 201-207 (2000).
- Lindon, J. C., Holmes, E., Nicholson, J. Pattern recognition methods and applications in biomedical magnetic resonance. Progress in Nuclear Magnetic Resonance Spectroscopy. 39, 1-40 (2001).
- Tate, A. R. Distinction between normal and renal cell carcinoma kidney cortical biopsy samples using pattern recognition of (1)H magic angle spinning (MAS) NMR spectra. NMR. Biomed. 13, 64-71 (2000).
- Wang, Y. Topographical variation in metabolic signatures of human gastrointestinal biopsies revealed by high-resolution magic-angle spinning 1H NMR spectroscopy. Journal of Proteome Research. 6, 3944-3951 (2007).
- Meiboom, S., Gill, D. Modified spin-echo method for measuring nuclear relaxation times. The review of scientific instruments. 29, 688-691 (1958).
- Nicholson, J. K., Holmes, E., Wilson, I. D. Gut microorganisms, mammalian metabolism and personalized health care. Nat. Rev. Microbiol. 3, 431-438 (2005).
- Martin, F. P. Effects of probiotic Lactobacillus paracasei treatment on the host gut tissue metabolic profiles probed via magic-angle-spinning NMR spectroscopy. Journal of Proteome Research. 6, 1471-1481 (2007).
- Swann, J. R. Variation in Antibiotic-Induced Microbial Recolonization Impacts on the Host Metabolic Phenotypes of Rats. J. Proteome. Res. , (2011).
- Jacobs, D. M., Gaudier, E., van Duynhoven, J., Vaughan, E. E. Non-digestible food ingredients, colonic microbiota and the impact on gut health and immunity: a role for metabolomics. Curr. Drug. Metab. 10, 41-54 (2009).
- Beckonert, O. High-resolution magic-angle-spinning NMR spectroscopy for metabolic profiling of intact tissues. Nat. Protoc. 5, 1019-1032 (2010).
- Hooper, L. V., Sansonetti, P., Zychlinsky, A. . Methods in microbiology. 31, 559-589 (2002).
- Rahija, R. J., Fox, J. G. Ch. 7. The mouse in biomedical research. , 217-234 (2007).
- Goodwin, B. L., Ruthven, C. R., Sandler, M. Gut flora and the origin of some urinary aromatic phenolic compounds. Biochemical Pharmacology. 47, 2294-2297 (1994).
- Koopman, J. P. 'Normalization' of germfree mice after direct and indirect contact with mice having a 'normal' intestinal microflora. Lab Anim. 20, 286-290 (1986).
- Nishikata, N., Shikata, N., Kimura, Y., Noguchi, Y. Dietary lipid-dependent regulation of de novo lipogenesis and lipid partitioning by ketogenic essential amino acids in mice. Nutrition and Diabetes. 1, 1-12 (2011).
- Spagou, K. A GC-MS metabolic profiling study of plasma samples from mice on low- and high-fat diets. J. Chromatogr. B. Analyt. Technol. Biomed. Life. Sci. 879, 1467-1475 (2011).
- Sanchez-Patan, F., Monagas, M., Moreno-Arribas, M. V., Bartolome, B. Determination of microbial phenolic acids in human faeces by UPLC-ESI-TQ MS. J. Agric. Food. Chem. 59, 2241-2247 (2011).
- Roux, A., Lison, D., Junot, C., Heilier, J. F. Applications of liquid chromatography coupled to mass spectrometry-based metabolomics in clinical chemistry and toxicology: A review. Clin. Biochem. 44, 119-135 (2011).
- Ryan, D., Robards, K., Prenzler, P. D., Kendall, M. Recent and potential developments in the analysis of urine: a review. Anal. Chim. Acta. 684, 8-20 (2011).
- Nagayama, K., Wuthrich, K., Bachmann, P., Ernst, R. R. Two-dimensional J-resolved 1H n.m.r. spectroscopy for studies of biological macromolecules. Biochem. Biophys. Res. Commun. 78, 99-105 (1977).
- Aue, W. P., Bartholdi, E., Ernst, R. R. Two-dimensional spectroscopy. Application to nuclear magnetic resonance. J. Chem. Phys. 64, 2229-2246 (1975).
- Bodenhausen, G., Ruben, D. J. Natural abundance 15N NMR by enhanced heteronuclear spectroscopy. Chemical. Physics. Letters. 69, 185-189 (1980).
- Fan, T. W. -. M. Metabolite profiling by one- and two-dimensional NMR analysis of complex mixtures. Progress in nuclear magnetic resonance spectroscopy. 28, 161-219 (1996).
- Fan, T., Lane, A. Structure-based profiling of metabolites and isotopomers by NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 52, 48-48 (2008).
- Fonville, J. M. The evolution of partial least squares models and related chemometric approaches in metabonomics and metabolic phenotyping. Journal of Chemometrics. 24, 636-649 (2010).
- Merrifield, C. A. A metabolic system-wide characterisation of the pig: a model for human physiology. Mol. Biosyst. , (2011).
- Tugnoli, V. Molecular characterization of human gastric mucosa by HR-MAS magnetic resonance spectroscopy. International Journal of Molecular Medicine. 14, 1065-1071 (2004).
- Sitter, B. Comparison of HR MAS MR spectroscopic profiles of breast cancer tissue with clinical parameters. NMR Biomed. 19, 30-40 (2006).
- Beckonert, O. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat. Protoc. 2, 2692-2703 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır