Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка изменения Печеночная Метаболический Во Прогрессивная Колонизация зародыш без мыши по 1 Н-ЯМР-спектроскопии
В этой статье
Резюме
Прогрессивная процедура колонизации описывается для дальнейшей оценки его влияния на метаболизм печеночных хоста. Колонизация контролируется, не invasively путем оценки экскреции микробных метаболитов совместного с помощью ЯМР основе метаболических профилей в то время как печеночный метаболизм оценивается Высокое разрешение магического угла Спиннинг (HR MAS) ЯМР профилирования интактных биопсии.
Аннотация
It is well known that gut bacteria contribute significantly to the host homeostasis, providing a range of benefits such as immune protection and vitamin synthesis. They also supply the host with a considerable amount of nutrients, making this ecosystem an essential metabolic organ. In the context of increasing evidence of the link between the gut flora and the metabolic syndrome, understanding the metabolic interaction between the host and its gut microbiota is becoming an important challenge of modern biology.1-4
Colonization (also referred to as normalization process) designates the establishment of micro-organisms in a former germ-free animal. While it is a natural process occurring at birth, it is also used in adult germ-free animals to control the gut floral ecosystem and further determine its impact on the host metabolism. A common procedure to control the colonization process is to use the gavage method with a single or a mixture of micro-organisms. This method results in a very quick colonization and presents the disadvantage of being extremely stressful5. It is therefore useful to minimize the stress and to obtain a slower colonization process to observe gradually the impact of bacterial establishment on the host metabolism.
In this manuscript, we describe a procedure to assess the modification of hepatic metabolism during a gradual colonization process using a non-destructive metabolic profiling technique. We propose to monitor gut microbial colonization by assessing the gut microbial metabolic activity reflected by the urinary excretion of microbial co-metabolites by 1H NMR-based metabolic profiling. This allows an appreciation of the stability of gut microbial activity beyond the stable establishment of the gut microbial ecosystem usually assessed by monitoring fecal bacteria by DGGE (denaturing gradient gel electrophoresis).6 The colonization takes place in a conventional open environment and is initiated by a dirty litter soiled by conventional animals, which will serve as controls. Rodents being coprophagous animals, this ensures a homogenous colonization as previously described.7
Hepatic metabolic profiling is measured directly from an intact liver biopsy using 1H High Resolution Magic Angle Spinning NMR spectroscopy. This semi-quantitative technique offers a quick way to assess, without damaging the cell structure, the major metabolites such as triglycerides, glucose and glycogen in order to further estimate the complex interaction between the colonization process and the hepatic metabolism7-10. This method can also be applied to any tissue biopsy11,12.
протокол
1. Колонизация неинфицированных животных и отбора образцов
- Удалить неинфицированных животных из изоляторов и их размещение в обычной комнате хозяйства в клетках, оборудованных фильтром перед обычных животных, которые будут служить в качестве контроля (рис. 1).
- Смешайте половину помета (3 дней), взятые из-под контроля обычных клетку с пометом неинфицированных животных. Всегда держите 1 / 3 от обычной грязной мусор каждый раз надо продлевать его, чтобы поддерживать уровень бактерий (держать его по крайней мере в течение 3 дней).
- Сбор мочи в 1,5 мл микропробирок путем обработки мыши над трубой и помочь мочеиспускания, осторожно массаж кишечника. Snap-немедленно заморозить в жидком азоте. Магазин по крайней мере при -40 ° C до анализа ЯМР. Минимальный объем 20 мкл требуется для приобретения с 5 мм датчик ЯМР, но рекомендуется использовать 30 мкл по улучшению качества метаболической профилирования.
- Животные должны бэлектронной эвтаназии без использования какой-либо анестезии, чтобы избежать смешанных резонансов ЯМР за счет метаболизма в печени соединений анестетика (например, использовать цервикальным сдвигом с последующей подтверждение смерти от кровопускания)
2. Рекомендации по сбору биопсии печени
- Не используйте продукт, содержащий алкоголь, чтобы избежать загрязнения. Вымойте инструменты, используя только воду или физиологический раствор.
- Не перфорации желчного пузыря. В случае утечки желчи, мыть ткани сразу же с водой или физиологическим раствором.
- Сбор биопсии печени (около 15-50 мг) с левой доли, как показано на рисунке 2. Для воспроизводимых биопсии, собирают последовательно в центре левой доли избегая периферийных районах, где ткань тоньше.
- Привязка заморозить биопсии в жидком азоте сразу и хранить их при температуре -80 ° C до анализа ЯМР.
3. ЯМР 1 Н приобретение мочи микрообъеме
- Подготовка 0,2 М натрий-фосфатного буфера решение в D2O (99,8%), рН 7,4, содержащем 1 мМ 3 - (триметилсилил) пропионовой кислоты-й 4 (TSP).
- Смешайте 30 мкл мочи с 30 мкл натрий фосфатного буфера.
- Передача 50 мкл смешанного раствора в 1,7 мм ЯМР капиллярной трубке (рис. 3 (2)), используя 50 мкл стеклянный шприц оснащен металлической иглы (OD 0,5 мм). Будьте осторожны, чтобы избежать пузырей.
- Fit капиллярной адаптера (рис. 3 (3)) в верхней части капиллярной содержащих мочу и поместите его в 2,5 мм ЯМР микропробирок на 5 мм, ЯМР-зонд (рис. 3 (1)). Используйте это сочетание трубы как обычный 5 мм ЯМР-трубки для спектрального приобретения.
- Используйте добычи стержня (рис. 3 (4)), чтобы удалить капиллярной трубки от 2,5 мм ЯМР при помощи винтов капиллярной адаптера аккуратно извлеките его.
. 4 1 H HR MAS ЯМР ткани печени биопсии: пробоподготовки
- MAS ротора компоненты и инструментыописано на рисунке 4.
- Вставьте биопсии (около 15-50 мг) в циркония ротора (рис. 4 (1)) и заполните остальные объем чистой D 2 O при ЯМР замок. Будьте осторожны, чтобы не делать никаких пузырей, потому что это изменило бы качество последующих прокладок и качество сбора данных.
- Вставьте 50 мкл Spacer тефлон (рис. 4 (2)) с помощью цилиндрических винта (рис. 4 (5)). Открутите его и калибровки с помощью глубиномера на короткой стороне (рис. 4 (8)). На данном этапе, важно обратить особое внимание на пример, потому что часть ее может просочиться через прокладку отверстие. Если это так, то часть биопсии разрушается, и вес образца больше не надежна. Таким образом, необходимо начать с самого начала подготовки образца.
- Место нарезаемой резьбы штифта (рис. 4 (3)) и винт аккуратно с помощью отвертки (рис. 4 (6)). Сухой любые остатки воды с кусочком ткани.
- Место крышкой (рис. 4 (4)) вверхней части ротора и вставить его в роторе пакером (рисунок 4 (6)). Плотно прижмите, пока крышка на месте. Там не должно быть свободного места между ротором и его шапку.
- Марк половины нижней части ротора использованием черного маркера, чтобы оптического детектирования скорости вращения.
- Место ротора внутри ЯМР-спектрометра и начинают крутиться на 5 кГц. Приобретать 1 H ЯМР-спектр использования CPMG последовательности импульсов 13 в соответствии с указаниями производителя.
- Использование α аномерный резонанс глюкозы в 5,22 промилле (дублет) для калибровки спектров ЯМР.
- Для распаковки ротора, действовать путем удаления крышки использованием колпачок для удаления (рис. 4 (9)). Отвинтите THEAD контактный и удаления тефлоновой Spacer использованием цилиндрических винта. Тщательно промыть с помощью воды и моющего средства.
5. Представитель Результаты
Гут микробной активности можно контролировать с помощью мочевого профилирования обмена веществ. Большое количество мочи микробныхсовместно метаболитов идентифицировать по 1 Н-ЯМР были описаны в литературе 7,14-17. Эти микробные совместно метаболиты особенно полезны для контроля процесса колонизации, поскольку они обеспечивают быстрый и неинвазивный способ оценить, когда вновь созданные экосистемы является устойчивой. Рисунок 5A наглядно иллюстрирует появление кишки микробных метаболитов со-за колонизации процесса. Эта цифра показывает, мочевого профиля метаболических получены по методике, описанной в шаге 2 для животных колонизировали 20 дней с помощью процедуры, описанной в шаге 1. Это животное не выделяют какой-либо indoxyl сульфат и очень мало количество phenylacetylglycine (PAG) и п-крезола сульфата в зародышевой свободном состоянии (день 0-синий). Как колонизация прогрессирует, эти 3 маркеров белкового обмена на кишечник микрофлоры значительно увеличить, чтобы достичь равновесия в день 20 (красный). Это особенно удобно для контроля за группой животных, как показано на рисунке 5B использованием PAGрезонанса. Эта диаграмма была получена за счет интеграции площадь под резонансов выделены серым цветом на рисунке 5А (δ 7.40-7.43), соответствующие конкретным резонанса (триплет) от PAG для группы из 7 животных.
1 Н высокого разрешения магическим углом Спиннинг (HR MAS) ЯМР спектроскопии неразрушающего техника, которая позволяет быстро и воспроизводимые приобретения метаболические профили любого вида биопсии 18. В этом протоколе, мы использовали этот мощный метод для получения профиля печеночной метаболических от 2 до мышей (синий цвет) и после (красный) колонизации (рис. 6). Эта цифра хорошо иллюстрирует информацию, которая может быть получена из MAS ЯМР основе метаболического профиля. Многочисленные аминокислот, а также метаболиты выводятся из энергетического обмена, такие как глюкоза, гликоген, лактат, триглицериды, (D)-3-оксибутират и nicotinurate могут быть визуализированы. Эти профили также содержат информацию, имеющую отношение к окислительному стрессу (например, аскорбиноваяСид, глутатион), нуклеотидных обмена веществ (например, инозин, уридина) и метиламина обмена веществ (например, холин, триметиламин-N-оксид). В этом примере, это очень ясно, что стерильных мышей почти не отображает гликогена и очень небольшое количество глюкозы и триглицеридов, как была ранее опубликована 7.
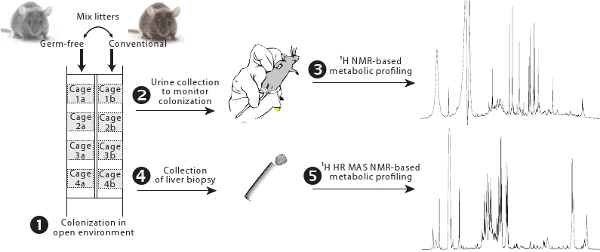
Рисунок 1. Обзор колонизации протокола. Стерильных и обычных животных размещены в клетках оборудованы боковыми фильтры с другом и их помета обмениваются, чтобы прогрессивные колонизации от обычной микрофлоры кишечника (1). Гут микробной активности контролируется с помощью ЯМР 1 Н основе метаболического профиля (2-3). Метаболизма в печени оценивается по 1 H ЯМР MAS HR основе метаболического профиля (4-5).
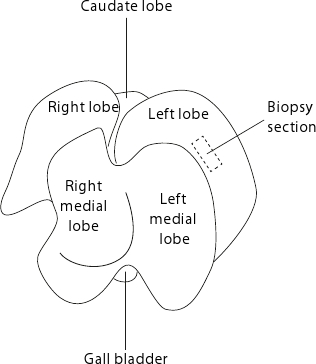
Рисунок 2. Мышь житьГ анатомии. Печень отображаются такие как плоская сторона лица органа таблице. Для воспроизводимых биопсии, рекомендуется, чтобы всегда брать образцы от центра левой доли, как показано штриховой прямоугольник.

Рисунок 3 1.7 мм ЯМР капиллярной комплект для работы с микрообъемах ключ:.. 1: 2,5 мм ЯМР микропробирок, 2: 1,7 мм ЯМР капиллярная трубка, 3: Капиллярное адаптер, 4: Извлечение стержня.

. Рисунок 4 MAS ротора оборудования Основные: 1.: MAS ротора, 2: 50 мкл Spacer тефлон, 3: THEAD контактный, 4: кепка, 5: цилиндрический винт, 6: отвертки, 7: ротор упаковщик, 8: глубина колеи.
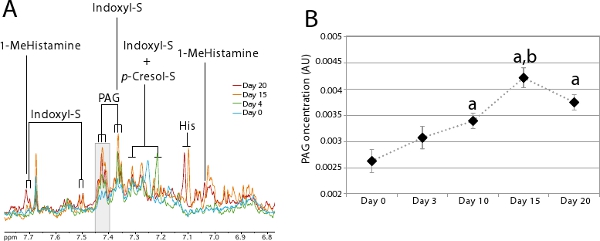
Рисунок 5. Эволюция мочевого профили метаболических во colonization.
- Увеличить на ароматические области спектра между 6.8-7.8 промилле, где микробное совместно метаболиты могут быть визуализированы. 1 H ЯМР спектры были получены из одного человека в день 0 (синий), 4 (зеленый), 15 (оранжевый) и 20 (красный) после колонизации. Серой зоне соответствует область, которая была интегрирована, чтобы сделать диаграмму B. Основные: 1-MeHistamine: 1-methylhistamine; Indoxyl-S: Indoxyl сульфата Его: Гистидин, п-крезола-S: п-крезола сульфата PAG : Phenylacetylglycine.
- Средняя концентрация PAG во время колонизации (п = 7). Стьюдента-тест был использован для сравнения разницы в PAG концентрации на различных временных точках:: р <0,05 по сравнению с днем 0, б: р <0,01 по сравнению с 10-й день.
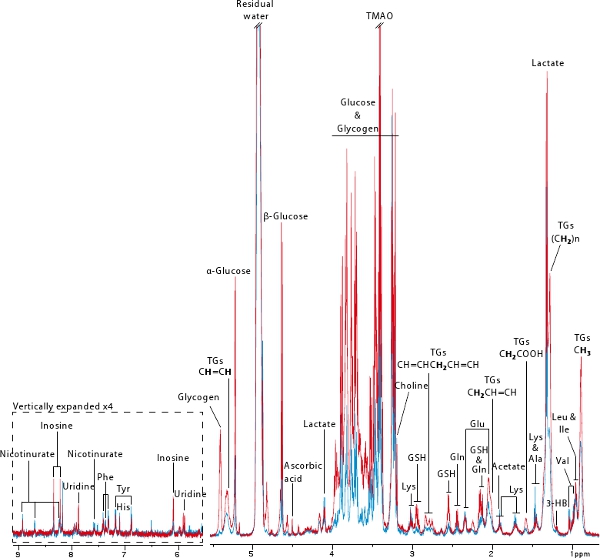
Рисунок 6. Типичные 600 МГц 1 Н HR MAS ЯМР биопсии печени производным от неинфицированных (синий) и экс-неинфицированных (рег) мышей. Жирный протоны несут ответственность за триглицеридов резонанс Key:. 3-HB: 3-оксибутирата, GSH: восстановленный глутатион, ТГ: триглицериды, ТМАО: триметиламин-N-оксид.
Обсуждение
В этом протоколе, мы описали прогрессивные процедуры колонизации в открытую среду для дальнейшего изучения воздействия микрофлоры кишечника на печеночный метаболизм оценивается 1 H HR MAS ЯМР профилирования интактных биопсии. Различные методы колонизации были описаны в литератур...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Все спектров ЯМР используется в качестве иллюстративных примеров взяты из ранее опубликованных исследований 7, которая выполнена при финансовой поддержке компании Nestle.
Материалы
Таблица специфических реагентов и оборудования:
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| 2,5 мм микропробирок | Новая эра | NE-H5/2.5-V-Br | |
| 1,7 мм капиллярная трубка | Sigma-Aldrich | NORS175001 | |
| Капиллярная адаптер | Новая эра | NE-325-5/1.7 | |
| Добыча стержень | Новая эра | NE-341-5 | |
| HR-MAS ротора BL4 с 50 мкл сферической Spacer тефлоновым комплект | Bruker | HZ07213 | |
| Набор для 50 мкл вставками | Bruker | B2950 | |
| Advance III 600МГц ЯМР | Bruker | ||
| 1 H HR MAS ЯМР твердого штыря | Bruker | ||
| Оксид дейтерия 99,9% | Sigma-Aldrich | 530 867-1L | |
| 3 - (триметилсилил) пропионовой кислотно-D 4 (TSP) | Sigma-Aldrich | 269913 |
Ссылки
- Cani, P. D., Delzenne, N. M. Gut microflora as a target for energy and metabolic. Curr. Opin. Clin. Nutr. Metab. Care. 10, 729-734 (2007).
- Ley, R. E., Turnbaugh, P. J., Klein, S., Gordon, J. I. Microbial ecology: human gut microbes associated with obesity. Nature. 444, 1022-1023 (2006).
- Raoult, D. Obesity pandemics and the modification of digestive bacterial flora. Eur. J. Clin. Microbiol. Infect. Dis. 27, 631-634 (2008).
- Turnbaugh, P. J., Backhed, F., Fulton, L., Gordon, J. I. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell. Host. Microbe. 3, 213-223 (2008).
- Balcombe, J. P., Barnard, N. D., Sandusky, C. Laboratory routines cause animal stress. Contemp. Top. Lab. Anim. Sci. 43, 42-51 (2004).
- Muyzer, G., Smalla, K. Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology. Antonie van Leeuwenhoek. 73, 127-141 (1998).
- Claus, S. P. Colonization-induced host-gut microbial metabolic interaction. MBio. 2, (2011).
- Waters, N. J. High-resolution magic angle spinning 1H NMR spectroscopy of intact liver and kidney: optimization of sample preparation procedures and biochemical stability of tissue during spectral acquisition. Anal. Biochem. 282, 16-23 (2000).
- Bollard, M. E. High-resolution 1H and 1H-13C magic angle spinning NMR spectroscopy of rat liver. Magnetic resonance in medicine. 44, 201-207 (2000).
- Lindon, J. C., Holmes, E., Nicholson, J. Pattern recognition methods and applications in biomedical magnetic resonance. Progress in Nuclear Magnetic Resonance Spectroscopy. 39, 1-40 (2001).
- Tate, A. R. Distinction between normal and renal cell carcinoma kidney cortical biopsy samples using pattern recognition of (1)H magic angle spinning (MAS) NMR spectra. NMR. Biomed. 13, 64-71 (2000).
- Wang, Y. Topographical variation in metabolic signatures of human gastrointestinal biopsies revealed by high-resolution magic-angle spinning 1H NMR spectroscopy. Journal of Proteome Research. 6, 3944-3951 (2007).
- Meiboom, S., Gill, D. Modified spin-echo method for measuring nuclear relaxation times. The review of scientific instruments. 29, 688-691 (1958).
- Nicholson, J. K., Holmes, E., Wilson, I. D. Gut microorganisms, mammalian metabolism and personalized health care. Nat. Rev. Microbiol. 3, 431-438 (2005).
- Martin, F. P. Effects of probiotic Lactobacillus paracasei treatment on the host gut tissue metabolic profiles probed via magic-angle-spinning NMR spectroscopy. Journal of Proteome Research. 6, 1471-1481 (2007).
- Swann, J. R. Variation in Antibiotic-Induced Microbial Recolonization Impacts on the Host Metabolic Phenotypes of Rats. J. Proteome. Res. , (2011).
- Jacobs, D. M., Gaudier, E., van Duynhoven, J., Vaughan, E. E. Non-digestible food ingredients, colonic microbiota and the impact on gut health and immunity: a role for metabolomics. Curr. Drug. Metab. 10, 41-54 (2009).
- Beckonert, O. High-resolution magic-angle-spinning NMR spectroscopy for metabolic profiling of intact tissues. Nat. Protoc. 5, 1019-1032 (2010).
- Hooper, L. V., Sansonetti, P., Zychlinsky, A. . Methods in microbiology. 31, 559-589 (2002).
- Rahija, R. J., Fox, J. G. Ch. 7. The mouse in biomedical research. , 217-234 (2007).
- Goodwin, B. L., Ruthven, C. R., Sandler, M. Gut flora and the origin of some urinary aromatic phenolic compounds. Biochemical Pharmacology. 47, 2294-2297 (1994).
- Koopman, J. P. 'Normalization' of germfree mice after direct and indirect contact with mice having a 'normal' intestinal microflora. Lab Anim. 20, 286-290 (1986).
- Nishikata, N., Shikata, N., Kimura, Y., Noguchi, Y. Dietary lipid-dependent regulation of de novo lipogenesis and lipid partitioning by ketogenic essential amino acids in mice. Nutrition and Diabetes. 1, 1-12 (2011).
- Spagou, K. A GC-MS metabolic profiling study of plasma samples from mice on low- and high-fat diets. J. Chromatogr. B. Analyt. Technol. Biomed. Life. Sci. 879, 1467-1475 (2011).
- Sanchez-Patan, F., Monagas, M., Moreno-Arribas, M. V., Bartolome, B. Determination of microbial phenolic acids in human faeces by UPLC-ESI-TQ MS. J. Agric. Food. Chem. 59, 2241-2247 (2011).
- Roux, A., Lison, D., Junot, C., Heilier, J. F. Applications of liquid chromatography coupled to mass spectrometry-based metabolomics in clinical chemistry and toxicology: A review. Clin. Biochem. 44, 119-135 (2011).
- Ryan, D., Robards, K., Prenzler, P. D., Kendall, M. Recent and potential developments in the analysis of urine: a review. Anal. Chim. Acta. 684, 8-20 (2011).
- Nagayama, K., Wuthrich, K., Bachmann, P., Ernst, R. R. Two-dimensional J-resolved 1H n.m.r. spectroscopy for studies of biological macromolecules. Biochem. Biophys. Res. Commun. 78, 99-105 (1977).
- Aue, W. P., Bartholdi, E., Ernst, R. R. Two-dimensional spectroscopy. Application to nuclear magnetic resonance. J. Chem. Phys. 64, 2229-2246 (1975).
- Bodenhausen, G., Ruben, D. J. Natural abundance 15N NMR by enhanced heteronuclear spectroscopy. Chemical. Physics. Letters. 69, 185-189 (1980).
- Fan, T. W. -. M. Metabolite profiling by one- and two-dimensional NMR analysis of complex mixtures. Progress in nuclear magnetic resonance spectroscopy. 28, 161-219 (1996).
- Fan, T., Lane, A. Structure-based profiling of metabolites and isotopomers by NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 52, 48-48 (2008).
- Fonville, J. M. The evolution of partial least squares models and related chemometric approaches in metabonomics and metabolic phenotyping. Journal of Chemometrics. 24, 636-649 (2010).
- Merrifield, C. A. A metabolic system-wide characterisation of the pig: a model for human physiology. Mol. Biosyst. , (2011).
- Tugnoli, V. Molecular characterization of human gastric mucosa by HR-MAS magnetic resonance spectroscopy. International Journal of Molecular Medicine. 14, 1065-1071 (2004).
- Sitter, B. Comparison of HR MAS MR spectroscopic profiles of breast cancer tissue with clinical parameters. NMR Biomed. 19, 30-40 (2006).
- Beckonert, O. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat. Protoc. 2, 2692-2703 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены