Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Beurteilung der Leber metabolischen Veränderungen während Progressive Colonization von Keimfrei Maus durch 1 H-NMR-Spektroskopie
In diesem Artikel
Zusammenfassung
Eine progressive Kolonisierung Verfahren wird beschrieben, weitere Beurteilung ihrer Auswirkungen auf den Host Leberstoffwechsel. Colonization wird überwacht nicht-invasiv durch die Auswertung der Ausscheidung von mikrobiellen Co-Metaboliten durch NMR-basierte Metabolic Profiling während Leberstoffwechsel von High Resolution Magic Angle Spinning (HR MAS)-NMR-Profiling von intakten Biopsie beurteilt wird.
Zusammenfassung
Es ist bekannt, dass Darmbakterien einen wesentlichen Beitrag an den Host-Homöostase, die eine Reihe von Vorteilen wie Immunschutz und Vitamin-Synthese. Sie liefern auch die Gastgeber mit einer beträchtlichen Menge an Nährstoffen, so dass dieses Ökosystem eine wichtige Stoffwechselorgan. Im Rahmen der zunehmenden Belege für den Zusammenhang zwischen der Darmflora und des metabolischen Syndroms, das Verständnis der metabolischen Interaktion zwischen dem Wirt und seine Darmflora wird immer eine wichtige Herausforderung der modernen Biologie. 1-4
Colonization (auch als Normalisierung bezeichnet) bezeichnet die Einrichtung von Mikroorganismen in einem ehemaligen keimfreie Tier. Es ist zwar ein natürlicher Prozess auftretenden bei der Geburt ist, ist es auch bei erwachsenen keimfreien Tieren verwendet werden, um den Darm floral Ökosystem-Steuerung und weiter zu bestimmen, deren Auswirkungen auf die Host-Stoffwechsel. Ein gängiges Verfahren, um die Kolonisierung Prozesssteuerung ist es, die Sonde Methode mit einem singl verwendene oder eine Mischung von Mikroorganismen. Diese Methode führt zu einer sehr schnellen Kolonisierung und präsentiert den Nachteil, dass sie extrem stressig 5. Es ist daher sinnvoll, um den Stress zu minimieren und eine langsamere Kolonisierung zu erhalten, um schrittweise beobachten die Auswirkungen der bakteriellen Etablierung auf dem Host-Stoffwechsel.
In diesem Manuskript, beschreiben wir ein Verfahren zur Änderung des Leberstoffwechsel während einer schrittweisen Kolonisation Verfahren unter Verwendung eines nicht-destruktiven Metabolic Profiling-Technik zu beurteilen. Wir schlagen vor, gut mikrobielle Besiedlung durch die Beurteilung des Darms mikrobielle Stoffwechselaktivität durch die renale Ausscheidung von mikrobiellen Co-Metaboliten durch 1 H-NMR-basierte Metabolic Profiling wider überwachen. Dies ermöglicht eine Aufwertung der Stabilität gut mikrobielle Aktivität über die stabile Etablierung des Darms mikrobiellen Ökosystems in der Regel durch die Überwachung der fäkalen Bakterien durch DGGE (denaturierende Gradienten-Gelelektrophorese) bewertet. 6 DerBesiedlung erfolgt in einem herkömmlichen offenen Umgebung und ist von einem schmutzigen Einstreu verschmutzt durch konventionelle Tiere, die als Kontrollen dienen wird eingeleitet. Nagetiere zu koprophage Tiere, sorgt diese eine homogene Besiedlung wie zuvor beschrieben. 7
Hepatische Metabolic Profiling wird direkt von einer intakten Leberbiopsie mit 1 H Hohe Auflösung MAS-NMR-Spektroskopie gemessen. Diese semi-quantitative Methode bietet einen schnellen Weg, um zu beurteilen, ohne Beschädigung der Zellstruktur, schätzen die Hauptmetaboliten wie Triglyceride, Glucose und Glykogen, um weiter die komplexen Wechselwirkungen zwischen Kolonialisierung und der Leberstoffwechsel 7-10. Diese Methode kann auch für alle Gewebebiopsie 11,12 angewendet werden.
Protokoll
1. Colonization von keimfreien Tieren und Probenentnahme
- Entfernen keimfreien Tieren aus Isolatoren und Haus sie in einem konventionellen Tierhaltung Raum in Käfigen mit Filter vor der konventionellen Tiere, die als Kontrollen (Abbildung 1) dienen ausgestattet.
- Die Hälfte des Wurfes (3 Tage alt) von der Steuerung konventioneller Käfig mit dem Wurf des keimfreien Tieren. Halten Sie immer 1 / 3 der schmutzigen herkömmlichen Wurf jedes Mal ist es notwendig, sie zu erneuern, um auf ein Niveau von Bakterien (halten Sie sie mindestens 3 Tage) zu erhalten.
- Sammeln Sie Urin in ein 1,5 ml Mikroröhrchen durch den Umgang mit der Maus über das Rohr und helfen Miktion durch sanfte Massage des Darmes. Snap-freeze sofort in flüssigem Stickstoff. Shop zumindest bei -40 ° C bis NMR-Analyse. Ein Mindestvolumen von 20 ul ist für den Erwerb mit einem 5 mm NMR-Sonde erforderlich, aber es wird empfohlen, 30 ul zu verwenden, um die Qualität der Metabolic Profiling zu verbessern.
- Die Tiere sollten be ohne Verwendung von Betäubung getötet, um Verwechselung-NMR-Signale durch den Leberstoffwechsel der Narkose Verbindungen (z. B. Verwendung Genickbruch durch eine Bestätigung des Todes durch Ausbluten folgt) zu vermeiden
2. Empfehlung für die Sammlung der Leberbiopsie
- Verwenden Sie keine Produkte, die Alkohol, um eine Kontamination zu vermeiden. Wash-Tools nur mit Wasser oder Kochsalzlösung.
- Nicht durchlöchern Gallenblase. Im Falle der Galle Leck, waschen Gewebe sofort mit Wasser oder Kochsalzlösung.
- Sammeln Leberbiopsien (etwa 15-50 mg) aus dem linken Lappen, wie in Abbildung 2 dargestellt. Für reproduzierbare Biopsien, konsequent zu sammeln in der Mitte des linken Lappens Vermeidung der peripheren Gebieten, in denen Gewebe wird dünner.
- Snap freeze Biopsien in flüssigem Stickstoff sofort und lagern Sie sie bei -80 ° C bis NMR-Analyse.
3. 1 H NMR Erwerb von Urin Mikrovolumens
- Bereiten 0,2 M Natrium-Phosphat-Puffer-Lösung in D2O (99,8%), pH 7,4 mit 1 mM 3 - (Trimethylsilyl)-propionsäure-d 4 (TSP).
- Mix 30 ul Urin mit 30 ul Natriumphosphatpuffer.
- Transfer-50 ul gemischte Lösung in 1,7 mm-NMR-Kapillare (Abbildung 3) (2) mit einem 50 ul Glasspritze mit einer Metall-Nadel (OD 0,5 mm) ausgestattet. Seien Sie vorsichtig, um Blasen zu vermeiden.
- Fit der Kapillare Adapter (Abbildung 3) (3) auf der Oberseite der Kapillare mit Urinprobe und legen Sie sie in einen 2,5-mm-NMR-Mikroröhrchen für 5 mm NMR-Sonde (Abbildung 3 (1)). Mit dieser Kombination aus Röhren als regulärer 5 mm NMR-Röhrchen für die spektrale Akquisition.
- Verwenden Sie die Extraktion Stange (Abbildung 3) (4) zur Kapillare von 2,5 mm NMR-Röhrchen zu entfernen durch Eindrehen der Kapillare Adapter vorsichtig, um ihn herauszuziehen.
. 4 1 H HR-MAS-NMR von Lebergewebe Biopsie: Probenvorbereitung
- MAS-Rotor-Komponenten und Werkzeuge sindbeschrieben in Abbildung 4.
- Legen Sie Biopsie (etwa 15-50 mg) in Zirkonium Rotor (Abbildung 4 (1)) und füllen den Rest des Volumens mit reinem D 2 O für die NMR-Lock. Achten Sie darauf, keinen Blasen, da diese die Qualität der späteren Shim und die Qualität der Datenerfassung ändern würde.
- Legen Sie 50 ul Teflon spacer (Abbildung 4) (2) mit der Zylinderschraube (Abbildung 4 (5)). Schrauben Sie es und kalibrieren es mit dem Tiefenmesser an der kurzen Seite (Abbildung 4 (8)). Bei diesem Schritt ist es wichtig, ein besonderes Augenmerk auf die Probe zu zahlen, weil ein Teil davon durch den Abstandhalter Loch austreten kann. Ist dies der Fall ist, dann Teil der Biopsie ist zerstört und Gewicht der Probe ist nicht mehr zuverlässig. Es ist daher notwendig, um wieder von vorne beginnen die Vorbereitung der Probe.
- Setzen Sie den thead pin (Abbildung 4) (3) und schrauben Sie ihn vorsichtig mit dem Schraubendreher (Abbildung 4 (6)). Austrocknen Restwasser mit einem Stück Gewebe.
- Setzen Sie die Kappe (Abbildung 4) (4) an derOberseite des Rotors und fügen Sie ihn in den Rotor Packer (Abbildung 4 (6)). Drücken Sie fest, bis die Kappe vorhanden ist. Es sollte keine Leerzeichen zwischen den Rotor und die Kappe gelassen werden.
- Mark die Hälfte der Unterseite des Rotors mit einem schwarzen Filzstift auf optische Spin-Rate-Erkennung ermöglichen.
- Setzen Sie den Rotor im Inneren des NMR-Spektrometers und rotieren beginnen bei 5 kHz. Acquire 1 H-NMR-Spektrum mit CPMG Pulsfolge 13 nach Hersteller-Richtlinien.
- Verwenden α anomeren Glucose Resonanz 5.22 ppm (Dublett), NMR-Spektren zu kalibrieren.
- Um den Rotor entpacken, indem Sie die Kappe mit dem cap-Entferner (Abbildung 4 (9)) fort. Lösen Sie thead Pin und entfernen Teflon spacer mit dem zylindrischen Schraube. Gründlich mit Wasser und Reinigungsmittel.
5. Repräsentative Ergebnisse
Gut mikrobielle Aktivität überwacht mit Urin Metabolic Profiling werden. Eine große Anzahl von Urin mikrobiellenCo-Metaboliten erkennbar durch 1 H-NMR sind in der Literatur 7,14-17 beschrieben worden. Diese mikrobielle Co-Metaboliten sind besonders nützlich, um die Besiedlung zu überwachen, da sie einen schnellen und nicht-invasive Methode zur Schätzung, wenn die neu gegründete Ökosystem stabil ist. 5A zeigt deutlich das Aussehen gut mikrobielle Co-Metaboliten über die Kolonisierung. Diese Figur zeigt eine Urin-metabolischen Profils, indem Sie die in Schritt 2 für ein Tier beschrieben, erhalten kolonisiert 20 Tage nach Verfahren in Schritt 1 beschrieben. Dieses Tier nicht scheiden alle indoxyl Sulfat und sehr geringe Mengen an phenylacetylglycine (PAG) und p-Kresol-Sulfat bei der keimfreien Zustand (Tag 0-blau). Als Kolonisierung fortschreitet, diese 3 Marker Protein-Stoffwechsel der Darmflora deutlich erhöhen, um ein Gleichgewicht am Tag 20 (rot) zu erreichen. Dies ist besonders einfach, für eine Gruppe von Tieren, wie dargestellt in Abbildung 5B mit dem PAG-MonitorResonanz. Dieses Diagramm wurde durch Integration der Fläche unter der Resonanzen in grau in Abbildung 5A (δ 7,40-7,43) hervorgehoben, das entspricht einer spezifischen Resonanz (Triplett) der PAG für eine Gruppe von 7 Tieren erhalten.
1 H Hohe Auflösung Magic Angle Spinning (HR MAS) NMR-Spektroskopie ist eine zerstörungsfreie Methode, die eine schnelle und reproduzierbare Akquisitionen von metabolischen Profilen jeglicher Art von Biopsie-18 ermöglicht. In diesem Protokoll haben wir diese leistungsstarke Technik auf eine hepatische metabolische Profil von 2 Mäuse vor (blau) und nach (rot) Kolonisierung (Abbildung 6) zu erhalten. Diese Abbildung zeigt auch die Informationen, die von einem MAS-NMR-basierte metabolische Profil abgeleitet werden können. Zahlreiche Aminosäuren sowie Metaboliten aus energetischen Stoffwechsel, wie Glukose, Glykogen, Laktat, Triglyceride, (D)-3-Hydroxybutyrat und nicotinurate abgeleitet werden können visualisiert werden. Diese Profile enthalten auch Informationen, die zu oxidativem Stress (zB Ascorbinsäure eincid, Glutathion), Nukleotid-Metabolismus (dh Inosin, Uridin) und Methylamin Stoffwechsel (zB Cholin, Trimethylamin-N-Oxid). In diesem Beispiel ist es sehr klar, dass die keimfreie Maus fast kein Glykogen und sehr geringe Mengen an Glucose und Triglyceride wie bisher 7 veröffentlicht Displays.
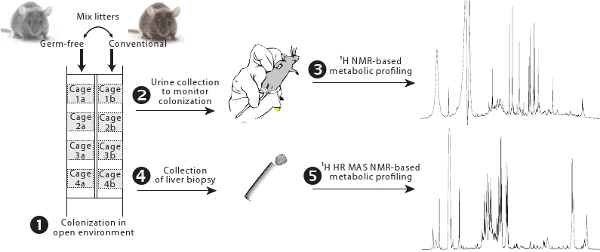
Abbildung 1. Übersicht über die Kolonisierung Protokoll. Keimfrei und konventionelle Tiere in Käfigen mit Filtern nebeneinander und ihre Würfe werden ausgetauscht, um progressive Kolonisierung von den herkömmlichen Darmflora (1) erlauben ausgestattet untergebracht. Gut mikrobielle Aktivität überwacht wird mittels 1 H-NMR-basierte Metabolic Profiling (2-3). Leberstoffwechsel wird durch 1 H HR-MAS-NMR-basierte Metabolic Profiling (4-5) beurteilt.
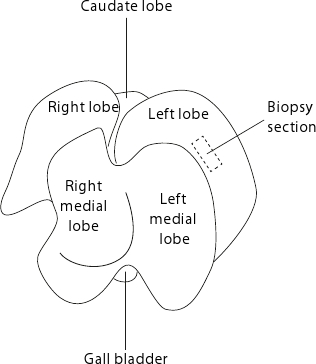
Abbildung 2. Maus lebenr Anatomie. Die Leber ist wie die flache Seite der Orgel Gesichter der Tabelle angezeigt. Für reproduzierbare Biopsien, ist es ratsam, immer die Proben an der Mitte des linken Lappens, wie durch die gestrichelte Rechteck angedeutet.

Abbildung 3 1,7 mm-NMR-Kapillar-Kit mit Mikrovolumina Arbeit Key:.. 1: 2,5 mm-NMR-Mikroröhrchen, 2: 1,7 mm-NMR-Kapillare, 3: Kapillar-Adapter, 4: Extraction Stange.

. Abbildung 4 MAS Läufer, Key:. 1: MAS-Rotor, 2: 50 ul Teflon spacer, 3: THEAD polig, 4: Mütze, 5: Zylinderschraube, 6: Schraubendreher, 7: Rotor Verpacker, 8: Tiefenmesser.
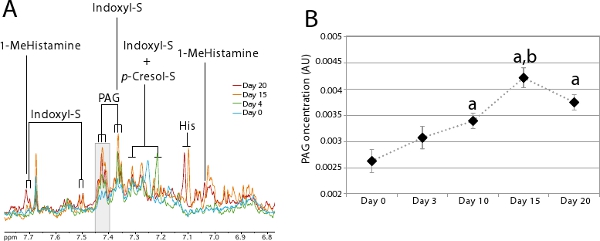
Abbildung 5. Evolution der Harnwege metabolischen Profile während colonization.
- Zoom auf den aromatischen Bereich des Spektrums zwischen 6,8 bis 7,8 ppm, wo mikrobielle Co-Metaboliten visualisiert werden. 1 H-NMR-Spektren können, wurden von einer einzigen Person am Tag 0 (blau), 4 (grün), 15 (orange) und 20 abgeleitet (red) Post-Kolonialismus. Die Grauzone entspricht der Fläche, die integriert werden, um das Diagramm in B. Key machen war: 1-MeHistamine: 1-Methylhistamin; Indoxyl-S: Indoxyl Sulfat; Sein: Histidin, p-Cresol-S: p-Cresol-Sulfat; PAG : Phenylacetylglycine.
- Durchschnittliche PAG-Konzentration während der Kolonisation (n = 7). Student-t-Test wurde verwendet, um den Unterschied in PAG-Konzentration an verschiedenen Zeitpunkten zu vergleichen: a: p <0,05 im Vergleich zu Tag 0; b: p <0,01 bis Tag 10 verglichen.
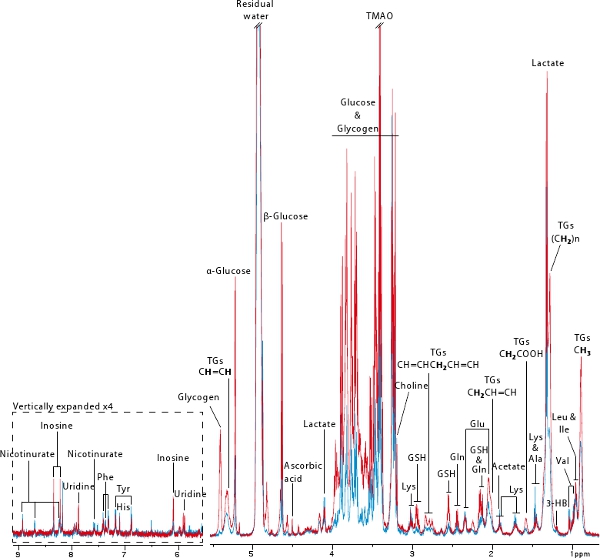
Abbildung 6. Typischer 600 MHz 1 H HR-MAS-NMR-Spektren der Leber Biopsien aus keimfrei (blau) und Ex-keimfrei (re abgeleitetd) Mäusen. Bold Protonen sind verantwortlich für die Triglycerid-Resonanz-Key:. 3-HB: 3-Hydroxybutyrat, GSH: reduziertes Glutathion, TGs: Triglyceride, TMAO: Trimethylamin-N-Oxid.
Diskussion
In diesem Protokoll haben wir beschrieben, eine fortschreitende Besiedlung Verfahren in einer offenen Umgebung zur weiteren Untersuchung der Auswirkungen der Darmflora auf den Leberstoffwechsel von 1 H HR-MAS-NMR-Profiling von intakten Biopsie beurteilt. Verschiedene Methoden der Kolonisation sind in der Literatur beschrieben worden. Die häufigsten Methoden, um Tiere mit einer definierten Mikrobiota besiedeln sind orale Gabe oder verunreinigtes Trinkwasser 19,20. Fecal Impfung kann auch verwendet ...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Alle NMR-Spektren als anschauliche Beispiele verwendet werden, aus einer zuvor veröffentlichten Studie 7, die finanziell von Nestlé unterstützt wurde abgeleitet.
Materialien
Tabelle der spezifischen Reagenzien und Geräte:
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| 2,5 mm Mikroröhrchen | New Era | NE-H5/2.5-V-Br | |
| 1,7 mm Kapillarrohr | Sigma-Aldrich | NORS175001 | |
| Kapillar-Adapter | New Era | NE-325-5/1.7 | |
| Extraction Stange | New Era | NE-341-5 | |
| HR-MAS-Rotor BL4 mit 50 ul kugelförmigen Teflon spacer kit | Bruker | HZ07213 | |
| Werkzeugsatz für 50 ul-Einsätze | Bruker | B2950 | |
| Advance-III 600MHz-NMR- | Bruker | ||
| 1 H HR-MAS-NMR feste Sonde | Bruker | ||
| Deuteriumoxid 99,9% | Sigma-Aldrich | 530867-1L | |
| 3 - (trimethylsilyl) Propionsäure Säure-d 4 (TSP) | Sigma-Aldrich | 269913 |
Referenzen
- Cani, P. D., Delzenne, N. M. Gut microflora as a target for energy and metabolic. Curr. Opin. Clin. Nutr. Metab. Care. 10, 729-734 (2007).
- Ley, R. E., Turnbaugh, P. J., Klein, S., Gordon, J. I. Microbial ecology: human gut microbes associated with obesity. Nature. 444, 1022-1023 (2006).
- Raoult, D. Obesity pandemics and the modification of digestive bacterial flora. Eur. J. Clin. Microbiol. Infect. Dis. 27, 631-634 (2008).
- Turnbaugh, P. J., Backhed, F., Fulton, L., Gordon, J. I. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell. Host. Microbe. 3, 213-223 (2008).
- Balcombe, J. P., Barnard, N. D., Sandusky, C. Laboratory routines cause animal stress. Contemp. Top. Lab. Anim. Sci. 43, 42-51 (2004).
- Muyzer, G., Smalla, K. Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology. Antonie van Leeuwenhoek. 73, 127-141 (1998).
- Claus, S. P. Colonization-induced host-gut microbial metabolic interaction. MBio. 2, (2011).
- Waters, N. J. High-resolution magic angle spinning 1H NMR spectroscopy of intact liver and kidney: optimization of sample preparation procedures and biochemical stability of tissue during spectral acquisition. Anal. Biochem. 282, 16-23 (2000).
- Bollard, M. E. High-resolution 1H and 1H-13C magic angle spinning NMR spectroscopy of rat liver. Magnetic resonance in medicine. 44, 201-207 (2000).
- Lindon, J. C., Holmes, E., Nicholson, J. Pattern recognition methods and applications in biomedical magnetic resonance. Progress in Nuclear Magnetic Resonance Spectroscopy. 39, 1-40 (2001).
- Tate, A. R. Distinction between normal and renal cell carcinoma kidney cortical biopsy samples using pattern recognition of (1)H magic angle spinning (MAS) NMR spectra. NMR. Biomed. 13, 64-71 (2000).
- Wang, Y. Topographical variation in metabolic signatures of human gastrointestinal biopsies revealed by high-resolution magic-angle spinning 1H NMR spectroscopy. Journal of Proteome Research. 6, 3944-3951 (2007).
- Meiboom, S., Gill, D. Modified spin-echo method for measuring nuclear relaxation times. The review of scientific instruments. 29, 688-691 (1958).
- Nicholson, J. K., Holmes, E., Wilson, I. D. Gut microorganisms, mammalian metabolism and personalized health care. Nat. Rev. Microbiol. 3, 431-438 (2005).
- Martin, F. P. Effects of probiotic Lactobacillus paracasei treatment on the host gut tissue metabolic profiles probed via magic-angle-spinning NMR spectroscopy. Journal of Proteome Research. 6, 1471-1481 (2007).
- Swann, J. R. Variation in Antibiotic-Induced Microbial Recolonization Impacts on the Host Metabolic Phenotypes of Rats. J. Proteome. Res. , (2011).
- Jacobs, D. M., Gaudier, E., van Duynhoven, J., Vaughan, E. E. Non-digestible food ingredients, colonic microbiota and the impact on gut health and immunity: a role for metabolomics. Curr. Drug. Metab. 10, 41-54 (2009).
- Beckonert, O. High-resolution magic-angle-spinning NMR spectroscopy for metabolic profiling of intact tissues. Nat. Protoc. 5, 1019-1032 (2010).
- Hooper, L. V., Sansonetti, P., Zychlinsky, A. . Methods in microbiology. 31, 559-589 (2002).
- Rahija, R. J., Fox, J. G. Ch. 7. The mouse in biomedical research. , 217-234 (2007).
- Goodwin, B. L., Ruthven, C. R., Sandler, M. Gut flora and the origin of some urinary aromatic phenolic compounds. Biochemical Pharmacology. 47, 2294-2297 (1994).
- Koopman, J. P. 'Normalization' of germfree mice after direct and indirect contact with mice having a 'normal' intestinal microflora. Lab Anim. 20, 286-290 (1986).
- Nishikata, N., Shikata, N., Kimura, Y., Noguchi, Y. Dietary lipid-dependent regulation of de novo lipogenesis and lipid partitioning by ketogenic essential amino acids in mice. Nutrition and Diabetes. 1, 1-12 (2011).
- Spagou, K. A GC-MS metabolic profiling study of plasma samples from mice on low- and high-fat diets. J. Chromatogr. B. Analyt. Technol. Biomed. Life. Sci. 879, 1467-1475 (2011).
- Sanchez-Patan, F., Monagas, M., Moreno-Arribas, M. V., Bartolome, B. Determination of microbial phenolic acids in human faeces by UPLC-ESI-TQ MS. J. Agric. Food. Chem. 59, 2241-2247 (2011).
- Roux, A., Lison, D., Junot, C., Heilier, J. F. Applications of liquid chromatography coupled to mass spectrometry-based metabolomics in clinical chemistry and toxicology: A review. Clin. Biochem. 44, 119-135 (2011).
- Ryan, D., Robards, K., Prenzler, P. D., Kendall, M. Recent and potential developments in the analysis of urine: a review. Anal. Chim. Acta. 684, 8-20 (2011).
- Nagayama, K., Wuthrich, K., Bachmann, P., Ernst, R. R. Two-dimensional J-resolved 1H n.m.r. spectroscopy for studies of biological macromolecules. Biochem. Biophys. Res. Commun. 78, 99-105 (1977).
- Aue, W. P., Bartholdi, E., Ernst, R. R. Two-dimensional spectroscopy. Application to nuclear magnetic resonance. J. Chem. Phys. 64, 2229-2246 (1975).
- Bodenhausen, G., Ruben, D. J. Natural abundance 15N NMR by enhanced heteronuclear spectroscopy. Chemical. Physics. Letters. 69, 185-189 (1980).
- Fan, T. W. -. M. Metabolite profiling by one- and two-dimensional NMR analysis of complex mixtures. Progress in nuclear magnetic resonance spectroscopy. 28, 161-219 (1996).
- Fan, T., Lane, A. Structure-based profiling of metabolites and isotopomers by NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 52, 48-48 (2008).
- Fonville, J. M. The evolution of partial least squares models and related chemometric approaches in metabonomics and metabolic phenotyping. Journal of Chemometrics. 24, 636-649 (2010).
- Merrifield, C. A. A metabolic system-wide characterisation of the pig: a model for human physiology. Mol. Biosyst. , (2011).
- Tugnoli, V. Molecular characterization of human gastric mucosa by HR-MAS magnetic resonance spectroscopy. International Journal of Molecular Medicine. 14, 1065-1071 (2004).
- Sitter, B. Comparison of HR MAS MR spectroscopic profiles of breast cancer tissue with clinical parameters. NMR Biomed. 19, 30-40 (2006).
- Beckonert, O. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat. Protoc. 2, 2692-2703 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten