JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
하여 세균없는 마우스 프로 그레시브 콜로니 동안 간장 신진 대사 변경 사항 평가 1 H NMR 분광학
요약
진보 식민 절차는 더욱 호스트 간장 대사에 미치는 영향을 평가하기 위해 설명되어 있습니다. 간장 신진 대사가 고해상도 매직 앵글 스피닝 (HR의 MAS) 그대로 생검의 NMR 프로 파일링에 의해 평가하는 동안 식민지는 NMR 기반의 신진 대사 프로 파일링 공동 metabolites 미생물의 비뇨기 배설을 평가하여 invasively 아닌 모니터입니다.
초록
그것은 내장 박테리아가 이러한 면역 보호와 비타민 합성과 같은 혜택의 범위를 제공하는 호스트 항상성에 크게 기여 잘 알려져있다. 그들은 또한 생태계 필수적인 대사 오르간 제작, 영양소의 상당한로 호스트를 제공합니다. 호스트와 내장 microbiota 사이의 신진 대사 상호 작용을 이해하는 창자의 식물과 대사 증후군 사이의 링크의 증가 증거의 맥락에서 현대 생물학의 중요한 과제가되고있다. 1-4
식민지는 (또한 정상화 과정으로 함) 전 세균없는 동물의 미생물의 설립을 지정합니다. 그것이 출생시 발생하는 자연적인 과정이지만, 그것은 또한 창자 꽃 생태계를 관리하고 추가로 호스트 신진 대사에 미치는 영향을 결정하기 위해 성인 세균없는 동물에 사용됩니다. 식민 프로세스를 제어하는 일반적인 절차는 singl로 gavage 방법을 사용하는 것입니다E 또는 미생물의 혼합물. 이 방법은 매우 빠른 식민지의 결과와 5 매우 스트레스가되는 단점을 선물한다. 그것은 스트레스를 최소화하고 점차 호스트 신진 대사에 세균 설립의 영향을 관찰하기 위해 느린 식민지 과정을 취득하는 것이 유용합니다.
이 원고에서는, 우리는 비파괴 신진 대사 프로 파일링 기법을 사용하여 점차 식민지 과정에서 간장 대사의 수정을 평가하는 절차를 설명합니다. 우리는 1 H NMR 기반의 신진 대사 프로 파일링 공동 metabolites 미생물의 비뇨기 배설에 의해 반영 내장 미생물의 신진 대사 활동을 평가하여 내장 미생물의 식민지를 모니터링 제안합니다. 이것은 일반적으로 DGGE (기울기 겔 전기 영동을 denaturing)에 의해 배설물 박테리아를 모니터링하여 평가 직감의 미생물 생태계의 안정 설립 넘어 직감의 미생물 활동의 안정성을 감사하실 수 있습니다. 6식민지는 종래의 열린 환경에서 열립니다하고 더러운 쓰레기 컨트롤로 될 것입니다 기존의 동물에 의해 더러워진에 의해 시작됩니다. coprophagous 동물 설치류되고, 이쪽은 이전에 설명한 것처럼 동질적인 식민지를 보장합니다. 7
간장 대사 프로 파일링은 NMR 분광법을 치는것 1 H 고해상도 매직 각도를 사용하여 손상 간 생검에서 직접 측정됩니다. 이 세미 양적 기술은 세포 구조를 손상시키지 않고, 평가하는 빠른 방법을 제공, 그러한 트리 글리세 리드, 포도당과 글리코겐으로 주요 metabolites 추가하기 위해서는 식민지 과정과 70-10 간장 신진 대사 사이의 복잡한 상호 작용을 예상하고있다. 이 방법은 모든 조직 생검 11,12에도 적용할 수 있습니다.
프로토콜
1. 세균없는 동물과 샘플 컬렉션의 식민지
- 컨트롤 (그림 1)로 될 것입니다 종래의 동물 앞에 필터를 갖춘 연습장에서 종래의 축산 룸에 isolators하고 집에서 그들로부터 세균없는 동물을 제거합니다.
- 쓰레기의 혼합 절반 (옛 3 일) 세균없는 동물의 쓰레기와 컨트롤 기존의 케이지에서 찍은. 항상 더러운 일반 쓰레기의 1 / 3이 박테리아의 수준 (적어도 3 일 동안 그것을 보관) 유지하기 위해서는 그것을 갱신하는 데 필요한 때마다 유지.
- 튜브 위에 마우스를 처리하여 1.5 ML의 microtube에 소변을 수집하고 부드럽게 마사지하여 대장 방뇨를 도와줍니다. 스냅인 동결 액화 질소에 즉시. NMR 분석까지 적어도 -40 ° C에서 보관하십시오. 20 μL의 최소 볼륨 5mm NMR 프로브와 함께 취득 필요하지만, 그것은 신진 대사 프로파일 링의 품질을 향상시키기 위해 30 μL를 사용하는 것이 좋습니다.
- 동물 B해야E는 마취 화합물의 간장 대사 (예를 들어, 과다에 의해 죽음의 확인 다음 경추 탈구를 사용)로 인해 혼란함을 주죠 NMR의 resonances를 피하기 위해 어떤 마취를 사용하지 않고 euthanized
2. 간 생검의 수집에 대한 추천
- 오염을 피하기 위해 알코올을 포함하는 모든 제품을 사용하지 마십시오. 물 전용 또는 생리 식염수를 사용하여 도구를 씻으십시오.
- 담즙 방광 구멍하지 마십시오. 담즙 누출의 경우 물 또는 생리 식염수 즉시 조직을 씻는다.
- 그림 2에 표시된 왼쪽 엽에서 간 biopsies을 (15-50 대해 MG)를 수집합니다. 재현성 biopsies 들어, 조직이 얇은있는 주변 지역을 피하는 왼쪽 엽의 중앙에 지속적으로 수집합니다.
- 즉시 액화 질소에 냉동 biopsies를 스냅과 -80에 그들을 저장 ° C를 NMR 분석까지.
소변 microvolume 3 1. H NMR 획득
- D2O (99.8 %), 1 ㎜ 3가 들어있는 산도 7.4의 0.2M 인산 나트륨 버퍼 솔루션을 준비 - (trimethylsilyl) 프로피 온산 - D 4 (TSP).
- 인산 나트륨 완충액 30 μL로 소변을 30 μL를 섞습니다.
- 금속 바늘 (OD 0.5 ㎜)을 갖춘 50 μL 유리 주사기를 사용하여 1.7 mm NMR 모세관 (그림 3 (2))에 혼합 용액 50 μL를 전송합니다. 거품을 피하기 위해주의하십시오.
- 모세관 포함하는 소변 샘플의 상단에있는 모세관 어댑터 (그림 3 (3))에 맞게하고 5mm NMR 프로브 (그림 3 (1))에 2.5 mm의 NMR의 microtube에 넣습니다. 분광 취득 정규 5mm의 NMR 튜브로 튜브의 조합을 사용합니다.
- 그것을 꺼내 부드럽게 모세관 어댑터를 속이고하여 2.5 mm의 NMR 튜브에서 모세를 제거하기 위해 추출로드 (그림 3 (4))를 사용합니다.
4. 간 조직의 1 H 인사 매스 NMR은 생검 : 샘플 준비
- 로터 구성 요소와 도구가 MAS그림 4에 설명되어.
- 삽입 지르코늄 로터에 생검 (15-50 대한 MG) (그림 4 (1)) 및 NMR 잠금에 대한 순수 D 2 O로 볼륨의 나머지 부분을 입력합니다. 이 데이터 수집의 후속 shimming 및 품질의 품질을 변경할 수 있기 때문에 모든 거품을하지 않도록주의한다.
- 원통형 나사 (그림 4 (5))을 사용하여 50 μL 테플론 스페이서 (그림 4 (2))를 넣습니다. 나사가 빠지다 그것을하고 (그림 4 (8)) 짧은 측면에 깊이 게이지를 사용하여 보정합니다. 이 단계에서, 그것의 부분은 스페이서 구멍을 통해 누설 수 있기 때문에 샘플에 대한 구체적인 관심을 지불하는 것이 중요합니다. 이 경우 다음 생검의 일부가 파괴되고 샘플 무게는 더 이상 신뢰할 수 없습니다. 그것은 따라서 처음 샘플의 준비부터 다시 시작하는 것이 필요합니다.
- thead 핀 (그림 4 (3)) 장소 및 드라이버 (그림 4 (6))로 부드럽게 그것을 나사. 조직의 조각으로 잔여 물을 건조.
- 에 캡 (그림 4 (4)) 장소회전자의 상단과 회전자 포장 (그림 4 (6))에 넣습니다. 뚜껑이 곳에 때까지 단단히 누르십시오. 회전자와 뚜껑 사이에 남아있는 공간이 없습니다.
- 광학 스핀 속도 감지를 허용하도록 검은 마커 펜을 사용하여 회전자의 바닥의 절반을 표시합니다.
- NMR 분광계 내부의 회전자를 놓고 5 kHz에서에서 회전 시작합니다. 제조 업체의 지침에 따라 CPMG 펄스 순서 13를 사용하여 1 H NMR 스펙트럼을 취득.
- NMR 스펙트럼을 교정하기 위해 5.22 PPM (이중어)에서 α anomeric 포도당 공진을 사용합니다.
- 날개를 풀고하려면 캡 제거합니다 (그림 4 (9))를 사용하여 뚜껑을 제거하여 진행합니다. 나사가 빠지다 thead 핀과 원통형 나사를 사용하여 제거 테플론 스페이서. 철저하게 물과 세제를 사용하여 씻으십시오.
5. 대표 결과
내장 미생물 활동이 요도 신진 대사 프로파일을 사용하여 모니터링할 수 있습니다. 요도 미생물의 대량1 H NMR에 의해 식별 공동 metabolites은 문학 7,14-17에 설명되어있다. 이러한 미생물 공동 metabolites들은 새로 설립된 생태계가 안정되었을 때 추정하기 위해 신속하고 비침 투 방법을 제공으로 식민지 과정을 모니터에 특히 유용합니다. 그림 5A 명확하게 식민지 과정을 통해 내장 미생물의 공동 metabolites의 모양을 보여줍니다. 이 그림은 동물에 대한 2 단계에서 설명한 절차를 수행하여 얻은 요도 신진 대사 프로필 1 단계에서 설명한 절차를 사용 이십일 식민지 보여줍니다. 이 동물은 indoxyl 황산 나물을하고 phenylacetylglycine (PAG)과 세균이없는 상태에서 P - 크레졸 황산 (매일 0 - 파란색)의 아주 작은 양의하지 않았다. 식민이 진행되는 창자의 microbiota하여 단백질 대사의 이러한 세 마커는 하루에 20 (적색)에서 평형에 도달하는 상당히 향상시킬 수 있습니다. 이것은 PAG를 사용하여 그림 5B에서 그림과 같이 동물의 그룹에 대한 모니터 특히 쉽습니다공명. 이 그림 7 동물의 그룹의 PAG의 특정 공명 (삼인승)에 해당하는 그림 5A에서 회색 (δ 7.40-7.43)에 강조 resonances, 아래 지역을 통합하여 얻은 것입니다.
1 H 고해상도 매직 앵글 스피닝 (HR의 MAS) NMR 분광법은 생검 18 어떤 종류의 대사 프로파일을 빠르고 재현성 인수를 허용하지 않는 파괴적인 기술입니다. 이 프로토콜에서는, 우리는 전 (파란색)과 (적색) 식민지 (그림 6) 후 2 마우스의 간장 대사 프로필을 얻으려면이 강력한 기술을 사용합니다. 이 그림은 잘 NMR 기반의 신진 대사 프로필 MAS에서 파생 될 수있는 정보를 보여줍니다. 수많은 아미노산뿐만 아니라 포도당, 글리코겐, 락테이트, 트리 글리세 리드, (D) - 3 - 하이드 록시 및 nicotinurate 같은 에너지 대사에서 파생된 metabolites는 시각하실 수 있습니다. 이 프로파일은 또한 산화 스트레스 관련 정보 (예 ascorbic 포함되어 있습니다CID, 글루타티온), 뉴클레오 티드 대사 (예 : 이노신, 유리딘)와 methylamine 대사 (즉, 콜린, 트리 메틸 아민 - N - 산화물). 이 예제에서는, 그것은 세균없는 마우스가 거의 글리코겐과 포도당과 트리 글리세 리드가 매우 낮은 금액으로 이전 7로 출판 되었음를 표시하지 않는 매우 분명하다.
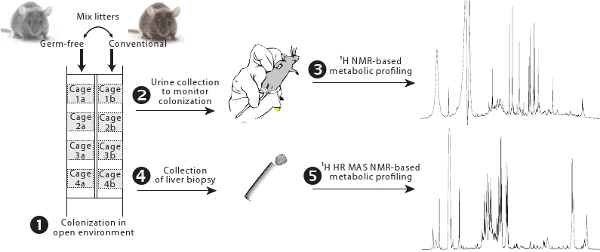
그림 1. 식민 프로토콜의 개요. 세균없는 일반 동물은 측면과 그 새끼는 기존의 내장 microbiota (1)에서 진보적인 식민지를 허용 교환 의해 필터 사이드 갖춘 케이지 안에 보관되어있다. 내장 미생물 활동은 1 H NMR 기반의 신진 대사 프로 파일링 (2-3)를 사용하여 모니터링할 수 있습니다. 간장 대사는 1 H 인사 MAS NMR 기반의 신진 대사 프로 파일링 (4-5)에 의해 평가됩니다.
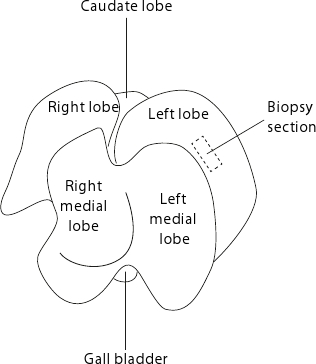
그림 2. 마우스 살고R의 해부학. 간이 같은 장기의 플랫 사이드 테이블을 얼굴로 표시됩니다. 재현성 biopsies 위해, 그것은 언제나처럼 점선 사각형으로 표시된 좌측 엽의 중심에서 샘플을 수집하는 것이 좋습니다.

그림 3 microvolumes 작동하도록 1.7 mm NMR 모세관 키트 키 :.. 1 : 2.5 mm의 NMR의 microtube, 2 : 1.7 mm NMR 모세관, 3 : 모세관 어댑터, 4 추출로드.

. 그림 4 MAS 로터 장비 키 : 1. : MAS의 회전자, 2 : 50 μL 테플론 스페이서, 3 : Thead 핀, 4 : 모자, 5 : 원통형 나사, 6 : 드라이버, 7 : 로터 포장, 8 : 깊이 게이지.
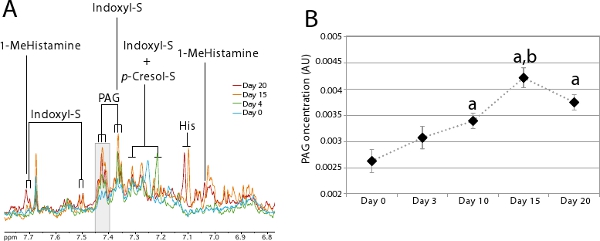
그림 5. colonizatio 동안 요도 신진 대사 프로파일의 진화N.
- 공동 metabolites은 시각 1. H NMR 스펙트럼 수있는 미생물 6.8-7.8 PPM 사이의 스펙트럼의 방향족 지역에 확대는 일 0 단일 개인 (파란색), 4 (녹색), 15 (오렌지) 20에서 파생되었습니다 (적색) 이후 식민지. Indoxyl 황산, 그의 : 히스티딘, P - 크레졸 - S :; : 1 MeHistamine : Indoxyl - S 1 - methylhistamine 회색 영역 B. 키의 다이어그램을 만들기 위해 통합되었습니다 영역에 해당하는 P - 크레졸 황산, PAG : Phenylacetylglycine.
- 식민 기간 동안 평균 PAG 농도 (n은 = 7). 학생의 T - 테스트는 여러 시간 지점에서 PAG 농도의 차이를 비교하는 데 사용되었습니다 : P 일 0으로 비교하여 <0.05, B : P <0.01 하루 10 비교했다.
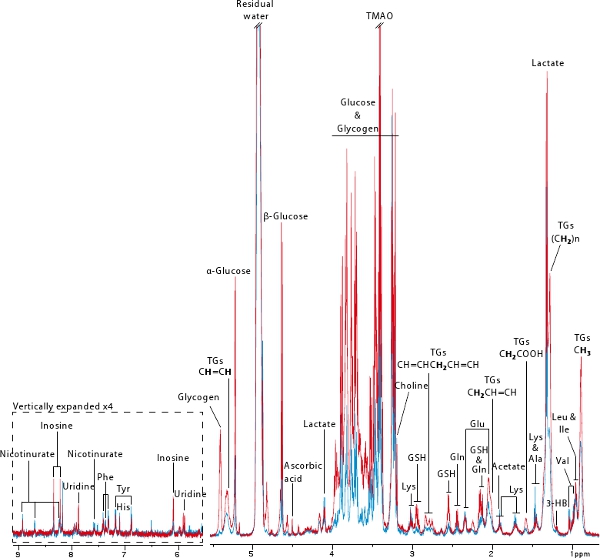
그림 6. 세균 무료 (파란색)과 전 세균 무료 (재에서 파생 간 biopsies의 전형적인 600 MHz의 1 H 인사 MAS NMR의 스펙트럼D) 마우스. 볼드 양자는 트리 글리세 라이드의 공명에 대한 책임은 키 :. 3 - HB : 3 - 하이드 록시, GSH : 감소 글루타티온, TGS : 트리 글리세 리드, TMAO : 트리 메틸 아민 - N - 산화물.
토론
이 프로토콜에서는, 우리는 더 이상 그대로 생검의 1 H 인사 MAS NMR의 프로 파일링에 의해 평가 간장 대사에 내장 microbiota의 영향을 조사하기 위해 열린 환경에서 진보 식민지 절차를 설명했다. 식민의 다양한 방법은 문헌에 설명되어있다. 정의된 microbiota과 동물을 식민지하는 가장 일반적인 방법은 구두 gavage이나 오염된 식수 19,20입니다. 이전 21 설명된대로 방패 접종도 사...
공개
우리는 공개 아무것도 없어.
감사의 말
설명의 예제로 사용된 모든 NMR 스펙트럼은 재정적으로 비벼 대다가 지원되었습니다 이전에 출판 연구 7에서 파생됩니다.
자료
특정 시약 및 장비의 테이블 :
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
|---|---|---|---|
| 2.5 mm의 microtube | 새로운 시대 | NE-H5/2.5-V-Br | |
| 1.7 mm 모세관 | 시그마 - 올드 리치 | NORS175001 | |
| 모세관 어댑터 | 새로운 시대 | NE-325-5/1.7 | |
| 추출로드 | 새로운 시대 | NE - 341-5 | |
| 50 μL와 HR - MAS 로터 BL4 구면 테플론 스페이서 키트 | Bruker | HZ07213 | |
| 50 μL 삽입을위한 도구 키트 | Bruker | B2950 | |
| 사전 III 600MHz의 NMR | Bruker | ||
| 1 H 인사 MAS NMR 견고한 프로브 | Bruker | ||
| 중수소 산화 99.9 % | 시그마 - 올드 리치 | 530867 - 1L | |
| 3 - (trimethylsilyl) 프로피 산성 - D 4 (TSP) | 시그마 - 올드 리치 | 269,913 |
참고문헌
- Cani, P. D., Delzenne, N. M. Gut microflora as a target for energy and metabolic. Curr. Opin. Clin. Nutr. Metab. Care. 10, 729-734 (2007).
- Ley, R. E., Turnbaugh, P. J., Klein, S., Gordon, J. I. Microbial ecology: human gut microbes associated with obesity. Nature. 444, 1022-1023 (2006).
- Raoult, D. Obesity pandemics and the modification of digestive bacterial flora. Eur. J. Clin. Microbiol. Infect. Dis. 27, 631-634 (2008).
- Turnbaugh, P. J., Backhed, F., Fulton, L., Gordon, J. I. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell. Host. Microbe. 3, 213-223 (2008).
- Balcombe, J. P., Barnard, N. D., Sandusky, C. Laboratory routines cause animal stress. Contemp. Top. Lab. Anim. Sci. 43, 42-51 (2004).
- Muyzer, G., Smalla, K. Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology. Antonie van Leeuwenhoek. 73, 127-141 (1998).
- Claus, S. P. Colonization-induced host-gut microbial metabolic interaction. MBio. 2, (2011).
- Waters, N. J. High-resolution magic angle spinning 1H NMR spectroscopy of intact liver and kidney: optimization of sample preparation procedures and biochemical stability of tissue during spectral acquisition. Anal. Biochem. 282, 16-23 (2000).
- Bollard, M. E. High-resolution 1H and 1H-13C magic angle spinning NMR spectroscopy of rat liver. Magnetic resonance in medicine. 44, 201-207 (2000).
- Lindon, J. C., Holmes, E., Nicholson, J. Pattern recognition methods and applications in biomedical magnetic resonance. Progress in Nuclear Magnetic Resonance Spectroscopy. 39, 1-40 (2001).
- Tate, A. R. Distinction between normal and renal cell carcinoma kidney cortical biopsy samples using pattern recognition of (1)H magic angle spinning (MAS) NMR spectra. NMR. Biomed. 13, 64-71 (2000).
- Wang, Y. Topographical variation in metabolic signatures of human gastrointestinal biopsies revealed by high-resolution magic-angle spinning 1H NMR spectroscopy. Journal of Proteome Research. 6, 3944-3951 (2007).
- Meiboom, S., Gill, D. Modified spin-echo method for measuring nuclear relaxation times. The review of scientific instruments. 29, 688-691 (1958).
- Nicholson, J. K., Holmes, E., Wilson, I. D. Gut microorganisms, mammalian metabolism and personalized health care. Nat. Rev. Microbiol. 3, 431-438 (2005).
- Martin, F. P. Effects of probiotic Lactobacillus paracasei treatment on the host gut tissue metabolic profiles probed via magic-angle-spinning NMR spectroscopy. Journal of Proteome Research. 6, 1471-1481 (2007).
- Swann, J. R. Variation in Antibiotic-Induced Microbial Recolonization Impacts on the Host Metabolic Phenotypes of Rats. J. Proteome. Res. , (2011).
- Jacobs, D. M., Gaudier, E., van Duynhoven, J., Vaughan, E. E. Non-digestible food ingredients, colonic microbiota and the impact on gut health and immunity: a role for metabolomics. Curr. Drug. Metab. 10, 41-54 (2009).
- Beckonert, O. High-resolution magic-angle-spinning NMR spectroscopy for metabolic profiling of intact tissues. Nat. Protoc. 5, 1019-1032 (2010).
- Hooper, L. V., Sansonetti, P., Zychlinsky, A. . Methods in microbiology. 31, 559-589 (2002).
- Rahija, R. J., Fox, J. G. Ch. 7. The mouse in biomedical research. , 217-234 (2007).
- Goodwin, B. L., Ruthven, C. R., Sandler, M. Gut flora and the origin of some urinary aromatic phenolic compounds. Biochemical Pharmacology. 47, 2294-2297 (1994).
- Koopman, J. P. 'Normalization' of germfree mice after direct and indirect contact with mice having a 'normal' intestinal microflora. Lab Anim. 20, 286-290 (1986).
- Nishikata, N., Shikata, N., Kimura, Y., Noguchi, Y. Dietary lipid-dependent regulation of de novo lipogenesis and lipid partitioning by ketogenic essential amino acids in mice. Nutrition and Diabetes. 1, 1-12 (2011).
- Spagou, K. A GC-MS metabolic profiling study of plasma samples from mice on low- and high-fat diets. J. Chromatogr. B. Analyt. Technol. Biomed. Life. Sci. 879, 1467-1475 (2011).
- Sanchez-Patan, F., Monagas, M., Moreno-Arribas, M. V., Bartolome, B. Determination of microbial phenolic acids in human faeces by UPLC-ESI-TQ MS. J. Agric. Food. Chem. 59, 2241-2247 (2011).
- Roux, A., Lison, D., Junot, C., Heilier, J. F. Applications of liquid chromatography coupled to mass spectrometry-based metabolomics in clinical chemistry and toxicology: A review. Clin. Biochem. 44, 119-135 (2011).
- Ryan, D., Robards, K., Prenzler, P. D., Kendall, M. Recent and potential developments in the analysis of urine: a review. Anal. Chim. Acta. 684, 8-20 (2011).
- Nagayama, K., Wuthrich, K., Bachmann, P., Ernst, R. R. Two-dimensional J-resolved 1H n.m.r. spectroscopy for studies of biological macromolecules. Biochem. Biophys. Res. Commun. 78, 99-105 (1977).
- Aue, W. P., Bartholdi, E., Ernst, R. R. Two-dimensional spectroscopy. Application to nuclear magnetic resonance. J. Chem. Phys. 64, 2229-2246 (1975).
- Bodenhausen, G., Ruben, D. J. Natural abundance 15N NMR by enhanced heteronuclear spectroscopy. Chemical. Physics. Letters. 69, 185-189 (1980).
- Fan, T. W. -. M. Metabolite profiling by one- and two-dimensional NMR analysis of complex mixtures. Progress in nuclear magnetic resonance spectroscopy. 28, 161-219 (1996).
- Fan, T., Lane, A. Structure-based profiling of metabolites and isotopomers by NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 52, 48-48 (2008).
- Fonville, J. M. The evolution of partial least squares models and related chemometric approaches in metabonomics and metabolic phenotyping. Journal of Chemometrics. 24, 636-649 (2010).
- Merrifield, C. A. A metabolic system-wide characterisation of the pig: a model for human physiology. Mol. Biosyst. , (2011).
- Tugnoli, V. Molecular characterization of human gastric mucosa by HR-MAS magnetic resonance spectroscopy. International Journal of Molecular Medicine. 14, 1065-1071 (2004).
- Sitter, B. Comparison of HR MAS MR spectroscopic profiles of breast cancer tissue with clinical parameters. NMR Biomed. 19, 30-40 (2006).
- Beckonert, O. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat. Protoc. 2, 2692-2703 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유