Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek hücreli Analizi Bacillus subtilis Biyofilmler
Bu Makalede
Özet
Mikrobiyal biyofilmler genellikle özel hücreler farklı subpopülasyonunun oluşturduğu edilir. Bu alt popülasyonlarının Tek hücreli analizi floresan gazetecilere kullanımını gerektirir. Burada birkaç subpopulationswithin görselleştirmek ve izlemek için bir protokol tarif B. subtilis Floresan mikroskobu ve akım sitometri kullanarak biyofilm.
Özet
Biyofilm oluşumu hemen hemen tüm bakterileri 1-6 genel bir niteliktir. Bakteriler biyofilmler oluştururlar, hücreler çoğunlukla 7-10 diğer faktörler arasında proteinler ve ekzopolisakkarit tarafından oluşturulmuştur hücre dışı matris içinde kaplı vardır. Mikrobiyal topluluk genellikle 11-17 özel hücreler farklı subpopülasyonu farklılaşması gösterir biyofilm içinde kaplı. Bu subpopülasyonunun arada ve genellikle 18-21 biyofilm içinde zamansal ve mekansal organizasyonu gösterir.
Model organizma Bacillus subtilis Biyofilm oluşumu özel hücreler farklı alt popülasyonlarının farklılaşmayı gerektirir. Bunlar arasında, biyofilm hücre dışı matriks üretmek ve salgılamak sorumlu matriks üreticileri, en subpopülasyonu 11,19 biyofilm oluşumu için gereklidir. Bu nedenle, matris üreticilerinin farklılaşması B. biyofilm oluşumu hallmark subtilis.
Biz B. Biyofilmlererde matris üreticilerin subpopülasyonu görselleştirmek ve ölçmek için floresan gazetecilere kullanmış subtilis 15,19,22-24. Somut olarak, bu matris üreticilerinin subpopülasyonu kendi ürettiği ekstraselüler sinyal surfactin 25 varlığında karşılık olarak ayırt olduğu araştırmacılar tarafından gözlenmiştir. İlginç bir şekilde, surfactin matris üreticileri 15 subpopülasyonu farklı özelleşmiş hücre bir alt tarafından üretilir.
Bu raporu B. subtilis biyofilmler içinde matrisi üretici ve surfactin üreticilerin subpopülasyonu görselleştirmek ve ölçmek için gerekli teknik yaklaşım ayrıntılı var. Bunu yapmak için, matris üretimi ve surfactin üretimi için gerekli olan genlerin flüoresan gazetecilere B'nin kromozom içine sokulur subtilis. Reporters sadece özel bir hücre subpopülasyonu cinsinden ifade edilmiştir. Daha sonra, alt popülasyonlar olabilirfloresan mikroskobu ve akım sitometri (Şekil 1'e bakınız) kullanılarak izlenir.
Özel hücrelerin farklı alt popülasyonlarda bakterilerin çok hücreli topluluklar içinde bir arada olması, bize Prokaryotlarda gen ifadesinin düzenlenmesinde hakkında farklı bir bakış açısı kazandırır. Bu protokol deneysel olarak bu fenomeni adresleri ve kolay bir mikrobiyal topluluk içinde fenotipik heterojenite altında yatan moleküler mekanizmaları aydınlatmak için, başka herhangi bir çalışma modeline adapte edilebilir.
Protokol
1. Etiketleme B. subtilis ve Biyofilm Oluşumu Deneyi
- PCR ile, ilgilenilen geni promoter bölgesi amplifiye. Bu örnek olarak P tapa, Tasa matriks proteini 26 üretimi sorumlu genlerin klonlanması arttırıcının göstermektedir. Pkm008 vektör (Özlü laboratuar, Harvard Tıp Okulu. Boston, ABD tarafından yaratılmış) içine Clone P tapa (Şekil 2).
- Enzimatik sindirimi (Enzyme önerilen, XhoI) ile plazmit doğrusallaştırmak.
- B. doğal yetkinlik neden subtilis, daha önce tarif Harwood tek adımlı protokolü takip eden ve 27 keserek 168 süzülür.
- Yetenekli hücrelerin kültürüne doğrusallaştırılmış plazmid ekleyin ve inkübasyon iki saat sonra spectinomycin direniş için seçin.
- Elde Suşlarının B. nötr amyE odağı haline yapı taktınız çift rekombinasyon tarafından subtilis (Şekil 4). Oluşturmak içinBir çift-etiketli suşu, bu şekil 3'de ortaya plazmid pDR183 kullanılarak nötr odağına Laca içine ikinci bir raportör entegre. Bu pKM008 içinde klonlanmış Muhabirlerin yerleştirilmesi için yukarıda açıklanan aynı teknik kullanılarak, bu raportör yerleştirin.
- Biyofilm oluşturan yapabiliyor NCIB3610 süzün 168 muhabir aktarın. SPP1 faj iletim protokolü 28,29 kullanın. TY ortamda donör suşu (LB +10 mM MgSO 4 +10 uM MnSO 4) Grow. Faj stok seyreltme 100 ul kültürünün 200 ul karıştırın. Inkübasyon 30 dakika sonra yumuşak agar 3 ml ekleyin ve faj haleler 37 ortaya izin ° C
- Yumuşak agar toplayın. O Santrifüj ve supernatant geçmesi bir şırınga 0.22 mikron filtre düşündüm. TY ortamda yetiştirilen alıcı suşu bir kültür bulaştırmak için bu süpernatant kullanın. 30 ul 10 kültürü seyreltilmiş 1:10 arasında ml ilave edilir. 30 dakika inkübe ve inkübasyon 24 saat sonra antibiyotik direnci için seçin.
- Se37 bir dosyayı içeren bir koloni ve LB gecede büyümek ° C
- % 1.5 agar 30 MSgg katı biyofilm uyaran ortamda gecede kültür 3 uL Nokta. Hücreler 30 ° C (Şekil 3) 72 saat boyunca büyümeye olanak sağlar. Büyüme Üç gün sonra, MSgg agar yüzeyi üzerinde oluşturulmuş biyofilmlerde agar yüzeyinde bir kompleks morfolojik mimarisini geliştirmiştir.
2. Biyofilm Dispersiyon ve Hücre Sabitleme
- Biyofilm şeklinde bir kürdan veya cımbız kullanarak MSgg agar yüzeyine çıkarın. Biyofilm tutarlılığı size tek parça agar yüzeyinden soyma kapalı izin vermelidir.
- PBS tamponu 3 ml biyofilm yerleştirin ve bir pipet veya iğne yoluyla tekrarlanan geçişi ile biyofilm dağıttı. Alternatif olarak, biyofilm dispersiyon hafif sonikasyon kullanılarak yapılabilir. Hafif sonikasyon bir 3 çıktı ve 0.7 saniye genliği 12 darbe gerektirir.
- Numuneler hücre tek analiz Fix. ResuspenTam olarak, yedi dakika için oda sıcaklığında 4% paraformaldehit çözeltisi ve inkübe 1 ml hücre süspansiyonu d 300 uL.
4% paraformaldehit eriyiğinin bileşimi:
Paraformaldehitten 2 g
PBS tampon 50 ml
4 ul 10 N NaOH
0,22 um bir alikot filtre ve yoluyla çözeltisi süzmek - PBS tamponu fiksasyon üç kez yıkayın ve sonra hücreler PBS tamponu 300 uL onları tekrar süspansiyon.
3. Floresans Mikroskopi
- Bir mikroskop lamı üzerinde% 0.8 agaroz 200 uL dökün ve dikkatli bir slayt ile örtün. Alt slayt bağlı agaroz bir tabaka elde etmek için 2 dakika sonra usulca üst slayt çıkarın.
- Nokta 2 agaroz tabakanın yüzeyi üzerinde sabit bir hücre uL ve bir mikroskop cam kapak ile birlikte kapsar.
- Floresans mikroskobu Örnek yerleştirin. Biz bir Leica CRT6000 iIluminat ile donatılmış bir Floresans mikroskop Leica DMI6000B kullanınsistemi iyon. BP500/20, Em: YFP için filtre Ex olan BP535/30 ve CFP Ex şunlardır: BP426/20, Em: 480/40
- Numunenin Açığa 50-200 ms arasında bir uyarma floresan. Deney için seçilen koşullar herhangi bir floresans gösteren bir negatif kontrol göre eksitasyon süresi ayarlanır.
- Parlak alan ile elde edilen aynı görüntü floresan görüntü bakın. Bir resimde iki görüntü birleştirme. Sonuçlar P tapa-YFP Şekil 6 'da reporter temsil edilirler barındıran bir tek-etiketli suşu kullanılarak akış floresans mikroskobu elde edilmiştir.
4. Akım Sitometri Kullanımı Tek Hücreli Kantitasyonu
- Hafif sonikasyon kullanarak sabit hücre örneği Dispers. Hücre erimesi neden olmadan tek hücrelere kümeleri dağıtmak için, bir 5 çıktı ve 0.7 saniye genliği ile 12 bakliyat 2 serisi performans örnek sonikasyon. Işık mikroskobu ile hücre dağılımı verimliliği onaylayın.
- Sitometresi analizi önce PBS tamponu örnek 1:100 sulandırınız. Biz bir akış sitometresi BD FACS Canto II kullanın. YFP floresan için, 530/30 filtre ile birleştiğinde 488 nm dalga boyunda lazer uyarma kullanın. CFP floresans, bir 408/40 filtresi ile birleştiğinde 405 nm'de lazer eksitasyon kullanabilir.
- Iki negatif kontroller ile akış sitometresi makine kalibre. Süspansiyon hiçbir hücreler PBS ile tampon A örneği akış sitometresi ile duyulana partikül boyutu için negatif kontrol olarak hizmet olmalıdır. Hiçbir floresan muhabiri etiketli örnek bir akış sitometresinin floresans duyarlılığı için negatif kontrol olarak hizmet edilmelidir.
- Akış sitometresi içinde flüoresan raportör etiketli Örnek yerleştirin. Her numune için, saniyede 300 ile 3000 olayları arasında bir akış hızı ile en az 50.000 olayları analiz.
- FACS Diva yazılımı (BD Biosciences) kullanarak veri yakalama ve FlowJo 8.5.2 yazılımı kullanarak bunları analiz. Gösteriyor ki kontrol için floresan sinyalleri bakınyok floresans.
- İki eksenli grafik bir tek etiketli suşu floresans sinyal izleme verileri sunmak. X ekseni ve Y eksen floresans farklı seviyelerde ifade eden hücrelerin sayısı tespit floresans sinyali çizilir. Sonuçlar P tapa-YFP şekil 8'de temsil muhabiri barındıran tek etiketli suşu kullanılarak flow sitometri analizi ile elde.
- Üç eksenli grafik bir çift etiketli suşu floresans sinyal izleme verileri sunmak. X ve Y ekseni (örneğin, GFP Y ekseni olarak X-eksenine ve CFP ölçülen olacaktır) takip kanalların her birinin floresans sinyali çizilir. Z-eksenine plot her bir raportör ve kağıt düzlem (Şekil 9 ve 10) dik olacak konturu izohatlar olarak eksprese eden hücrelerin sayısı.
4. Temsilcisi Sonuçlar
Zaman B. subtilis b bir plaka üzerinde büyüriofilm tetikleyen orta MSgg, biyofilm oluşumu 30 ° C 30 inkübasyon üç gün sonra görülür. Biyofilm güçlü tutarlılık gösteren ve bu tek parça agar yüzeyinden soyulmuş olabilir. Dahası, belirgin biyofilm katılan hücre alt (Şekil 5) bir göstergesidir karmaşık bir morfolojik mimarisini göstermektedir. Örneğin, koloninin yüzeyinde kırışıklık oluşumunda biyofilmler sonuçlar hücredışı matrisin üretimi. Bu özellik matriks üreticileri 19 subpopülasyonu farklılaşması ile korele edilebilir. Sporların, bu yapıların 30 apikal alanda beri lokalize Benzer şekilde, biyofilm yüzeyinde hava yapıların yaratma, sporlanan hücrelerin bir alt varlığında bir göstergesidir.
Bir tek etiketli ve floresan mikroskobu kullanarak bir çift etiketli olan gerginlik r hücre farklılaşmasının görselleştirme örneklerisırası ile, Şekil 6 ve 7'de epresented. Tek-etiketli suşu flüoresan raportör barındıran matris üreten hücrelerin subpopülasyonu olarak ifade edilir P tapa-CFP. Bu subpopülasyonu biyofilm (Şekil 6) oluşturan hücre dışı matriks üretmek ve salgılamak sorumludur. Çift etiketli suşu muhabiri barındıran P tapa-CFP 26 ve ek muhabiri P srfAA-YFP 31. Bu ikinci muhabiri matris üreticilerin farklılaşma (Şekil 7) sinyal basamaklarını tetikler sinyal molekülü surfactin salgılamaya sorumlu hücrelerin subpopülasyonu izlemenizi sağlar. Surfactin üreticilerin subpopülasyonu sarı renkli yanlış ise matris üreticilerin subpopülasyonu mavi renkli yanlıştır.
Muhabir P tapa-YFP Şekil 8'de sunulmaktadır barındıran tek etiketli suşu kullanılarak flow sitometri analizi. Tedavi edilmeyen kontrol susu barındıran değilHerhangi bir floresan protein genleri tek bir nüfusu düşük bağıl floresans gösterdi. Olmayan biyofilm uyaran koşullarda P tapa-YFP barındıran Hücreleri matris üreticilerin subpopülasyonu ayırt etmedi ve bütün nüfusun düşük bağıl floresans gösterdi. Biyofilm tetikleyen durumda, yüksek nisbi floresan hücrelerin bir alt düşük bağıl floresan tepe noktasında 23 sağında bir omuz olarak gözlenen, oluştu.
Bir çift-etiketli suşu akış sitometresi kullanılarak analizinden elde edilen sonuçlar Şekil 9 ve 10'da temsil edilir. Şekil 9 çift etiketli suşu P tapa-CFP, P srfAA-YFP kullanarak matrisi üretici ve surfactin üreticilerin subpopülasyonunun izlenir. Arkaplan floresan kontrolü olarak biz herhangi bir floresan protein genleri barındıran olmayan bir suş kullanılmıştır. Sonra, tek etiketli suşu kullanarak her floresan kanal matrisi üretici ve surfactin üreticilerin her subpopülasyonu tespit kontrol olarak s. Çift etiketli suşu P tapa-CFP, P srfAA-YFP floresan gazetecilere yüksek düzeyde eksprese eden hücrelerin iki subpopülasyonunun gösterdi. Her nüfus özel hücreler 15 iki alt popülasyonlar arasındaki gazetecilere ifadesi hiçbir örtüşme olduğunu gösteren çerçeveli. Çift etiketli kullanarak Benzer şekilde, akım sitometri analizi suşu P skf-YFP, P tapa-YFP rakam 10 sunulmuştur. Geni skf için reportör matris üreticileri 24 subpopülasyonu ile koordineli ayırt etmek için tarif edilmiştir yamyamlar 32, bir subpopülasyonu farklılaşmasını izler. Bu durumda, çift-etiketli suşu YFP ve CFP hem de ifade flöresanlı hücre tek bir subpopülasyonu gösterdi. Bu iki hücre farklılaşması yollarının koordineli aynı subpopülasyonu aktive olduğunu göstermiştir.
"1.jpg />
Şekil 1.. Deney genel şeması. Protokolü üç ana adımda ayrılır. Birinci adımda B'nin suşu etiketlenmesi gerektirir ilgi subpopülasyonu izler muhabiri füzyon subtilis. İkincisi, biyofilm uyaran koşulları etiketli suşları büyür. Üçüncü olarak, biyofilm dağıtmak ve floresan mikroskobu ve akım sitometri kullanarak nüfusun tek hücreli analizi yürütmek.

Şekil 2. Entegrasyon vektör pKM008 şematik gösterimi. Bu vektör çift rekombinasyon tarafından nötr odağı amyE içine ilgi muhabiri füzyon bütünleştirir. Ilgi (P tapa) ile promotör EcoRI sınırlama sitelerini ve HindIII kullanılarak vektörüne klonlanır. Sonra, CFP genin ekspresyonu promotör P tapa kontrolü altındadır. Orientatplazmid içinde genlerin iyon bir ok olarak temsil edilir.
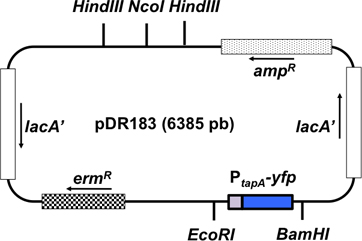
Şekil 3. Entegrasyon vektör pDR183 şematik gösterimi. Bu vektör çift rekombinasyon tarafından nötr odağı Laca içine ilgi muhabiri füzyon bütünleştirir. Ilgi (P tapa - CFP) arasında füzyon EcoRI sınırlama sitelerini ve BamHI ile vektörüne klonlanır. Plazmid içinde genlerin yönelimi bir ok olarak temsil edilir.

Şekil 4. B. kromozom içine gazetecilere entegrasyon şeması çift rekombinasyon tarafından subtilis. (A) B. subtilis kromozom biyofilm gelişimini etkilemeden muhabiri füzyonları bütünleştirmek için iki nötr lokusları, amyE ve Laca sahiptir. (B) Süreci Lüks. Doğrusallaştırılmış plazmid B. genomunun içine entegre çift rekombinasyon tarafından subtilis. Muhabiri füzyon istikrarlı bir şekilde nötr lokus entegre.

Şekil 5. B. biyofilm suşu B. subtilis bioflm oluşumu NCIB3610. Proses subtilis NCIB 3610 30 az üç gün boyunca biyofilm uyaran orta MSgg büyüyen ° C Biyofilm gelişmesi Sıralı resimleri 12 saatte çekildi.

6 Şekil. Floresan mikroskop altında matriks üreticilerin subpopülasyonu Görselleştirilmesi. B. bir biyofilm gelen bir örnek subtilis P tapa - metreden parmak sayma floresan mikroskop altında sabit ve incelenmiştir. Floresans 200 mseksitasyon hücrelerinin geri kalanından daha yüksek floresans yayan hücrelerin bir alt kanıtlandığı. Bu matris üreten hücrelerin subpopülasyonu olarak kabul subpopülasyonu. Ölçek bar 3 mikron olduğunu.
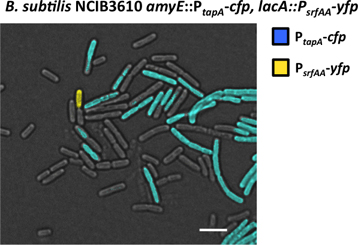
Şekil 7. Floresan mikroskop altında matrisi üretici ve surfactin üreticilerin subpopülasyonu Görselleştirilmesi. B. bir biyofilm örnek subtilis P tapa-metreden parmak sayma, P srfAA-YFP çift etiketli zorlanma tespit ve floresan mikroskop altında incelendi. Hücrelerin geri kalanından daha yüksek floresans yayan hücre 250 ms kanıtladığı iki alt popülasyonlarının Pozlama süresi. Bir subpopülasyonu YFP ifade ve münhasıran YFP kanal (sarı renkli yanlış) ile tespit edildi. Bu surfactin üreticilerin alt nüfusudur. Başka subpopülasyonu CFP ifade ve münhasıran OBP chann ile tespit edildi El. Bu matris üreticilerin alt nüfusudur. Ölçek bar 3 mikron olduğunu.
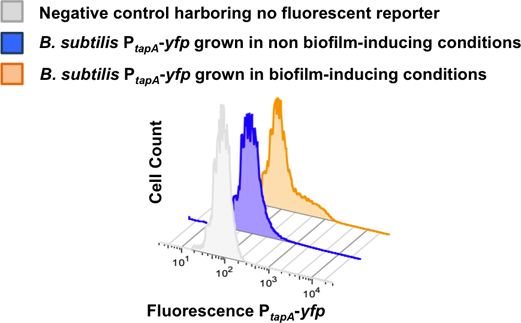
Şekil 8. 2-B akım sitometri. Kullanarak matris üreticilerin subpopülasyonu Kantitasyonu B. bir biyofilm hücreleri Dağınık subtilis P tapa-YFP akım sitometri ile takip edildi. Akış sitometresi 50.000 olaylar sayılır ve her olay için floresan sinyal izlendi. YFP sinyal yoğunluğu X ekseni çizilir iken sayılır hücre sayısı Y ekseni çizilir. Hücre dışı biyofilm uyaran koşulları elde etmek için LB ortamda yetiştirildi. Hücreler biyofilm uyaran koşulları elde etmek için orta MSgg yetiştirildi. Matris üreticilerin subpopülasyonu sadece biyofilm uyaran koşullarda farklılaştırır. Bu rakam López ark uyarlanmıştır., PNAS (2009) 106 :280-285.
s/ftp_upload/3796/3796fig9.jpg "/>
Şekil 9. 3-D akış sitometresi kullanılarak matris üretici ve surfactin üreticilerinin subpopülasyonu Kantitasyonu. Izlenir kanalların Floresans sinyali X ekseni (YFP için) ve Y ekseni (CFP için) 'de verilmiştir. Z-eksenine her reporter eksprese eden hücrelerin sayısını ölçer ve konturu izohatlar kağıt düzlemine dik olarak ölçülür. Bu deneyde kontrol olayların sayısı 50,000 olaylardı. Sol üst panel hiçbir floresan protein genleri barındıran eşiğe bir kontrol sunuyor. Sağ üst panel tek etiketli suşu P srfAA-YFP kullanarak YFP floresans kanal (sarı çerçeveli) içinde surfactin üreticilerin subpopülasyonu algılar. Sol alt panel tek etiketli suşu P tapa-CFP kullanarak OBP floresans kanal (mavi çerçeveli) matris üreticilerin subpopülasyonu algılar. Çift etiketli suşu P tapa </ Em>-CFP, P srfAA-YFP sağ alt panelde izlenir. Bu sarı ve mavi çerçeveli iki subpopülasyonunun gösterdi. Bu rakam López ark uyarlanmıştır., Genler ve Gelişim (2009) 23 :1631-1638.
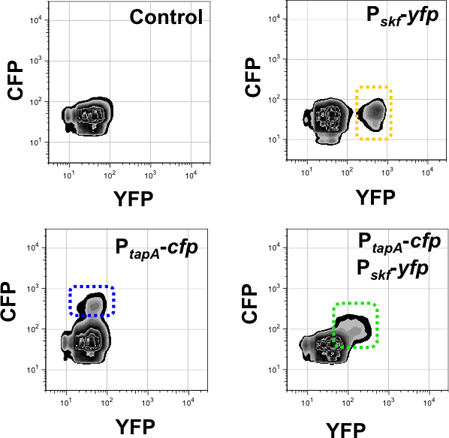
10 Şekil. Matris üretici ve 3-D akış sitometresi kullanılarak yamyamız subpopülasyonu Kantitasyonu. Izlenir kanalların Floresans sinyali X ekseni (YFP için) ve Y ekseni (CFP için) 'de verilmiştir. Bu deneyde kontrol olayların sayısı 50,000 idi. Sağ üst panel tek etiketli suşu P skf-YFP içinde YFP floresans kanal (sarı çerçeveli) içinde yamyamız subpopülasyonu algılar. Sol alt panel tek etiketli suşu P tapa-CFP içinde OBP floresans kanal (mavi çerçeveli) matris üreticilerin subpopülasyonu algılar. Double etiketli suşu P tapa-CFP, P skf-YFP X ve Y eksenleri (yeşil çerçeveli) için çapraz hücrelerin sadece bir alt gruptaki gösterdi. Aynı anda iki muhabir ifade Çünkü subpopülasyonu YFP ve CFP kanal tespit edilir. Lopez ve ark., Genes and Development (2009) 23 :1631-1638.
Tartışmalar
Bakteri toplulukları genler delillerin mikrobiyal topluluklar 33,34 karmaşıklığı belirli ifade hücrelerin subpopülasyonunun gösteriyor olması. Bu protokol ilgi herhangi bir gen ekspresyonu mikrobiyal toplum içinde özel hücreler belli bir subpopülasyonu kısıtlı olup olmadığını belirlemek için yardımcı olmalıdır. Geleneksel yöntemlerin bütün mikrobiyal topluluk ve mikrobiyal toplum içinde gen ekspresyon dalgalanmalara gen ekspresyonu veya mikroarray analizi oranı gen ekspresyonu d...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma, Würzburg Üniversitesi Enfeksiyon Hastalıkları Araştırma Merkezi (ZINF) gelen, Genç Araştırmacı Araştırma Programı tarafından finanse edilmektedir. Juan C Garcia-Betancur Würzburg Üniversitesi Yaşam Bilimleri Enstitüsü (GSLS) bir doktora üyesidir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Teknik | Reaktif Adı | Şirket | Katalog numarası |
| Kompozisyon MSgg | 5 mM potasyum fosfat | Roth | 6878 |
| 100mM MOPS | Sigma-Aldrich | M1254 | |
| Magnezyum klorür 2mm | Roth | 2189.1 | |
| Kalsiyum klorür 700μM | Roth | A119.1 | |
| Demir klorür 50μM | Sigma-Aldrich | 157740 | |
| Çinko klorid 1 mikrona | ¸ | A2076 | |
| Tiamin 2μM | Sigma-Aldrich | 74625 | |
| Gliserol% 0.5 | Roth | 7533 | |
| Glutadostum% 0.5 | Sigma-Aldrich | 49621 | |
| Triptofan 50μg/ml | Sigma-Aldrich | T0254 | |
| Fenilalanin 50μg/ml | Sigma-Aldrich | P2126 | |
| Hücre fiksasyon | Paraformaldehyde | Roth | 0335 |
| Ekipman Adı | Şirket | Katalog numarası | |
| Sonikasyon | Hücre Sonicator | Bandelin | D-1000 |
| Floresans Mikroskopi | Floresan Mikroskop | Leica | DMI6000B |
| Yazılım Adı | Şirket | Katalog Numarası | |
| Floresans Mikroskopi | Asaf | Leica | |
| Flow sitometri | FCASDiva | BD | |
| Flow sitometri | FlowJo | Treestar |
Referanslar
- Costerton, J. W. Overview of microbial biofilms. J. Ind. Microbiol. 15, 137-140 (1995).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiol. Mol. Biol. Rev. 64, 847-867 (2000).
- Kolenbrander, P. E. Oral microbial communities: biofilms, interactions, and genetic systems. Annu. Rev. Microbiol. 54, 413-437 (2000).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerg. Infect. Dis. 8, 881-890 (2002).
- Lopez, D., Vlamakis, H., Kolter, R. Biofilms. Cold Spring Harb. Perspect. Biol. 2, a000398-a000398 (2010).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Latasa, C., Solano, C., Penades, J. R., Lasa, I. Biofilm-associated proteins. C. R. Biol. 329, 849-857 (2006).
- O'Gara, J. P. ica and beyond: biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus. FEMS Microbiol Lett. 270, 179-188 (2007).
- Chai, Y., Chu, F., Kolter, R., Losick, R. Bistability and biofilm formation in Bacillus subtilis. Mol. Microbiol. 67, 254-263 (2008).
- Chen, R., Guttenplan, S. B., Blair, K. M., Kearns, D. B. Role of the sigmaD-dependent autolysins in Bacillus subtilis population heterogeneity. J. Bacteriol. 191, 5775-5784 (2009).
- Guttenplan, S. B., Blair, K. M., Kearns, D. B. The EpsE flagellar clutch is bifunctional and synergizes with EPS biosynthesis to promote Bacillus subtilis biofilm formation. PLoS Genet. 6, e1001243-e1001243 (2010).
- Kearns, D. B., Losick, R. Cell population heterogeneity during growth of Bacillus subtilis. Genes Dev. 19, 3083-3094 (2005).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Paracrine signaling in a bacterium. Genes Dev. 23, 1631-1638 (2009).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Jongbloed, J. D., Kuipers, O. P. Visualization of differential gene expression by improved cyan fluorescent protein and yellow fluorescent protein production in Bacillus subtilis. Appl. Environ. Microbiol. 70, 6809-6815 (2004).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Kuipers, O. P. Single cell analysis of gene expression patterns of competence development and initiation of sporulation in Bacillus subtilis grown on chemically defined media. J. Appl. Microbiol. 101, 531-541 (2006).
- Veening, J. W., Kuipers, O. P., Brul, S., Hellingwerf, K. J., Kort, R. Effects of phosphorelay perturbations on architecture, sporulation, and spore resistance in biofilms of Bacillus subtilis. J. Bacteriol. 188, 3099-3109 (2006).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Stewart, P. S., Franklin, M. J. Physiological heterogeneity in biofilms. Nat. Rev. Microbiol. 6, 199-210 (2008).
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev. Microbiol. 62, 193-210 (2008).
- Aguilar, C., Vlamakis, H., Guzman, A., Losick, R., Kolter, R. KinD is a checkpoint protein linking spore formation to extracellular-matrix production in Bacillus subtilis biofilms. MBio. 1, (2010).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Cannibalism enhances biofilm development in Bacillus subtilis. Mol. Microbiol. 74, 609-618 (2009).
- Arima, K., Kakinuma, A., Tamura, G. Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation. Biochem. Biophys. Res. Commun. 31, 488-494 (1968).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol. Microbiol. 80, 1155-1168 (2011).
- Hardwood, C. R., Cutting, S. M. . Molecular Biological Methods for Bacillus. , (1990).
- Novick, R. P. Genetic systems in staphylococci. Methods Enzymol. 204, 587-636 (1991).
- Yasbin, R. E., Young, F. E. Transduction in Bacillus subtilis by bacteriophage SPP1. J. Virol. 14, 1343-1348 (1974).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Nakano, M. M. srfA is an operon required for surfactin production, competence development, and efficient sporulation in Bacillus subtilis. J. Bacteriol. 173, 1770-1778 (1991).
- Gonzalez-Pastor, J. E., Hobbs, E. C., Losick, R. Cannibalism by sporulating bacteria. Science. 301, 510-513 (2003).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr. Opin. Microbiol. 10, 638-643 (2007).
- Shapiro, J. A. Thinking about bacterial populations as multicellular organisms. Annu. Rev. Microbiol. 52, 81-104 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır