Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyse unicellulaire des Les biofilms par microscopie à fluorescence et cytométrie de flux
Dans cet article
Résumé
Biofilms microbiens sont généralement constitués par des sous-populations distinctes de cellules spécialisées. Analyse unicellulaire de ces sous-populations nécessite l'utilisation de reporters fluorescents. Nous décrivons ici un protocole de visualiser et de contrôler plusieurs subpopulationswithin B. subtilis Biofilms en utilisant la microscopie par fluorescence et la cytométrie en flux.
Résumé
La formation du biofilm est un attribut général à presque tous les 1-6 bactéries. Lorsque les bactéries forment des biofilms, les cellules sont enfermés dans la matrice extracellulaire qui est le plus souvent constitué par les protéines et les exopolysaccharides, entre autres facteurs 7-10. La communauté microbienne enfermé au sein du biofilm se montre souvent la différenciation des sous-populations distinctes de cellules spécialisées 11-17. Ces sous-populations coexistent et font souvent preuve d'organisation spatiale et temporelle au sein du biofilm 18-21.
La formation du biofilm dans les modèle Bacillus subtilis organisme exige la différenciation des sous-populations distinctes de cellules spécialisées. Parmi eux, la sous-population des producteurs de la matrice, responsable de produire et de sécréter la matrice extracellulaire du biofilm est essentiel pour la formation de biofilm 11,19. Ainsi, la différenciation des producteurs de la matrice est une caractéristique de la formation de biofilms dans B. subtilis.
Nous avons utilisé des reporters fluorescents de visualiser et de quantifier la sous-population des producteurs de la matrice dans les biofilms de B. subtilis 15,19,22-24. Concrètement, nous avons observé que la sous-population des producteurs de la matrice différencie en réponse à la présence d'auto-produit un signal extracellulaire surfactine 25. Intéressant, surfactine est produit par une sous-population de cellules spécialisées différentes de la sous-population de producteurs de matrice de 15.
Nous avons détaillé dans le présent rapport l'approche technique nécessaire pour visualiser et de quantifier la sous-population des producteurs de la matrice et les producteurs dans les biofilms surfactine de B. subtilis. Pour ce faire, les journalistes fluorescents de gènes nécessaires à la production de la matrice et de la production surfactine sont insérés dans le chromosome de B. subtilis. Reporters ne sont exprimées que dans une sous-population de cellules spécialisées. Ensuite, les sous-populations peuvent êtrecontrôlée à l'aide de microscopie par fluorescence et la cytométrie de flux (voir fig 1).
Le fait que différentes sous-populations de cellules spécialisées au sein des communautés coexistent multicellulaires de bactéries nous donne une perspective différente sur la régulation de l'expression génique chez les procaryotes. Ce protocole traite de ce phénomène expérimentalement et il peut être facilement adapté à n'importe quel modèle de travail d'autre part, d'élucider les mécanismes moléculaires sous-jacents hétérogénéité phénotypique au sein d'une communauté microbienne.
Protocole
1. Étiquetage B. subtilis et essai de formation de biofilm
- Amplifier par PCR de la région promoteur du gène d'intérêt. Nous montrons à titre d'exemple le clonage de P tapa, le promoteur des gènes responsables de la production de Tasa matrice protéique 26. Clone P tapa dans pkm008 vecteur (créé par le laboratoire Rudner, Harvard Medical School. Boston, Etats-Unis) (Fig. 2).
- Linéariser les plasmides par digestion enzymatique (Enzyme recommandée, Xhol).
- Provoquer la compétence naturelle de B. subtilis souche 168 en suivant le protocole en une seule étape décrite précédemment par Harwood et de coupe 27.
- Ajouter les plasmides linéarisés dans la culture de cellules compétentes et sélection pour la résistance à la spectinomycine après deux heures d'incubation.
- Les souches obtenues ont inséré la construction dans le locus amyE neutre de B. subtilis par double recombinaison (figure 4). Pour créerune souche double-étiquetés, intégrer le deuxième rapporteur dans le locus LacA neutre en utilisant le plasmide pDR183 nous présentons dans la figure 3. Insérer ce journaliste en utilisant la même technique que nous avons décrit ci-dessus pour l'insertion des journalistes cloné dans pKM008.
- Transférer le journaliste de la souche 168 à NCIB3610 qui est capable de former des biofilms. Utilisez la transduction du phage SPP1 protocole 28,29. Grow souche donneuse dans TY milieu (LB +10 mM MgSO 4 +10 uM MnSO 4). Mélanger 200 pi de la culture avec 100 ul de dilution stock de phages. Ajouter 3 ml de gélose molle après 30 min d'incubation et de permettre à des halos de phages de se poser à 37 ° C.
- Recueillir l'agar mou. Il Centrifuger et passer le surnageant pensé une seringue de 0,22 um filtre. Utiliser ce surnageant à infecter une culture de la souche réceptrice cultivées dans un milieu TY. Ajouter 30 ul à 10 ml de 1:10 culture diluée. Incuber pendant 30 min et sélectionner pour la résistance aux antibiotiques après 24 h d'incubation.
- Setionner un colonie et grandir durant la nuit sur LB à 37 ° C.
- Spot 3 ul de la culture de la nuit sur des bases solides biofilm milieu inducteur de MSgg agar 1,5% 30. Laisser les cellules à croître pendant 72 heures à 30 ° C (figure 3). Après trois jours de croissance, les biofilms formés sur la surface de la gélose MSgg développé une architecture complexe morphologique dans la surface de la gélose.
2. Dispersion biofilm et la fixation des cellules
- Retirez la forme de biofilm à la surface de l'agar MSgg l'aide d'un cure-dent ou des pincettes. La cohérence du biofilm devrait vous permettre de lui décoller de la surface de l'agar-agar dans une seule pièce.
- Placez le biofilm dans 3 ml de tampon PBS et de disperser le biofilm par passage répétitif à travers une pipette ou une aiguille. Alternativement, la dispersion du biofilm peut être fait en utilisant la sonication douce. Sonication douce nécessite 12 impulsions avec une sortie de 3 et de l'amplitude de 0,7 secondes.
- Fixer les échantillons avant l'analyse cellulaire unique. Resuspend 300 ul de la suspension cellulaire dans 1 ml de solution de paraformaldéhyde 4% et incuber à température ambiante pendant exactement sept minutes.
Composition de la solution de paraformaldéhyde à 4%:
2 g de paraformaldéhyde
50 ml de tampon PBS
4 pl NaOH 10 N
Filtrer la solution à travers un filtre de 0,22 um et aliquote - Laver les cellules après fixation dans du tampon PBS trois fois et les remettre en suspension dans 300 ul de tampon PBS.
3. Microscopie de fluorescence
- Verser 200 ul de 0,8% d'agarose sur une lame de microscope et soigneusement le couvrir avec une autre diapositive. Retirer la lame supérieure doucement après 2 minutes pour obtenir une couche d'agarose fixée à la glissière de fond.
- Spot 2 pl de cellules fixes sur la surface de la couche d'agarose et le couvrir avec un couvercle en verre de microscope.
- Placer l'échantillon dans le microscope à fluorescence. Nous utilisons un microscope à fluorescence Leica DMI6000B équipé d'un Leica iIluminat CRT6000ion du système. Les filtres pour YFP sont Ex: BP500/20, Em: BP535/30 et pour la PCP sont Ex: BP426/20, Em: 480/40
- Exposez votre échantillon à une excitation de fluorescence entre 50-200 ms. Définir la période d'excitation selon une commande négative qui ne présente pas de fluorescence dans les conditions choisies pour l'expérience.
- Reportez-vous l'image de fluorescence à la même image obtenue avec le champ lumineux. Fusionner les deux images en une seule image. Les résultats obtenus à partir de la microscopie à fluorescence en flux en utilisant une souche unique marqué abriter le journaliste P Tapa-YFP sont représentés dans la figure 6.
4. Quantification des cellules isolées Par cytométrie en flux
- Disperse l'échantillon de cellules fixes utilisant sonication douce. Sonication l'échantillon d'interprétation 2 série de 12 impulsions par un signal de sortie et l'amplitude de 5 0,7 seconde, pour disperser des touffes dans des cellules individuelles sans provoquer la lyse cellulaire. Confirmer l'efficacité de la dispersion des cellules par microscopie optique.
- Diluer l'échantillon 1:100 dans du tampon PBS avant l'analyse par cytométrie en flux. Nous utilisons un cytomètre de flux BD FACS Canto II. Pour YFP fluorescence, utilisez une excitation laser à 488 nm couplé avec un filtre 530/30. Pour PCP fluorescence, utilisez l'excitation laser à 405 nm couplé avec un filtre 408/40.
- Calibrer la machine cytomètre de flux avec deux contrôles négatifs. Un échantillon de tampon PBS sans cellules en suspension doit servir de témoin négatif pour la taille des particules détectées par le cytomètre de flux. Un échantillon marqué par fluorescence sans rapporteur doit être servir comme témoin négatif pour la sensibilité de fluorescence du cytomètre en flux.
- Placer l'échantillon étiqueté avec le rapporteur fluorescent dans le cytomètre en flux. Pour chaque échantillon, l'analyse d'au moins 50.000 événements avec un débit compris entre 300 et 3000 événements par seconde.
- Capture des données en utilisant FACS Diva logiciels (BD Biosciences) et de l'analyser à l'aide FlowJo 8.5.2 du logiciel. Reportez-vous les signaux de fluorescence à la commande qui montrentpas de fluorescence.
- Présenter les données de surveillance du signal de fluorescence d'une souche unique marqué dans un graphique à deux axes. Tracer le signal de fluorescence détectée dans l'axe X et le nombre de cellules exprimant les différents niveaux de fluorescence dans l'axe des Y. Les résultats obtenus de l'analyse par cytométrie en flux en utilisant une souche unique marqué abriter le journaliste P Tapa-YFP sont représentés dans la figure 8.
- Présenter les données de surveillance du signal de fluorescence d'une souche double-étiquetés dans un graphique en trois axes. Tracer le signal de fluorescence de chacun des canaux suivis dans les axes X et Y (par exemple, la GFP serait mesurée dans l'axe X et de la PCP dans l'axe Y). Plot de l'axe Z le nombre de cellules exprimant chaque rapporteur et les présenter comme isolignes de contour qui seraient perpendiculaire au plan du papier (fig. 9 et 10).
4. Les résultats représentatifs
Lorsque B. subtilis pousse sur une plaque de la bMSgg moyennes iofilm induisant, la formation de biofilm est observé après trois jours d'incubation à 30 ° C 30. Le biofilm présente une cohérence solide et qu'il peut être décollée de la surface de la gélose en un seul morceau. En outre, le biofilm montre une architecture complexe morphologique qui est indicatif des sous-populations distinctes de cellules participant (Fig. 5). Par exemple, la production de la matrice extracellulaire dans les résultats de biofilms dans la formation de rides sur la surface de la colonie. Cette fonctionnalité peut être corrélée avec la différenciation de la sous-population des producteurs de la matrice 19. De même, l'élévation de structures aériennes sur la surface du biofilm est indicative de la présence d'une sous-population de cellules sporulantes, depuis les spores localisée dans la zone apicale de ces structures 30.
Des exemples de visualisation de la différenciation cellulaire dans un seul r-étiquetés et une souche double-étiquetés en utilisant la microscopie de fluorescence sontepresented dans la figure 6 et 7, respectivement. La seule souche marqué abrite le rapporteur fluorescent P Tapa-PCP qui est exprimée dans la sous-population de cellules de la matrice de production. Cette sous-population est responsable de produire et de sécréter la matrice extracellulaire qui constitue le biofilm (Fig. 6). La souche double-étiquetés abrite le journaliste P Tapa-PCP 26 et le journaliste supplémentaire P srfAA-YFP 31. Ce journaliste second permet de contrôler la sous-population de cellules responsables de sécréter la surfactine molécule de signalisation, ce qui déclenche la cascade de signalisation à la différenciation des producteurs de la matrice (Fig. 7). Sous-population des producteurs de la matrice sont fausses colorée en bleu tandis que le sous-population de producteurs surfactine est faux de couleur jaune.
L'analyse par cytométrie en flux en utilisant une souche unique marqué abriter le journaliste P Tapa-YFP est présenté dans la figure 8. Souche témoin non traité n'est pas hébergerdes gènes des protéines fluorescentes a montré une fluorescence seule population relativement faible. Cellules hébergeant P Tapa-YFP chez les non-biofilm conditions induisant n'établit pas de distinction de la sous-population des producteurs de la matrice et toute la population a montré faible fluorescence relative. Dans biofilm condition induisant, une sous-population de cellules avec la fluorescence produite par rapport haute, observé comme un épaulement vers la droite du pic de fluorescence par rapport à faible 23.
Résultats obtenus à partir de l'analyse par cytométrie en flux en utilisant une souche double-étiquetés sont représentés dans la figure 9 et 10. Figure 9 suivi des sous-populations de producteurs de la matrice et les producteurs surfactine en utilisant la souche double-étiquetés P Tapa-PCP, P srfAA-YFP. Comme le contrôle de la fluorescence de fond, nous avons utilisé une souche non héberger des gènes des protéines fluorescentes. Ensuite, nous avons détecté chaque sous-population des producteurs de la matrice et les producteurs surfactine dans chaque canal de fluorescence, en utilisant la souche unique étiquetés s comme témoins. La souche double-étiquetés P Tapa-PCP, P srfAA-YFP a montré deux sous-populations de cellules exprimant des niveaux élevés des journalistes fluorescentes. Chaque population est encadrée, montrant qu'il n'y a pas de chevauchement dans l'expression des journalistes entre les deux sous-populations de cellules spécialisées 15. De même, l'analyse par cytométrie en flux en utilisant le double-étiquetés souche P skf-YFP, P Tapa-YFP est présenté dans la figure 10. Le journaliste de la SKF gène contrôle la différenciation de la sous-population de cannibales 32, qui a été décrite pour différencier de manière coordonnée avec la sous-population de 24 producteurs de la matrice. Dans ce cas, la souche double-étiquetés a montré une sous-population unique de cellules fluorescentes exprimant à la fois YFP et de la PCP. Cela indique que les deux voies de différenciation cellulaires sont activé de façon coordonnée dans le même sous-population.
1.jpg "/>
Figure 1. Diagramme d'ensemble de l'expérience. Le protocole est divisé en trois étapes principales. La première étape exige l'étiquetage de la souche de B. subtilis avec la fusion journaliste qui surveille la sous-population d'intérêt. Deuxièmement, développer souches marquées dans le biofilm induisant conditions. Troisièmement, disperser le biofilm et d'effectuer une seule cellule d'analyse de la population en utilisant un microscope à fluorescence et la cytométrie en flux.

Figure 2. Représentation schématique de la pKM008 vecteur d'intégration. Ce vecteur intègre la fusion journaliste d'intérêt dans le locus amyE neutre par double recombinaison. Le promoteur d'intérêt (P tapa) est cloné dans le vecteur en utilisant les sites de restriction EcoRI et HindIII. Ensuite, l'expression du gène cfp est sous le contrôle du promoteur P tapa. Le orientationique des gènes dans le plasmide est représentée comme une flèche.
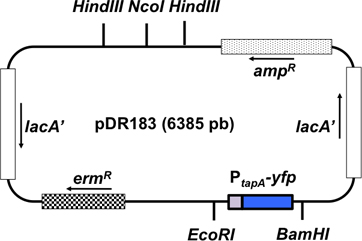
Figure 3. Représentation schématique du vecteur pDR183 intégration. Ce vecteur intègre la fusion journaliste d'intérêt dans le neutre LacA locus par double recombinaison. La fusion d'intérêts (P tapa - cfp) est cloné dans le vecteur en utilisant les sites de restriction EcoRI et BamHI. L'orientation des gènes dans le plasmide est représentée comme une flèche.

Figure 4. Schéma de l'intégration des journalistes dans le chromosome de B. subtilis par double recombinaison. (A) B. chromosome subtilis possède deux loci neutres, Amye et Laca, pour intégrer les fusions reporter sans affecter le développement du biofilm. (B) de double recombinaison de pKM008. Plasmide linéarisé s'intègre dans le génome de B. subtilis par double recombinaison. La fusion rapporteur intègre dans le locus neutre de manière stable.

Figure 5. La formation du biofilm de B. subtilis. NCIB3610 Procédé de formation de l'bioflm souche B. subtilis NCIB 3610 lorsque la croissance sur le moyen MSgg biofilm induisant pendant trois jours à 30 ° C. Images séquentielles d'un développement du biofilm ont été prises toutes les 12h.

Figure 6. Visualisation de la sous-population des producteurs de la matrice dans le cadre du microscope à fluorescence. Un échantillon provenant d'un biofilm de B. subtilis P tapa - cfp a été fixé et examiné au microscope à fluorescence. 200 ms de la fluorescenced'excitation en évidence une sous-population de cellules émettant de fluorescence supérieur que dans le reste des cellules. Nous avons considéré cette sous-population que la sous-population de la matrice des cellules productrices. La barre d'échelle est de 3 um.
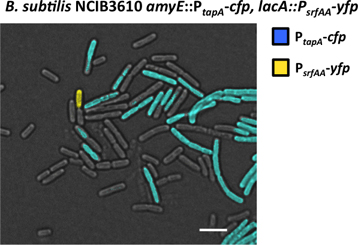
Figure 7. Visualisation de la sous-population des producteurs de la matrice et les producteurs en vertu de la surfactine microscope à fluorescence. Échantillon à partir d'un biofilm de la B. subtilis P Tapa-cfp, P srfAA-YFP souche double-marqué a été fixé et examiné au microscope à fluorescence. Le temps d'exposition de 250 ms en témoignent deux sous-populations de cellules émettant plus de fluorescence que le reste des cellules. Une sous-population a exprimé YFP et il a été détecté en utilisant exclusivement le canal YFP (fausse couleur jaune). Il s'agit de la sous-population de producteurs surfactine. Un autre sous-population a exprimé PCP et il a été exclusivement détectés à l'aide de la PCP Chann el. Il s'agit de la sous-population des producteurs de la matrice. La barre d'échelle est de 3 um.
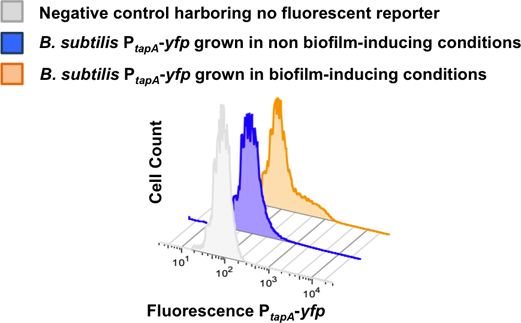
Figure 8. La quantification de la sous-population des producteurs de la matrice en utilisant 2-D cytométrie en flux. Cellules dispersées à partir d'un biofilm de B. subtilis P Tapa-YFP ont été suivis par cytométrie en flux. Le cytomètre de flux compté 50.000 événements et le signal de fluorescence pour chaque événement a été suivi. Nombre de cellules comptées est tracée dans l'axe Y alors que l'intensité du signal YFP est tracée dans l'axe X. Les cellules ont été cultivées dans un milieu LB pour obtenir des conditions induisant non-biofilm. Les cellules ont été cultivées dans MSgg milieu pour obtenir un biofilm conditions induisant. La sous-population des producteurs de la matrice différencie uniquement dans le biofilm induisant conditions. Ce chiffre a été adapté à partir López et al., PNAS (2009) 106 :280-285.
s/ftp_upload/3796/3796fig9.jpg "/>
Figure 9. La quantification de la sous-population des producteurs de la matrice et les producteurs surfactine par cytométrie en flux 3-D. Signal de fluorescence des voies surveillées sont présentés dans l'axe X (pour YFP) et l'axe Y (pour la PCP). L'axe Z mesure le nombre de cellules exprimant chaque reporter et elle est quantifiée en tant isolignes de contour perpendiculaires au plan du papier. Le nombre d'événements surveillés dans cette expérience était de 50.000 événements. Gauche panneau supérieur présente un contrôle de la fluorescence de fond abriter aucun gènes des protéines fluorescentes. Droit panneau supérieur détecte la sous-population des producteurs de surfactine dans le canal de fluorescence YFP (encadré en jaune) en utilisant un seul marqué la souche P srfAA-YFP. Panneau en bas à gauche détecte la sous-population des producteurs de la matrice dans le canal PCP de fluorescence (encadré en bleu) en utilisant une souche unique étiquetés P Tapa-PCP. Le double-étiquetés souche P tapa </ Em>-PCP, P srfAA-YFP est surveillée dans le panneau en bas à droite. Il a montré deux sous-populations qui sont encadrées en jaune et bleu. Ce chiffre a été adapté à partir López et al., Genes and Development (2009) 23 :1631-1638.
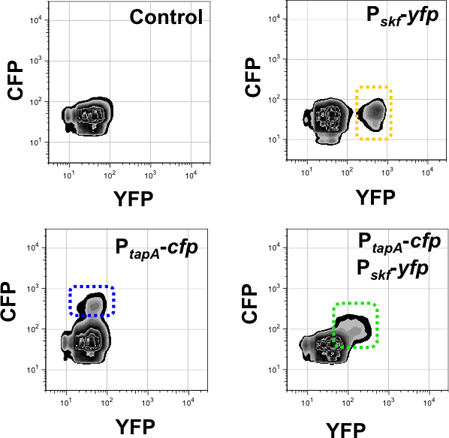
Figure 10. La quantification de la sous-population des producteurs de la matrice et des cannibales par cytométrie en flux 3-D. Signal de fluorescence des voies surveillées sont présentés dans l'axe X (pour YFP) et l'axe Y (pour la PCP). Le nombre d'événements surveillés dans cette expérience était 50.000. Droit panneau supérieur détecte la sous-population de cannibales dans le canal de fluorescence YFP (encadré en jaune) dans une seule souche marqué P skf-YFP. Panneau en bas à gauche détecte la sous-population des producteurs de la matrice dans le canal PCP de fluorescence (encadré en bleu) dans une seule souche marqué P Tapa-PCP. Le double marqué la souche P Tapa-PCP, P skf-YFP a montré une seule sous-population de cellules en diagonale pour les axes X et Y (encadrée en vert). Cette sous-population est détecté dans le canal YFP et de la PCP, car elle exprime les deux journalistes en même temps. Lopez et al., Des gènes et le développement (2009) 23 :1631-1638.
Discussion
Le fait que les communautés bactériennes montrent sous-populations de cellules exprimant ensemble spécifique de gènes preuves de la complexité des communautés microbiennes 33,34. Ce protocole devrait aider à déterminer si l'expression de tout gène d'intérêt est limitée à une sous-population particulière de cellules spécialisées au sein de la communauté microbienne. La visualisation de ces sous-populations nécessite le développement de nouvelles techniques, parce que les méthodes tr...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce travail est financé par le Programme de recherche du jeune chercheur, à partir du Centre de recherche sur les maladies infectieuses (ZINF) de l'Université de Würzburg. Juan Garcia C-Betancur est un garçon un doctorat de la Graduate School of Life Sciences (GSLS) de l'Université de Würzburg.
matériels
| Name | Company | Catalog Number | Comments |
| Technique | Nom du réactif | Entreprise | Le numéro de catalogue |
| MSgg composition | phosphate de potassium 5mM | Roth | 6878 |
| MOPS 100mm | Sigma-Aldrich | M1254 | |
| Le chlorure de magnésium 2 mM | Roth | 2189,1 | |
| 700μM de chlorure de calcium | Roth | A119.1 | |
| 50 um de chlorure ferrique | Sigma-Aldrich | 157740 | |
| 1 uM chlorure de zinc | Applichem | A2076 | |
| Thiamine 2 pm | Sigma-Aldrich | 74625 | |
| 0,5% de glycérol | Roth | 7533 | |
| Glutacompagnon de 0,5% | Sigma-Aldrich | 49621 | |
| Le tryptophane 50μg/ml | Sigma-Aldrich | T0254 | |
| Phénylalanine 50μg/ml | Sigma-Aldrich | P2126 | |
| La fixation de cellules | Paraformaldéhyde | Roth | 0335 |
| Nom de l'équipement | Entreprise | Le numéro de catalogue | |
| Sonication | Sonicator portable | Bandelin | D-1000 |
| Microscopie de fluorescence | Microscope à fluorescence | Leica | DMI6000B |
| Nom du logiciel | Entreprise | Numéro de catalogue | |
| Microscopie de fluorescence | Asaf | Leica | |
| La cytométrie en flux | FCASDiva | BD | |
| La cytométrie en flux | FlowJo | Treestar |
Références
- Costerton, J. W. Overview of microbial biofilms. J. Ind. Microbiol. 15, 137-140 (1995).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiol. Mol. Biol. Rev. 64, 847-867 (2000).
- Kolenbrander, P. E. Oral microbial communities: biofilms, interactions, and genetic systems. Annu. Rev. Microbiol. 54, 413-437 (2000).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerg. Infect. Dis. 8, 881-890 (2002).
- Lopez, D., Vlamakis, H., Kolter, R. Biofilms. Cold Spring Harb. Perspect. Biol. 2, a000398-a000398 (2010).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Latasa, C., Solano, C., Penades, J. R., Lasa, I. Biofilm-associated proteins. C. R. Biol. 329, 849-857 (2006).
- O'Gara, J. P. ica and beyond: biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus. FEMS Microbiol Lett. 270, 179-188 (2007).
- Chai, Y., Chu, F., Kolter, R., Losick, R. Bistability and biofilm formation in Bacillus subtilis. Mol. Microbiol. 67, 254-263 (2008).
- Chen, R., Guttenplan, S. B., Blair, K. M., Kearns, D. B. Role of the sigmaD-dependent autolysins in Bacillus subtilis population heterogeneity. J. Bacteriol. 191, 5775-5784 (2009).
- Guttenplan, S. B., Blair, K. M., Kearns, D. B. The EpsE flagellar clutch is bifunctional and synergizes with EPS biosynthesis to promote Bacillus subtilis biofilm formation. PLoS Genet. 6, e1001243-e1001243 (2010).
- Kearns, D. B., Losick, R. Cell population heterogeneity during growth of Bacillus subtilis. Genes Dev. 19, 3083-3094 (2005).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Paracrine signaling in a bacterium. Genes Dev. 23, 1631-1638 (2009).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Jongbloed, J. D., Kuipers, O. P. Visualization of differential gene expression by improved cyan fluorescent protein and yellow fluorescent protein production in Bacillus subtilis. Appl. Environ. Microbiol. 70, 6809-6815 (2004).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Kuipers, O. P. Single cell analysis of gene expression patterns of competence development and initiation of sporulation in Bacillus subtilis grown on chemically defined media. J. Appl. Microbiol. 101, 531-541 (2006).
- Veening, J. W., Kuipers, O. P., Brul, S., Hellingwerf, K. J., Kort, R. Effects of phosphorelay perturbations on architecture, sporulation, and spore resistance in biofilms of Bacillus subtilis. J. Bacteriol. 188, 3099-3109 (2006).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Stewart, P. S., Franklin, M. J. Physiological heterogeneity in biofilms. Nat. Rev. Microbiol. 6, 199-210 (2008).
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev. Microbiol. 62, 193-210 (2008).
- Aguilar, C., Vlamakis, H., Guzman, A., Losick, R., Kolter, R. KinD is a checkpoint protein linking spore formation to extracellular-matrix production in Bacillus subtilis biofilms. MBio. 1, (2010).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Cannibalism enhances biofilm development in Bacillus subtilis. Mol. Microbiol. 74, 609-618 (2009).
- Arima, K., Kakinuma, A., Tamura, G. Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation. Biochem. Biophys. Res. Commun. 31, 488-494 (1968).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol. Microbiol. 80, 1155-1168 (2011).
- Hardwood, C. R., Cutting, S. M. . Molecular Biological Methods for Bacillus. , (1990).
- Novick, R. P. Genetic systems in staphylococci. Methods Enzymol. 204, 587-636 (1991).
- Yasbin, R. E., Young, F. E. Transduction in Bacillus subtilis by bacteriophage SPP1. J. Virol. 14, 1343-1348 (1974).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Nakano, M. M. srfA is an operon required for surfactin production, competence development, and efficient sporulation in Bacillus subtilis. J. Bacteriol. 173, 1770-1778 (1991).
- Gonzalez-Pastor, J. E., Hobbs, E. C., Losick, R. Cannibalism by sporulating bacteria. Science. 301, 510-513 (2003).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr. Opin. Microbiol. 10, 638-643 (2007).
- Shapiro, J. A. Thinking about bacterial populations as multicellular organisms. Annu. Rev. Microbiol. 52, 81-104 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon