JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
의 단일 세포 분석 바실러스 subtilis Biofilms
요약
미생물 biofilms은 일반적으로 전문의 세포 독특한 subpopulations에 의해 형성된다. 이러한 subpopulations의 단일 세포 분석은 형광 기자의 사용을 필요로합니다. 여기 몇 가지 subpopulationswithin을 시각화하고 모니터하는 프로토콜을 설명 B. subtilis 형광 현미경 및 유동세포계측법을 사용 biofilms.
초록
Biofilm 형성은 거의 모든 박테리아 1-6에 일반 속성입니다. 박테리아가 biofilms를 형성하면, 전지는 주로 7-10 기타 요인 중에서 단백질과 exopolysaccharides에 의해 형성되는 세포외 기질에 쌌다 있습니다. 미생물 커뮤니티는 종종 11-17 특화된 세포의 뚜렷한 subpopulation의 분화를 보여줍니다 biofilm 내에서 이탈식. 이러한 subpopulations가 공존하며 종종 biofilm 18-21 사이 공간과 시간적 조직을 보여줍니다.
모델 유기체 바실러스 subtilis의 Biofilm 형성은 전문적인 세포의 뚜렷한 subpopulations의 분화가 필요합니다. 그중 biofilm의 세포외 기질을 생산하고 분비하는 책임 매트릭스 제작자의 subpopulation는 biofilm 형성 11,19 위해 필수적입니다. 따라서 매트릭스 생산자의 차별화는 B에 biofilm 형성에 각인되어있는 것입니다 subtilis.
우리는 B.의 biofilms에서 매트릭스 생산 subpopulation을 시각화하고 수치 형광 기자를 사용한 subtilis 15,19,22-24. 구체적으로, 우리는 매트릭스 생산 subpopulation 자기 생산 세포 신호 surfactin 25 존재에 대한 응답으로 차별화 것을 관찰했습니다. 흥미롭게도 surfactin는 매트릭스 생산자 15 subpopulation과 다른 특수 세포 subpopulation에 의해 생산됩니다.
우리는이 보고서 바실러스 subtilis의 biofilms 이내 매트릭스 생산자와 surfactin 생산자의 subpopulation을 시각화하고 계량하는 데 필요한 기술적인 접근 방식에 자세히 있습니다. 이렇게하려면 행렬 생산 및 surfactin 생산에 필요한 유전자의 형광 기자 B.의 염색체에 삽입됩니다 subtilis. 기자는 전문화된 세포 subpopulation에 표현됩니다. 다음 subpopulations가 될 수 있습니다형광 현미경 및 유동세포계측법합니다 (그림 1 참조)을 사용하여 모니터.
전문 세포의 다른 subpopulations는 박테리아의 다세포 지역 사회 내에 공존한다는 사실은 우리에게 prokaryotes의 유전자 발현의 조절에 대해 다른 관점을 제공합니다. 이 프로토콜은 실험적으로 이러한 현상을 해결하고 쉽게 미생물 지역 사회 내에서 phenotypic 이질의 기본 분자 메커니즘을 명료하게하다하기 위해 다른 작업 모델에 적용할 수 있습니다.
프로토콜
1. 레이블 B. subtilis 및 Biofilm 형성 분석
- PCR에 의해 관심 유전자의 프로 모터 영역을 확대. 우리는 예로 P tapA, TasA 매트릭스 단백질 26 생산을 담당하는 유전자의 프로 모터의 복제를 보여줍니다. pkm008 벡터 (Rudner 연구소, 하버드 의과 대학. 보스톤, 미국에서 만든)로 클론 P tapA (그림 2).
- 효소 소화 (효소 권장, XhoI)에 의해 plasmids을 Linearize.
- B.의 자연 능력을 유도 subtilis 이전에 하워드에 기술된 한 단계 절차를 따르는 27을 절단하여 168을 변형.
- 유능한 세포 문화에 선형 plasmids을 추가하고 인큐베이션의 두 시간 후에 spectinomycin의 저항에 따라 선택합니다.
- 취득 변종은 B.의 중립 amyE의 현장에 구조를 넣었습니다 이중 재조합에 의한 subtilis (그림 4). 만들려면이중 라벨 변형은 우리가 그림 3에 제시 플라스미드 pDR183를 사용하여 중립 현장의 lacA로 두 번째 기자를 통합합니다. 우리가 pKM008에서 복제된 기자의 삽입을 위해 위에서 설명한 동일한 기법을 사용하여이 기자를 삽입합니다.
- biofilms을 형성 수 NCIB3610로 변형 168에서 기자를 전송합니다. SPP1 파지의 도입에게 프로토콜 28,29을 사용합니다. 타이 중간의 기증자 스트레인 (LB 10 MM MgSO 4 10 μm의 MnSO 4) 성장. 파지 주식 희석을 100 μl와 문화 200 μl를 섞는다. 부화 후 30 분 후에 부드러운 한천의 3 ML을 추가하고 파지의 halos는 37 발생할 수 ° C.
- 부드러운 한천를 수집합니다. 그것을 원심 분리기와 뜨는 합격은 주사기 0.22 μm의 필터 알았는데. 타이 매체 재배받는 변형의 문화를 감염이 뜨는을 사용하십시오. 30 μl ~ 10 문화 희석 1시 10분의 ML을 추가합니다. 30 분 동안 부화하며 부화 후 24 H 후 항생제 내성에 대한 선택합니다.
- SE37 식민지를 lect 및 LB에서 하룻밤을 성장 ° C.
- 1.5 % 한천 30 MSgg 고체 biofilm - 유도 매체에서 하룻밤 문화의 3 μL를 정확 해요. 세포가 30 ° C (그림 3)에서 72시간 동안 성장하도록 허용합니다. 성장 3 일 후, MSgg 한천의 표면에 형성 biofilms는 한천의 표면에 복잡한 형태학의 아키텍처를 개발했습니다.
2. Biofilm 분산 및 셀 고정
- biofilm 양식에게 이쑤시개 또는 핀셋을 사용하여 MSgg 한천의 표면을 제거합니다. biofilm의 일관성은 한 조각의 한천의 표면의 껍질을 해제해서는 안된다.
- PBS 버퍼 3 ML에 biofilm을 넣고 피펫이나 주사 바늘을 통해 반복적인 구절에 의한 biofilm을 분산. 또는 biofilm 분산은 가벼운 sonication을 사용하여 수행할 수 있습니다. 가벼운 sonication은 3의 출력과 0.7 초 진폭 12 펄스를 필요로합니다.
- 샘플에게 사전 셀 - 하나의 분석을 수정합니다. Resuspen정확히 7 분을위한 상온에서 4 % paraformaldehyde 솔루션과 부화 1 ML의 세포 현탁액의 D 300 μL.
4 % paraformaldehyde 솔루션의 구성 :
paraformaldehyde의 2g
PBS 버퍼의 50 ML
4 μl 10 N NaOH
0.22, 음 필터 나누어지는를 통해 솔루션을 필터링 - PBS 버퍼에 고정 세 번 이후에 세포를 씻어하고 PBS 완충액 300 μL에 그들을 resuspend.
3. 형광 현미경
- 현미경 슬라이드여 0.8 % 아가로 오스 200 μL를 붓고 신중하게 다른 슬라이드로 다룹니다. 하단의 슬라이드에 부착된 아가로 오스의 레이어를 얻기 위해 2 분 후에 부드럽게 상단 슬라이드를 제거합니다.
- 스팟이 아가로 오스 층의 표면에 고정된 세포 μL와 현미경 덮개 유리로 덮어.
- 형광 현미경으로 시료를 놓습니다. 우리는 Leica CRT6000 iIluminat 장착된 형광 현미경 Leica DMI6000B를 사용하여시스템이 이온. BP500/20, 엠 : YFP위한 필터는 예입니다 BP535/30 및 CFP에 대한 예입니다 BP426/20, 엠 : 40분의 480
- 샘플을 폭로 50-200 MS 사이에 여기 형광합니다. 실험을 위해 선택한 조건에는 형광을 보여줍없는 부정적인 통제에 따라 여기 기간을 설정합니다.
- 명시야로 얻은 같은 이미지로 형광 이미지를 참조하시기 바랍니다. 한 장의 사진에서 두 이미지를 병합합니다. 결과 P tapA-YFP는 그림 6에 나타나있는 기자를 숨겨주는 단일 레이블 변형을 사용하여 유동 형광 현미경에서 얻은.
4. 유동세포계측법를 사용하여 단일 세포의 부량
- 가벼운 sonication을 사용하여 고정 세포의 샘플을 분산. 세포 용해를 일으키는 않고 단일 세포에 대단히 짧은 시간을 분산하기 위해 5의 출력과 0.7 초 진폭 12 펄스 2 시리즈를 수행하는 샘플을 Sonicate. 가벼운 현미경으로 세포 분산의 효율성을 확인합니다.
- 유동세포계측법 분석하기 전에 PBS 버퍼에 샘플 1:100을 희석. 우리는 흐름 cytometer BD FACS 캔토 II를 사용합니다. YFP 형광 들어, 30분의 530 필터와 결합 488 nm의에서 레이저 여기를 사용합니다. CFP 형광 들어, 40분의 408 필터와 결합 405 nm의에서 레이저 여기를 사용합니다.
- 이 부정적인 컨트롤 흐름 cytometer 기계 보정. 서스펜션의없이 세포와 PBS 버퍼의 예제는 흐름 cytometer에 의해 감지 입자의 크기에 대한 부정적인 제어 역할을한다. 노 형광 기자와 라벨이 예제는 흐름 cytometer의 형광 감도에 대한 부정적인 제어 역할을해야합니다.
- 흐름 cytometer에 형광 기자와 레이블 샘플을 놓습니다. 각 샘플의 경우 초당 300 3000 이벤트 사이의 유량과 최소 50,000 이벤트를 분석합니다.
- FACS 디바 소프트웨어 (BD Biosciences)를 사용하여 데이터를 캡처하고 FlowJo 8.5.2 소프트웨어를 사용하여 그것을 분석합니다. 표시되는 컨트롤에 형광 신호를 참조의 더 형광 없습니다.
- 두 축의 그래픽에서 단일 레이블 변형의 형광 신호를 모니터링 데이터를 제시한다. X 축 및 Y 축의 형광의 다른 수준을 표현하는 세포의 수가 검출 형광 신호를 잡아. 결과 P tapA-YFP은 그림 8에 나타나있는 기자를 숨겨주는 단일 레이블 변형을 사용하여 유동세포계측법 분석에서 얻은.
- 세 축의 그래픽의 이중 라벨 변형의 형광 신호를 모니터링 데이터를 제시한다. X와 Y 축 (예를 들어, GFP는 Y 축에있는 X 축 및 CFP로 측정됩니다)에 모니터 채널 각각의 형광 신호를 잡아. Z 축의 플롯 각각 기자와 종이 비행기 (그림 9 및 10)에 수직 될 윤곽 isolines로 제시을 표현 세포의 수.
4. 대표 결과
언제 B. subtilis는 B의 접시에 성장iofilm - 유도 매체 MSgg, biofilm 형성은 30 ° C에서 30에서 배양 3 일 후에 관찰한다. biofilm은 강하고 일관성을 보여줍니다 그리고 그것은 한 조각의 한천의 표면에서 떨어져 벗겨 수 있습니다. 또한, biofilm은 별개의 참여 세포 subpopulations (그림 5)는 지표입니다 복잡한 형태학의 아키텍처를 보여줍니다. 예를 들어, 식민지의 표면에 주름 형성의 biofilms 결과 세포외 기질 생산. 이 기능은 매트릭스 생산자 19 subpopulation의 분화와 상호하실 수 있습니다. 포자가 이러한 구조 30 혀끝의 영역에 지역화된 이후 마찬가지로, biofilm의 표면에 공중 구조의 마련이 sporulating 세포의 subpopulation의 존재는 지표입니다.
단일 레이블과 형광 현미경을 사용하여 이중 라벨 변형이 연구에서 세포 분화의 시각화의 예각각 그림 6과 7에 epresented. 단일 레이블 변형은 형광 기자를 비호하는 행렬 생산 세포의 subpopulation로 표현되는 P tapA-CFP. 이 subpopulation는 biofilm (그림 6) 구성 세포외 기질을 생산하고 분비하는 책임이있다. 이중 레이블 발표했던 기자를 비호하는 P tapA-CFP 26 추가 기자 P srfAA-YFP 31. 이 두 번째 기자 매트릭스 제작자의 분화 (그림 7)에 신호 폭포를 트리거 신호 전달 분자 surfactin을 분비 책임 세포의 subpopulation를 모니터할 수 있습니다. surfactin 제작자의 subpopulation 노란색의 유색 인종 허위 반면 매트릭스 생산 Subpopulation는 파란 색 허위입니다.
기자가 P tapA-YFP은 그림 8에 표시됩니다 은닉 단일 레이블 변형을 사용하여 유동세포계측법 분석. 치료 제어 변형은 은닉하지모든 형광 단백질 유전자는 단일 인구 낮은 상대의 형광을 보여주었다. 비 biofilm - 유도 조건에서 P tapA-YFP을 품고 세포는 매트릭스 생산 subpopulation을 차별하지 않았고 전체 인구는 낮은 상대 형광을 보여주었다. biofilm - 유도 조건에서 높은 상대 형광있는 세포의 subpopulation이 낮은 상대 형광 피크 23 오른쪽 어깨로 관찰, 발생했습니다.
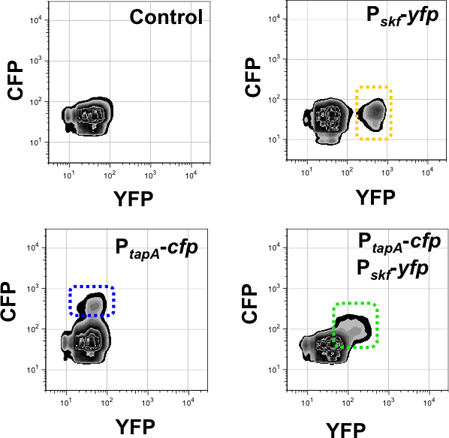
이중 라벨 변형을 사용하여 유동세포계측법 분석에서 얻은 결과는 그림 9와 10으로 표시됩니다. 그림 9는 이중 라벨 스트레인 P tapA-CFP, P srfAA-YFP을 사용하여 매트릭스 생산자와 surfactin 생산자의 subpopulations을 감시. 배경 형광 제어로서 우리는 어떠한 형광 단백질 유전자를 숨겨주는되지 변종를 사용했습니다. 다음, 우리는 단일 레이블 변형을 사용하여 각각의 형광 채널에 매트릭스 생산자와 surfactin 생산의 각 subpopulation를 감지 컨트롤로의. 이중 레이블 스트레인 P tapA-CFP, P srfAA-YFP은 형광 기자의 높은 수준을 표현 세포의 두 subpopulations을 보여주었다. 각각의 인구는 특정한 세포 15 두 subpopulations 사이 기자의 표현에는 중복이 없다는 것을 보여주는 함정에 있습니다. 이중 레이블을 사용하여 마찬가지로, 유동세포계측법 분석은 스트레인 P skf-YFP, P tapA-YFP는 그림 10에 표시됩니다. 유전자 skf에 대한 기자는 매트릭스 생산 24 subpopulation와 coordinately 차별 설명되어 식인종 32 subpopulation의 차별을 모니터링합니다. 이 경우 이중 라벨 변형은 YFP와 CFP를 모두 표현하는 형광 세포의 단일 subpopulation을 보여주었다. 이것은 두 세포 분화 경로가 coordinately 같은 subpopulation에서 활성화되는 지적했다.
"1.jpg />
1 그림. 실험의 전체 구조는. 프로토콜은 세 가지 주요 단계로 나뉘어져 있습니다. 첫 번째 단계는 B.의 긴장을 레이블링 필요 관심 subpopulation을 모니터링 기자 융합과 subtilis. 둘째, biofilm - 유도 조건에서 분류된 변종을 재배. 셋째, biofilm을 분산하고 형광 현미경과 유동세포계측법를 사용하는 인구의 단일 세포 분석을 수행.

그림 2. 통합 벡터 pKM008의 도식 표현.이 벡터는 두 재조합에 의해 중립 현장의 amyE에 관심있는 기자 융합을 통합합니다. 관심 (P tapA)의 발기인은 제한 사이트 EcoRI과 HindIII를 사용하여 벡터로 복제됩니다. 그런 다음, CFP 유전자의 표현은 발기인 P tapA의 통제하에있다. orientat플라스미드의 유전자 이온은 화살표로 표시됩니다.
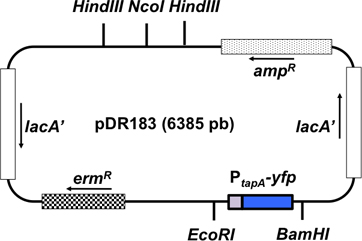
그림 3. 통합 벡터 pDR183의 도식 표현.이 벡터는 두 재조합에 의해 중립 현장 lacA에 관심있는 기자 융합을 통합합니다. 관심 (P tapA - CFP)의 융합이 제한 사이트 EcoRI과 BamHI를 사용하여 벡터로 복제됩니다. 플라스미드의 유전자의 방향이 화살표로 표시됩니다.

4 그림. B.의 염색체에 기자의 통합 계획 이중 재조합에 의한 subtilis. () B. subtilis의 염색체는 biofilm의 발전에 영향을주지 않고 기자 fusions을 통합하는 방법은 두 중립 loci, amyE 및 lacA을 가지고 있습니다. (B) Process를 trong. 선형 플라스미드는 B.의 게놈에 통합 이중 재조합에 의한 subtilis. 기자 융합은 안정적으로 중립 현장에 통합합니다.

그림 5. B.의 Biofilm 형성 변형 B.의 bioflm 형성 subtilis NCIB3610 있습니다. 프로세스 subtilis NCIB 3610 일 세명 일간 biofilm-유도 매체 MSgg에서 재배 ° C. biofilm의 발전의 연속 사진은 모든 12h를 촬영했다.

6 그림. 형광 현미경 매트릭스 생산 subpopulation의 시각화. B.의 biofilm의 샘플 subtilis P tapA - CFP는 형광 현미경으로 고정하고 조사되었다. 형광 200 MS여기는 세포의 나머지 부분보다 높은 형광을 방출하고 세포의 subpopulation을 입증. 우리는 매트릭스 생산 세포의 subpopulation로 subpopulation로 간주. 스케일 바는 3 μm의입니다.
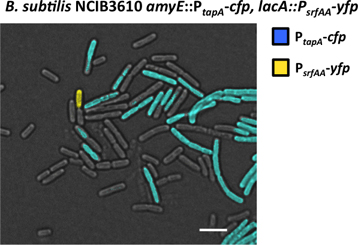
그림 7. 형광 현미경 매트릭스 생산자와 surfactin 생산자의 subpopulation의 시각화. B.의 biofilm의 샘플 subtilis P tapA-CFP, P srfAA-yfp 이중 라벨 변형은 고정하고 형광 현미경으로 조사되었다. 세포의 나머지 부분보다 높은 형광을 방출 셀 250 MS 입증이 subpopulations의 노출 시간. 한 subpopulation는 YFP을 표명하고 그것은 독점적 YFP 채널 (노란색의 유색 인종 거짓)를 사용하여 감지되었습니다. 이것은 surfactin 생산자의 subpopulation입니다. 또 다른 subpopulation는 CFP를 표현하고 그것은 독점적으로 CFP chann를 사용하여 감지되었습니다 엘. 이것은 매트릭스 생산 subpopulation입니다. 스케일 바는 3 μm의입니다.
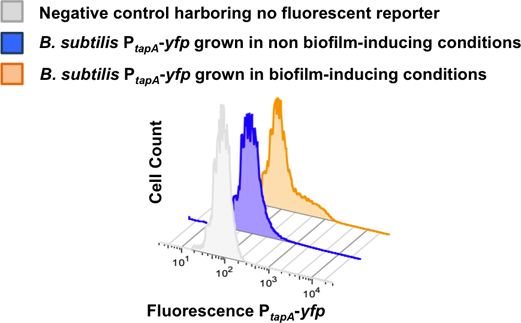
그림 8. 2-D의 유동세포계측법 있습니다. 사용하는 매트릭스 생산 subpopulation의 부량는 B.의 biofilm의 세포 분산 subtilis P tapA-yfp은 유동세포계측법을 사용하여 모니터링할되었다. 유동 cytometer은 50.000 이벤트를 계산하고 각 이벤트에 대해 형광 신호가 모니터링되었습니다. YFP 신호의 강도는 X 축에 꾸몄다하는 동안 계산 세포의 개수는 Y 축에 꾸몄다있다. 전지는 비 biofilm 유도 조건을 얻기 위해 LB 배지에서 성장했다. 세포는 biofilm-유도 조건을 얻기 위해 매체를 MSgg 재배되었다. 매트릭스 생산 subpopulation는 biofilm - 유도 조건에서 차별화합니다. 이 수치는 로페즈 외에서 적응되었다., PNAS (2009) 106 :280-285가.
s/ftp_upload/3796/3796fig9.jpg "/>
9 그림. 3 차원 유동세포계측법을 사용하여 매트릭스 생산자와 surfactin 생산자의 subpopulation의 부량. 모니터 채널의 형광 신호는 X 축 (YFP 용)과 Y 축 (CFP의 경우)로 표시됩니다. Z 축 각각의 기자를 표현하는 세포의 수를 측정 및 윤곽 isolines는 종이 비행기에 수직으로 그것을 계량합니다. 본 실험에서는 모니터 이벤트의 숫자는 50.000 행사했습니다. 왼쪽 상단 패널은 형광 단백질 유전자를 숨겨주는되지 배경 형광 반응의 제어를 제공합니다. 오른쪽 상단 패널에는 단일 레이블 스트레인 P srfAA-YFP를 사용 YFP 형광 채널 (노란색으로 누명을)에서 surfactin 생산자의 subpopulation를 감지합니다. 왼쪽 하단 패널은 단일 레이블 스트레인 P tapA-CFP를 사용하여 CFP 형광 채널 (파란색으로 누명을)에서 매트릭스 생산 subpopulation를 감지합니다. 이중 라벨 변형 P tapA </ em>는 - CFP, P srfAA-YFP가 오른쪽 하단 패널에 모니터하고 있습니다. 그것은 노란색과 파란색으로 누명되는 두 subpopulations을 보여주었다. 이 수치는 로페즈 외에서 적응되었다., 유전자 개발 (2009) 23 :1631-1638은.
10 그림. 매트릭스 생산자와 3 차원 유동세포계측법을 사용 식인종의 subpopulation의 부량. 모니터 채널의 형광 신호는 X 축 (YFP 용)과 Y 축 (CFP의 경우)로 표시됩니다. 본 실험에서는 모니터 이벤트의 숫자는 50.000했습니다. 오른쪽 상단 패널에는 단일 레이블 스트레인 P skf-YFP의 YFP 형광 채널 (노란색으로 누명을)에서 식인종의 subpopulation를 감지합니다. 왼쪽 하단 패널은 단일 레이블 스트레인 P tapA-CFP의 CFP 형광 채널 (파란색으로 누명을)에서 매트릭스 생산 subpopulation를 감지합니다. Double-라벨 스트레인 P tapA-CFP, P skf-YFP는 X 및 Y 축 (녹색 액자)에 대각선으로 세포의 한 subpopulation을 보여주었다. 그것이 동시에 두 기자를 표현하기 때문에 subpopulation는 YFP와 CFP 채널에 감지됩니다. 로페즈 외., 유전자 개발 (2009) 23 :1631-1638.
토론
세균성 커뮤니티 유전자 증거 미생물 커뮤니티 33,34의 복잡의 특정 집합을 표현하는 세포의 subpopulations 보여주는 사실. 이 프로토콜은 관심사의 유전자의 표현이 미생물 지역 사회 내에서 전문화된 세포의 특정 subpopulation로 제한 여부를 확인하는 데 도움이됩니다. 전통적인 방법은 전체 미생물 커뮤니티 및 미생물 지역 사회 내에서 유전자 발현의 변동에 대한 유전자 발현이나 microarray 분...
공개
우리는 공개 할게 없다.
감사의 말
이 작품은 뷔르츠부르크 대학에서 감염증 연구 센터 (ZINF)에서 젊은 탐정 연구 프로그램으로 후원됩니다. 후안 C 가르시아-Betancur은 뷔르츠부르크 대학의 생명 과학 대학원 (GSLS)에서 박사 동료입니다.
자료
| Name | Company | Catalog Number | Comments |
| 기술 | 시약의 이름 | 회사 | 카탈로그 번호 |
| 조성을 MSgg | 5mM 인산 칼륨 | 로스 | 6878 |
| 100mM 맙스 | 시그마 - 올드 리치 | M1254 | |
| 마그네슘 염화물 2mM | 로스 | 2189.1 | |
| 칼슘 염화물 700μM | 로스 | A119.1 | |
| 산화철 염화물 50μM | 시그마 - 올드 리치 | 157,740 | |
| 아연 염화물 1μM | Applichem | A2076 | |
| 티아민 2μM | 시그마 - 올드 리치 | 74,625 | |
| 글리세롤 0.5 % | 로스 | 7533 | |
| Gluta친구 0.5 % | 시그마 - 올드 리치 | 49,621 | |
| 트립토판 50μg/ml | 시그마 - 올드 리치 | T0254 | |
| 페닐알라닌 50μg/ml | 시그마 - 올드 리치 | P2126 | |
| 세포 고정 | Paraformaldehyde | 로스 | 0335 |
| 장비의 명칭 | 회사 | 카탈로그 번호 | |
| Sonication | 세포 Sonicator | Bandelin | D-1000 |
| 형광 현미경 | 형광 현미경 | Leica | DMI6000B |
| 소프트웨어의 이름 | 회사 | 카탈로그 번호 | |
| 형광 현미경 | AsaF | Leica | |
| 유동세포계측법 | FCASDiva | BD | |
| 유동세포계측법 | FlowJo | Treestar |
참고문헌
- Costerton, J. W. Overview of microbial biofilms. J. Ind. Microbiol. 15, 137-140 (1995).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiol. Mol. Biol. Rev. 64, 847-867 (2000).
- Kolenbrander, P. E. Oral microbial communities: biofilms, interactions, and genetic systems. Annu. Rev. Microbiol. 54, 413-437 (2000).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerg. Infect. Dis. 8, 881-890 (2002).
- Lopez, D., Vlamakis, H., Kolter, R. Biofilms. Cold Spring Harb. Perspect. Biol. 2, a000398-a000398 (2010).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Latasa, C., Solano, C., Penades, J. R., Lasa, I. Biofilm-associated proteins. C. R. Biol. 329, 849-857 (2006).
- O'Gara, J. P. ica and beyond: biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus. FEMS Microbiol Lett. 270, 179-188 (2007).
- Chai, Y., Chu, F., Kolter, R., Losick, R. Bistability and biofilm formation in Bacillus subtilis. Mol. Microbiol. 67, 254-263 (2008).
- Chen, R., Guttenplan, S. B., Blair, K. M., Kearns, D. B. Role of the sigmaD-dependent autolysins in Bacillus subtilis population heterogeneity. J. Bacteriol. 191, 5775-5784 (2009).
- Guttenplan, S. B., Blair, K. M., Kearns, D. B. The EpsE flagellar clutch is bifunctional and synergizes with EPS biosynthesis to promote Bacillus subtilis biofilm formation. PLoS Genet. 6, e1001243-e1001243 (2010).
- Kearns, D. B., Losick, R. Cell population heterogeneity during growth of Bacillus subtilis. Genes Dev. 19, 3083-3094 (2005).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Paracrine signaling in a bacterium. Genes Dev. 23, 1631-1638 (2009).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Jongbloed, J. D., Kuipers, O. P. Visualization of differential gene expression by improved cyan fluorescent protein and yellow fluorescent protein production in Bacillus subtilis. Appl. Environ. Microbiol. 70, 6809-6815 (2004).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Kuipers, O. P. Single cell analysis of gene expression patterns of competence development and initiation of sporulation in Bacillus subtilis grown on chemically defined media. J. Appl. Microbiol. 101, 531-541 (2006).
- Veening, J. W., Kuipers, O. P., Brul, S., Hellingwerf, K. J., Kort, R. Effects of phosphorelay perturbations on architecture, sporulation, and spore resistance in biofilms of Bacillus subtilis. J. Bacteriol. 188, 3099-3109 (2006).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Stewart, P. S., Franklin, M. J. Physiological heterogeneity in biofilms. Nat. Rev. Microbiol. 6, 199-210 (2008).
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev. Microbiol. 62, 193-210 (2008).
- Aguilar, C., Vlamakis, H., Guzman, A., Losick, R., Kolter, R. KinD is a checkpoint protein linking spore formation to extracellular-matrix production in Bacillus subtilis biofilms. MBio. 1, (2010).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Cannibalism enhances biofilm development in Bacillus subtilis. Mol. Microbiol. 74, 609-618 (2009).
- Arima, K., Kakinuma, A., Tamura, G. Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation. Biochem. Biophys. Res. Commun. 31, 488-494 (1968).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol. Microbiol. 80, 1155-1168 (2011).
- Hardwood, C. R., Cutting, S. M. . Molecular Biological Methods for Bacillus. , (1990).
- Novick, R. P. Genetic systems in staphylococci. Methods Enzymol. 204, 587-636 (1991).
- Yasbin, R. E., Young, F. E. Transduction in Bacillus subtilis by bacteriophage SPP1. J. Virol. 14, 1343-1348 (1974).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Nakano, M. M. srfA is an operon required for surfactin production, competence development, and efficient sporulation in Bacillus subtilis. J. Bacteriol. 173, 1770-1778 (1991).
- Gonzalez-Pastor, J. E., Hobbs, E. C., Losick, R. Cannibalism by sporulating bacteria. Science. 301, 510-513 (2003).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr. Opin. Microbiol. 10, 638-643 (2007).
- Shapiro, J. A. Thinking about bacterial populations as multicellular organisms. Annu. Rev. Microbiol. 52, 81-104 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유