Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Одноклеточный анализ Сенная Bacillus Биопленки с помощью флуоресцентной микроскопии и проточной цитометрии
В этой статье
Резюме
Микробные биопленки, как правило, составляет от различных субпопуляций специализированных клеток. Одноклеточный анализ этих подгрупп требует использования флуоресцентных журналистам. Здесь мы опишем протокол визуализировать и контролировать несколько subpopulationswithin В. Сенная Биопленок с помощью флуоресцентной микроскопии и проточной цитометрии.
Аннотация
Биопленки общий атрибут почти всех бактерий 1-6. Когда бактерии образуют биопленки, клетки заключены в внеклеточный матрикс, который в основном составляют от белков и экзополисахариды, среди прочих факторов 7-10. Микробного сообщества заключенная в биопленки часто показывает дифференциацию различных субпопуляций специализированных клеток 11-17. Эти субпопуляции сосуществовать и часто показывают пространственную и временную организацию внутри биопленки 18-21.
Биопленки в модели Сенная организма Bacillus требует дифференциации различных субпопуляций специализированных клеток. Среди них, субпопуляции матрицы производители, ответственные производить и выделять внеклеточного матрикса биопленки имеет важное значение для формирования биопленок 11,19. Таким образом, дифференциация матрица производителей является отличительной чертой биопленки в B. Сенная.
Мы использовали флуоресцентные журналистам визуализировать и количественно субпопуляции матрица производителей биопленки Б. Сенная 15,19,22-24. Конкретно, мы заметили, что субпопуляции матрица производителей отличается в связи с наличием собственного производства внеклеточного сигнала surfactin 25. Интересно, что surfactin производится субпопуляции специализированные клетки отличается от субпопуляции производителей матрицы 15.
Мы подробно в докладе технического подхода необходимо визуализировать и количественно субпопуляции матрица производителей и surfactin производителей в биопленки В. зиЫШз. Для этого, флуоресцентные журналистам генов, необходимых для производства матриц и surfactin производства вставляются в хромосомы B. Сенная. Репортеры выражаются только в субпопуляции специализированных клеток. Тогда, может быть субпопуляцииконтролируется с помощью флуоресцентной микроскопии и проточной цитометрии (см. рис 1).
Тот факт, что различные субпопуляции специализированных клеток многоклеточного сосуществовать в пределах сообщества бактерий дает нам различные точки зрения о регуляции экспрессии генов у прокариот. Данный протокол рассматривает этот феномен экспериментально и может быть легко адаптирована к любой другой модели работы, выяснить молекулярные механизмы, лежащие в основе фенотипических неоднородность в микробного сообщества.
протокол
1. Маркировка B. Сенная и Анализ биопленки
- Усиление с помощью ПЦР промоторной области гена. Мы покажем, как например, клонирование P Тапа, промоутер генов, ответственных за производство белка Таса матрицы 26. Клон Р тапа в pkm008 вектор (созданные Rudner лаборатории, Гарвардской медицинской школы. Бостон, США) (рис. 2).
- Линеаризации плазмиды ферментативного пищеварения (ферментов рекомендовал XhoI).
- Вызвать природных компетенции в B. Сенная напряжение 168, выполнив один шаг протокола ранее описываемых Харвуд и резки 27.
- Добавить линеаризованной плазмиды в культуре клеток и компетентный выбор для спектиномицину сопротивление после двух часов инкубации.
- Штаммы получены вставили конструкция в нейтральных локус amyE Б. Сенная двойной рекомбинации (рис. 4). Чтобы создатьдвойной надписью напряжения, интегрировать второй репортер в нейтральную КБСМ локуса с помощью плазмиды pDR183 мы представляем на рисунке 3. Вставьте этот репортер используя ту же технику мы описали выше для вставки журналистам клонированы в pKM008.
- Передача репортер от напряжения 168 NCIB3610, который может формировать биопленки. Используйте SPP1 трансдукции фагом протокол 28,29. Рост напряженности в донора TY среде (LB +10 мм MgSO 4 +10 мкМ MnSO 4). Смешайте 200 мл культуры с 100 мкл разведения фага акций. Добавьте 3 мл мягком агаре через 30 мин инкубации и позволяют фага гало возникают при 37 ° C.
- Соберите мягком агаре. Центрифуга его и передать супернатант думал шприц 0,22 мкм фильтр. Используйте этот супернатант заразить культуру получателя штамма выращивают в среде TY. Добавить 30 мкл до 10 мл культуры разбавляют 1:10. Выдержите в течение 30 минут и выберите для устойчивости к антибиотикам через 24 ч инкубации.
- Seвыделите нужную колонии и вырастить его в ночь на LB при 37 ° C.
- SPOT 3 мкл ночной культуры на твердой биопленки вызывающие среднего MSgg 1,5% агар 30. Позвольте клеткам расти в течение 72 часов при температуре 30 ° С (рис. 3). После трех дней роста биопленки образуются на поверхности MSgg агар разработан комплекс морфологических архитектуру на поверхности агара.
2. Дисперсия биопленки и фиксации клеток
- Удаление биопленки форма поверхности MSgg агар помощью зубочистки или пинцет. Согласованность биопленки позволит вам очистить ее от поверхности агара в один кусок.
- Поместите биопленки в 3 мл PBS буфера и разогнать биопленки повторяющихся прохождении через пипетки или иглы. Кроме того, биопленки дисперсии можно сделать с помощью мягкой ультразвуком. Мягкий ультразвуком требуется 12 импульсов с выхода 3 и амплитудой 0,7 секунды.
- Исправить образцы до одной клетки-анализа. Resuspenг 300 мкл суспензии клеток в 1 мл 4% раствора параформальдегида и инкубировать при комнатной температуре в течение ровно семь минут.
Состав на 4% параформальдегид решение:
2 г параформальдегида
50 мл PBS буфера
4 мкл 10 N NaOH
Фильтр решение через 0,22 мкм фильтр и аликвоту - Вымойте клеток после фиксации в буфере PBS в три раза и ресуспендируют их в 300 мкл буфера PBS.
3. Флуоресцентной микроскопии
- Залить 200 мкл 0,8% агарозном на предметное стекло и тщательно ее другой слайд. Снимите верхнюю слайд мягко после 2 минут, чтобы получить слой агарозы прикреплены к слайду дна.
- Spot 2 мкл фиксированные клетки на поверхности слоя агарозы и накройте его стеклом микроскопа.
- Поместите образец в флуоресцентный микроскоп. Мы используем флуоресцентный микроскоп Leica DMI6000B оснащен Leica CRT6000 iIluminatионной системы. Фильтры для YFP являются Ex: BP500/20, Em: BP535/30 и СФП являются Ex: BP426/20, Em: 480/40
- Подвергать образец для возбуждения флуоресценции между 50-200 мс. Установить возбуждения период в соответствии с отрицательным контролем, который показывает не флуоресценции в условиях, отобранных для эксперимента.
- См. флуоресценции изображение того же изображения, полученные с яркой области. Слияние двух изображений в одно изображение. Результаты, полученные из потока флуоресцентной микроскопии с помощью одного-меченных деформации несущих репортер P Тапа-YFP представлены на рисунке 6.
4. Количественная оценка отдельных клеток методом проточной цитометрии
- Дисперсных образцов основных клеток с использованием мягкого ультразвуком. Разрушать ультразвуком образца выполнения 2 серии из 12 импульсов с выходной мощностью 5 и амплитудой 0,7 секунды, чтобы разогнать скопления в отдельные клетки, не вызывая лизис клетки. Подтверждение эффективности клеточной дисперсии с помощью световой микроскопии.
- Разбавьте образцы 1:100 в буфере PBS до цитометрическим анализом. Мы используем проточной цитометрии BD FACS Песнь II. Для YFP флуоресценции, использование лазерного возбуждения при 488 нм в сочетании с 530/30 фильтров. Для CFP флуоресценции, использование лазерного возбуждения при 405 нм в сочетании с 408/40 фильтров.
- Калибровка машины проточной цитометрии с двумя отрицательными контролями. Образец PBS буфера нет клеток в суспензии должна служить в качестве отрицательного контроля за размером частиц воспринимается проточной цитометрии. Пример помечены не флуоресценции репортера должно служить в качестве отрицательного контроля за флуоресценцию чувствительность проточной цитометрии.
- Поместите образец помечены флуоресцентным репортером в проточной цитометрии. Для каждого образца, анализ по крайней мере 50 000 событий с расходом от 300 до 3000 событий в секунду.
- Захват данных с использованием программного обеспечения СУИМ Diva (BD Biosciences) и анализировать его с помощью FlowJo 8.5.2 программного обеспечения. См. сигналов флуоресценции для контроля, которые показывают,нет флуоресценции.
- Представить данные мониторинга сигнала флуоресценции одной-меченных напряжение в двух осях графика. Постройте флуоресценции обнаружена по оси X и числа клеток, экспрессирующих различные уровни флюоресценции по оси Y. Результаты, полученные с помощью проточной цитометрии анализ с помощью одного-меченных деформации несущих репортер P Тапа-YFP представлены на рисунке 8.
- Представить данные мониторинга флуоресцентного сигнала с двойной надписью напряжения в трех осях графика. Постройте флуоресцентного сигнала каждого из каналов, мониторинг в X и Y оси (например, GFP будет измеряться по оси Х и СФП в Y-ось). Земельный участок в Z-оси числа клеток, экспрессирующих каждый репортер и представить их в качестве контура изолиний, которая была бы перпендикулярна плоскости чертежа (рис. 9 и 10).
4. Представитель Результаты
Когда Б. Сенная растет на тарелку бiofilm вызывающие среднего MSgg, формирование биопленок наблюдается после трех дней инкубации при 30 ° C 30. Биопленки показывает сильную последовательность и она может быть снята с поверхности агара в один кусок. Кроме того, биопленки показывает комплекс морфологических архитектуру, которая указывает на различные клетки участвуют групп населения (рис. 5). Например, производство внеклеточного матрикса в биопленки приводит к образованию морщин на поверхности колонии. Эта особенность может быть связана с дифференциацией субпопуляции матрица производителей 19. Кроме того, повышение воздушных структур на поверхности биопленки указывает на наличие субпопуляции спорообразующих клеток, так как споры локализован в апикальной области этих структур 30.
Примеры визуализации дифференцировки клеток в одном-меченых и дважды помечены деформации с помощью флуоресцентной микроскопии тepresented на рисунке 6 и 7, соответственно. Одного штамма помечены флуоресцентным таит в себе репортер P Тапа-CFP, что выражается в субпопуляции матрицы продуцирующих клеток. Это субпопуляции отвечает производить и выделять внеклеточного матрикса, что представляет собой биопленки (рис. 6). Дважды помечены штамм таит в себе репортер P Тапа-CFP 26 и дополнительные репортер P srfAA-YFP 31. Это второй репортер позволяет контролировать субпопуляции клеток, ответственных выделяют сигнальные молекулы surfactin, который вызывает сигнального каскада к дифференциации производителей матрицы (рис. 7). Субпопуляции матрицы производители являются ложными окрашены в синий цвет, а субпопуляции производителей surfactin ложно окрашены в желтый цвет.
Проточная цитометрия анализ с помощью одного-меченных деформации несущих репортер P Тапа-YFP представлена на рисунке 8. Необработанные штамм управления не укрываетлюбой флуоресцентные гены белков показало, одной популяции низкой относительной флуоресценции. Клетки укрывательство P Тапа-YFP в не биопленки вызывающие условия не дифференцировать субпопуляции матрица производителей и всего населения показала, низкой относительной флуоресценции. В биопленки вызывающие состояние, субпопуляции клеток с высокой относительной флуоресценции происходило, наблюдал, как плечо справа от низкой относительной флуоресценции пик 23.
Результаты, полученные с помощью проточной цитометрии анализа с использованием двойной надписью деформации представлен на рисунке 9 и 10. Рисунок 9 мониторинг субпопуляций матрица производителей и производителей surfactin использованием двойной надписью штамм Р Тапа-CFP, P-srfAA YFP. Как управления фоновой флуоресценции был использован штамм не укрывают любой флуоресцентные гены белков. Далее, мы обнаружили каждой подгруппе матриц производители и surfactin производителей в каждом канале флуоресценции, используя один-меченных деформации с в качестве контроля. Дважды помечены штамм Р Тапа-CFP, P-srfAA YFP показал две субпопуляции клеток, экспрессирующих высокого уровня флуоресцентного журналистам. Каждая популяция оформлена, показывая, что нет совпадения по выражению журналистов двух подгруппах специализированных клеток 15. Кроме того, проточной цитометрии анализа с использованием двойной надписью штамм Р SKF-YFP, P-тапа YFP представлена на рисунке 10. Репортер ген контролирует SKF дифференциации субпопуляций каннибалов 32, который был описан дифференцировать согласованно с субпопуляции матрица производителей 24. В этом случае дважды помечены штамма показали одну субпопуляции клеток, экспрессирующих люминесцентные и YFP и СФП. Это показывает, что оба пути дифференциации клеток будут согласованно активируются в тот же субпопуляции.
1.jpg "/>
Рисунок 1. Общая схема эксперимента. Протокол делится на три основных этапа. Первый шаг требует маркировки штамма B. Сенная с корреспондентом сплав, который следит за субпопуляции интерес. Во-вторых, рост меченых штаммов в биопленки, вызывающих условиях. В-третьих, разогнать биопленки и выполнять одноклеточные анализ населения с помощью флуоресцентной микроскопии и проточной цитометрии.

Рисунок 2. Схематическое изображение pKM008 вектор интеграции. Этот вектор интегрируется репортер слияние интересов в нейтральной amyE локус двойной рекомбинации. Промоутер интерес (P тапа) клонируют в вектора с использованием сайтов рестрикции EcoRI и HindIII. Тогда выражение гена CFP находится под контролем промотора P Тапа. Orientatионов генов в плазмиды представляют, как стрела.
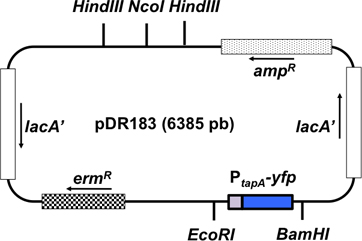
Рисунок 3. Схематическое изображение вектора интеграции pDR183. Этот вектор интегрируется репортер слияние интересов в нейтральной локус КБСМ двойной рекомбинации. Слияние интересов (P Тапа - CFP) клонируют в вектора с использованием сайтов рестрикции EcoRI и BamHI. Ориентация генов в плазмиды представлена в виде стрелки.

Рисунок 4. Схема интеграции журналистам в хромосому B. Сенная двойной рекомбинации. (A) B. Сенная хромосома имеет два нейтральных локусов, amyE и КБСМ, интегрировать репортер слияния, не влияя на развитие биопленки. (B) Процесс двойной рекомбинации pKM008. Линеаризованные плазмиды встраивается в геном B. Сенная двойной рекомбинации. Корреспондент слияние интегрируется в нейтральном локусе в стабильной форме.

Рисунок 5. Биопленки Б. Сенная NCIB3610. Процесс формирования bioflm штамма B. Сенная NCIB 3610 при выращивании на биопленки вызывающие среднего MSgg в течение трех дней при температуре 30 ° C. Последовательные фотографии развитие биопленки были каждые 12 часов.

Рисунок 6. Визуализация субпопуляции матрица производителей под флуоресцентным микроскопом. Выборки из биопленки Б. Сенная P Тапа - CFP было зафиксировано и исследуется под флуоресцентным микроскопом. 200 мс флуоресценциивозбуждения свидетельствует субпопуляции клеток излучающих выше флуоресценции, чем остальные клетки. Мы считаем это субпопуляции как субпопуляции матрица-продуцирующих клеток. Шкала бар 3 мкм.
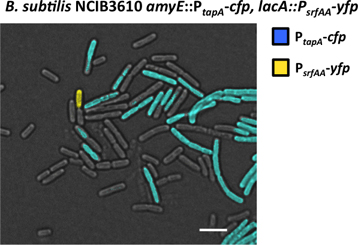
Рисунок 7. Визуализация субпопуляции матрица производителей и surfactin производителей под флуоресцентным микроскопом. Пример из биопленки из B. Сенная P Тапа-CFP, P-srfAA YFP дважды помечены штамм был зафиксирован и исследуется под флуоресцентным микроскопом. Выдержка из 250 мс свидетельствуют две субпопуляции клеток излучающих выше флуоресценции, чем остальные клетки. Один субпопуляции выразил YFP и он был обнаружен только использование канала YFP (ложный окрашены в желтый цвет). Это субпопуляции surfactin производителей. Другой субпопуляции выразил CFP и было исключительно обнаруженных с применением CFP Chann эл. Это субпопуляции матрица производителей. Шкала бар 3 мкм.
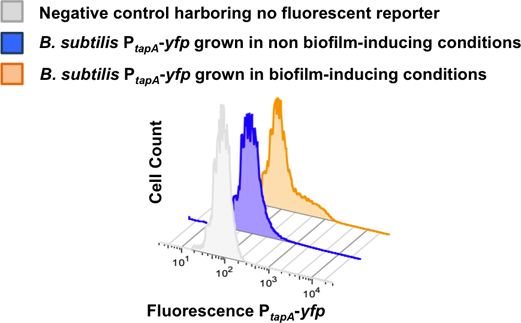
Рисунок 8. Количественное определение субпопуляции матрица производителей с использованием 2-D проточной цитометрии. Дисперсных клетки биопленки Б. Сенная P Тапа-YFP было контролировать с помощью проточной цитометрии. Проточной цитометрии считается 50,000 событий и флуоресценции для каждого события следили. Количество ячеек считаются строится по оси Y, а интенсивность сигнала YFP строится по оси X. Клетки, выращенные в средней LB получить без биопленки условиях вызывающие. Клетки, выращенные в средней MSgg получить биопленки вызывающих условиях. Субпопуляции матрица производителей отличает только в биопленки, вызывающих условиях. Эта цифра была адаптирована с Лопесом и соавт., PNAS (2009) 106 :280-285.
s/ftp_upload/3796/3796fig9.jpg "/>
Рисунок 9. Количественное определение субпопуляции матрица производителей и surfactin производителей с использованием 3-D проточной цитометрии. Флуоресцентный сигнал каналов мониторинга представлены в оси X (для YFP) и Y оси (для CFP). Z-ось измеряет количество клеток, экспрессирующих каждый репортер и количественно, как контур изолинии, перпендикулярных к плоскости бумаги. Число событий, мониторинг в этом эксперименте было 50,000 событий. Левая верхняя панель представляет собой контроль фоновой флуоресценции укрывательство не флуоресцентные гены белков. Правая верхняя панель определяет субпопуляции surfactin производителей в YFP флуоресценции канал (оформлена в желтый цвет) с помощью одного-меченных штамм Р-srfAA YFP. Левая нижняя панель определяет субпопуляции матрица производителей в CFP флуоресценции канал (оформлена в синий) с помощью одного-меченных штамм Р Тапа-CFP. Дважды помечены штамм Р тапа </ EM>, CFP, P-srfAA YFP контролируется в правой панели внизу. Он показал две подгруппы, которые сформулированы в желтый и синий. Эта цифра была адаптирована с Лопесом и соавт., Гены и развития (2009) 23 :1631-1638.
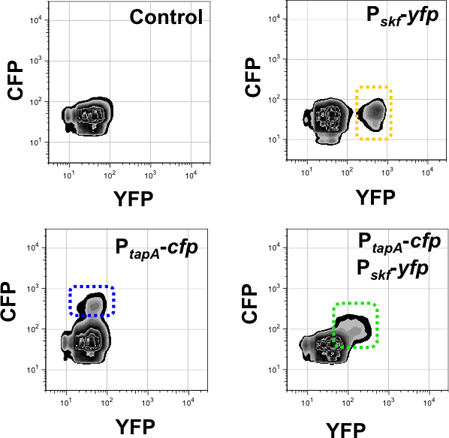
Рисунок 10. Количественное определение субпопуляции матрица производителей и каннибалов с использованием 3-D проточной цитометрии. Флуоресцентный сигнал каналов мониторинга представлены в оси X (для YFP) и Y оси (для CFP). Число событий, мониторинг в этом эксперименте было 50.000. Правая верхняя панель определяет субпопуляции каннибалов в YFP флуоресценции канал (обрамленный желтым цветом) в одном-меченных штамм Р SKF-YFP. Левая нижняя панель определяет субпопуляции матрица производителей в CFP флуоресценции канал (оформлена в синий) в одном-меченных штамм Р Тапа-CFP. Гouble-меченных штамм Р Тапа-CFP, P SKF-YFP показали только один субпопуляции клеток по диагонали на X и Y оси (в зеленой рамке). Это субпопуляции обнаружен в канале YFP и CFP, потому что она выражает двух журналистов одновременно. Лопес и соавт., Гены и развития (2009) 23 :1631-1638.
Обсуждение
Тот факт, что бактериальных сообществ показать субпопуляции клеток, экспрессирующих определенный набор генов, свидетельствует о сложности микробных сообществ 33,34. Этот протокол должен помочь определить, является ли выражение любого интересующего гена ограничена определенной ?...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа финансируется за счет молодых исследователей программы исследований, Центра исследований в области инфекционных болезней (ZINF) из университета Вюрцбурга. С Хуан Гарсия-Бетанкур является членом доктора Высшей школы наук о жизни (GSLS) из Университета Вюрцбурга.
Материалы
| Name | Company | Catalog Number | Comments |
| Техника | Название реагента | Компания | Номер в каталоге |
| MSgg состав | 5 мМ фосфата калия | Рот | 6878 |
| MOPS 100mM | Sigma-Aldrich | M1254 | |
| Хлорид магния 2 мМ | Рот | 2189,1 | |
| 700μM Кальций хлористый | Рот | A119.1 | |
| Железа хлорид 50 мкм | Sigma-Aldrich | 157740 | |
| Цинк хлористый 1 мкм | AppliChem | A2076 | |
| Тиамин 2 мкм | Sigma-Aldrich | 74625 | |
| Глицерин 0,5% | Рот | 7533 | |
| Glutaпомощник 0,5% | Sigma-Aldrich | 49621 | |
| Триптофан 50μg/ml | Sigma-Aldrich | T0254 | |
| Фенилаланин 50μg/ml | Sigma-Aldrich | P2126 | |
| Сотовые фиксации | Параформальдегид | Рот | 0335 |
| Наименование оборудования | Компания | Номер в каталоге | |
| Разрушение ультразвуком | Сотовые Sonicator | Bandelin | D-1000 |
| Флуоресцентной микроскопии | Флуоресцентный микроскоп | Leica | DMI6000B |
| Название программы | Компания | Номер в каталоге | |
| Флуоресцентной микроскопии | Асаф | Leica | |
| Проточная цитометрия | FCASDiva | BD | |
| Проточная цитометрия | FlowJo | Treestar |
Ссылки
- Costerton, J. W. Overview of microbial biofilms. J. Ind. Microbiol. 15, 137-140 (1995).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiol. Mol. Biol. Rev. 64, 847-867 (2000).
- Kolenbrander, P. E. Oral microbial communities: biofilms, interactions, and genetic systems. Annu. Rev. Microbiol. 54, 413-437 (2000).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerg. Infect. Dis. 8, 881-890 (2002).
- Lopez, D., Vlamakis, H., Kolter, R. Biofilms. Cold Spring Harb. Perspect. Biol. 2, a000398-a000398 (2010).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Latasa, C., Solano, C., Penades, J. R., Lasa, I. Biofilm-associated proteins. C. R. Biol. 329, 849-857 (2006).
- O'Gara, J. P. ica and beyond: biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus. FEMS Microbiol Lett. 270, 179-188 (2007).
- Chai, Y., Chu, F., Kolter, R., Losick, R. Bistability and biofilm formation in Bacillus subtilis. Mol. Microbiol. 67, 254-263 (2008).
- Chen, R., Guttenplan, S. B., Blair, K. M., Kearns, D. B. Role of the sigmaD-dependent autolysins in Bacillus subtilis population heterogeneity. J. Bacteriol. 191, 5775-5784 (2009).
- Guttenplan, S. B., Blair, K. M., Kearns, D. B. The EpsE flagellar clutch is bifunctional and synergizes with EPS biosynthesis to promote Bacillus subtilis biofilm formation. PLoS Genet. 6, e1001243-e1001243 (2010).
- Kearns, D. B., Losick, R. Cell population heterogeneity during growth of Bacillus subtilis. Genes Dev. 19, 3083-3094 (2005).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Paracrine signaling in a bacterium. Genes Dev. 23, 1631-1638 (2009).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Jongbloed, J. D., Kuipers, O. P. Visualization of differential gene expression by improved cyan fluorescent protein and yellow fluorescent protein production in Bacillus subtilis. Appl. Environ. Microbiol. 70, 6809-6815 (2004).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Kuipers, O. P. Single cell analysis of gene expression patterns of competence development and initiation of sporulation in Bacillus subtilis grown on chemically defined media. J. Appl. Microbiol. 101, 531-541 (2006).
- Veening, J. W., Kuipers, O. P., Brul, S., Hellingwerf, K. J., Kort, R. Effects of phosphorelay perturbations on architecture, sporulation, and spore resistance in biofilms of Bacillus subtilis. J. Bacteriol. 188, 3099-3109 (2006).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Stewart, P. S., Franklin, M. J. Physiological heterogeneity in biofilms. Nat. Rev. Microbiol. 6, 199-210 (2008).
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev. Microbiol. 62, 193-210 (2008).
- Aguilar, C., Vlamakis, H., Guzman, A., Losick, R., Kolter, R. KinD is a checkpoint protein linking spore formation to extracellular-matrix production in Bacillus subtilis biofilms. MBio. 1, (2010).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Cannibalism enhances biofilm development in Bacillus subtilis. Mol. Microbiol. 74, 609-618 (2009).
- Arima, K., Kakinuma, A., Tamura, G. Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation. Biochem. Biophys. Res. Commun. 31, 488-494 (1968).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol. Microbiol. 80, 1155-1168 (2011).
- Hardwood, C. R., Cutting, S. M. . Molecular Biological Methods for Bacillus. , (1990).
- Novick, R. P. Genetic systems in staphylococci. Methods Enzymol. 204, 587-636 (1991).
- Yasbin, R. E., Young, F. E. Transduction in Bacillus subtilis by bacteriophage SPP1. J. Virol. 14, 1343-1348 (1974).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Nakano, M. M. srfA is an operon required for surfactin production, competence development, and efficient sporulation in Bacillus subtilis. J. Bacteriol. 173, 1770-1778 (1991).
- Gonzalez-Pastor, J. E., Hobbs, E. C., Losick, R. Cannibalism by sporulating bacteria. Science. 301, 510-513 (2003).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr. Opin. Microbiol. 10, 638-643 (2007).
- Shapiro, J. A. Thinking about bacterial populations as multicellular organisms. Annu. Rev. Microbiol. 52, 81-104 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены