É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise de uma única célula de Bacillus subtilis Os biofilmes utilizando microscopia de fluorescência e citometria de fluxo
Neste Artigo
Resumo
Biofilmes microbianos são geralmente constituídos por subpopulações distintas de células especializadas. De célula única análise destas subpopulações requer a utilização de repórteres fluorescentes. Aqui nós descrevemos um protocolo para visualizar e monitorar vários subpopulationswithin B. subtilis Biofilmes através de microscopia de fluorescência e citometria de fluxo.
Resumo
Formação de biofilme é um atributo geral para quase todos 1-6 bactérias. Quando as bactérias formar biofilmes, as células são encerradas em matriz extracelular que é principalmente constituída por proteínas e exopolissacarídeos, entre outros factores 7-10. A comunidade microbiana encaixada dentro do biofilme, muitas vezes mostra a diferenciação de subpopulação distinta de células especializadas 11-17. Estas subpopulações coexistir e muitas vezes mostram organização espacial e temporal dentro do biofilme 18-21.
A formação de biofilme no modelo de Bacillus subtilis organismo requer a diferenciação de subpopulações distintas de células especializadas. Entre eles, a subpopulação de produtores de matriz, responsáveis para produzir e secretar a matriz extracelular do biofilme é essencial para a formação de biofilme 11,19. Assim, a diferenciação dos produtores de matrizes é uma característica da formação de biofilme em B. subtilis.
Usámos repórteres fluorescentes para visualizar e quantificar a subpopulação de produtores de matriz em biofilmes de B. subtilis 15,19,22-24. Concretamente, observou-se que a subpopulação de produtores de matriz diferencia em resposta à presença de auto-produzido sinal extracelular surfactina 25. Curiosamente, surfactina é produzida por uma subpopulação de células especializadas diferentes a partir da subpopulação de produtores de matriz 15.
Temos detalhadas neste relatório a abordagem técnica necessária para visualizar e quantificar a subpopulação de produtores de matrizes e produtores surfactina dentro dos biofilmes de B. subtilis. Para fazer isso, repórteres fluorescentes de genes necessários para a produção de matriz e da produção surfactina são inseridos no cromossoma de B. subtilis. Repórteres são expressos apenas em uma subpopulação de células especializadas. Em seguida, as subpopulações pode sermonitorizada utilizando microscopia de fluorescência e citometria de fluxo (ver Fig. 1).
O fato de que diferentes subpopulações de células especializadas coexistir dentro de comunidades multicelulares de bactérias nos dá uma perspectiva diferente sobre a regulação da expressão gênica em procariontes. Este protocolo aborda esse fenômeno experimentalmente e pode ser facilmente adaptado a qualquer modelo de outros, para elucidar os mecanismos moleculares subjacentes à heterogeneidade fenotípica dentro de uma comunidade microbiana.
Protocolo
1. Rotulagem B. subtilis e ensaio de formação de biofilme
- Amplificar por PCR da região promotora do gene de interesse. Nós mostramos como exemplo, a clonagem de P tapa, o promotor dos genes responsáveis pela produção de proteína de matriz Tasa 26. Clone P tapa em pkm008 vetor (criado pelo laboratório Rudner, Harvard Medical School. Boston, EUA) (Fig. 2).
- Linearizar os plasmídeos por digestão enzimática (Enzyme recomendada, Xhol).
- Induzir competência natural em B. subtilis estirpe 168, seguindo o protocolo de um passo anteriormente descrito por Harwood e Cutting 27.
- Adicionar os plasmídeos linearizados para a cultura de células competentes e selecção de resistência à espectinomicina após duas horas de incubação.
- Estirpes obtidas ter sido inserido o construto no locus amyE neutro de B. subtilis por recombinação dupla (Fig. 4). Para criaruma estirpe de duplo rotulado, integrar o repórter para o segundo laca lócus neutro usando o plasmídeo pDR183 apresentamos na figura 3. Inserir este repórter usando a mesma técnica descrita acima para a inserção de repórteres clonado em pKM008.
- Transferir o repórter a partir da estirpe 168 de NCIB3610 que é capaz de formar biofilmes. Utilizar a transdução de fago SPP1 protocolo 28,29. Cresce tensão doador em meio TY (LB +10 mm MgSO4 +10 mM MnSO 4). Misturar 200 ul da cultura com 100 ul de diluição de fago estoque. Adicionar 3 ml de agar mole após 30 min de incubação e permitir halos de fagos de surgir a 37 ° C.
- Recolher o agar mole. Centrifugar-lo e passar o sobrenadante pensou uma seringa de 0,22 filtro. Use este sobrenadante para infectar uma cultura da estirpe receptora crescidas em meio TY. Adicionar 30 ul a 10 ml de cultura diluída 1:10. Incubar durante 30 min e selecção de resistência a antibióticos, após 24 h de incubação.
- Secionar uma colônia e crescer durante a noite em LB a 37 ° C.
- Manchar 3 uL da cultura durante a noite em meio de indução de biofilme-sólido MSgg ágar 1,5% 30. Permitir que as células a crescer durante 72 horas a 30 ° C (Figura 3). Após três dias de crescimento, biofilmes formados na superfície do agar MSgg desenvolvida uma arquitectura de complexo morfológica na superfície do agar.
2. Dispersão de biofilme e fixação das células
- Remover a forma de biofilme da superfície do agar MSgg usando um palito de dentes ou pinças. A consistência do biofilme deve permitir-lhe a descascar-lo a partir da superfície do agar em uma peça.
- Coloque o biofilme em 3 ml de tampão PBS e dispersar o biofilme por passagem através de uma pipeta repetitivo ou uma agulha. Alternativamente, a dispersão de biofilme pode ser feito usando sonicação suave. Sonicação suave requer 12 pulsos com uma saída de 3 e amplitude de 0,7 segundos.
- Fix amostras análise única célula anterior. Resuspend uL 300 da suspensão de células em 1 ml de solução de paraformaldeído a 4% e incubar à temperatura ambiente durante exactamente sete minutos.
Composição da solução de paraformaldeído a 4%:
2 g de paraformaldeído
50 ml de tampão PBS
4 uL 10 N NaOH
Filtrar a solução através de um filtro de 0,22 UM e alíquota - Lave as células após fixação em tampão PBS três vezes e ressuspender-los em 300 uL de tampão PBS.
3. A microscopia de fluorescência
- Despeje 200 mL de agarose 0,8% sobre uma lâmina de microscópio e, cuidadosamente, cobri-lo com outro slide. Remover a corrediça superior suavemente após 2 minutos para se obter uma camada de agarose ligado à corrediça do fundo.
- UL local 2 de células fixas sobre a superfície da camada de agarose e cobrir com uma tampa de vidro de microscópio.
- Colocar a amostra no microscópio de fluorescência. Usamos um Microscópio de fluorescência Leica DMI6000B equipado com um CRT6000 Leica iIluminatião sistema. Os filtros são para YFP Ex: BP500/20, Em: BP535/30 e PCP são Ex: BP426/20, Em: 480/40
- Exponha sua amostra para uma fluorescência de excitação entre 50-200 ms. Definir o período de excitação de acordo com um controlo negativo que não mostra nenhuma fluorescência nas condições seleccionadas para a experiência.
- Referem-se a imagem de fluorescência para a mesma imagem obtida com o campo brilhante. Mesclar as duas imagens em uma imagem. Os resultados obtidos a partir de microscopia de fluxo de fluorescência usando uma única estirpe marcada com abrigando o repórter P tapa-YFP estão representados na figura 6.
4. Quantificação de células individuais por citometria de fluxo
- Dispersar a amostra de células fixas usando sonicação suave. Sonicar a amostra realizando 2 série de 12 impulsos com uma saída de 5 e amplitude de 0,7 segundos, para dispersar aglomerados em células individuais, sem causar a lise das células. Confirmar a eficiência da dispersão de células por microscopia de luz.
- , Diluir a amostra 1:100 em tampão de PBS antes da análise de citometria de fluxo. Nós usamos um citômetro de fluxo BD FACS Canto II. Para YFP fluorescência, utilizar uma excitação com laser a 488 nm em conjugação com um filtro 530/30. Para PCP de fluorescência, utilizar a excitação com laser a 405 nm em conjugação com um filtro 408/40.
- Calibrar o citómetro de fluxo máquina com dois controles negativos. Uma amostra de tampão PBS sem células em suspensão devem servir como controlo negativo para o tamanho das partículas detectado pelo citómetro de fluxo. Uma amostra marcada com fluorescência nenhum repórter deve ser servir como controlo negativo para a sensibilidade de fluorescência do citómetro de fluxo.
- Colocar a amostra marcada com o repórter fluorescente no citómetro de fluxo. Para cada amostra, analisar pelo menos 50.000 acontecimentos com uma taxa de fluxo entre 300 e 3000 eventos por segundo.
- Captura de dados usando FACS Diva software (BD Biosciences) e analisá-lo usando FlowJo software 8.5.2. Consulte sinais de fluorescência para o controle que mostrams de fluorescência não.
- Apresentar os dados de monitoramento do sinal de fluorescência de uma única estirpe marcada em um gráfico de dois eixos. Traça-se a sinal de fluorescência detectada no eixo X e do número de células que expressam os diferentes níveis de fluorescência no eixo Y. Os resultados obtidos a partir de análise de citometria de fluxo utilizando uma única estirpe marcada com abrigando o repórter P tapa-YFP estão representados na figura 8.
- Apresentar os dados de monitoramento do sinal de fluorescência de uma estirpe duplo marcado em um gráfico de três eixos. Traça-se a sinal de fluorescência de cada um dos canais monitorados em eixos X e Y (por exemplo, a GFP seria medido no eixo X e PCP no eixo Y). Lote no eixo Z do número de células que expressam cada repórter e apresentá-los como isolinhas de contorno que seria perpendicular ao plano do papel (Fig. 9 e 10).
4. Os resultados representativos
Quando B. subtilis cresce em uma placa de biofilm indutora de MSgg médio, a formação de biofilme é observada após três dias de incubação a 30 ° C 30. O biofilme mostra consistência forte e pode ser removida a partir da superfície do agar em uma peça. Além disso, o biofilme mostra uma arquitectura de complexo morfológica que é indicativo das subpopulações de células distintas participantes (Fig. 5). Por exemplo, a produção da matriz extracelular nos resultados de biofilmes na formação de rugas na superfície da colónia. Esta característica pode ser correlacionado com a diferenciação da subpopulação de produtores de matriz 19. Do mesmo modo, o aumento das estruturas aéreas na superfície do biofilme é indicativo da presença de uma subpopulação de células esporulados, uma vez que os esporos localizada na área apical dessas estruturas 30.
Exemplos de visualização de diferenciação celular de um único r-rotulados e uma estirpe de duplo rotulado usando microscopia de fluorescência sãoepresented na figura 6 e 7, respectivamente. A estirpe de um único rotulado abriga o repórter fluorescente P tapa-CFP que é expresso na subpopulação de células produtoras de matriz. Esta subpopulação é responsável para produzir e secretar a matriz extracelular que constitui o biofilme (Fig. 6). A cepa duplo marcado abriga o repórter P tapa-PCP 26 eo repórter adicional P srfAA-YFP 31. Este repórter segundo permite controlar a subpopulação de células responsáveis para secretar o surfactina molécula de sinalização, o que desencadeia a cascata de sinalização para a diferenciação dos produtores de matriz (Fig. 7). Subpopulação de produtores de matrizes são falsas em tons de azul, enquanto a subpopulação de produtores surfactina é falso colorido do amarelo.
Análise de citometria de fluxo utilizando uma única estirpe marcada com abrigando o repórter P tapa-YFP é apresentada na figura 8. Estirpe de controlo não tratado não abrigandoquaisquer genes de proteínas fluorescentes mostrou uma única população de fluorescência relativamente baixo. As células que abrigam P tapa-YFP em não biofilme condições indutoras de não diferenciar a subpopulação de produtores de matrizes e toda a população mostrou fluorescência relativamente baixo. Em biofilme indutora de condição, uma subpopulação de células com fluorescência relativa elevada ocorreu, observado como um ombro para a direita do pico de fluorescência relativa baixa 23.
Resultados obtidos por análise de citometria de fluxo utilizando uma estirpe de duplo rotulados são representados na figura 9 e 10. Figura 9 monitoradas as subpopulações de produtores de matrizes e produtores surfactina usando a estirpe duplo marcado P tapa-PCP, P srfAA-YFP. Como controle de fluorescência de fundo foi utilizado uma estirpe que não abrigando quaisquer genes de proteínas fluorescentes. Em seguida, foram detectados cada subpopulação de produtores de matriz e os produtores surfactina em cada canal de fluorescência, utilizando a estirpe de um único rotulado s como controles. A estirpe de duplo rotulado P tapa-CFP, P-srfAA YFP mostrou duas subpopulações de células que expressam níveis elevados dos repórteres fluorescentes. Cada população é moldada, mostrando que não há sobreposição na expressão dos repórteres entre as duas subpopulações de células especializadas 15. Do mesmo modo, a análise de citometria de fluxo utilizando duas vezes rotulado estirpe P SKF-YFP, P tapa-YFP é apresentada na figura 10. O repórter para o gene da SKF monitoriza a diferenciação da subpopulação de canibais 32, que tem sido descritos para diferenciar coordenadamente com a subpopulação de produtores de matriz 24. Neste caso, a estirpe de duplo rotulado mostrou uma subpopulação de células fluorescentes único que expressam tanto YFP e PCP. Isto indicou que ambas as vias de diferenciação de células são coordenadamente activado na subpopulação mesmo.
1.jpg "/>
Figura 1. Esquema geral do experimento. O protocolo é dividido em três etapas principais. O primeiro passo requer etiquetar a estirpe de B. subtilis com a fusão repórter que monitora a subpopulação de interesse. Em segundo lugar, crescer as estirpes identificadas em condições indutoras de biofilme. Em terceiro lugar, dispersar o biofilme e levar a cabo de uma única célula análise da população utilizando microscópio de fluorescência e citometria de fluxo.

Figura 2. Representação esquemática do pKM008 vetor de integração. Este vector integra a fusão repórter de interesse para o amyE lugar neutro por recombinação dupla. O promotor de interesse (P tapa) é clonado em vector usando a restrição sítios EcoRI e HindIII. Em seguida, a expressão do gene PCP está sob o controlo do promotor P Tapa. O orientatião dos genes no plasmídeo é representada como uma seta.
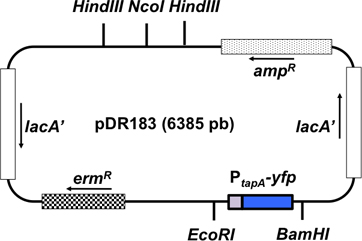
Figura 3. Representação esquemática do vetor de integração pDR183. Este vector integra a fusão repórter de interesse para o lugar neutro laca por recombinação dupla. A fusão de interesse (P tapa - PCP) é clonado no vector utilizando o restrição sítios EcoRI e BamHI. A orientação dos genes no plasmídeo é representada como uma seta.

Figura 4. Esquema da integração dos repórteres no cromossoma de B. subtilis por recombinação dupla. (A) B. cromossoma subtilis tem dois loci neutros, amyE e laca, para integrar fusões repórter sem afectar o desenvolvimento do biofilme. (B) Processo de recombinação dupla de pKM008. Plasmídeo linearizado se integra no genoma de B. subtilis por recombinação dupla. A fusão repórter integra o locus neutro de uma maneira estável.

Figura 5. Formação de biofilmes de B. subtilis NCIB3610. Processo de formação bioflm da estirpe B. subtilis NCIB 3610 quando crescem na MSgg meio indutor de biofilme, durante três dias a 30 ° C. Imagens seqüenciais do desenvolvimento de biofilme foram realizadas a cada 12h.

Figura 6. A visualização da subpopulação de produtores matriz sob um microscópio de fluorescência. Uma amostra a partir de um biofilme de B. subtilis P tapa - PCP foi fixado e examinado ao microscópio de fluorescência. 200 ms de fluorescênciaexcitação evidenciado uma subpopulação de células que emitem fluorescência mais elevada do que o resto das células. Considerou-se esta subpopulação como a subpopulação de células produtoras de matriz. Barra de escala é 3 mm.
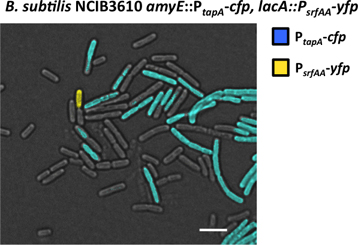
Figura 7. A visualização da subpopulação de produtores de matriz e os produtores surfactina sob um microscópio de fluorescência. Exemplo a partir de um biofilme da B. subtilis P tapa-PCP, P tensão srfAA-YFP duplo marcado foi fixado e examinado ao microscópio de fluorescência. Tempo de exposição de 250 ms evidenciadas duas subpopulações de células que emitem fluorescência mais elevada do que o resto das células. Uma subpopulação expressa YFP e foi detectado apenas usando o canal YFP (falsa cor em amarelo). Esta é a subpopulação de produtores surfactina. Outra subpopulação expressa PCP e foi detectado exclusivamente usando o Chann PCP el. Esta é a subpopulação de produtores de matriz. Barra de escala é 3 mm.
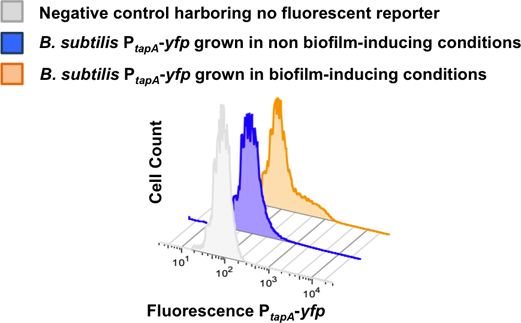
Figura 8. Quantificação da subpopulação de produtores de matriz usando 2-D de citometria de fluxo. Dispersed células a partir de um biofilme de B. subtilis P tapa-YFP foram monitorados por citometria de fluxo. O citómetro de fluxo contadas 50.000 acontecimentos e do sinal de fluorescência para cada evento foi monitorado. Número de células contadas é traçado no eixo Y, enquanto a intensidade do sinal YFP é traçado no eixo X. As células foram cultivadas em meio LB para obter as condições de não-biofilme indutores. As células foram cultivadas em MSgg meio para a obtenção de biofilme condições indutoras de. A subpopulação de produtores de matriz diferencia apenas em condições indutoras de biofilme. Este valor foi adaptado a partir Lopez et al., PNAS (2009) 106 :280-285.
s/ftp_upload/3796/3796fig9.jpg "/>
Figura 9. Quantificação da subpopulação de produtores de matriz e os produtores surfactina utilizando 3-D citometria de fluxo. Sinal de fluorescência dos canais monitorados são apresentados no eixo X (por YFP) e ao eixo Y (por PCP). O eixo Z mede o número de células que expressam cada repórter e é quantificada como isolinhas contorno perpendiculares ao plano do papel. O número de eventos monitorados neste experimento foi de 50.000 eventos. Painel superior esquerdo apresenta um controlo de fluorescência de fundo abrigando nenhum gene da proteína fluorescente. Painel superior direito detecta a subpopulação de produtores surfactina na fluorescência YFP canal (com moldura em amarelo) usando um único marcado cepa P srfAA-YFP. Painel inferior esquerdo detecta a subpopulação de produtores da matriz na fluorescência PCP canal (com moldura em azul) usando uma única estirpe marcada P tapa-PCP. O duplo-rotulado estirpe P tapa </ Em>-PCP, P srfAA-YFP é monitorado no painel inferior direito. Ele mostrou duas subpopulações que estão enquadradas em amarelo e azul. Este valor foi adaptada de López et al., Genes and Development (2009) 23 :1631-1638.
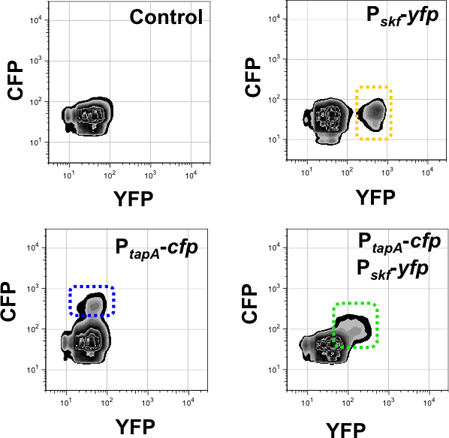
Figura 10. Quantificação da subpopulação de produtores de matriz e canibais utilizando 3-D citometria de fluxo. Sinal de fluorescência dos canais monitorados são apresentados no eixo X (por YFP) e ao eixo Y (por PCP). O número de eventos monitorados neste experimento foi 50,000. Painel superior direito detecta a subpopulação de canibais na fluorescência YFP canal (com moldura na cor amarela) em uma única estirpe marcada P skf-YFP. Painel inferior esquerdo detecta a subpopulação de produtores da matriz na fluorescência PCP canal (com moldura em azul) em uma única estirpe marcada P tapa-PCP. A double marcado cepa P tapa-PCP, P skf-YFP mostrou apenas uma subpopulação de células em diagonal para os eixos X e Y (enquadrada no verde). Esta subpopulação é detectada no canal YFP e PCP porque expressa os dois repórteres simultaneamente. López et al, Genes and Development (2009) 23 :1631-1638.
Discussão
O fato de que as comunidades bacterianas mostrar subpopulações de células que expressam conjunto específico de genes evidencia a complexidade das comunidades microbianas 33,34. Este protocolo deve ajudar a determinar se a expressão de qualquer gene de interesse é restrita a uma subpopulação específica de células especializadas na comunidade microbiana. Visualização destas subpopulações exige o desenvolvimento de novas técnicas, porque os métodos tradicionais para monitorizar a expressão do ge...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho é financiado pelo Programa Jovem Investigador de Pesquisa, do Centro de Pesquisas de Doenças Infecciosas (Zinf) da Universidade de Würzburg. Juan C Garcia-Betancur é uma bolsa de doutoramento da Escola de Pós-Graduação em Ciências Biológicas (GSLs) da Universidade de Würzburg.
Materiais
| Name | Company | Catalog Number | Comments |
| Técnica | Nome do reagente | Companhia | Número de Catálogo |
| MSgg composição | fosfato de potássio 5 mM | Roth | 6878 |
| MOPS 100mM | Sigma-Aldrich | M1254 | |
| Cloreto de magnésio 2mM | Roth | 2189,1 | |
| Cloreto de cálcio 700μM | Roth | A119.1 | |
| Férricos 50 ìm de cloreto | Sigma-Aldrich | 157740 | |
| 1μM cloreto de zinco | Applichem | A2076 | |
| Tiamina 2μM | Sigma-Aldrich | 74625 | |
| Glicerol 0,5% | Roth | 7533 | |
| Gluta% companheiro de 0,5 | Sigma-Aldrich | 49621 | |
| Triptofano 50μg/ml | Sigma-Aldrich | T0254 | |
| Fenilalanina 50μg/ml | Sigma-Aldrich | P2126 | |
| Fixação das células | Paraformaldeído | Roth | 0335 |
| Nome do equipamento | Companhia | Número de Catálogo | |
| Sonicação | Sonicador celular | Bandelin | D-1000 |
| A microscopia de fluorescência | Microscópio de fluorescência | Leica | DMI6000B |
| Nome do software | Companhia | Número de Catálogo | |
| A microscopia de fluorescência | Asaf | Leica | |
| A citometria de fluxo | FCASDiva | BD | |
| A citometria de fluxo | FlowJo | Treestar |
Referências
- Costerton, J. W. Overview of microbial biofilms. J. Ind. Microbiol. 15, 137-140 (1995).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiol. Mol. Biol. Rev. 64, 847-867 (2000).
- Kolenbrander, P. E. Oral microbial communities: biofilms, interactions, and genetic systems. Annu. Rev. Microbiol. 54, 413-437 (2000).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Donlan, R. M. Biofilms: microbial life on surfaces. Emerg. Infect. Dis. 8, 881-890 (2002).
- Lopez, D., Vlamakis, H., Kolter, R. Biofilms. Cold Spring Harb. Perspect. Biol. 2, a000398-a000398 (2010).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol. Microbiol. 59, 1229-1238 (2006).
- Latasa, C., Solano, C., Penades, J. R., Lasa, I. Biofilm-associated proteins. C. R. Biol. 329, 849-857 (2006).
- O'Gara, J. P. ica and beyond: biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus. FEMS Microbiol Lett. 270, 179-188 (2007).
- Chai, Y., Chu, F., Kolter, R., Losick, R. Bistability and biofilm formation in Bacillus subtilis. Mol. Microbiol. 67, 254-263 (2008).
- Chen, R., Guttenplan, S. B., Blair, K. M., Kearns, D. B. Role of the sigmaD-dependent autolysins in Bacillus subtilis population heterogeneity. J. Bacteriol. 191, 5775-5784 (2009).
- Guttenplan, S. B., Blair, K. M., Kearns, D. B. The EpsE flagellar clutch is bifunctional and synergizes with EPS biosynthesis to promote Bacillus subtilis biofilm formation. PLoS Genet. 6, e1001243-e1001243 (2010).
- Kearns, D. B., Losick, R. Cell population heterogeneity during growth of Bacillus subtilis. Genes Dev. 19, 3083-3094 (2005).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Paracrine signaling in a bacterium. Genes Dev. 23, 1631-1638 (2009).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Jongbloed, J. D., Kuipers, O. P. Visualization of differential gene expression by improved cyan fluorescent protein and yellow fluorescent protein production in Bacillus subtilis. Appl. Environ. Microbiol. 70, 6809-6815 (2004).
- Veening, J. W., Smits, W. K., Hamoen, L. W., Kuipers, O. P. Single cell analysis of gene expression patterns of competence development and initiation of sporulation in Bacillus subtilis grown on chemically defined media. J. Appl. Microbiol. 101, 531-541 (2006).
- Veening, J. W., Kuipers, O. P., Brul, S., Hellingwerf, K. J., Kort, R. Effects of phosphorelay perturbations on architecture, sporulation, and spore resistance in biofilms of Bacillus subtilis. J. Bacteriol. 188, 3099-3109 (2006).
- Vlamakis, H., Aguilar, C., Losick, R., Kolter, R. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev. 22, 945-953 (2008).
- Stewart, P. S., Franklin, M. J. Physiological heterogeneity in biofilms. Nat. Rev. Microbiol. 6, 199-210 (2008).
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev. Microbiol. 62, 193-210 (2008).
- Aguilar, C., Vlamakis, H., Guzman, A., Losick, R., Kolter, R. KinD is a checkpoint protein linking spore formation to extracellular-matrix production in Bacillus subtilis biofilms. MBio. 1, (2010).
- Lopez, D., Fischbach, M. A., Chu, F., Losick, R., Kolter, R. Structurally diverse natural products that cause potassium leakage trigger multicellularity in Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 106, 280-285 (2009).
- Lopez, D., Vlamakis, H., Losick, R., Kolter, R. Cannibalism enhances biofilm development in Bacillus subtilis. Mol. Microbiol. 74, 609-618 (2009).
- Arima, K., Kakinuma, A., Tamura, G. Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation. Biochem. Biophys. Res. Commun. 31, 488-494 (1968).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol. Microbiol. 80, 1155-1168 (2011).
- Hardwood, C. R., Cutting, S. M. . Molecular Biological Methods for Bacillus. , (1990).
- Novick, R. P. Genetic systems in staphylococci. Methods Enzymol. 204, 587-636 (1991).
- Yasbin, R. E., Young, F. E. Transduction in Bacillus subtilis by bacteriophage SPP1. J. Virol. 14, 1343-1348 (1974).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11626 (2001).
- Nakano, M. M. srfA is an operon required for surfactin production, competence development, and efficient sporulation in Bacillus subtilis. J. Bacteriol. 173, 1770-1778 (1991).
- Gonzalez-Pastor, J. E., Hobbs, E. C., Losick, R. Cannibalism by sporulating bacteria. Science. 301, 510-513 (2003).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr. Opin. Microbiol. 10, 638-643 (2007).
- Shapiro, J. A. Thinking about bacterial populations as multicellular organisms. Annu. Rev. Microbiol. 52, 81-104 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados