Method Article
Bitki Tırnak Lipid Polyester Monomer İzolasyonu ve biçim Analizi
Bu Makalede
Özet
Lipid polyesters constitute the structural components of two cell wall modifications, the plant cuticle and suberin-containing diffusion barriers. In this video, we describe a method to depolymerize cutin from whole delipidated leaves. The method can be applied to investigating mutants compromised in either cutin or suberin biosynthesis.
Özet
Terrestrial plants produce extracellular aliphatic biopolyesters that modify cell walls of specific tissues. Epidermal cells synthesize cutin, a polyester of glycerol and modified fatty acids that constitutes the framework of the cuticle that covers aerial plant surfaces. Suberin is a related lipid polyester that is deposited on the cell walls of certain tissues, including the root endodermis and the periderm of tubers, tree bark and roots. These lipid polymers are highly variable in composition among plant species, and often differ among tissues within a single species. Here, we describe a detailed protocol to study the monomer composition of cutin in Arabidopsis thaliana leaves by sodium methoxide (NaOMe)-catalyzed depolymerisation, derivatization, and subsequent gas chromatography-mass spectrometry (GC/MS) analysis. This method can be used to investigate the monomers of insoluble polyesters isolated from whole delipidated plant tissues bearing either cutin or suberin. The method can by applied not only to characterize the composition of lipid polymers in species not previously analyzed, but also as an analytical tool in forward and reverse genetic approaches to assess candidate gene function.
Giriş
Vasküler bitkiler, bitki dokuları ve dış ortam arasında su geçirmez bariyerler olarak işlev dışı katmanları güveniyor. Bu lipofilik hücre duvarı ile ilişkili yapıları, patojenik enfeksiyonun kısıtlama içinde ve bitki dokularında 1 üzerinden gaz, su ve çözünmüş maddelerin pasif taşıma düzenler. Bu tür engeller bitki manikür, bitkiler 2, ve farklı süberin içeren difüzyon bariyerleri özgü bir synapomorphic yapı vardır. Kütikül hücre duvarının 3-5 hücre dışı tarafında pektinli tabakası yoluyla epidermal hücreleri tarafından sentezlenen ve bunlara bağlı olan bir oleofilik bir katmandır. Bu bitki dokularında ve çevre arasındaki hayati bir arayüz olarak işlev, yüksek bitkilerin birincil hava organlarını encases.
Kütin, manikür yapısal matris ve süberin solvent ekstrakte mumlar 2,4 ile bağlantılı iki çözünmez gliserolipid polyesterlerdir. Bu polimerik lipids doymuş ve doymamış yağlı asit türevleri oluşur ve her iki yapısal ve fonksiyonel olarak benzer. Bununla birlikte, kimyasal bileşimi ve yerleştirme siteleri karakteristik farklılıklardan ayırt edilebilir.
Suberin ikincil duvar oluşturan, belirli dahili ve harici dokuların hücre duvarları içinde yer alan bir alifatik polyester. Suberize olmuş dokular köklerinin periderms, yumrular ve ağaç kabuğu, kök endodermis, çiğit katmanları ve iyileşmiş yaralar 2 bulunur. Kütin farklı olarak, suberin poliester genellikle alkoller, doymuş ve mono-doymamış dikarboksilik asitler ve çok uzun zincirli monomerler büyük bir kısmı (C≥20) içerir.
Kütin damarlı bitkilerin 6 içinde en bol lipid polyester ve gliserol ve hidroksi ve hidroksi-epoksi ikameli yağlı asitler 4 olarak C16-C18 yağlı asit ara esterleşmiş türevleri oluşur. Kütin polimerlerin bileşimi iken0, 18-hidroksi-9,10-epoksi 18: 0 ve 18 9,10,18-trihidroksi: 0 yağ asitleri tracheophyte türler arasında değişiklik gösterir, en baskın ana monomerler, 16, 16-dihidroksi, 10 vardır. 2 dikarboksilik asit 7,8: İlginç bir şekilde, Arabidopsis yaprağı ve kütin kök esas olarak 18 oluşmaktadır.
Bitki cuticles da birkaç mikrometre 9 birkaç nanometre arasında değişen kalınlıkta bir önemli ölçüde değişkenlik mevcut. Manikür izolasyonu özellikle bu tür Arabidopsis thaliana'nın 8 gibi çok ince yaprak cuticles için zahmetli ve zaman alıcı bir adım, olduğundan manikür izolasyonu bypass yöntemleri geliştirilmiş ve 7,8 doğrulanmıştır. Burada, sodyum metoksit (NaOMe) katalize depolimerizasyon ve daha sonra gaz kromatografisi / kütle spektrometrisi (GC / MS) analizi ile, Arabidopsis thaliana yapraklarda kütin monomer bileşiminin incelemek için ayrıntılı bir protokol açıklar. Bu protokol co tahlil için sağlam bir yöntem sunmaktadırBütün delipide dokularda bitki lipid poliesterlerin bir kompozisyon, ve daha önce bildirilen protokoller 7,10,11 adapte edilmiştir. Tüm doku örnekleri vardır homojenize ilk ve etraflıca cuticular ve epikütikülar mumlar, membran lipitleri ve triaçilgliseroller dahil solvent ekstrakte lipidlerin kaldırarak, delipide. Hücre duvarı zenginleştirilmiş kalıntıları daha sonra sodyum metoksit ile katalize metanoliz ile kendi kurucu metil ester monomerlere depolimerize edilmektedir. Yağ asidi metil esterleri asitleştirme üzerine ekstre edilebilmekte ve bunların karşılık gelen trimetilsilil veya asetildir türevlerini elde etmek üzere derivatize edilir. Türetilmiş kalıntısı uçucudur ve GC / MS analizi sırasında yapısal konformasyonunun değiştirmeden makul bir sıcaklıkta bir gaz kromatografisi sütunundan elute edilebilir.
Protokol
Not: Bu protokol Bonaventure ve ark uyarlanmıştır. (2004), Molina ve ark. (2006), Li ve diğ. (2013) 7,10,11. Adım 1-5, Şekil 1 'de özetlenmiştir.
1. Doku delipidasyon
Not: Her zaman, kloroform ile tüm cam ve kapaklarını durulayın kullanmadan önce, davlumbaz altında kuru icar.
DİKKAT: Doku homojenizasyon ve davlumbaz altında bütün solvent transferi adımları uygulayın; Her zaman kimyasallarla direkt temastan kaçınmak ve kirlenmeye örnekleri korumak için laboratuvar önlüğü, eldiven ve sıçrama koruyucu gözlük kullanın.
- Ön ısıtma su banyosu aldı ve 85 ° C'ye kadar ısıtma bloğu.
- Politetrafloroetilen (PTFE) -faced Vidalı kapakları olan önceden tartılmış 20 mm x 125 mm ebadındaki bir cam test tüpleri içine her yaprak numunenin yaklaşık olarak 0.5 g tartılır. Numune başına dört çoğaltır ekleyin.
- Bir Erlenmeyer şişesine (yaklaşık 125 ml 2-propanol yerleştirin; samp gramı başına 25 mlle). % 0.01'lik bir nihai konsantrasyona kadar (aynı zamanda butile hidroksitolüen, BHT olarak da bilinir), 2,6-di-tert-bütil-4-metilfenol ekleme (ağırlık / hacim).
Not: Metanol içinde stok çözeltisi (ağ / hac) bir% 5 ila BHT ekleyin (BHT doymamış yağlı asitlerin oksidasyonunu en aza indirir). - Su banyosu içinde 85 ° C'ye kadar ön ısıtma 2-propanol çözeltisi.
- Isıtma bloğu, 85 ° C'de 15 dakika boyunca, her numune tüpü ve ısıya 12 ml sıcak 2-propanol çözücü ekleyin. Bu adım, kesintiye hücrelerden serbest bırakılabilir lipazlar inaktive eder.
- Tüpler oda sıcaklığında kadar soğutulur ve homojen bir süspansiyon elde edilene kadar homojenize ile iyice doku öğütmek olsun.
- Orbital çalkalayıcı numuneler ve 100 rpm ve oda sıcaklığında 1-2 saat çalkalanmıştır.
- 800 x g'de 10 dakika boyunca santrifüj ve supernatant atın.
- 2-propanol eşit hacimde ilave edilir ve oda sıcaklığında 12 saat boyunca çalkalanır.
- 800 x g'de 10 dakika boyunca santrifüj ve supernatant atın.
- 12 ml CH eklemeCı 3: CH3OH (2: 1, h / h) (numunenin gramı başına 25 mi) ila kalıntısı 100 rpm'de ve oda sıcaklığında gece boyunca sallamak.
- 800 x g'de 10 dakika boyunca santrifüj ve supernatant atın.
- 12 ml CHCl3 ekleyin: CH3 OH (1: 2, h / h) ila kalıntısı 100 rpm'de ve oda sıcaklığında gece boyunca sallamak.
- 800 x g'de 10 dakika boyunca santrifüj ve ayrılması için kullanılabilir.
- Numuneler oda sıcaklığında bir gece boyunca davlumbaz altında kurumasına izin verin.
- Tortu hava-kurutun ve daha sonra susuz CaCI2 veya sabit ağırlık (3-5 gün) ulaşılana kadar CaSO 4 üzerinde bir vakum kurutucu içinde yer.
2. depolimerizasyonu: sodyum metoksit ile metanoliziyle (Şekil 2)
UYARI: - 2.4, 2.7 - 2.8, 2.10 - 2.3 adımları uygulayın 2.15 ve 2.17 - - 2.11, 2.13 davlumbaz altında 2.18; Her zaman laboratuvar önlüğü, eldiven ve sıçrama koruyucu gözlük kullanın.
- 60 ° C'ye kadar ısıtın ısı bloğu.
- (Diğer hesaplamalar için önemli), kuru bir tortu ihtiva eden test tüpleri tartılır.
- Her bir tüp, iç standartlar ekleyin: 25 ωL metil heptadecanoate (1 mg / ml stok) ve 25 ul ω-pentadecalactone (1 mg / ml stok).
- Her tüpe 0.9 ml metil asetat, 1,5 ml sodyum metoksit ve 3.6 ml metanol eklenir ve bunları kap. Alternatif olarak, bu üç reaktifler ile, bir reaksiyon karışımı hazırlamak ve her bir örnek için 6 ml'lik alikotları ekleyin.
- 2 60 ° C de saat ve periyodik olarak 15 dakika aralıklarla girdap için ısı örnekleri.
- Numuneler oda sıcaklığına kadar soğumasını bekleyin.
- Yağlı asit metil esterlerinin elde etmek için metilen diklorid (CH2C! 2) ve buzlu asetik asit 1.5 ml 10 ml ekleyin.
- Her bir tüp ve kap doldurmak için tuzlu su çözeltisi (0.5 M NaCI) ekleyin.
- 800 x g'de 10 dakika boyunca 1 dakika santrifüj vorteksleyin örnekleri.
- Poli orta boy tüpleri temizlemek için (alt) Organik fazı aktarın (16 x 125 mm cam test tüpleri(PTFE) -faced vidalı kapak).
- Her bir tüp ve kap doldurmak için tuzlu su çözeltisi (0.5 M NaCI) ekleyin.
- 800 x g'de 10 dakika boyunca 1 dakika santrifüj vorteksleyin örnekleri.
- Sulu (üst) fazı çıkarın ve tekrar 2.11-2.12 adımları.
- Tüm sulu (üst) fazı çıkarın.
- 1 dakika için tüpler, ve vorteks kap, bir çözücü susuz sodyum sülfat (Na SO 2 4) ilave et; Numuneler artık şu güne kadar bırakılabilir. Bu noktada örnekleri davlumbaz altında bir gecede terk edilebilir At.
- Alt Na 2 SO 4 tuzu sıkıştırmak için 800 xg'de 2 dakika süreyle santrifüj.
- Küçük bir cam tek boru (politetrafloroetilen ile 13 x 100 mm ebadındaki bir cam test tüpleri (PTFE) -faced vidalı kapak) organik fazın aktarın.
- Nitrojen altında kuruyana kadar buharlaştırılır ve bir türetme aşamasına geçin. Hemen işleme değilse, -20 ° C'de saklayın Örnekleri buharlaştınldı (örnekleri olabilir,LSO) buharlaştırma basamağından önce saklandı.
Gaz Kromatografi için 3. Türev hazırlanması
DİKKAT: adımlar 3.1.2 ve 3.1.5 gerçekleştirin - davlumbaz altında 3.1.8; Her zaman laboratuvar önlüğü, eldiven ve sıçrama koruyucu gözlük kullanın.
- Trimetilsilil türevleri
- 100 ° C'ye kadar ısıtın ısı bloğu.
- Her tüpe 100 ul piridin ve BSTFA (N, O-Bis trimetilsilil-trifloroasetamid) 100 ul ilave edin ve bunları kap.
- 10 dakika boyunca 100 ° C'de ısı örnekleri.
- Numuneler oda sıcaklığına kadar soğumasını bekleyin.
- Oda sıcaklığında nitrojen altında örnekleri buharlaştınn. Numunelerin ısı uygulamaktan kaçının, monomerler bu aşamada son derece uçucu bulunmaktadır.
- 1 (h / h) heptan: toluen 1 500 ul ekle.
- 800 x g'de 2 dakika süre ile 1 dakika santrifüj vorteksleyin örnekleri.
- GC şişeleri örnekleri ekleyin ve GC / MS analizi geçin.
- Asetiltürevleri
Not: asetilasyondan için adımları değiştirmeniz 3.1.1-3.1.3 yukarıdaki (video gösterilmemiştir) aşağıdaki gibi; 3.1.4-3.1.8 aynı adım:- 60 ° C'ye kadar ısıtın ısı bloğu.
- Piridin 100 ul ve tüpler asetik anhidrid 100 ul (O Ac 2) eklenir.
- Isı örnekleri 60 ° C 'de 1 saat.
4. GC / MS analizi
- HP-5 kılcal kolon (30 mx 0.25 mm x 0.25 mm film kalınlığı) veya eşdeğeri (yani.,% 5 difenil,% 95 dimetil polisiloksan) kullanınız. Program 3 ° C / dakikada 300 ° C'ye kadar 150 ile programlanan helyum taşıyıcı gaz, 1.5 ml / dak olarak belirlenmiştir akış ve fırın sıcaklığı GC.
- 40-600 amu (elektron darbe iyonizasyon) üzerinden tarama moduna bölünmüş enjeksiyon (split oranı 1:10) ve set kütle spektrometresi kullanın.
- Solvent (boş), WT ve mutant çoğaltır, her kullanılarak belirtilen kütin analiz yöntemi de dahil olmak üzere bir dizi tablo oluşturun.
- Yük çözücüve carrousel örnek şişeleri, gerekirse otomatik numune şırınga durulama şişeleri hekzan ekleyin ve sırasını başlatın. Sekansı tamamlandıktan sonra, toplam iyon kromatogram izleri tüm örnekler için kullanılabilir.
5. Veri Analizi
- Yayınlanan kütle spektrumları her zirvenin kütle spektrumu karşılaştırarak veya varsa ticari bir kütüphane arayarak lipit polyester monomerleri tanımlayın.
- Toplam iyon akımı kromatogramdaki Belirlenen her tepe için, GC / MS yazılımı (Ek Şekil 1) den entegrasyonu sonuçları masaya alanları bulmak için kendi tutma kez kullanabilirsiniz.
- Her monomer (sütunlar AB) için, bir monomer Excel tablosu (Ek Dosya 2, sütunlar CF), numune çoğaltmak her için ilgili sütuna entegrasyon tablosu (İletişim Şekil 1, sütun D) bulunan alan değerleri eklemek Bir elektronik tablo Arabidopsis ölçmek içinkütin TMSI türevleridir. Asetillenmiş türevler yerine hazırlanır eğer Ltd. Dosya 3 kullanın.
- BS sütunları (HK) iç standartları (IS) alanlarını ekleyin. Monomer tabloda miktar (mor gölgeli hücreleri için olduğu gibi 0 FAME (IS1) Tamamlayıcı: O, yani yağ asidi metil esterleri türetilmiş olmayan monomerler (FAME) ve dikarboksilik asit dimetil ester (DCA DMEs) için, 17 kullanımı Dosyaları 2/3). Primer alkoller, ferulik asit ve ω-hidroksi asitler de dahil olmak üzere hidroksillenmiş monomerlerin, 15 kullanın: Bileşik ölçümü için tercih IS 0 15-hidroksi FAME (IS2) (monomer tablosunda yeşil-shadded hücreler; 2/3 Yan Files) .
- Her kuru yaprak ağırlığı ekle sütunları çoğaltmak AX-BA (Ek Dosya 2) ya da AQ-AT (Ek Dosya 3); alternatif birimi başına monomer yükleri ifade yüzey alanları hesaplamak ve monomer tabloya alan değerlerini eklemek için yaprakları taramayüzey alanı.
Sonuçlar
. Bu yazıda anlatılan protokol Şekil 1 olmayan kütin lipidlerin 10 katkılarını en aza indirerek, (., Kütin veya süberin yani) lipit polyester monomerleri belirlemek için kurulan toplam 8 arasında sürer tahlil, genel bir bakış sunuyor edilir - 10 gün (GC verilerinin elde edilmesi için ilk dokusu hasat), kurumaya bırakılır ne kadar süre örnekler bağlı olarak değişir.
Seçilen baz katalizörlü metanolizi (Şekil 2) polyesterleri depolimerize yöntemi daha önce kütin ve mantarözü her ikisini de içerir Arabidopsis tohumu için doğrulanmıştır. Dokular ilk homojenize ve etraflıca solvent ekstrakte lipidlerin kaldırmak için delipide edilmiştir. Ekstraksiyondan sonra tortu, verimi, başlangıç taze ağırlığının yüzdesi olarak, A. genellikle% 6 thaliana Col-0 bırakır. Hücre duvarı zenginleştirilmiş tortular bir vakum kurutucu içinde kurutuldu ve daha sonra kendi oluşturucu metil ester monomerlere depolimerize edilirBaz katalizli metillenmenin. İki saatlik inkübasyon uygun depolimerizasyon ve lipid polyester bileşenlerinin geri kazanımı için gerekli kritik süre olarak seçildi. Daha uzun inkübasyon süreleri 2-hidroksi asitler artış ile sonuçlanmıştır; Bu potansiyel membran sfingolipidler 10 kaynaklanmaktadır.
O -TMSi eter türevleri (Şekil 3A) ve O-asetil türevleri (Şekil 3B) Arabidopsis yabani tip yaprak kütin, Şekil 3 'de gösterilmiştir, eğer tipik bir kromatogramı. Her bir en yüksek literatürde 7,8 ve 12 .our video protokol TMSI türevleri hazırlamak için gösterilmiştir genel veritabanı kütle spektrumları ile karşılaştırılarak tespit edildi, fakat örnekler alternatif hidroksil grubu türetmek için asetile edilebilir. Onlar teşhis kitle spektrumları vermek için Silillenmiş türevleri tanımlama amacıyla iyidir. Fakat asetillenmiş türevleri daha kararlı olan ve bir alternatif sililasyonu içinBir kez monomerler, 10 tespit edilmiştir. Sadece GC alev iyonizasyon detektörü (FID) bağlanır olan laboratuarlarda bu protokolü uygulamaya yardımcı olmak için, GC / FID WT yaprak kütin monomer ve yağ asidi metil ester, standartların bir homolog dizi asetillenmiş türevlerden tekabül de gösterilir izleri (Ek Şekil 4).
Bu yöntem nitel ve nicel örnekler arasında farklılıklar mutant analizi için dolayısıyla değerini tespit eder. Bireysel monomer miktarları örnekler arasındaki monomer bolluğu karşılaştırmalar sağlayan ölçümü iç standart yöntemi kullanılarak belirlenmiştir. Pik boyutu (toplam iyon sayısı) polyester monomerlerin mol oranlarını yansıtmıyor olabilir, ancak, açıklığa kavuşturulmalıdır. Bu yağlı asit metil esterleri ve TMSI türevleri (Ek İçerik 1) ya da as olarak Arabidopsis yaprağı kütin monomer miktarlarını hesaplayabilecektir monomerlerin düzenlenebilir tablolar dahil alkollerin asetil türevleri (İletişim Dosyası 2). Bu tablolar, numuneler farklı organ ve bitki türlerinden ekstrakte durumunda adapte edilmesi gerekebilir.
Bir örnek olarak, analiz edilen adres Arabidopsis thalia na Columbia (Col-0), vahşi tip yaprak ve CYP86A2 / ATT1 geni att1-1 (m-1) ve att1-2 iki, daha önce karakterize boş mutant aleli (m-2 ) 13,14. CYP86A alt ailesinin sitokrom P450 monooksijenazlar varsayılan ω-oksidazlar kodlamak ve suberin ve kütin monomer biyosentezi katılmak. Bizim sonuçlarımız (Şekil 4) WT yaprakları ile karşılaştırıldığında mutant yapraklarda üç büyük lipid monomer yükleri önemli azalmalar göstermektedir. 0, 18: 2 ve 18: enzimin tahmin fonksiyonu 16 ile uyumlu olarak 1 dikarboksilatlar, özellikle att1 mutant etkilendi.
"Src =" / files / ftp_upload / 53386 / 53386fig1.jpg "/>
Şekil lipit polyester analizi 1. Genel Bakış. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
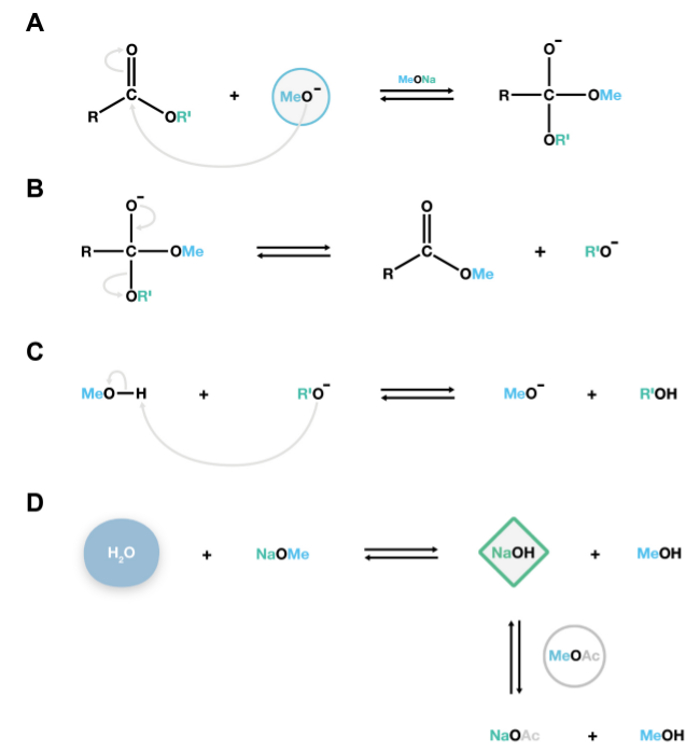
Şekil NaOMe katalizörlü metillenmenin reaksiyon 2. mekanizması. Nükleofilik metoksit anyonları kolaylıkla yağlı asit metil esterlerinin ve alkoksit anyonlar (B) ayrışırlar kararsız bir tetrahedral ara (A) oluşturmak için lipid polyesterlerin karboml karbon saldırır. Bu alkoksitler konjuge bazlar ve bu suretle de ilave depolimerizasyon reaksiyonları (C) sürdürülmesi, katalitik olarak aktif metoksit anyonları rejenere metanol ile reaksiyona girmektedirler. Su içinde mevcut değilseSistem, sodyum hidroksit, geri dönüşü olmayan istenmeyen serbest yağlı asitlerin üretilmesi için esterleri hidrolize eden güçlü bir baz oluşturmak üzere sodyum metoksit ile reaksiyona girer. Metil asetat. Sisteminde (D) içindeki sodyum hidroksit küçük miktarlarda kaldırmak için bir ko-çözücü 15 olarak eklenir, bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
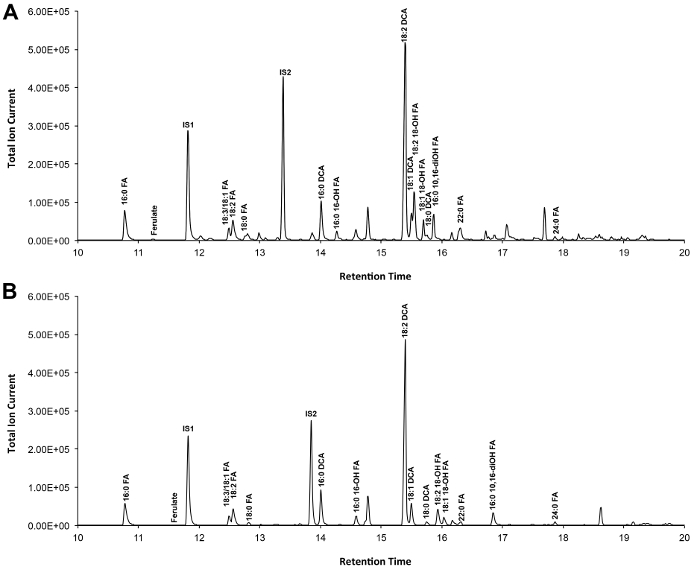
Şekil 3. Yabani tip Arabidopsis thaliana yaprağı kütin monomerlerin Temsilcisi toplam iyon kromatogramı. (A) O -trimethylsilyl (TMSI) eter ve (B) asetat hidroksil türevleri. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
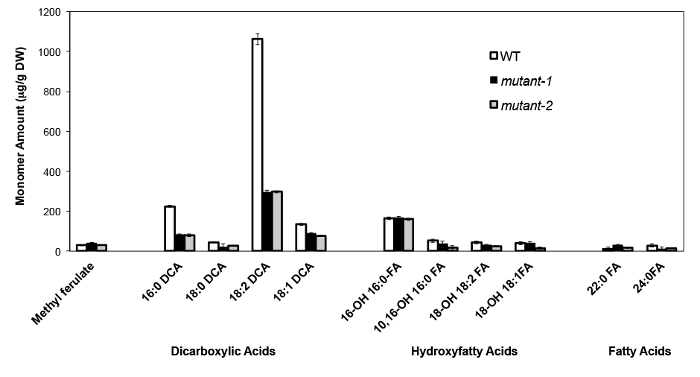
Şekil, Arabidopsis thaliana WT 4. Kütin monomer bileşimi ve CYP86A2 geninin iki boş mutant aleli. (Mutant-1 = att1-1 mutant-2 = att1-2) Hata çubukları (n = 4), ortalamanın standart sapmasını temsil eder . © Blackwell Publishing (2007) izni ile, 13 uyarlanmıştır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
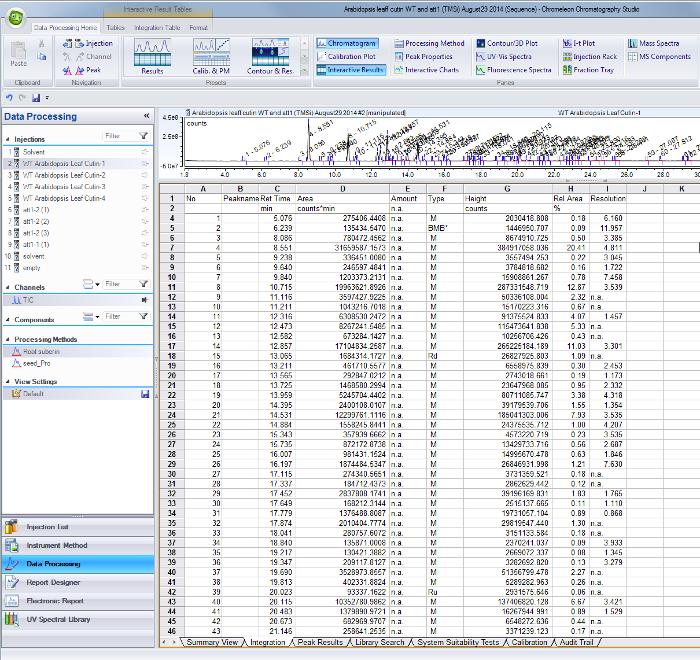
GC / MS yazılım yazmak Şekil 1. Tepe entegrasyon sonuçları tablosu. Belirlenen monomer ve iç standartlarına uygun Peaks kendi retenti ile tanımlanır zaman (sütun C) ve alan değerleri sütununda tablolanmıştır D. bu dosyayı indirmek için buraya tıklayınız.
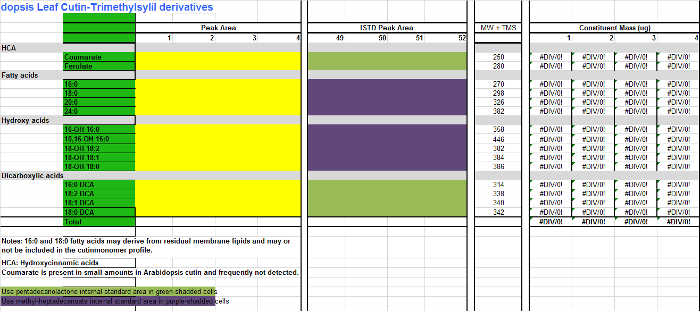
Arabidopsis kütin monomerlerin (hidroksi yağ asidi metil esterlerinin trimetilsilil eter türevleri) İletişim File 2. Tablo. Bu dosyayı indirmek için buraya tıklayınız.
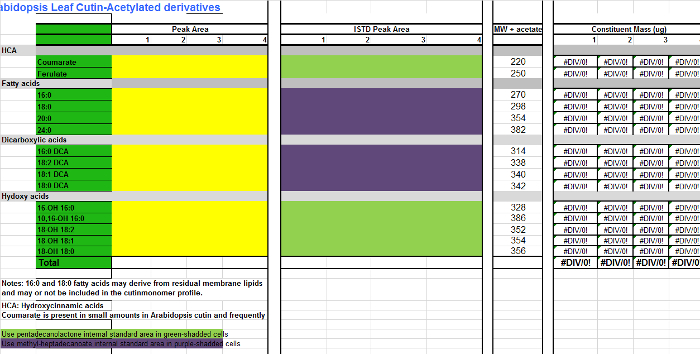
Arabidopsis kütin monomer (hidroksi yağ asidi metil esterlerinin O-asetil türevleri) Company Dosya 3. Tablo.com / files / ftp_upload / 53386 / Supplemental_File_3_Cutin_template_Acetylated_derivatives.xlsx "target =" _ blank "> Bu dosyayı indirmek için buraya tıklayınız.
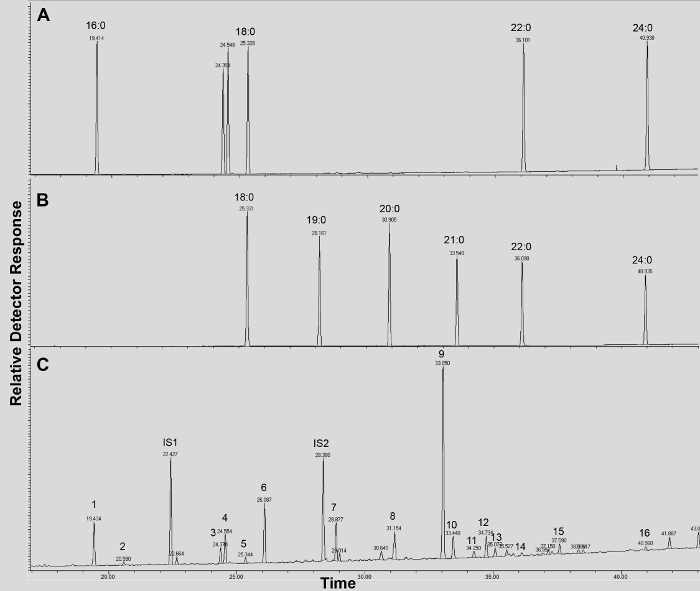
Ek Şekil 4. GC / FID izleri (AB) yağlı asit metil ester (FAME) alıkoyma göstergesi standartları (tepe değeri, her doymuş FAME zincir uzunluğu ile etiketlenmiştir); ve (C) A. asetilatlı thaliana yaprağı WT kütin monomerler. 16: 0, FAME (1), ferulat (2), 18: 3 FAME (3), 18: 1/18: 2 kareleri (4), 18 (5), sinapate 0 FAME (6 tepe numaralarına karşılık gelen ), 16: 0 DCA (7), 16-OH, 16: 0 FAME (8), 18: 2 DCA (9), 18: 1 DCA (10) 18: 0 DCA (11), 18-OH, 18: 2 FAME (12), 18-OH, 18: 1 FAME (13), 20: 0 FAME (14), 10,16-DIOH 16: 0 FAME (15), 24: 0 FAME (16). DCA: dikarboksilik asit dimetil ester; FAME: yağlı asit metil ester; IS1: iç standart 1, 17: 0 FAME; IS2: İç standard 2, 15-OH 15: 0 FAME. Bu dosyayı indirmek için buraya tıklayınız.
Tartışmalar
DNA ve proteinler gibi diğer biyopolimerler farklı olarak, bitki lipid polyesterler bir şablondan yapılmamıştır. Bunun yerine, bu bileşimler, hücre dışı polimerlerin hazırlanması dokularda mevcut enzimlerin özgünlüğünün bağlıdır. Böyle, kimyasal bileşen analizleri gibi bileşenleri lipit polyester bileşimi anlamak için kritik öneme sahiptir.
Ester bağları parçalama kimyasal yöntemler sabunlaşma, hidrojenoliz, asit katalizli metillenmenin ve baz ile katalize edilen metillenmenin 2 içerir. Bunların her biri avantajları ve dezavantajları vardır. Sabunlaşma ikincil reaksiyonlara tabi olabilir serbest yağ asitlerini üretir hidroksi. Lityum alüminyum hidrid ile Hidrojenoliz (LiAIH4) 16 kütin analizi 7 kullanılmaktadır. Hidrojenoliz alkollere işlevselleştirilmiş karbona azaltır ve orijinal yapılar lityum alüminyum deuteride (LiAlD 4) ile deuteriolysis anlaşılabilir olması gerekir.Bu yaklaşımın dezavantajı kendi yapılarının atamalarını yapmak için elde edilen yağ poliollerin deuteriation derecesini karşılaştırmak için yüksek çözünürlüklü GC / MS gerekliliktir. Metanolik boron trifluorid (BF 3) ile asit katalizörlü transesterifikasyon genellikle kütin ve suberin depolymerizations 8,17,18 kullanılmıştır, fakat ayıraç sınırlı bir raf ömrü vardır ve tepkilerini 15 yan nedeniyle eserler katabilmektedir. Metanolik sülfürik asit de diğer yöntemlerle 10 ile karşılaştırıldığında, monomerlerin ancak muhtemelen doğru lipid polyester bileşenleri olmayan 2-hidroksi yağ asitlerinin daha yüksek oranlarda, metil esterler elde edilir.
Bu protokolde belirtilen NaOMe ile katalize edilen transesterifikasyon yöntemi tanımlanması için karakteristik kütle spektrumu sağlayan, hidroksil grupları sililasyonu türetilmiş olan yağlı asit metil esterlerinin üretimi veya asetilasyonu ile fo hidroksil gruplarının daha kararlı türevleri sağlamaktırr ölçümü. Bu tekniğin bir dezavantajı, su reaksiyonda mevcut olduğunda hidroliz transesterifikasyon ile rekabet olmasıdır. Su NaOMe (katalizörü) ile reaksiyona girer ve bu da serbest asitlerin (Şekil 2B) elde etmek için yağlı asit metil esterleri hidrolize eden NaOH üretir. Bu şekilde analiz komplike bir metil ester ve bir TMSI ester türevi: iki tepe her yağlı asit mevcut olacaktır, bu arzu edilmeyen bir yan reaksiyondur. Susuz reaktifler kullanılarak ve sabunlaştırma ile rekabet etmek için, bir ko-çözücü olarak metil asetat eklenerek hidroliz (Şekil 2B) engellemek için ve böylece önemli adımlardır.
Kütin ve suberin 1 ve% 26 gliserol 4 arasında içerirler. Bununla birlikte, bu monomer bu protokolde belirtilen deney şartları ile tespit edilmez. Gliserol yağ asidi metil ester monomerlerin farklı olarak, sulu bir çözücü yıkama adımları sırasında elimine edilecektir, yüksek oranda hidrofilik ve. Bu sınırlama, aynı zamanda birDiğer kütin depolimerizasyon yöntemleri ancak gliserol NN = normal sıfır, bir enzimatik yöntem kullanılarak, transesterleştirme sonrasında elde edilen sulu tabaka içinde belirlenebilir. Seçenek olarak ise, daha hafif koşullar kullanılarak ölçülebilir (örn., 0.05 M NaOMe) daha fazla su çıkarma olmaksızın tüm monomerler tespit etmek için, gliserol ölçümü amacıyla vardır.Her ne kadar yararlı gliserol 19,20 dahil olmak üzere yumuşak koşullar genellikle kütin eksik depolimerizasyonunu verip süberin.
Bir alev iyonizasyon detektörü (FID) bağlı bir GC mevcut ise temsili bir numunenin tepe GC / MS yolu ile teşhis edildikten sonra, tüm çoğaltır nicel amacıyla bu alet olarak analiz edilebilir. , Tutma endeksleri bilinmektedir Alternatif olarak, GC / FID izleri monomerler, tespit edilebilir. Alev iyonizasyon dedektörü büyük ve küçük numune bileşenlerinin miktarının tayini için önemlidir, özellikle yüksek hassasiyet ve orantılılık, geniş bir yelpazede yer alırTek çalıştırır. Buna ek olarak, bu sağlam ve korumak ve 15 işletmek kolaydır.
Açıklanan protokol, bir ya da daha fazla lipit poliester monomer bileşimin farklı mutantların kimyasal özelliklerini sağlayan bitki lipid poliester monomer, güvenilir ve tekrarlanabilir izolasyonu, tanınması ve miktar tayini için izin verir. Prosedür kolayca kökler, tohumlar, yapraklar, saplar ve çiçekler dahil olmak üzere çeşitli bitki malzemeleri, küçük ve dökme hem de miktarını işlemek için adapte edilebilir, ölçeklenebilir. Birçok türün lipid polyester monomerlerin kütle spektral verileri, 21-26. Örneğin yayınlanan ve diğer dokuların ve / veya türlerin bu protokolü adapte zaman bilinmeyen monomerleri tanımlamak için değerli kaynakları teşkil edilmiştir. Bu yöntem, yüksek bitki lipid poliesterlerin sentezi, düzenleme ve dağıtım araştırmalar için de geçerlidir.
Açıklamalar
No conflicts of interest declared.
Teşekkürler
This work was supported by a Natural Sciences and Engineering Research (NSERC)-USRA grant to S.J., and by an NSERC-Discovery Grant to I.M. We thank Richard Bourgault, Meghan Rains, and Amanda Fluke for technical assistance. Seeds of att1-1 and att1-2 mutants were kindly provided by Dr. Jian-Min Zhou, Institute of Genetics and Developmental Biology, Beijing, China.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-propanol | Fisher Scientific | BPA451-4 | Solvent for delipidation |
| Anhydrous sodium sulfate | Fisher Scientific | S421500 | |
| Acetic anhydride | Sigma Aldrich | 320102 | Derivatization agent |
| BSTFA (N,O-bis(trimethylsilyl)-trifluoroacetamide) | Sigma-Aldrich | 15222 | Derivatization agent |
| Butylated hydroxytoluene (BHT) | Sigma-Aldrich | 101162 | Antioxidant |
| Calcium chloride, anhydrous | Fisher Scientific | C614-3 | Desiccation agent |
| Calcium suflate, anhydrous (DRIERITE- 8 MESH with indicator) | Acros Organics | 219090020 | Desiccation agent |
| Chloroform (Trichloromethane) | Fisher Scientific | C6074 | Organic solvent |
| Glacial acetic acid | Fisher Scientific | BP2401212 | Acidification agent |
| Helium carrier gas, compressed | Air Liquide | ALPHAGAZ1-UN1046 | Carrier gas, GC/MS |
| Heptane | Fisher Scientific | H3501 | Organic solvent |
| Hexanes | Fisher Scientific | H3024 | Organic solvent |
| Methanol | Fisher Scientific | A4124 | Organic solvent, transmethylation reactive |
| Methyl acetate | Sigma-Aldrich | 296996 | Organic solvent |
| Methyl heptadecanoate | Sigma-Aldrich | H4515 | Internal standard (1mg/mL stock) |
| Methylene dichloride (Dichloromethane) | Fisher Scientific | D374 | Organic solvent |
| Nitrogen, compressed | Air Liquide | ALPHAGAZ1-UN1044 | Carrier gas, GC-FID |
| Pentadecanolactone | Fluka | 76530 | Internal standard (1 mg/mL stock) |
| Pyridine | Sigma-Aldrich | 270970 | Co-solvent for derivatization |
| Sodium chloride | Fisher Scientific | BP358212 | Saline solution |
| Sodium methoxide (25wt.%) | Sigma-Aldrich | 156256 | Nucleophile |
| Toluene | FIsher Scientific | T2904 | Organic solvent |
| Plant Growth Supplies | |||
| Pro-Mix PGX | Premier Tech Horticulture Ltd | Pro-Mix PGX is recommended to grow Arabidopsis plants (Eddy, R. and Hahn, D.T., 2012,http://docs.lib.purdue.edu/pmag/2) Purdue Methods for Arabidopsis Growth. | |
| PermaNest Humidity Dome | Grower's Solution, LLC, Cookeville, TN | GD2211-24 | |
| Perma-Nest Plant Trays (22x11in) | Grower's Solution, LLC, Cookeville, TN | N/A | |
| Square greenhouse pots, 3.5 inch | Grower's Solution, LLC, Cookeville, TN | P86 | |
| General Purpose Plant Fertilizer, Plant-Prod 20-20-20 | Premier Tech Home and Garden In., Brantford, ON | N/A | |
| Glassware | |||
| 13 x 100 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-13100 | |
| 16 x 125 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-16125 | |
| 20 x 125 mm glass test tubes with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-20125 | |
| GC vial caps | National Scientific | C400051A | |
| GC vial microinserts | National Scientific | C4011631 | |
| GC vials | National Scientific | C40001 | |
| Disposable pasteur pipets | Fisher Scientific | 1367820B | |
| Flasks | Fisher Scientific | ||
| Equipment | |||
| Allegra X15R centrifuge | Beckman Coulter | ||
| Analytic balance | Fisher Scientific | ||
| Belly dancer | A shaker can be used for this purpose if Belly Dancer not available | ||
| DB-5 Capillary GC column | J&W Scientific, CA, USA; | 30 m x 0.25 mm x 0.25 μm film thickness | |
| Desiccator | |||
| Isotemp 202 water bath | Fisher Scientific | ||
| ISQ LT single quadupole mass spectrometer | Thermo Scientific | ||
| Heat block | Fisher Scientific | ||
| Nitrogen evaporator | |||
| Polytron homogenizer | Birkmann | ||
| Trace 1300 gas chromatograph | Thermo Scientific | ||
| Two-stage regulator | Air Liquide | Q1-318B-580 | |
| Vacuum desiccator | Fisher Scientific | ||
| Vortex mixer | Fisher Scientific |
Referanslar
- Kolattukudy, P. Biopolyester membranes of plants: cutin and suberin. Science. 208 (4447), 990-1000 (1980).
- Kolattukudy, P. E. Polyesters in higher plants. Adv. Biochem. Eng. Biot. 71, 1-49 (2001).
- Yeats, T. H., Rose, J. K. C. The formation and function of plant cuticles. Plant Physiol. 163 (1), 5-20 (2013).
- Pollard, M., Beisson, F., Li, Y., Ohlrogge, J. B. Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13 (5), 236-246 (2008).
- Beisson, F., Li-Beisson, Y., Pollard, M. Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15 (3), 329-337 (2012).
- Heredia, A. Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta. 1620 (1-3), 1-7 (2003).
- Bonaventure, G., Beisson, F., Ohlrogge, J., Pollard, M. Analysis of the aliphatic monomer composition of polyesters associated with Arabidopsis epidermis: occurrence of octadeca-cis-6, cis-9-diene-1, 18-dioate as the major component. Plant J. 40 (6), 920-930 (2004).
- Franke, R., et al. Apoplastic polyesters in Arabidopsis surface tissues - A typical suberin and a particular cutin. Phytochemistry. 66 (22), 2643-2658 (2005).
- Vogg, G., et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid -ketoacyl-CoA synthase. J. Exp. Bot. 55 (401), 1401-1410 (2004).
- Molina, I., Bonaventure, G., Ohlrogge, J., Pollard, M. The lipid polyester composition of Arabidopsis thaliana and Brassica napus seeds. Phytochemistry. 67 (23), 2597-2610 (2006).
- Li-Beisson, Y., et al. Acyl-lipid metabolism. The Arabidopsis Book. 11, e0161 (2013).
- Molina, I., Ohlrogge, J. B., Pollard, M. Deposition and localization of lipid polyester in developing seeds of Brassica napus and Arabidopsis thaliana. Plant J. 53 (3), 437-449 (2008).
- Xiao, F., et al. Arabidopsis CYP86A2 represses Pseudomonas syringae type III genes and is required for cuticle development. EMBO J. 23 (14), 2903-2913 (2004).
- Christie, W. W., Han, X. . Lipid Analysis - Isolation, Separation, Identification and Lipidomic Analysis. , 446 (2010).
- Walton, T. J., Kolattukudy, P. E. Determination of the structures of cutin monomers by a novel depolymerization procedure and combined gas chromatography and mass spectrometry. Biochemistry. 11 (10), 1885-1896 (1972).
- Matzke, K., Riederer, M. A comparative study into the chemical constitution of cutins and suberins from Picea abies (L.) Karst., Quercus robur L., and Fagus sylvatica L. Planta. 185 (2), 233-245 (1991).
- Riederer, M., Schönherr, J. Quantitative gas chromatographic analysis of methyl esters of hydroxy fatty acids derived from plant cutin. J. Chromatogr. 360, 151-161 (1986).
- Moire, L., Schmutz, A., Buchala, A., Yan, B., Stark, R., Ryser, U. Glycerol Is a Suberin Monomer. New Experimental Evidence for an Old Hypothesis. Plant Physiol. 119 (3), 1137-1146 (1999).
- Graça, J., Schreiber, L., Rodrigues, J., Pereira, H. Glycerol and glyceryl esters of omega-hydroxyacids in cutins. Phytochemistry. 61 (2), 205-215 (2002).
- Eglinton, G., Hunneman, D. H. Gas chromatographic-mass spectrometric studies of long chain hydroxy acids-I: The constituent cutin acids of apple cuticle. Phytochemistry. 7 (2), 313-322 (1968).
- Espelie, K. E., Köller, W., Kolattukudy, P. E. 9,16-dihydroxy-10-oxo-hexadecanoic acid, a novel component in citrus cutin. Chem. Phys. Lipids. 32 (1), 13-26 (1983).
- Holloway, P. J. Intracuticular lipids of spinach leaves. Phytochemistry. 13 (10), 2201-2207 (1974).
- Holloway, P. J., Deas, A. H. B. Epoxyoctadecanoic acids in plant cutins and suberins. Phytochemistry. 12 (7), 1721-1735 (1973).
- Holloway, P. J., Cutler, D. F., Alvin, K. L., Price, C. E. . The chemical constitution of plant cutins. , 45-85 (1982).
- Croteau, R., Fagerson, I. S. The constituent cutin acids of cranberry cuticle. Phytochemistry. 11 (1), 353-363 (1972).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır