Method Article
Выделение и анализ состава растительных липидов кутикулы полиэфирные мономеры
В этой статье
Резюме
Lipid polyesters constitute the structural components of two cell wall modifications, the plant cuticle and suberin-containing diffusion barriers. In this video, we describe a method to depolymerize cutin from whole delipidated leaves. The method can be applied to investigating mutants compromised in either cutin or suberin biosynthesis.
Аннотация
Terrestrial plants produce extracellular aliphatic biopolyesters that modify cell walls of specific tissues. Epidermal cells synthesize cutin, a polyester of glycerol and modified fatty acids that constitutes the framework of the cuticle that covers aerial plant surfaces. Suberin is a related lipid polyester that is deposited on the cell walls of certain tissues, including the root endodermis and the periderm of tubers, tree bark and roots. These lipid polymers are highly variable in composition among plant species, and often differ among tissues within a single species. Here, we describe a detailed protocol to study the monomer composition of cutin in Arabidopsis thaliana leaves by sodium methoxide (NaOMe)-catalyzed depolymerisation, derivatization, and subsequent gas chromatography-mass spectrometry (GC/MS) analysis. This method can be used to investigate the monomers of insoluble polyesters isolated from whole delipidated plant tissues bearing either cutin or suberin. The method can by applied not only to characterize the composition of lipid polymers in species not previously analyzed, but also as an analytical tool in forward and reverse genetic approaches to assess candidate gene function.
Введение
Сосудистые растения полагаются на внеклеточных слоев, которые функционируют как водонепроницаемых барьеров между растительных тканей и внешней среды. Эти стены-ассоциированных структур липофильный клеток ограничивают патогенной инфекции и регулировать пассивный транспорт газов, воды и растворенных веществ в и из растительных тканей 1. Такие барьеры завод кутикулы, А synapomorphic структура уникальна для растений 2, и различных суберина содержащие диффузионных барьеров. Кутикула олеофильный слой синтезированы эпидермальных клеток и связаны с ними через пектиновые слоя на внеклеточной части клеточной стенки 3-5. Это заключает основные воздушные органы высших растений, используемых в качестве важного интерфейса между растительных тканей и окружающей среды.
Кутин, структурной матрицы кутикулы и суберин два нерастворимые глицеролипид полиэфиры, связанные с растворителем-экстрагируемых восков 2,4. Эти полимерные лipids состоят из насыщенных и ненасыщенных производных жирных кислот и структурно и функционально похожи. Тем не менее, они отличались характерными различиями в химическом составе и осаждения сайтов.
Суберин является алифатический полиэфир, расположенный внутри клеточных стенок некоторых внешних и внутренних тканей, образующих вторичную стенку. Опробковевших ткани включают periderms корней, клубней и кору деревьев, корневые эндодермы, кожуры слои, и исцелил раны 2. В отличие кутина, то суберин полиэфир обычно содержит спирты, насыщенные и моно-ненасыщенных дикарбоновых кислот и большую часть мономеров с очень длинной цепью (C≥20).
Кутин является наиболее распространенным липидов полиэфир в сосудистых растений 6, и состоит из глицерина и С 16 -С 18 жирных производных переэтерифицированную кислот, такие как гидрокси и гидрокси-замещенных эпоксидных жирных кислот 4. В то время как состав кутина полимеровварьируется в зависимости от вида tracheophyte, наиболее преобладающие первичные мономеры 10, 16-дигидрокси 16: 0, 18-гидрокси-9,10-эпокси 18: 0, и 9,10,18-триокси 18: 0 жирных кислот. Интересно, что Arabidopsis листьев и стеблей кутин в основном состоит из 18: 2 дикарбоновой кислоты 7,8.
Кутикулы растений также представит значительные различия в толщине, начиная от нескольких нанометров до нескольких микрометров 9. Так изоляции кутикулы является трудоемким и занимает много времени шаг, особенно для тонких листовых очень кутикулы, такие как те из Arabidopsis THALIANA 8, способы в обход изоляции кутикулы были разработаны и проверены 7,8. Здесь мы описываем подробный протокол для изучения мономерный состав кутина в Arabidopsis THALIANA листьев по метоксид натрия (NaOMe) -catalyzed деполимеризации и последующего газовой хроматографии / масс-спектрометрии (/ MS GC) анализ. Этот протокол обеспечивает надежную способ анализа СОmposition липидных завод полиэфиров в целом delipidated тканей, и была заимствована из ранее представленных протоколов 7,10,11. Образцы цельной ткани сначала гомогенизируют и исчерпывающе delipidated, удаление растворителя экстрагируемой липидов в том числе и кутикулярные epicuticular восков, липидов мембран и триацилглицеринов. Клеточной стенки обогащенный остатки затем деполимеризованный в их учредительных мономеров метилового эфира по метанолята катализируемой метанолиза натрия. Метиловые эфиры жирных кислот экстрагируют при подкислении и дериватизации с получением их соответствующих триметилсилил или ацетил производные. Производные остатки обладают высокой летучестью, и может быть элюировали из колонки газовой хроматографии по разумной температуры без изменения их структурной конформации при анализе ГХ / МС.
протокол
Примечание: Этот протокол был адаптирован с Бонавентура и др. (2004), Молина и др. (2006), Ли и др. (2013) 7,10,11. Шаги 1-5 приведены на рисунке 1.
1. Ткань делипидированием
Примечание: Всегда прополощите все стекла и крышки с хлороформом, давая сухой под вытяжкой, перед использованием.
ВНИМАНИЕ: Выполните ткани гомогенизации и все шаги растворителей передачи под вытяжкой; всегда носить лаборатории пальто, перчатки и защитные очки всплеск, чтобы избежать прямого контакта с химическими веществами и защитить образцы от загрязнения.
- Разогреть на водяной бане и тепло блок 85 ° C.
- Взвешивают приблизительно 0,5 г образца листьев каждого в предварительно взвешенный 20 мм х 125 мм стеклянные пробирки с политетрафторэтилен (ПТФЭ) -faced винтовыми пробками. Включают в себя четыре дубликатов на образце.
- Поместите 2-пропанол в колбе Эрленмейера (примерно 125 мл; 25 мл на г SAMPле). Добавить 2,6-ди-трет-бутил-4-метилфенол (также известный как бутилированный гидрокситолуол, ВНТ) до конечной концентрации 0,01% (вес / объем).
Примечание: Добавить ВНТ из 5% (вес / об) маточного раствора в метаноле (ВНТ помогает свести к минимуму окисление ненасыщенных жирных кислот). - Предварительный нагрев 2-пропанол до 85 ° С на водяной бане.
- Добавить 12 мл горячей 2-пропанол растворитель в каждую пробирку и тепла в течение 15 мин при 85 ° С в нагревательный блок. Этот шаг инактивирует липазы, что может быть освобожден от разрушенных клеток.
- Пусть трубки остыть до комнатной температуры и измельчить ткань тщательно гомогенизаторе до получения однородной суспензии.
- Поместите образцы в орбитальном шейкере и встряхивают в течение 1-2 часов при 100 оборотов в минуту и при комнатной температуре.
- Центрифуга в течение 10 мин при 800 мкг и отбросить супернатант.
- Добавить равный объем 2-пропанола и встряхивают в течение 12 часов при комнатной температуре.
- Центрифуга в течение 10 мин при 800 мкг и отбросить супернатант.
- Добавить 12 мл CHCl 3: CH 3 OH (2: 1, объем / объем) до остатка (25 мл на грамм образца) и встряхивали в течение ночи при 100 оборотах в минуту и при комнатной температуре.
- Центрифуга в течение 10 мин при 800 мкг и отбросить супернатант.
- Добавить 12 мл CHCl 3: CH 3 OH (1: 2, об / об) до остатка и встряхивают в течение ночи при 100 оборотах в минуту и при комнатной температуре.
- Центрифуга в течение 10 мин при 800 мкг и удаления растворителя.
- Пусть образцы сушат при вытяжном шкафу в течение ночи при комнатной температуре.
- Высушите остаток, а затем поместить в вакуум-эксикаторе над безводным CaCl 2 или 4 до тех пор, CaSO постоянной массы достигается (3-5 дней).
2. Деполимеризация: метанолизе с метоксид натри (рисунок 2)
ВНИМАНИЕ: Выполните шаги 2.3 - 2.4, 2.7 - 2.8, 2.10 - 2.11, 2.13 - 2.15 и 2.17 - 2.18 под вытяжкой; всегда носить лаборатории пальто, перчатки и защитные очки всплеск.
- Разогреть тепло блок 60 ° C.
- Взвесьте пробирки, содержащие сухой остаток (важный для дальнейших расчетов).
- Добавить внутренние стандарты в каждую пробирку: 25 ωL метил heptadecanoate (1 мг / мл) и акции 25 мкл со-pentadecalactone (1 мг / мл акции).
- Добавить 0,9 мл метилацетата, 1,5 мл метоксида натрия и 3,6 мл метанола в каждую пробирку и колпачок их. Кроме того, подготовить реакционной смеси этих трех реагентов и добавить 6 мл аликвоты с каждого образца.
- Образцы тепла течение 2 часов при 60 ° С и вихря периодически 15-минутными интервалами.
- Давайте образцы остыть до комнатной температуры.
- Добавьте 10 мл хлористого метилена (СН 2 Cl 2) и 1,5 мл ледяной уксусной кислоты, чтобы извлечь метиловых эфиров жирных кислот.
- Добавить физиологический раствор (0,5 М NaCl), чтобы заполнить каждую пробирку и шапку.
- Образцы Вихревые в течение 1 мин и центрифугируют в течение 10 мин при 800 х г в.
- Трансфер органическую фазу (нижний) для очистки труб среднего размера (16 х 125 мм стеклянные пробирки с политетрафторэтилена (ПТФЭ) -faced винтовой крышкой).
- Добавить физиологический раствор (0,5 М NaCl), чтобы заполнить каждую пробирку и шапку.
- Образцы Вихревые в течение 1 мин и центрифугируют в течение 10 мин при 800 х г в.
- Удалить водный (верхний) фазы и повторите шаги 2.11-2.12.
- Удалить все водный (верхний) фазы.
- Добавить безводный сульфат натрия (Na 2 SO 4) в растворителе, крышка трубы, и вихрь в течение 1 мин; Образцы могут быть оставлены в настоящее время до следующего дня. На этом этапе образцы могут быть оставлена на ночь при вытяжном шкафу.
- Центрифуга в течение 2 мин при 800 мкг для уплотнения Na 2 SO 4 соль на дне.
- Перевести органическую фазу в маленький стакан одноразовой трубки (13 х 100 мм стеклянные пробирки с политетрафторэтилена (ПТФЭ) -faced винтовой крышкой).
- Растворитель выпаривают досуха в атмосфере азота и переходите к шагу дериватизации. Если не обрабатываются немедленно, хранить образцы выпаривали при -20 ° С (образцы могут бытьLSO хранятся до стадии испарения).
3. Подготовка производных для газовой хроматографии
ВНИМАНИЕ: Выполните шаги 3.1.2 и 3.1.5 - 3.1.8 под вытяжкой; всегда носить лаборатории пальто, перчатки и защитные очки всплеск.
- Производные триметилсилила
- Разогреть тепла блок до 100 ° С.
- Добавить 100 мкл пиридина и 100 мкл (БСТФА N, О бис-триметилсилил-трифторацетамид) в каждую пробирку и колпачок их.
- Образцы тепла при 100 ° С в течение 10 мин.
- Давайте образцы остыть до комнатной температуры.
- Выпаривают образцы в атмосфере азота при комнатной температуре. Избегать применения тепла к образцам, мономеры обладают высокой летучестью на данном этапе.
- Добавить 500 мкл 1: 1 (объем / объем) гептан: толуол.
- Образцы Вихревые в течение 1 мин и центрифугируют в течение 2 мин при 800 х г в.
- Добавить образцы GC флаконы и приступить к GC / MS анализа.
- Ацетилпроизводные
Примечание: ацетилирование, изменять шаги 3.1.1-3.1.3 выше следующим образом (не показано на видео); шаги 3.1.4-3.1.8 те же:- Разогреть тепло блок 60 ° C.
- Добавить 100 мкл пиридина и 100 мкл уксусного ангидрида (AC 2 O) в пробирки.
- Тепловые пробы 1 часа при 60 ° С.
4. ГХ / МС анализ
- Использование капиллярной колонки HP-5 (30 м х 0,25 мм х 0,25 мкм толщины пленки) или эквивалент (т.е.., 5% дифенил, 95% диметилполисилоксану). Программа ГХ с потоком газа гелия-носителя устанавливают при 1,5 мл / мин и температуре печи запрограммированной от 150 до 300 ° С со скоростью 3 ° С / мин.
- Используйте сплит инъекции (сплит соотношение 1:10) и установить масс-спектрометр в режим сканирования по 40-600 а.е.м. (ударной ионизации электрона).
- Создайте таблицу последовательности в том числе растворителей (пустой), WT и мутантных повторов, каждый с использованием указанного метода кутина анализа.
- Нагрузка растворителяи флаконы на карусели, добавить гексан шприцев полоскания флаконах в пробоотборник при необходимости, и начать последовательность. После того, как последовательность завершена, общей ионной хроматограммы следов доступны для всех образцов.
Анализ данных 5.
- Определить липидный полиэфирные мономеры, сравнивая масс-спектр каждого пика к опубликованному масс-спектров, либо путем поиска коммерческих библиотеку, если можно.
- Для каждого идентифицированного пика в общем ионного тока хроматограмме, использовать их соответствующие сроки хранения, чтобы найти области на таблицу результатов интеграции с GC / MS программного обеспечения (Справочная Рисунок 1).
- Для каждого мономера (столбцы AB), добавьте значения площади, найденные в таблице интеграции (Справочная Рисунок 1, колонка D) в соответствующей колонке для каждого повторить образец в Excel таблицы мономеров (Справочная файла 2, колонн CF), которая электронные таблицы для количественного арабидопсисакутина TMSI производные. Используйте Дополнительный файл 3, если ацетилированные производные получают вместо этого.
- Добавить области внутренних стандартов (IS) в колоннах (HK). Для тех мономеров, которые не дериватизированных, а именно жирных кислот метиловых эфиров (FAMEs), и дикарбоновых сложных эфиров кислоты диметилового (DCA DME,), использовать 17: 0 FAME (IS1), как для количественного (фиолетовый тени ячеек в таблице мономера; Справочная Файлы 2/3). Для гидроксилированных мономеров, в том числе первичных спиртов, феруловая кислоты и ω-гидроксикислот, используют 15: 0 15-гидрокси FAME (IS2), как выбор для соединения количественной (зелено-shadded ячеек в таблице мономера; дополнительные файлы 2/3) ,
- Добавить сухую массу листьев для каждого репликации на колонках АХ-BA (Справочная файла 2) или AQ-АТ (Справочная файла 3); альтернативно, сканировать листья для расчета площади поверхности и добавить значения площади к столу мономера, чтобы выразить мономера нагрузки на единицуплощадь поверхности.
Результаты
Протокол, описанный в этой рукописи устанавливается для определения липидов мономеров полиэфира, минимизируя вклад без кутина липидов 10 Рисунок 1 представляет обзор анализа, который вообще занимает от 8 (т.е., кутина или суберина.) -. 10 дней (от начальной заготовки ткани получения данных ГХ), в зависимости от того, сколько образцы дают высохнуть.
Выбранный катализируемой основанием метанолиза (рис 2) способ деполимеризации полиэфиры ранее утверждены для семян Arabidopsis, которые содержат как кутин и суберина. Ткани сначала гомогенизировали и исчерпывающе delipidated для удаления растворителя-извлекаемые липиды. Выход остатка после экстракции в процентах от первоначальной сырой массы, в обычно 6% для A. THALIANA Кол-0 листья. Клеточной стенки обогащенного остатки сушат в вакуумном эксикаторе и затем деполимеризации на составляющие мономеров сложного метилового эфира скатализируемой основанием трансметилирования. Два часа инкубации был выбран в качестве критического времени, необходимого для правильного деполимеризации и восстановления липидных компонентов полиэфирных. Более длительные времена инкубации в результате увеличения 2-оксикислот; это потенциально извлечь из мембранных сфинголипиды 10.
Типичный хроматограмма, если Arabidopsis дикого типа листьев кутина показано на рисунке 3, для вывода -TMSi эфирных производных (рис 3а) и производных О-ацетил (рис 3b). Каждый пик был определен в сравнении с масс-спектров от литературы и 7,8 публичной базе данных 12 протокола .our видео показывает, как подготовить TMSI производные, но образцы могут быть альтернативно ацетилированный для получения производных гидроксильные группы. Силилированный производные полезны для целей идентификации потому что они дают диагностическую масс-спектров. Тем не менее, ацетилированные производные являются более стабильными и хорошая альтернатива Силилированиеодин мономеров были идентифицированы 10. Чтобы помочь реализовать этот протокол в лабораториях, которые только были ГК, соединенный с пламенно-ионизационным детектором (FID), ГХ / ПИД следы, соответствующие ацетилированного производные WT мономеров лист кутина и в гомолога серии стандартов метилового эфира жирных кислот также показаны (Справочная Рисунок 4).
Этот метод является качественной и обнаруживает количественные различия между образцами, следовательно, его значение для мутанта анализа. Количества отдельных мономеров определяются с использованием метода внутреннего стандарта количественного, что позволяет сравнивать мономера изобилии между образцами. Следует уточнить, однако, что пик размер (суммарного количества ионов) могут не отражать молярные соотношения мономеров в полиэфира. Мы в том числе редактируемых таблиц мономеров для расчета суммы мономеров в Arabidopsis листьев кутина, как метиловых эфиров жирных кислот и производных (TMSI Справочная файла 1), или туз производные TYŁ (Справочная файла 2) спиртов. Эти таблицы могут должны быть адаптированы, если образцы извлекают из различных органов или видов растений.
В качестве примера, мы проанализировали Arabidopsis Талия на Колумбия (Кол-0) листья дикого типа и два ранее охарактеризованных нулевые-мутантных аллелей гена CYP86A2 / att1, att1-1 (м-1) и att1-2 (м-2 ) 13,14. Цитохрома Р450 монооксигеназ о CYP86A подсемейства кодируют предполагаемые Q-oxydases и участвовать в суберина и кутина мономера биосинтеза. Наши результаты (рисунок 4) показывают, значительное снижение нагрузок трех основных мономеров липидов в листьях мутантных по сравнению с WT листьев. В соответствии с прогнозируемым функции фермента, 16: 0, 18: 2, и 18: 1 дикарбоксилатов были специально затронуты в att1 мутантов.
"SRC =" / файлы / ftp_upload / 53386 / 53386fig1.jpg "/>
Рисунок 1. Обзор анализа липидов полиэфирной. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
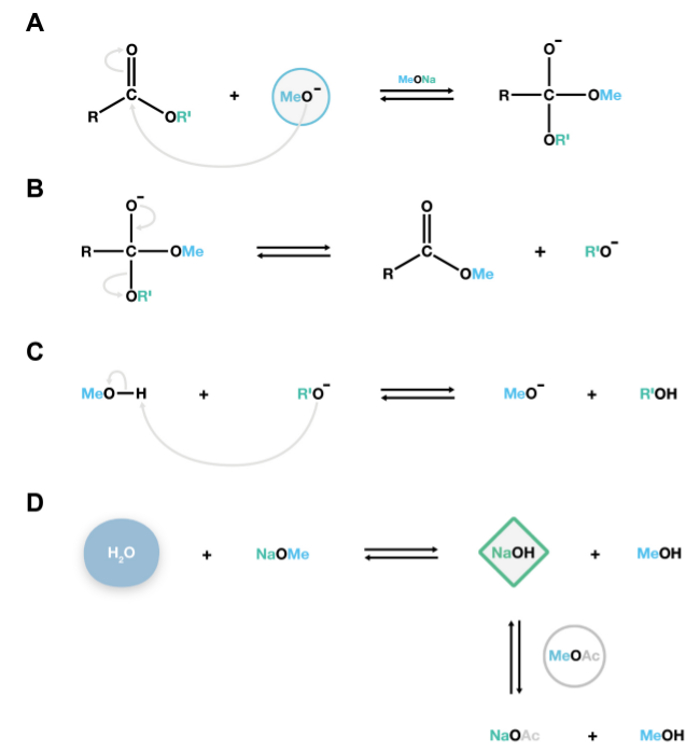
Рисунок 2. Механизм NaOMe-катализируемой реакции трансметилирования. Нуклеофильного метоксид анионы атаковать cabonyl углерод липидных сложных полиэфиров, чтобы сформировать нестабильную тетраэдрического интермедиата (а), который легко диссоциирует на метиловых эфиров жирных кислот и алкоксидов анионов (B). Эти алкоксиды являются сопряженными основы, и реагирует с метанолом, регенерации каталитически активных метоксид анионы, тем самым поддерживая дополнительные реакции деполимеризации (C). Если вода присутствует вСистема, он будет реагировать с метоксид натрия с образованием гидроксид натрия, сильное основание, что необратимо гидролизует эфиры, чтобы привести к нежелательным свободных жирных кислот. Метилацетат добавлен в качестве со-растворителя 15 для удаления небольших количеств гидроксида натрия в системе (D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
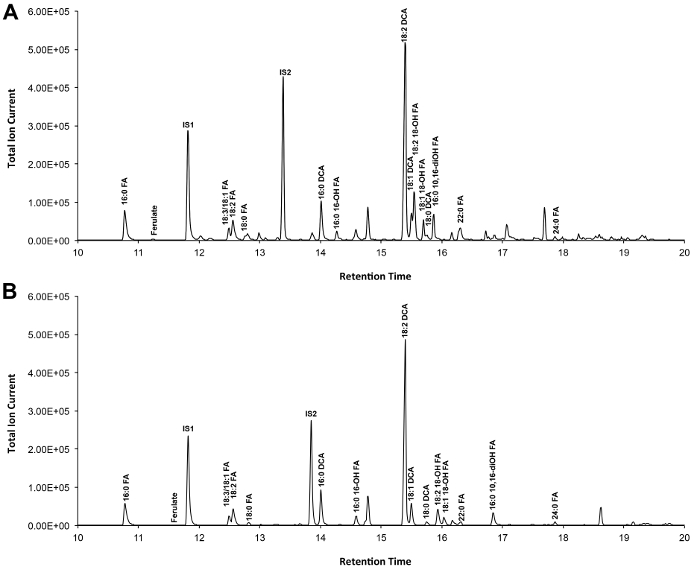
Рисунок 3. Представитель общая ионная хроматограмма дикого типа Arabidopsis THALIANA листьев кутина мономеров. (А) О -trimethylsilyl (TMSI) эфир и (Б) ацетат гидроксильные производные. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
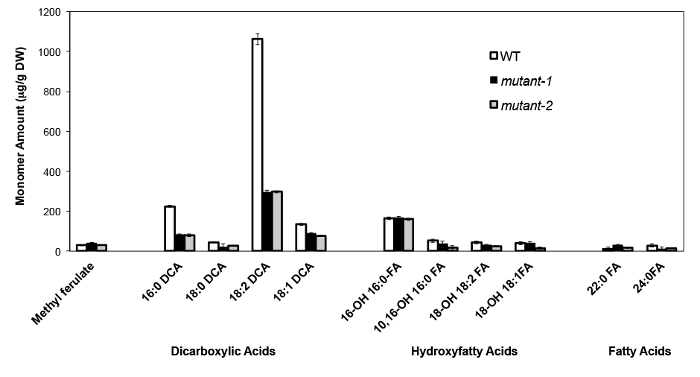
Рисунок 4. кутин мономера состав Arabidopsis THALIANA WT и двух нулевые мутантные аллели гена CYP86A2. (Мутант-1 = att1-1; мутанта-2 = att1-2) Столбики ошибок обозначают стандартное отклонение среднего (n = 4) , Взято из 13, с разрешения © Blackwell Publishing (2007). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
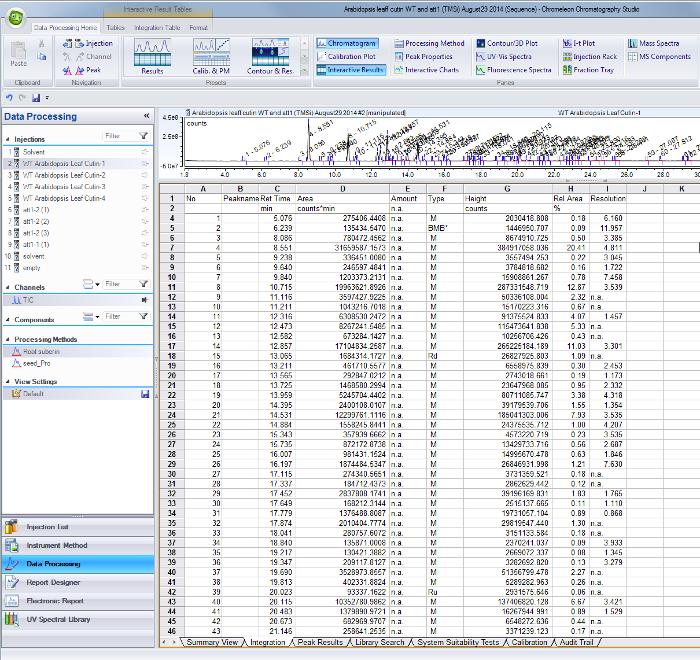
Справочная Рисунок 1. Пиковая результаты интеграции стол с / MS программного обеспечения GC. Пики, соответствующие выявленных мономеров и внутренних стандартов идентифицируются по их retenti на время (столбец С) и значения площадь приведены в колонке Д. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
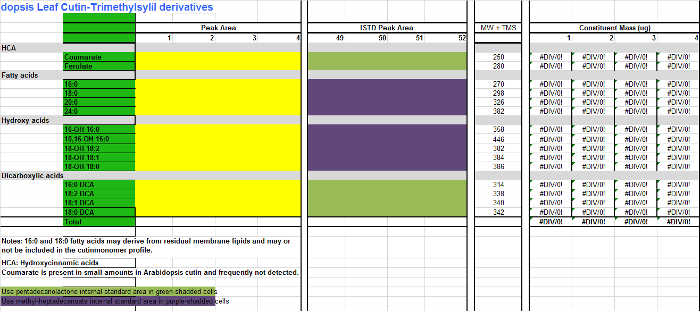
Справочная файла 2. Таблица Arabidopsis кутина мономеров (производных триметилсилил эфира гидроксильных метиловые эфиры жирных кислот). Пожалуйста, нажмите здесь, чтобы скачать этот файл.
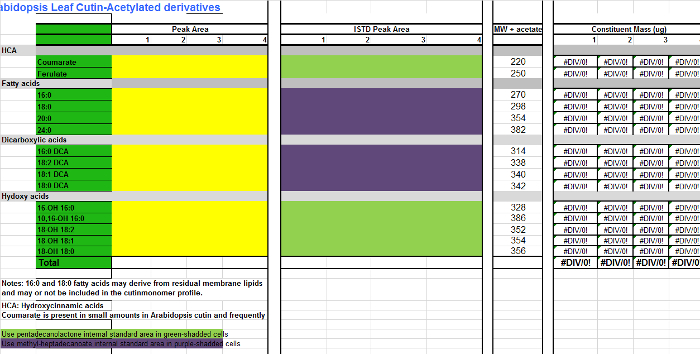
Справочная файла 3. Таблица Arabidopsis кутина мономеров (производных О-ацетил гидроксильных метиловые эфиры жирных кислот).ком / файлы / ftp_upload / 53386 / Supplemental_File_3_Cutin_template_Acetylated_derivatives.xlsx "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы скачать этот файл.
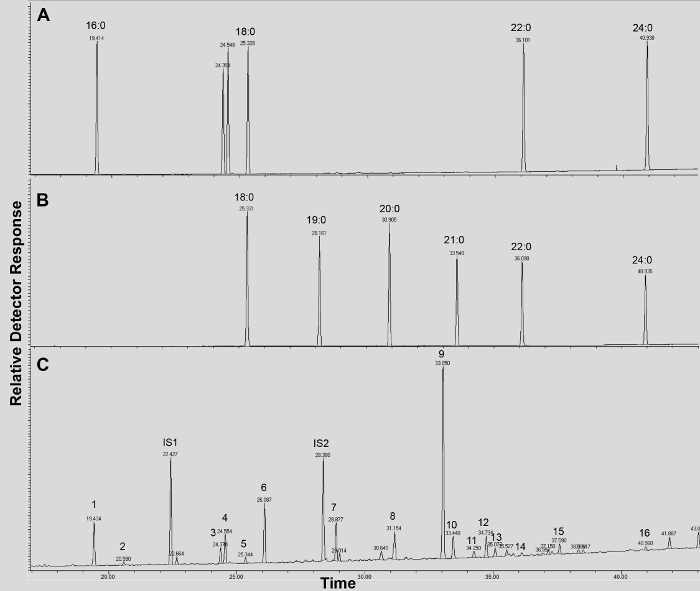
Справочная Рисунок 4. ГХ / FID следы от (АВ) метил жирной кислоты (FAME) стандарты индекса удерживания (пики помечены каждого насыщенного FAME длиной цепи); и (С) А. ацетилированный THALIANA WT лист кутина мономеры. Цифры на пике соответствуют: 16: 0 FAME (1), ферулата (2), 18: 3 FAME (3), 18: 1/18: 2 FAMEs (4), 18: 0 FAME (5), (6 sinapate ), 16: 0 DCA (7), 16-ОН 16: 0 FAME (8), 18: 2 DCA (9), 18: 1 DCA (10) 18: 0 DCA (11), 18-ОН 18: 2 FAME (12), 18-ОН 18: 1 FAME (13), 20: 0 FAME (14), 10,16-diOH 16: 0 FAME (15), 24: 0 FAME (16). DCA: диметиловый эфир дикарбоновой кислоты; FAME: метиловый эфир жирной кислоты; IS1: внутренний стандарт 1, 17: 0 Слава; ИС2: внутренний улandard 2, 15-ОН 15: 0 славы. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
В отличие от других биополимеров, таких как ДНК и белков, липидов растений полиэфиры не сделаны из шаблона. Вместо этого их композиции зависит от специфичности ферментов, присутствующих в тканях, которые делают эти внеклеточные полимеры. Таким образом, химические анализы на компоненты которой важно понять липидный состав сложного полиэфира.
Химические методы расщепляют эфирные связи, включают омыление, гидрогенолиз, кислотный катализируемой трансметилирования и катализируемой основанием трансметилирования 2. Каждый из них имеет свои преимущества и недостатки. Омыления производит свободные жирные кислоты, которые гидроксильные могут подвергаться вторичной реакции. Гидрирование алюмогидридом лития (LiAlH 4) 16 была использована для анализа кутина 7. Гидрогенолиз уменьшает функциональными углерода спирты и оригинальные структуры должны быть выведены с помощью deuteriolysis с литий-алюминий дейтеридом (LiAlD 4).Недостатком этого подхода является требование высокой разрешающей ГХ / МС, чтобы сравнить степень deuteriation жирных полиолов, полученных, чтобы сделать их назначений структур. Катализируемой кислотой переэтерификации с метанольным трифторида бора (BF 3) был часто используется в кутин и суберина деполимеризации 8,17,18, но реагент имеет ограниченный срок годности и может ввести искажений, обусловленных побочных реакций 15. Метанольный серной кислоты также дает метиловые эфиры мономеров, но с более значительным числом 2-гидрокси жирные кислоты, которые, предположительно, не являются истинными липидных компонентов полиэфирные, по сравнению с другими методами 10.
NaOMe катализируемой Способ переэтерификации описано в данном протоколе производит метиловых эфиров жирных кислот, которые модифицируют силилированием гидроксильных групп, обеспечивая характерный масс-спектров для идентификации или ацетилированием, чтобы обеспечить более стабильные производные гидроксильных групп FOг количественная. Одним из недостатков этого метода является то, что гидролиз конкурирует с переэтерификации, когда вода присутствует в реакции. Вода реагирует с NaOMe (катализатор) и производит NaOH, который в свою очередь гидролизует жирные кислоты метиловый эфиры с образованием свободных кислот (рис 2D). Это нежелательно, так как побочная реакция два пика будет присутствовать для каждого жирной кислоты: метилового эфира и сложного эфира производного TMSI, что усложняет анализ. С использованием безводного реагентов и добавление метилацетат, как сорастворитель, чтобы конкурировать с омылением, таким образом, решающие шаги, чтобы предотвратить гидролиз (рис 2D).
Кутина и суберина содержать от 1 до 26% глицерина 4. Однако, это мономера не будет обнаружено в экспериментальных условиях, описанных в данном протоколе. Глицерин высокой гидрофильностью и, в отличие от мономеров метилового эфира жирной кислоты, будут устранены в течение водных растворителей шагов стирки. Это ограничение такжеpplies к другим методам кутин деполимеризации, но глицерина может быть определена в водном слое, полученном после переэтерификации с использованием метода ферментативного. В качестве альтернативы, он может быть количественно с использованием более мягких условий (например., 0,05 М NaOMe) без дополнительной водной экстракции для обнаружения всех мономеров, в том числе глицерин 19,20 .Although полезной для целей количественного глицерина, мягкие условия обычно дают неполное деполимеризации кутина и суберина.
Если ГК соединен с пламенно-ионизационным детектором (FID) доступен, все повторности могут быть проанализированы в настоящем документе для целей количественного после пики репрезентативной выборки были определены ГХ / МС. В качестве альтернативы, мономеров в GC / FID следов могут быть идентифицированы, если их индексы удерживания известны. Детектор ионизации пламени имеет особенно высокую чувствительность и широкий спектр пропорциональности, которая имеет решающее значение для количественного определения главных и второстепенных компонентов пробыв единичных трасс. Кроме того, это надежный и простой в обслуживании и эксплуатации 15.
Описанный протокол позволяет надежным и воспроизводимым изоляции, идентификации и количественного определения, липидных растений мономеров полиэфира, позволяя химических характеристик мутантов, которые отличаются по составу одного или более липидных мономеров полиэфира. Процедура является масштабируемой, он может быть легко приспособлен для обработки как малых, так и больших количествах различных растительных материалов, в том числе корни, семена, листья, стебли и цветки. Массовые спектральные данные липидных полиэфирных мономеров из многих видов были опубликованы, например,., 21-26 и составляют ценные ресурсы для выявления неизвестных мономеров при адаптации этого протокола для других тканей и / или видов. Этот метод применим к исследованию биосинтеза, регулирования и распределения липидов полиэфиров в высших растений.
Раскрытие информации
No conflicts of interest declared.
Благодарности
This work was supported by a Natural Sciences and Engineering Research (NSERC)-USRA grant to S.J., and by an NSERC-Discovery Grant to I.M. We thank Richard Bourgault, Meghan Rains, and Amanda Fluke for technical assistance. Seeds of att1-1 and att1-2 mutants were kindly provided by Dr. Jian-Min Zhou, Institute of Genetics and Developmental Biology, Beijing, China.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-propanol | Fisher Scientific | BPA451-4 | Solvent for delipidation |
| Anhydrous sodium sulfate | Fisher Scientific | S421500 | |
| Acetic anhydride | Sigma Aldrich | 320102 | Derivatization agent |
| BSTFA (N,O-bis(trimethylsilyl)-trifluoroacetamide) | Sigma-Aldrich | 15222 | Derivatization agent |
| Butylated hydroxytoluene (BHT) | Sigma-Aldrich | 101162 | Antioxidant |
| Calcium chloride, anhydrous | Fisher Scientific | C614-3 | Desiccation agent |
| Calcium suflate, anhydrous (DRIERITE- 8 MESH with indicator) | Acros Organics | 219090020 | Desiccation agent |
| Chloroform (Trichloromethane) | Fisher Scientific | C6074 | Organic solvent |
| Glacial acetic acid | Fisher Scientific | BP2401212 | Acidification agent |
| Helium carrier gas, compressed | Air Liquide | ALPHAGAZ1-UN1046 | Carrier gas, GC/MS |
| Heptane | Fisher Scientific | H3501 | Organic solvent |
| Hexanes | Fisher Scientific | H3024 | Organic solvent |
| Methanol | Fisher Scientific | A4124 | Organic solvent, transmethylation reactive |
| Methyl acetate | Sigma-Aldrich | 296996 | Organic solvent |
| Methyl heptadecanoate | Sigma-Aldrich | H4515 | Internal standard (1mg/mL stock) |
| Methylene dichloride (Dichloromethane) | Fisher Scientific | D374 | Organic solvent |
| Nitrogen, compressed | Air Liquide | ALPHAGAZ1-UN1044 | Carrier gas, GC-FID |
| Pentadecanolactone | Fluka | 76530 | Internal standard (1 mg/ml stock) |
| Pyridine | Sigma-Aldrich | 270970 | Co-solvent for derivatization |
| Sodium chloride | Fisher Scientific | BP358212 | Saline solution |
| Sodium methoxide (25wt.%) | Sigma-Aldrich | 156256 | Nucleophile |
| Toluene | FIsher Scientific | T2904 | Organic solvent |
| Plant Growth Supplies | |||
| Pro-Mix PGX | Premier Tech Horticulture Ltd | Pro-Mix PGX is recommended to grow Arabidopsis plants (Eddy, R. and Hahn, D.T., 2012,http://docs.lib.purdue.edu/pmag/2) Purdue Methods for Arabidopsis Growth. | |
| PermaNest Humidity Dome | Grower's Solution, LLC, Cookeville, TN | GD2211-24 | |
| Perma-Nest Plant Trays (22x11in) | Grower's Solution, LLC, Cookeville, TN | N/A | |
| Square greenhouse pots, 3.5 inch | Grower's Solution, LLC, Cookeville, TN | P86 | |
| General Purpose Plant Fertilizer, Plant-Prod 20-20-20 | Premier Tech Home and Garden In., Brantford, ON | N/A | |
| Glassware | |||
| 13 x 100 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-13100 | |
| 16 x 125 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-16125 | |
| 20 x 125 mm glass test tubes with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-20125 | |
| GC vial caps | National Scientific | C400051A | |
| GC vial microinserts | National Scientific | C4011631 | |
| GC vials | National Scientific | C40001 | |
| Disposable pasteur pipets | Fisher Scientific | 1367820B | |
| Flasks | Fisher Scientific | ||
| Equipment | |||
| Allegra X15R centrifuge | Beckman Coulter | ||
| Analytic balance | Fisher Scientific | ||
| Belly dancer | A shaker can be used for this purpose if Belly Dancer not available | ||
| DB-5 Capillary GC column | J&W Scientific, CA, USA; | 30 m x 0.25 mm x 0.25 μm film thickness | |
| Desiccator | |||
| Isotemp 202 water bath | Fisher Scientific | ||
| ISQ LT single quadupole mass spectrometer | Thermo Scientific | ||
| Heat block | Fisher Scientific | ||
| Nitrogen evaporator | |||
| Polytron homogenizer | Birkmann | ||
| Trace 1300 gas chromatograph | Thermo Scientific | ||
| Two-stage regulator | Air Liquide | Q1-318B-580 | |
| Vacuum desiccator | Fisher Scientific | ||
| Vortex mixer | Fisher Scientific |
Ссылки
- Kolattukudy, P. Biopolyester membranes of plants: cutin and suberin. Science. 208 (4447), 990-1000 (1980).
- Kolattukudy, P. E. Polyesters in higher plants. Adv. Biochem. Eng. Biot. 71, 1-49 (2001).
- Yeats, T. H., Rose, J. K. C. The formation and function of plant cuticles. Plant Physiol. 163 (1), 5-20 (2013).
- Pollard, M., Beisson, F., Li, Y., Ohlrogge, J. B. Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13 (5), 236-246 (2008).
- Beisson, F., Li-Beisson, Y., Pollard, M. Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15 (3), 329-337 (2012).
- Heredia, A. Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta. 1620 (1-3), 1-7 (2003).
- Bonaventure, G., Beisson, F., Ohlrogge, J., Pollard, M. Analysis of the aliphatic monomer composition of polyesters associated with Arabidopsis epidermis: occurrence of octadeca-cis-6, cis-9-diene-1, 18-dioate as the major component. Plant J. 40 (6), 920-930 (2004).
- Franke, R., et al. Apoplastic polyesters in Arabidopsis surface tissues - A typical suberin and a particular cutin. Phytochemistry. 66 (22), 2643-2658 (2005).
- Vogg, G., et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid -ketoacyl-CoA synthase. J. Exp. Bot. 55 (401), 1401-1410 (2004).
- Molina, I., Bonaventure, G., Ohlrogge, J., Pollard, M. The lipid polyester composition of Arabidopsis thaliana and Brassica napus seeds. Phytochemistry. 67 (23), 2597-2610 (2006).
- Li-Beisson, Y., et al. Acyl-lipid metabolism. The Arabidopsis Book. 11, e0161 (2013).
- Molina, I., Ohlrogge, J. B., Pollard, M. Deposition and localization of lipid polyester in developing seeds of Brassica napus and Arabidopsis thaliana. Plant J. 53 (3), 437-449 (2008).
- Xiao, F., et al. Arabidopsis CYP86A2 represses Pseudomonas syringae type III genes and is required for cuticle development. EMBO J. 23 (14), 2903-2913 (2004).
- Christie, W. W., Han, X. . Lipid Analysis - Isolation, Separation, Identification and Lipidomic Analysis. , 446 (2010).
- Walton, T. J., Kolattukudy, P. E. Determination of the structures of cutin monomers by a novel depolymerization procedure and combined gas chromatography and mass spectrometry. Biochemistry. 11 (10), 1885-1896 (1972).
- Matzke, K., Riederer, M. A comparative study into the chemical constitution of cutins and suberins from Picea abies (L.) Karst., Quercus robur L., and Fagus sylvatica L. Planta. 185 (2), 233-245 (1991).
- Riederer, M., Schönherr, J. Quantitative gas chromatographic analysis of methyl esters of hydroxy fatty acids derived from plant cutin. J. Chromatogr. 360, 151-161 (1986).
- Moire, L., Schmutz, A., Buchala, A., Yan, B., Stark, R., Ryser, U. Glycerol Is a Suberin Monomer. New Experimental Evidence for an Old Hypothesis. Plant Physiol. 119 (3), 1137-1146 (1999).
- Graça, J., Schreiber, L., Rodrigues, J., Pereira, H. Glycerol and glyceryl esters of omega-hydroxyacids in cutins. Phytochemistry. 61 (2), 205-215 (2002).
- Eglinton, G., Hunneman, D. H. Gas chromatographic-mass spectrometric studies of long chain hydroxy acids-I: The constituent cutin acids of apple cuticle. Phytochemistry. 7 (2), 313-322 (1968).
- Espelie, K. E., Köller, W., Kolattukudy, P. E. 9,16-dihydroxy-10-oxo-hexadecanoic acid, a novel component in citrus cutin. Chem. Phys. Lipids. 32 (1), 13-26 (1983).
- Holloway, P. J. Intracuticular lipids of spinach leaves. Phytochemistry. 13 (10), 2201-2207 (1974).
- Holloway, P. J., Deas, A. H. B. Epoxyoctadecanoic acids in plant cutins and suberins. Phytochemistry. 12 (7), 1721-1735 (1973).
- Holloway, P. J., Cutler, D. F., Alvin, K. L., Price, C. E. . The chemical constitution of plant cutins. , 45-85 (1982).
- Croteau, R., Fagerson, I. S. The constituent cutin acids of cranberry cuticle. Phytochemistry. 11 (1), 353-363 (1972).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены