Method Article
Isolamento e analisi della composizione delle piante cuticola lipidi poliestere monomeri
In questo articolo
Riepilogo
Lipid polyesters constitute the structural components of two cell wall modifications, the plant cuticle and suberin-containing diffusion barriers. In this video, we describe a method to depolymerize cutin from whole delipidated leaves. The method can be applied to investigating mutants compromised in either cutin or suberin biosynthesis.
Abstract
Terrestrial plants produce extracellular aliphatic biopolyesters that modify cell walls of specific tissues. Epidermal cells synthesize cutin, a polyester of glycerol and modified fatty acids that constitutes the framework of the cuticle that covers aerial plant surfaces. Suberin is a related lipid polyester that is deposited on the cell walls of certain tissues, including the root endodermis and the periderm of tubers, tree bark and roots. These lipid polymers are highly variable in composition among plant species, and often differ among tissues within a single species. Here, we describe a detailed protocol to study the monomer composition of cutin in Arabidopsis thaliana leaves by sodium methoxide (NaOMe)-catalyzed depolymerisation, derivatization, and subsequent gas chromatography-mass spectrometry (GC/MS) analysis. This method can be used to investigate the monomers of insoluble polyesters isolated from whole delipidated plant tissues bearing either cutin or suberin. The method can by applied not only to characterize the composition of lipid polymers in species not previously analyzed, but also as an analytical tool in forward and reverse genetic approaches to assess candidate gene function.
Introduzione
Piante vascolari si basano su livelli extracellulari che fungono da barriera impermeabile tra tessuti vegetali e l'ambiente esterno. Queste strutture associate parete cellulare lipofilo limitano infezione patogena e regolano il trasporto passivo di gas, acqua e sostanze disciolte in e fuori di tessuti vegetali 1. Tali ostacoli sono la cuticola impianto, una struttura unica per synapomorphic piante 2, e le diverse barriere di diffusione-suberina contenente. La cuticola è uno strato oleophilic sintetizzata dalle cellule epidermiche e legato a loro tramite uno strato pectinaceous sul lato extracellulare della parete cellulare 3-5. Esso racchiude gli organi aerei primarie di piante superiori, funzionando come interfaccia vitale tra tessuti vegetali e l'ambiente.
Cutin, la matrice strutturale della cuticola, e suberina sono due poliesteri glycerolipid insolubili associati con cere solventi estraibili 2,4. Questi polimerico lipids sono composti derivati degli acidi grassi saturi e insaturi e sono strutturalmente e funzionalmente simili. Tuttavia, essi si distinguono per differenze caratteristiche nei siti composizione e deposizione chimica.
Suberina è un poliestere alifatico situato all'interno delle pareti cellulari di alcuni tessuti esterni ed interni formando una parete secondaria. Tessuti Suberized includono periderms di radici, tuberi e corteccia degli alberi, endodermis radice, strati cappotto di semi, e le ferite rimarginate 2. A differenza cutina, poliestere suberina genere contiene alcoli, saturi e acidi dicarbossilici monoinsaturi, e una gran parte di monomeri-molto-lunga catena (C≥20).
Cutin è il più abbondante in poliestere lipidico piante vascolari 6, ed è composta da glicerolo e derivati di acidi grassi C16-C18 interesterificato, come idrossi e idrossi-sostituito epossidiche acidi grassi 4. Mentre la composizione di polimeri cutinavaria tra le specie tracheophyte, i monomeri principali predominanti sono 10, 16-diidrossi 16: 0, 18-idrossi-9,10-epossi 18: 0, e 9,10,18-triidrossi 18: 0 acidi grassi. È interessante notare che, foglie e gambo Arabidopsis cutina è principalmente composto da 18: 2 dicarbossilico 7,8.
Cuticole pianta presente anche una notevole variabilità di spessore, da pochi nanometri a diversi micrometri 9. Poiché isolamento cuticola è un passo laboriosa e che richiede tempo, particolarmente per cuticole foglia molto sottili, come quelli di Arabidopsis thaliana 8, metodi che non utilizzano isolamento cuticola sono stati sviluppati e validati 7,8. Qui, descriviamo un protocollo dettagliato per studiare la composizione monomero di cutina in foglie Arabidopsis thaliana da metilato sodico (Naome) depolimerizzazione -catalyzed e gascromatografia successiva / spettrometria di massa (GC / MS) analisi. Questo protocollo offre un metodo affidabile per saggiare il comPosition di poliesteri pianta di lipidi in interi tessuti delipidato, ed è stato adattato da protocolli precedentemente riportati 7,10,11. Campioni di tessuto integrali sono prima omogeneizzati ed esaustivo delipidato, eliminando i lipidi solventi estraibili, tra cui cuticolare e cere epicuticolari, lipidi di membrana, e trigliceridi. Residui arricchita di parete cellulare vengono poi depolimerizzati nei loro costituenti monomeri di esteri metilici da sodio metilato-catalizzata metanolisi. Grassi esteri metilici degli acidi vengono estratti su acidificazione, e derivatizzati per ottenere i loro derivati trimetilsilileteri o acetil corrispondenti. Residui derivatizzati sono altamente volatili, e possono essere eluiti da una colonna gascromatografica ad una temperatura ragionevole senza alterarne la conformazione strutturale durante l'analisi GC / MS.
Protocollo
Nota: Questo protocollo è stato adattato da Bonaventura et al. (2004), Molina et al. (2006), Li et al. (2013) 7,10,11. Passi 1-5 sono riassunti nella figura 1.
1. Tissue delipidizzazione
Nota: Sciacquare sempre la vetreria e cappellini con cloroformio, lasciando asciugare sotto cappa, prima di utilizzare.
ATTENZIONE: Eseguire omogeneizzazione dei tessuti e tutte le misure di trasferimento di solvente sotto cappa; indossare sempre camice da laboratorio, guanti e occhiali di sicurezza iniziale per evitare il contatto diretto con i prodotti chimici e per proteggere i campioni dalla contaminazione.
- Bagnomaria Preriscaldare e blocco termico a 85 ° C.
- Pesare circa 0,5 g di ciascun campione in foglia 20 mm provette di vetro pre-pesato x 125 mm con politetrafluoroetilene (PTFE) tappi a vite -faced. Include quattro repliche per campione.
- Mettere 2-propanolo in una beuta (circa 125 ml, 25 ml per g di sample). Aggiungere 2,6-di-tert-butil-4-metilfenolo (noto anche come idrossitoluene butilato, BHT) ad una concentrazione finale di 0,01% (w / v).
Nota: Aggiungere BHT da un 5% (w / v) di soluzione stock in metanolo (BHT aiuta minimizzare l'ossidazione degli acidi grassi insaturi). - Preriscaldamento soluzione 2-propanolo a 85 ° C a bagnomaria.
- Aggiungere 12 ml calda 2-propanolo solvente ogni provetta e calore per 15 min a 85 ° C in blocco termico. Questo passaggio inattiva lipasi che possono essere rilasciati dalle cellule distrutte.
- Lasciare raffreddare tubi a temperatura ambiente e macinare accuratamente tessuto con omogeneizzatore fino ad ottenere una sospensione omogenea.
- Mettere i campioni in un agitatore orbitale e agitare per 1-2 ore a 100 giri al minuto e la temperatura ambiente.
- Centrifugare per 10 minuti a 800 xg e scartare il surnatante.
- Aggiungere un volume equivalente di 2-propanolo e agitare per 12 ore a temperatura ambiente.
- Centrifugare per 10 minuti a 800 xg e scartare il surnatante.
- Aggiungere 12 ml di CHCl 3: CH 3 OH (2: 1, v / v) a residuo (25 ml per g di materiale) e agitare per una notte a 100 rpm e la temperatura ambiente.
- Centrifugare per 10 minuti a 800 xg e scartare il surnatante.
- Aggiungere 12 ml CHCl 3: CH 3 OH (1: 2, v / v) a residuo e agitare per una notte a 100 rpm e la temperatura ambiente.
- Centrifugare per 10 minuti a 800 xg e rimuovere il solvente.
- Lasciate asciugare i campioni sotto cappa notte a temperatura ambiente.
- Asciugare il residuo e poi posto in un essiccatore sotto vuoto ad anidro CaCl 2 o CaSO 4 fino a peso costante a raggiungere (3-5 giorni).
2. Depolimerizzazione: metanolisi con sodio Methoxide (Figura 2)
ATTENZIONE: Eseguire i passaggi 2,3-2,4, 2,7-2,8, 2,10-2,11, 2,13-2,15 e 2,17-2,18 sotto cappa; indossare sempre camice da laboratorio, guanti e occhiali di protezione spruzzi.
- Blocco termico Preriscaldare a 60 ° C.
- Pesare provette contenenti il residuo secco (importante per ulteriori calcoli).
- Aggiungi standard interni in ogni provetta: 25 ωL heptadecanoate metile (1 mg / ml azione) e 25 ml ω-pentadecalactone (1 mg / ml azione).
- Aggiungere 0,9 ml di acetato di metile, 1,5 ml di sodio metilato, e 3,6 ml di metanolo per ciascuna provetta e tappo. In alternativa, preparare una miscela di reazione con questi tre reagenti e aggiungere aliquote 6 ml per ogni campione.
- Campioni di calore per 2 ore a 60 ° C e vortice periodicamente a intervalli di 15 min.
- Lasciate raffreddare i campioni a temperatura ambiente.
- Aggiungere 10 ml di cloruro di metilene (CH 2 Cl 2) e 1,5 ml di acido acetico glaciale per estrarre gli esteri metilici degli acidi grassi.
- Aggiungere la soluzione salina (0,5 M NaCl) per riempire ogni provetta e tappo.
- Campioni vortex per 1 min e centrifugare per 10 min a 800 x g.
- Trasferire la fase organica (inferiore) per pulire i tubi di medie dimensioni (16 x 125 mm, provette di vetro con politetrafluoroetilene (PTFE) tappo a vite -faced).
- Aggiungere la soluzione salina (0,5 M NaCl) per riempire ogni provetta e tappo.
- Campioni vortex per 1 min e centrifugare per 10 min a 800 x g.
- Rimuovere fase acquosa (superiore) e ripetere i passaggi 2,11-2,12.
- Rimuovere tutti i fase acquosa (superiore).
- Aggiungere solfato di sodio anidro (Na 2 SO 4) al solvente, tappare i tubi e vortex per 1 min; campioni possono ora essere lasciati fino al giorno successivo. A questo punto i campioni possono essere lasciati durante la notte sotto la cappa.
- Centrifugare per 2 min a 800 xg per compattare il Na 2 SO 4 sale nel fondo.
- Trasferire la fase organica in una provetta monouso bicchiere piccolo (13 x 100 mm provette di vetro con politetrafluoroetilene (PTFE) tappo a vite -faced).
- Far evaporare il solvente a secco sotto azoto e procedere con il passo derivatizzazione. Se non vengono trasformati subito, negozio evaporato a -20 ° C (campioni possono essereLSO immagazzinato prima della fase di evaporazione).
3. Preparazione dei derivati per gascromatografia
ATTENZIONE: Eseguire i passi 3.1.2 e 3.1.5 - 3.1.8 sotto una cappa; indossare sempre camice da laboratorio, guanti e occhiali di protezione spruzzi.
- Derivati trimetilsilil
- Preriscaldare il blocco termico a 100 ° C.
- Aggiungere 100 ml di piridina e 100 ml di BSTFA (N, O Bis-trimetilsilil-trifluoroacetammide) per ogni tubo e cappuccio.
- Campioni di calore a 100 ° C per 10 min.
- Lasciate raffreddare i campioni a temperatura ambiente.
- Evaporare campioni sotto azoto a temperatura ambiente. Evitare l'applicazione di calore per campioni, monomeri sono altamente volatili, in questa fase.
- Aggiungere 500 ml di 1: 1 (v / v) eptano: toluene.
- Campioni vortex per 1 minuto e centrifugare per 2 min a 800 x g.
- Aggiungere esempi di fiale GC e procedere dell'analisi GC / MS.
- Acetilderivati
Nota: Per acetilazione, modificare passaggi 3.1.1-3.1.3 sopra come segue (non mostrato in video); passi 3.1.4-3.1.8 sono gli stessi:- Blocco termico Preriscaldare a 60 ° C.
- Aggiungere 100 ml di piridina e 100 ml di anidride acetica (At 2 O) ai tubi.
- Campioni di calore 1 ora a 60 ° C.
4. GC / MS Analysis
- Utilizzare una capillare colonna HP-5 (30 mx 0,25 mm x 0,25 di spessore micron film) o equivalenti (es., 5% difenil, il 95% dimetilpolisilossano). Programma il GC con gas di trasporto elio flusso fissato a 1,5 ml / min e la temperatura del forno programmata da 150 a 300 ° C a 3 ° C / min.
- Utilizzare iniezione split (divisione rapporto 1:10) e impostare spettrometro di massa modalità per eseguire la scansione su 40-600 amu (impatto elettronico di ionizzazione).
- Creare una tabella di sequenza inclusi solventi (in bianco), WT e repliche mutanti, ciascuno utilizzando il metodo di analisi cutina indicato.
- Carico di solventee fiale di campione sulla giostra, aggiungere esano per fiale-siringa risciacquo nel campionatore automatico, se necessario, e avviare la sequenza. Dopo la sequenza è completata, tracce di ioni totali cromatogramma sono disponibili per tutti i campioni.
Analisi 5. I dati
- Identificare monomeri lipidi poliestere confrontando spettro di massa di ogni picco di spettri di massa pubblicato oppure cercando una libreria commerciale, se disponibile.
- Per ogni picco individuati nel totale cromatogramma corrente ionica, utilizzare i rispettivi tempi di ritenzione per trovare le aree sul tavolo risultati di integrazione dal software GC / MS (Supplemental Figura 1).
- Per ogni monomero (colonne AB), aggiungere i valori dell'area trovano nella tabella integrazione (riferimento figura 1, colonna D) alla colonna corrispondente per ogni replicare campione nella tabella Excel di monomeri (File di riferimento 2, colonne CF), che è un foglio di calcolo per quantificare Arabidopsisderivati cutina TMSI. Utilizzare file supplementare 3 se derivati acetilati si preparano invece.
- Aggiungere le aree delle norme interne (IS) alle colonne IS (HK). Per quei monomeri che non sono derivatizzata, esteri metilici cioè grassi acidi (fames) ed esteri dell'acido dimetilici dicarbossilici (DCA DME), utilizzare 17: 0 FAME (IS1) come IS per quantificazione (cellule viola-ombreggiata nella tabella monomero; Supplemental File 2/3). Ai monomeri idrossilati, tra cui alcoli primari, acido ferulico e acidi ω-idrossi, utilizzare 15: 0 FAME 15-idrossi (IS2) come IS di scelta per la quantificazione composto (cellule verdi shadded nella tabella monomero; Supplemental file 2/3) .
- Aggiungere a secco peso foglia per ogni replica alle colonne AX-BA (File supplementare 2) o AQ-AT (File supplementare 3); in alternativa, eseguire la scansione di foglie di calcolare superfici e aggiungere i valori dell'area alla tabella monomero di esprimere carichi monomeri per unità diarea di superficie.
Risultati
Il protocollo descritto in questo manoscritto è impostato per determinare lipidi monomeri poliestere, riducendo al minimo i contributi di lipidi non cutina 10 figura 1 presenta una panoramica del saggio, che prende tutto tra le 8 (cioè, cutina o suberina.) -. 10 giorni (dalla raccolta dei tessuti prima di ottenere dati GC), a seconda di quanto tempo i campioni sono lasciate asciugare.
Il metanolisi selezionato base-catalizzata (Figura 2) metodo per depolimerizzano poliesteri è stato precedentemente convalidato per i semi di Arabidopsis, che contengono sia cutina e suberina. I tessuti vengono prima omogeneizzati ed esaustivo delipidato per rimuovere i lipidi solventi estraibili. La resa residui dopo l'estrazione, come percentuale del peso fresco iniziale, è di solito 6% per A. thaliana Col-0 foglie. Residui arricchita di parete cellulare vengono essiccati in un essiccatore a vuoto e poi depolimerizzati nei loro costituenti monomeri di esteri metilici dabase-catalizzata transmetilazione. Due ore di incubazione è stato scelto come il tempo critico richiesto per il corretto depolimerizzazione e il recupero dei componenti lipidici poliestere. Tempi di incubazione più, determina aumento di acidi 2-idrossi; questi potenzialmente derivano da sfingolipidi di membrana 10.
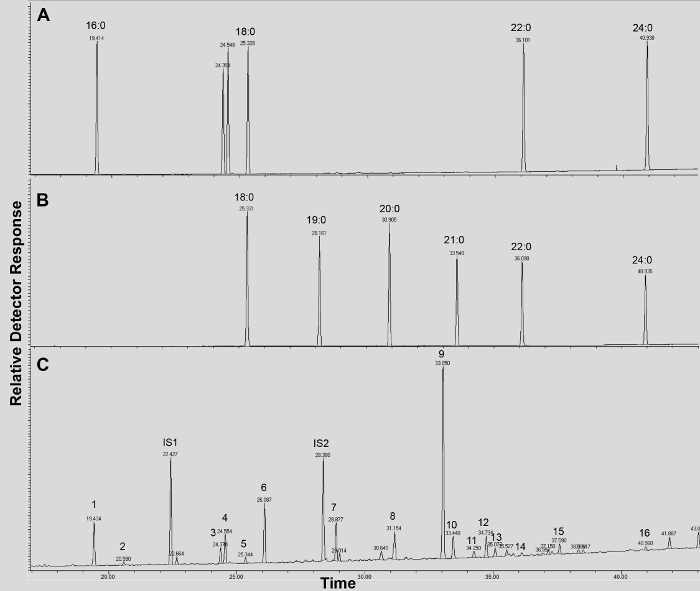
Un tipico cromatogramma se viene mostrato Arabidopsis tipo selvaggio del foglio cutina in figura 3, per i derivati O -TMSi etere (Figura 3A) e derivati O acetil (Figura 3B). Ogni picco è stato identificato dal confronto con spettri di massa dalla letteratura 7,8 e una banca dati pubblica 12 protocollo video .La nostra mostra come preparare derivati TMSI, ma campioni possono in alternativa essere acetilato a derivatize gruppi idrossile. Derivati sililati sono un bene per scopi di identificazione perché danno spettri di massa diagnostico. Tuttavia, i derivati acetilati sono più stabili e una buona alternativa a sililazionemonomeri una volta sono stati identificati 10. Per contribuire all'attuazione di questo protocollo in laboratori che solo hanno GC accoppiato a ionizzazione di fiamma (FID), GC / FID tracce corrispondenti a derivati acetilati di WT monomeri foglia cutina e ad una serie omologa di norme esteri metilici di acidi grassi sono anche visualizzati (Figura supplementare 4).
Questo metodo è qualitativo e rileva le differenze quantitative tra i campioni, quindi il suo valore per l'analisi mutante. Gli importi dei singoli monomeri vengono determinati con il metodo standard interno di quantificazione, consentendo il confronto di monomero abbondanza tra i campioni. Va chiarito, tuttavia, che la dimensione di picco (conte totali di ioni) non può riflettere i rapporti molari dei monomeri del poliestere. Stiamo comprese le tabelle modificabili di monomeri per calcolare gli importi dei monomeri in foglia Arabidopsis cutina come esteri di acidi grassi e derivati metilici TMSI (File di riferimento 1), o asso derivati Tyl (File di riferimento 2) di alcoli. Le tabelle possono dover essere adattati se i campioni sono estratti da diversi organi o specie vegetali.
A titolo di esempio, abbiamo analizzato Arabidopsis Thalia na Columbia (Col-0) foglie wild type e due alleli nulli-mutante in precedenza caratterizzati del gene CYP86A2 / ATT1, att1-1 (m-1) e att1-2 (m-2 ) 13,14. Citocromo P450 monossigenasi della sottofamiglia CYP86A codificano putativi Ohm-oxydases e partecipa nella suberina e cutina monomero biosintesi. I nostri risultati (Figura 4) dimostrano una significativa riduzione dei carichi di tre principali monomeri lipidici nelle foglie mutante rispetto alle foglie WT. Coerentemente con la funzione dell'enzima previsto, 16: 0, 18: 2, e 18: 1 dicarbossilati furono particolarmente colpite nei mutanti ATT1.
"Src =" / files / ftp_upload / 53386 / 53386fig1.jpg "/>
Figura 1. Panoramica di analisi dei lipidi in poliestere. Cliccate qui per vedere una versione più grande di questa figura.
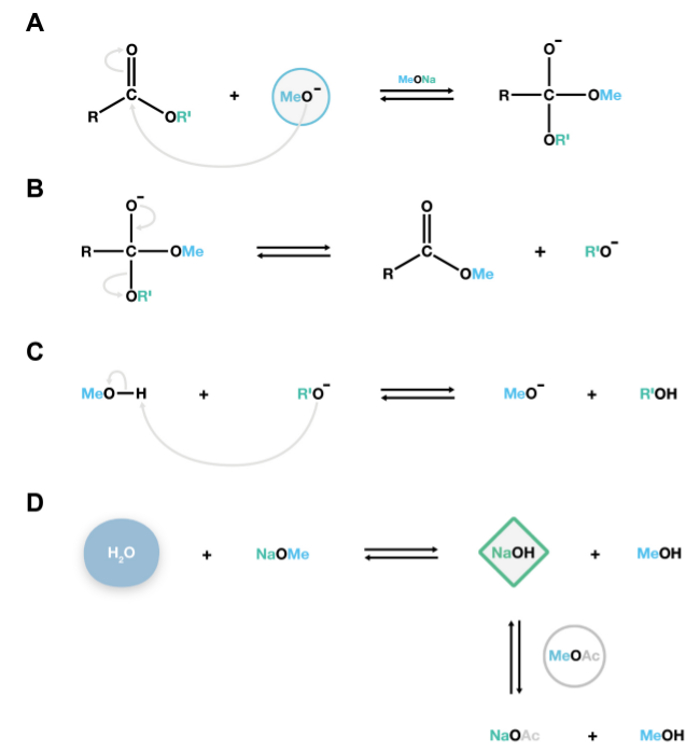
Figura 2. Meccanismo della reazione transmetilazione Naome catalizzata. Gli anioni metossido nucleofili attaccano il carbonio cabonyl di poliesteri lipidi per formare un intermedio instabile tetraedrica (A), che si dissocia facilmente in esteri metilici di acidi grassi e anioni alcossido (B). Questi alcossidi sono basi coniugate, e reagiscono con metanolo, rigenerando gli anioni metossido cataliticamente attivi, sostenendo così reazioni di depolimerizzazione addizionali (C). Se l'acqua è presente nelsistema, reagirà con metilato di sodio per formare idrossido di sodio, una base forte che idrolizza irreversibilmente esteri producendo acidi grassi liberi indesiderabili. Acetato di metile viene aggiunto come co-solvente 15 per rimuovere piccole quantità di idrossido di sodio all'interno del sistema (D). Cliccate qui per vedere una versione più grande di questa figura.
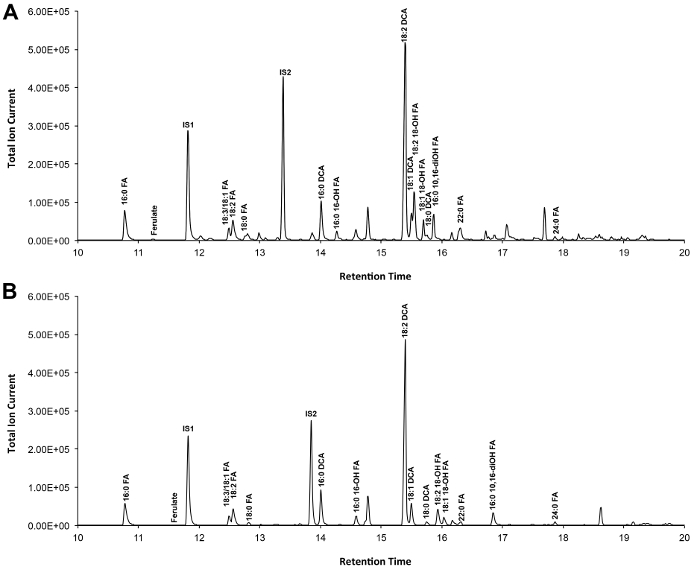
Figura 3. Rappresentante cromatogramma ionico totale di wild-type foglia Arabidopsis thaliana monomeri cutina. (A) O -trimethylsilyl (TMSI) etere e (B) Derivati ossidrile acetato. Cliccate qui per vedere una versione più grande di questa figura.
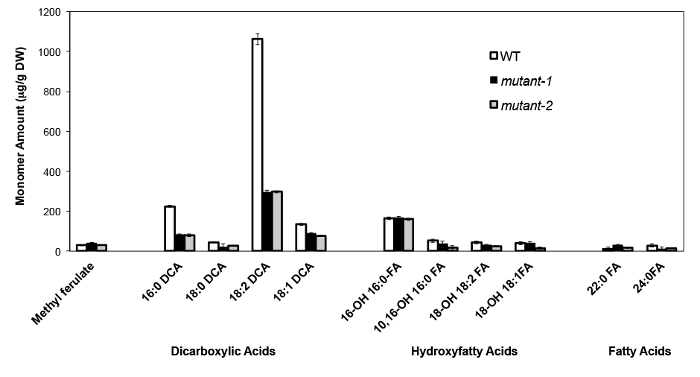
Figura 4. Cutin monomero composizione della Arabidopsis thaliana WT e due nulli alleli mutanti del gene CYP86A2 (mutante-1 = att1-1; mutante-2 = att1-2) barre di errore rappresentano la deviazione standard della media (n = 4). . Adattato da 13, con il permesso di © Blackwell Publishing (2007). Cliccate qui per vedere una versione più grande di questa figura.
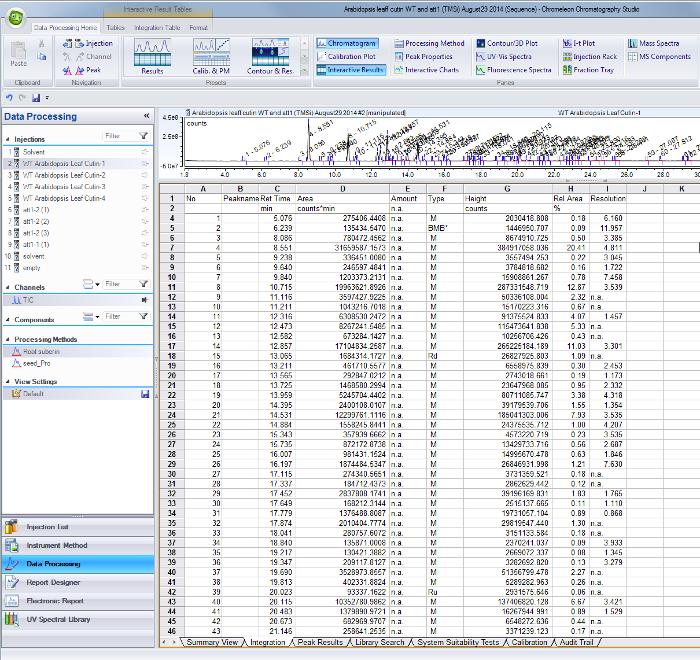
Figura 1. supplementare Peak risultati di integrazione tavolo dal software GC / MS. Picchi corrispondenti ai monomeri identificati e standard interni sono identificati dal loro retenti in tempo (colonna C) e valori dell'area sono riportati nella colonna D. Clicca qui per scaricare il file.
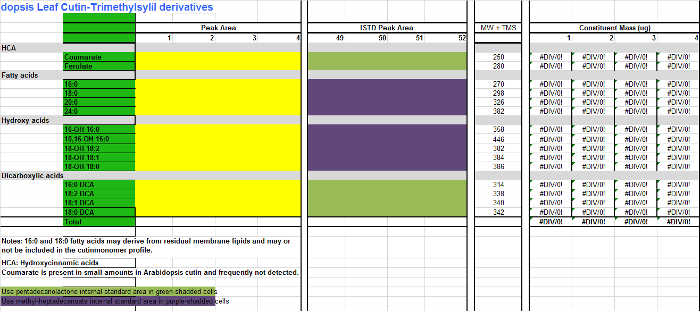
Supplemental file 2. Tabella di Arabidopsis monomeri cutina (derivati trimetilsilil etere di esteri metilici degli acidi grassi idrossi). Cliccate qui per scaricare il file.
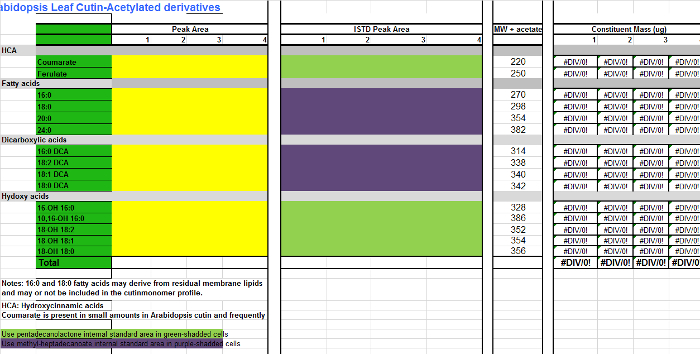
Supplemental file 3. Tabella di Arabidopsis monomeri cutina (derivati O acetil di esteri metilici degli acidi grassi idrossi).com / file / ftp_upload / 53386 / Supplemental_File_3_Cutin_template_Acetylated_derivatives.xlsx "target =" _ blank "> Clicca qui per scaricare il file.
Supplementare Figura 4. GC / FID tracce di (AB) estere metilico di acidi grassi (FAME) norme indice di conservazione (picchi sono etichettati con ogni FAME saturo lunghezza della catena); e (C) acetilato A. thaliana WT foglia monomeri cutina. Numeri sulla visiera corrispondono a: 16: 0 FAME (1), Ferulate (2), 18: 3 FAME (3), 18: 1/18: 2 FAME (4), 18: 0 FAME (5), sinapate (6 ), 16: 0 DCA (7), 16-OH 16: 0 FAME (8), 18: 2 DCA (9), 18: 1 DCA (10) 18: 0 DCA (11), 18-OH 18: 2 FAME (12), 18-OH 18: 1 FAME (13), 20: 0 FAME (14), 10,16-Dioh 16: 0 FAME (15), 24: 0 FAME (16). DCA: dicarbossilico dimetil estere; FAME: grassi estere metilico; IS1: standard interno 1, 17: 0 FAME; IS2: interna stAndard 2, 15-OH 15: 0 FAME. Cliccate qui per scaricare il file.
Discussione
A differenza di altri biopolimeri come il DNA e le proteine, poliesteri pianta di lipidi non sono fatti da un modello. Invece, le loro composizioni dipendono dalla specificità degli enzimi presenti nei tessuti che rendono questi polimeri extracellulari. Come tale analisi, chimica del componente componenti sono fondamentali per capire composizione di poliestere lipidica.
Metodi chimici di fendere le obbligazioni estere includono saponificazione, idrogenolisi, transmetilazione acido-catalizzata, e la base-catalizzata transmetilazione 2. Ciascuno di essi presenta vantaggi e svantaggi. Saponificazione produce grassi idrossi acidi liberi che possono subire reazioni secondarie. Idrogenolisi con litio alluminio idruro (LiAlH 4) 16 è stato utilizzato per l'analisi cutina 7. Idrogenolisi riduce carboni funzionalizzati per alcoli e delle strutture originali devono essere dedotto da deuteriolysis con deuteruro litio alluminio (LiAlD 4). Ilsvantaggio di questo approccio è il requisito di alta risoluzione GC / MS per confrontare il grado di deuteriation dei polioli grassi ottenuti per fare assegnazioni delle loro strutture. Transesterificazione acido-catalizzata con metanolica trifluoruro di boro (BF 3) è stata spesso utilizzata in cutina e suberina depolymerizations 8,17,18, ma il reagente ha una durata limitata e può introdurre artefatti dovuti a lato reazioni 15. Acido solforico metanolica produce anche esteri metilici dei monomeri, ma con proporzioni maggiori di acidi grassi 2-idrossi, che presumibilmente non sono veri componenti lipidici poliestere, rispetto ad altri metodi 10.
Il metodo transesterificazione catalizzata Naome descritto in questo protocollo produce esteri metilici di acidi grassi che sono derivatizzati da sililazione dei gruppi ossidrilici, fornendo caratteristiche spettri di massa per l'identificazione o per acetilazione di fornire più derivati stabili di gruppi ossidrilici for quantificazione. Uno svantaggio di questa tecnica è che compete con l'idrolisi transesterificazione presenza di acqua nella reazione. Acqua reagisce con Naome (catalizzatore) e produce NaOH, che a sua volta idrolizza grassi esteri metilici acido per produrre acidi liberi (Figura 2D). Questa è una reazione collaterale indesiderabile perché due picchi saranno presenti per ogni acido grasso: un estere metilico e un estere derivato TMSI, complicando così l'analisi. Utilizzando reagenti anidri e aggiungendo acetato di metile come co-solvente di competere con saponificazione sono passaggi così cruciali per prevenire l'idrolisi (Figura 2D).
Cutin e suberina contengono tra l'1 e il 26% glicerolo 4. Tuttavia, questo monomero non viene rilevata dalle condizioni sperimentali descritte in questo protocollo. Il glicerolo è altamente idrofila e, a differenza degli acidi grassi monomeri di estere metilico, sarà eliminato durante le fasi acquose di lavaggio con solvente. Questa limitazione anchepplies ad altri metodi di depolimerizzazione cutina, ma glicerolo possono essere determinati nello strato acquoso ottenuto dopo transesterificazione utilizzando un metodo enzimatico. In alternativa, può essere quantificato utilizzando condizioni più blande (ad es., 0,05 M Naome) senza ulteriore estrazione dell'acqua per rilevare tutti monomeri, compresi glicerolo 19,20 .Anche se utile ai fini della quantificazione glicerolo, condizioni blande solito danno depolimerizzazione incompleta di cutina e suberina.
Se un GC accoppiato ad un rilevatore a ionizzazione di fiamma (FID) è disponibile, tutte le repliche possono essere analizzati in questo strumento a fini quantitativi, dopo i picchi di un campione rappresentativo sono stati identificati mediante GC / MS. In alternativa, i monomeri in GC / FID tracce possono essere identificati se i loro indici di ritenzione sono noti. Il rivelatore a ionizzazione di fiamma ha particolarmente elevata sensibilità ed una vasta gamma di proporzionalità, che è fondamentale per la quantificazione della maggiori e minori componenti di esempioin corse singole. Inoltre, è robusto e facile da mantenere e far funzionare 15.
Il protocollo descritto consente l'affidabile e riproducibile isolamento, l'identificazione e la quantificazione degli impianti lipidici monomeri poliestere, permettendo la caratterizzazione chimica di mutanti che differiscono nella composizione di uno o più monomeri di poliestere lipidi. La procedura è scalabile, può essere facilmente adattato per elaborare sia piccole e sfusi quantità di vari materiali vegetali, tra radici, semi, foglie, steli e fiori. Dati spettrali di massa di lipidi monomeri poliestere da molte specie sono stati pubblicati ad es., 21-26 e costituiscono risorse preziose per identificare monomeri sconosciuti quando adattare questo protocollo ad altri tessuti e / o specie. Questo metodo è applicabile alle indagini della biosintesi, la regolamentazione e la distribuzione di poliesteri di lipidi nelle piante superiori.
Divulgazioni
No conflicts of interest declared.
Riconoscimenti
This work was supported by a Natural Sciences and Engineering Research (NSERC)-USRA grant to S.J., and by an NSERC-Discovery Grant to I.M. We thank Richard Bourgault, Meghan Rains, and Amanda Fluke for technical assistance. Seeds of att1-1 and att1-2 mutants were kindly provided by Dr. Jian-Min Zhou, Institute of Genetics and Developmental Biology, Beijing, China.
Materiali
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-propanol | Fisher Scientific | BPA451-4 | Solvent for delipidation |
| Anhydrous sodium sulfate | Fisher Scientific | S421500 | |
| Acetic anhydride | Sigma Aldrich | 320102 | Derivatization agent |
| BSTFA (N,O-bis(trimethylsilyl)-trifluoroacetamide) | Sigma-Aldrich | 15222 | Derivatization agent |
| Butylated hydroxytoluene (BHT) | Sigma-Aldrich | 101162 | Antioxidant |
| Calcium chloride, anhydrous | Fisher Scientific | C614-3 | Desiccation agent |
| Calcium suflate, anhydrous (DRIERITE- 8 MESH with indicator) | Acros Organics | 219090020 | Desiccation agent |
| Chloroform (Trichloromethane) | Fisher Scientific | C6074 | Organic solvent |
| Glacial acetic acid | Fisher Scientific | BP2401212 | Acidification agent |
| Helium carrier gas, compressed | Air Liquide | ALPHAGAZ1-UN1046 | Carrier gas, GC/MS |
| Heptane | Fisher Scientific | H3501 | Organic solvent |
| Hexanes | Fisher Scientific | H3024 | Organic solvent |
| Methanol | Fisher Scientific | A4124 | Organic solvent, transmethylation reactive |
| Methyl acetate | Sigma-Aldrich | 296996 | Organic solvent |
| Methyl heptadecanoate | Sigma-Aldrich | H4515 | Internal standard (1mg/mL stock) |
| Methylene dichloride (Dichloromethane) | Fisher Scientific | D374 | Organic solvent |
| Nitrogen, compressed | Air Liquide | ALPHAGAZ1-UN1044 | Carrier gas, GC-FID |
| Pentadecanolactone | Fluka | 76530 | Internal standard (1 mg/ml stock) |
| Pyridine | Sigma-Aldrich | 270970 | Co-solvent for derivatization |
| Sodium chloride | Fisher Scientific | BP358212 | Saline solution |
| Sodium methoxide (25wt.%) | Sigma-Aldrich | 156256 | Nucleophile |
| Toluene | FIsher Scientific | T2904 | Organic solvent |
| Plant Growth Supplies | |||
| Pro-Mix PGX | Premier Tech Horticulture Ltd | Pro-Mix PGX is recommended to grow Arabidopsis plants (Eddy, R. and Hahn, D.T., 2012,http://docs.lib.purdue.edu/pmag/2) Purdue Methods for Arabidopsis Growth. | |
| PermaNest Humidity Dome | Grower's Solution, LLC, Cookeville, TN | GD2211-24 | |
| Perma-Nest Plant Trays (22x11in) | Grower's Solution, LLC, Cookeville, TN | N/A | |
| Square greenhouse pots, 3.5 inch | Grower's Solution, LLC, Cookeville, TN | P86 | |
| General Purpose Plant Fertilizer, Plant-Prod 20-20-20 | Premier Tech Home and Garden In., Brantford, ON | N/A | |
| Glassware | |||
| 13 x 100 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-13100 | |
| 16 x 125 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-16125 | |
| 20 x 125 mm glass test tubes with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-20125 | |
| GC vial caps | National Scientific | C400051A | |
| GC vial microinserts | National Scientific | C4011631 | |
| GC vials | National Scientific | C40001 | |
| Disposable pasteur pipets | Fisher Scientific | 1367820B | |
| Flasks | Fisher Scientific | ||
| Equipment | |||
| Allegra X15R centrifuge | Beckman Coulter | ||
| Analytic balance | Fisher Scientific | ||
| Belly dancer | A shaker can be used for this purpose if Belly Dancer not available | ||
| DB-5 Capillary GC column | J&W Scientific, CA, USA; | 30 m x 0.25 mm x 0.25 μm film thickness | |
| Desiccator | |||
| Isotemp 202 water bath | Fisher Scientific | ||
| ISQ LT single quadupole mass spectrometer | Thermo Scientific | ||
| Heat block | Fisher Scientific | ||
| Nitrogen evaporator | |||
| Polytron homogenizer | Birkmann | ||
| Trace 1300 gas chromatograph | Thermo Scientific | ||
| Two-stage regulator | Air Liquide | Q1-318B-580 | |
| Vacuum desiccator | Fisher Scientific | ||
| Vortex mixer | Fisher Scientific |
Riferimenti
- Kolattukudy, P. Biopolyester membranes of plants: cutin and suberin. Science. 208 (4447), 990-1000 (1980).
- Kolattukudy, P. E. Polyesters in higher plants. Adv. Biochem. Eng. Biot. 71, 1-49 (2001).
- Yeats, T. H., Rose, J. K. C. The formation and function of plant cuticles. Plant Physiol. 163 (1), 5-20 (2013).
- Pollard, M., Beisson, F., Li, Y., Ohlrogge, J. B. Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13 (5), 236-246 (2008).
- Beisson, F., Li-Beisson, Y., Pollard, M. Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15 (3), 329-337 (2012).
- Heredia, A. Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta. 1620 (1-3), 1-7 (2003).
- Bonaventure, G., Beisson, F., Ohlrogge, J., Pollard, M. Analysis of the aliphatic monomer composition of polyesters associated with Arabidopsis epidermis: occurrence of octadeca-cis-6, cis-9-diene-1, 18-dioate as the major component. Plant J. 40 (6), 920-930 (2004).
- Franke, R., et al. Apoplastic polyesters in Arabidopsis surface tissues - A typical suberin and a particular cutin. Phytochemistry. 66 (22), 2643-2658 (2005).
- Vogg, G., et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid -ketoacyl-CoA synthase. J. Exp. Bot. 55 (401), 1401-1410 (2004).
- Molina, I., Bonaventure, G., Ohlrogge, J., Pollard, M. The lipid polyester composition of Arabidopsis thaliana and Brassica napus seeds. Phytochemistry. 67 (23), 2597-2610 (2006).
- Li-Beisson, Y., et al. Acyl-lipid metabolism. The Arabidopsis Book. 11, e0161 (2013).
- Molina, I., Ohlrogge, J. B., Pollard, M. Deposition and localization of lipid polyester in developing seeds of Brassica napus and Arabidopsis thaliana. Plant J. 53 (3), 437-449 (2008).
- Xiao, F., et al. Arabidopsis CYP86A2 represses Pseudomonas syringae type III genes and is required for cuticle development. EMBO J. 23 (14), 2903-2913 (2004).
- Christie, W. W., Han, X. . Lipid Analysis - Isolation, Separation, Identification and Lipidomic Analysis. , 446 (2010).
- Walton, T. J., Kolattukudy, P. E. Determination of the structures of cutin monomers by a novel depolymerization procedure and combined gas chromatography and mass spectrometry. Biochemistry. 11 (10), 1885-1896 (1972).
- Matzke, K., Riederer, M. A comparative study into the chemical constitution of cutins and suberins from Picea abies (L.) Karst., Quercus robur L., and Fagus sylvatica L. Planta. 185 (2), 233-245 (1991).
- Riederer, M., Schönherr, J. Quantitative gas chromatographic analysis of methyl esters of hydroxy fatty acids derived from plant cutin. J. Chromatogr. 360, 151-161 (1986).
- Moire, L., Schmutz, A., Buchala, A., Yan, B., Stark, R., Ryser, U. Glycerol Is a Suberin Monomer. New Experimental Evidence for an Old Hypothesis. Plant Physiol. 119 (3), 1137-1146 (1999).
- Graça, J., Schreiber, L., Rodrigues, J., Pereira, H. Glycerol and glyceryl esters of omega-hydroxyacids in cutins. Phytochemistry. 61 (2), 205-215 (2002).
- Eglinton, G., Hunneman, D. H. Gas chromatographic-mass spectrometric studies of long chain hydroxy acids-I: The constituent cutin acids of apple cuticle. Phytochemistry. 7 (2), 313-322 (1968).
- Espelie, K. E., Köller, W., Kolattukudy, P. E. 9,16-dihydroxy-10-oxo-hexadecanoic acid, a novel component in citrus cutin. Chem. Phys. Lipids. 32 (1), 13-26 (1983).
- Holloway, P. J. Intracuticular lipids of spinach leaves. Phytochemistry. 13 (10), 2201-2207 (1974).
- Holloway, P. J., Deas, A. H. B. Epoxyoctadecanoic acids in plant cutins and suberins. Phytochemistry. 12 (7), 1721-1735 (1973).
- Holloway, P. J., Cutler, D. F., Alvin, K. L., Price, C. E. . The chemical constitution of plant cutins. , 45-85 (1982).
- Croteau, R., Fagerson, I. S. The constituent cutin acids of cranberry cuticle. Phytochemistry. 11 (1), 353-363 (1972).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon