Method Article
Isolierung und Analyse der Zusammensetzung von Pflanzen Cuticle Lipid Polyester Monomere
In diesem Artikel
Zusammenfassung
Lipid polyesters constitute the structural components of two cell wall modifications, the plant cuticle and suberin-containing diffusion barriers. In this video, we describe a method to depolymerize cutin from whole delipidated leaves. The method can be applied to investigating mutants compromised in either cutin or suberin biosynthesis.
Zusammenfassung
Terrestrial plants produce extracellular aliphatic biopolyesters that modify cell walls of specific tissues. Epidermal cells synthesize cutin, a polyester of glycerol and modified fatty acids that constitutes the framework of the cuticle that covers aerial plant surfaces. Suberin is a related lipid polyester that is deposited on the cell walls of certain tissues, including the root endodermis and the periderm of tubers, tree bark and roots. These lipid polymers are highly variable in composition among plant species, and often differ among tissues within a single species. Here, we describe a detailed protocol to study the monomer composition of cutin in Arabidopsis thaliana leaves by sodium methoxide (NaOMe)-catalyzed depolymerisation, derivatization, and subsequent gas chromatography-mass spectrometry (GC/MS) analysis. This method can be used to investigate the monomers of insoluble polyesters isolated from whole delipidated plant tissues bearing either cutin or suberin. The method can by applied not only to characterize the composition of lipid polymers in species not previously analyzed, but also as an analytical tool in forward and reverse genetic approaches to assess candidate gene function.
Einleitung
Gefäßpflanzen verlassen sich auf extrazellulären Schichten, die als wasserdichte Barrieren zwischen Pflanzengewebe und der äußeren Umgebung zu funktionieren. Diese lipophilen Zellwand-assoziierten Strukturen beschränken pathogenen Infektionen und regulieren den passiven Transport von Gasen, Wasser und gelöste Stoffe in und aus Pflanzengeweben 1. Solche Barrieren sind die Kutikula, einem synapomorphic Struktur einzigartige Pflanzen 2 und verschiedenen Suberin haltigen Diffusionsbarrieren. Das Häutchen eine oleophile Schicht durch epidermale Zellen synthetisiert und an sie gebunden über eine pektinösen Schicht auf der extrazellulären Seite der Zellenwand 3-5. Er umhüllt die primären Luft Organe höherer Pflanzen, die als eine vitale Schnittstelle zwischen Pflanzengewebe und die Umwelt.
Cutin, die Strukturmatrix der Kutikula und Suberin gibt zwei unlöslichen Glycerolipid Polyester mit Lösungsmittel extrahierbaren Wachse 2,4 verbunden. Diese polymeren lipids sind aus gesättigten und ungesättigten Fettsäurederivaten besteht und sowohl strukturell als auch funktionell ähnlich. Jedoch sind sie unterscheidbar durch charakteristische Unterschiede in der chemischen Zusammensetzung und die Abscheidungsstellen.
Suberin ein aliphatischer Polyester ist in den Zellwänden bestimmter äußeren und inneren Geweben Bildung einer Sekundärwand. Korkartige Gewebe schließen periderms von Wurzeln, Knollen und Baumrinde, Wurzeln Endodermis, Samenschale Schichten und geheilten Wunden 2. Im Gegensatz Cutin, Suberin enthält der Polyester in der Regel Alkohole, gesättigte und mono-ungesättigten Dicarbonsäuren, und einen großen Anteil der sehr langkettigen Monomeren (C≥20).
Cutin ist das häufigste Lipid Polyester in Gefäßpflanzen 6 und wird von Glycerin und C16-C18 umgeesterten Fettsäurederivate wie Hydroxy und Hydroxy-Epoxy-substituierten Fettsäuren 4 besteht. Während die Zusammensetzung der Cutin Polymerenvariiert über tracheophyte Arten, die vorherrschende Primär Monomere sind 10, 16-Dihydroxy 16: 0, 18-Hydroxy-9,10-Epoxy-18: 0 und 9,10,18-Trihydroxy 18: 0-Fettsäuren. 2 Dicarbonsäure 7,8: Interessant ist, dass Arabidopsis Blatt und Stamm Cutin hauptsächlich aus 18 zusammengesetzt ist.
Pflanzen cuticles präsentieren auch eine beträchtliche Variabilität in der Dicke im Bereich von wenigen Nanometern bis einigen Mikrometern. 9 Da Kutikula Isolation ist ein mühsamer und zeitraubender Schritt, insbesondere für sehr dünne Blatt cuticles wie die von Arabidopsis thaliana 8. Verfahren, die Kutikula Isolierung umgehen, wurden entwickelt und validiert 7,8. Hier beschreiben wir ein ausführliches Protokoll, um die Monomerzusammensetzung von Cutin in Arabidopsis thaliana Blätter von Natriummethylat (NaOMe) -katalysierte Depolymerisation und anschließender Gaschromatographie / Massenspektrometrie (GC / MS) Analyse zu studieren. Dieses Protokoll bietet eine robuste Methode zur Untersuchung der ZusammenarbeitmPosition von Pflanzenlipid Polyester ganz delipidiertem Gewebe und hat sich von früher berichteten Protokolle 7,10,11 angepasst. Whole Gewebeproben werden zunächst homogenisiert und abschließend delipidierten, Entfernen von Lösungsmittel extrahierbaren Lipide einschließlich Kutikula und epikutikulären Wachse, Membranlipiden und Triacylglyceride. Zellwand-angereicherten Reste werden dann von Natriummethoxid-katalysierten Methanolyse in ihre konstituierenden Methylester-Monomeren depolymerisiert. Fettsäuremethylester werden nach Ansäuerung extrahiert, derivatisiert werden, um ihre entsprechenden Trimethylsilyl oder Acetyl-Derivaten erhalten. Derivatisierte Reste sind stark flüchtig und können aus einer Gaschromatographiesäule zu einem angemessenen Temperatur ohne Veränderung ihrer strukturellen Konformation während der GC / MS-Analyse eluiert werden.
Protokoll
Hinweis: Dieses Protokoll wurde von Bonaventure et al angepasst. (2004), Molina et al. (2006), Li et al. (2013) 7,10,11. Schritte 1-5 sind in Abbildung 1 zusammengefasst.
1. Tissue Delipidierung
Hinweis: Spülen Sie alle Glaswaren und Mützen mit Chloroform, ließ trockenen unter Abzug, vor der Verwendung.
ACHTUNG: Führen Sie Gewebehomogenisierung und alle Lösungsmittel-Transferschritte unter Abzug; immer tragen Laborkittel, Schutzhandschuhe und Spritzschutzbrille, um den direkten Kontakt mit Chemikalien zu vermeiden und um die Proben vor Verunreinigung zu schützen.
- Vorheizen Wasserbad und Heizblock auf 85 ° C.
- Ein Gewicht von etwa 0,5 g jeder Blattprobe in vorgewogene 20 mm x 125 mm Glasröhrchen mit Polytetrafluorethylen (PTFE) -Flächen Schraubverschlüssen. Fügen Sie vier Wiederholungen pro Probe.
- Platzieren 2-Propanol in einem Erlenmeyerkolben (etwa 125 ml; 25 ml pro g sample). Hinzufügen von 2,6-Di-tert-butyl-4-methylphenol (auch als butyliertes Hydroxytoluol, BHT bezeichnet) zu einer Endkonzentration von 0,01% (w / v).
Anmerkung: BHT Hinzufügen von einem 5% (w / v) Stammlösung in Methanol (BHT trägt zur Minimierung Oxidation ungesättigter Fettsäuren). - Vorheizen 2-Propanol-Lösung auf 85 ° C im Wasserbad.
- Hinzuzufügen 12 ml heißem 2-Propanol-Lösungsmittel zu jedem Probenröhrchen und Hitze für 15 Minuten bei 85 ° C im Heizblock. Dieser Schritt inaktiviert Lipasen, die aus zerstörten Zellen freigesetzt werden können.
- Lassen Rohre abkühlen auf Raumtemperatur und schleifen Gewebe gründlich mit Homogenisator, bis eine homogene Suspension entstanden ist.
- Legen Sie die Proben in einem Orbitalschüttler und schütteln Sie für 1-2 Stunden bei 100 UpM und Raumtemperatur.
- Zentrifugieren für 10 Minuten bei 800 xg und Überstand verwerfen.
- Fügen Sie ein gleiches Volumen 2-Propanol und schütteln für 12 Stunden bei Raumtemperatur.
- Zentrifugieren für 10 Minuten bei 800 xg und Überstand verwerfen.
- In 12 ml CHCl 3: CH 3 OH (2: 1, v / v) bis zu dem Rest (25 ml pro g Probe) und schüttelt über Nacht bei 100 rpm und Raumtemperatur.
- Zentrifugieren für 10 Minuten bei 800 xg und Überstand verwerfen.
- Hinzuzufügen 12 ml CHCl 3: CH 3 OH (1: 2, v / v) bis Rest und schütteln über Nacht bei 100 rpm und Raumtemperatur.
- Zentrifugieren für 10 Minuten bei 800 xg und Lösungsmittel zu entfernen.
- Lassen Proben trocknen unter Abzug Nacht bei Raumtemperatur.
- Der Luft trocknen den Rückstand und legen Sie dann in einem Vakuumexsikkator über wasserfreiem CaCl 2 oder CaSO 4 bis zur Gewichtskonstanz (3-5 Tage) erreicht ist.
2. Depolymerisation: Methanolyse mit Natriummethoxid (Abbildung 2)
ACHTUNG: Führen Sie die Schritte 2,3 bis 2,4, 2,7 bis 2,8, 2,10 bis 2,11, 2,13 bis 2,15 und 2,17 bis 2,18 unter Abzug; immer tragen Laborkittel, Schutzhandschuhe und Spritzschutzbrille.
- Vorheizwärmetauscher Block auf 60 ° C.
- Wiegen Teströhrchen mit dem trockenen Rückstand (wichtig für die weiteren Berechnungen).
- In internen Standards in jedes Röhrchen: 25 & omega; L Methyl heptadecanoate (1 mg / ml Stamm) und 25 & mgr; l ω-Pentadecalacton (1 mg / ml Stamm).
- In 0,9 ml Essigsäuremethylester, 1,5 ml Natriummethylat und 3,6 ml Methanol zu jedem Röhrchen und diese abschließen. Alternativ bereiten eine Reaktionsmischung mit diesen drei Reagenzien und fügen 6-ml-Teilmengen zu jeder Probe.
- Wärme Proben für 2 Stunden bei 60 ° C und Vortex periodisch in Intervallen von 15 min.
- Lassen Proben abkühlen auf Raumtemperatur.
- 10 ml Methylenchlorid (CH 2 Cl 2) und 1,5 ml Eisessig, um die Fettsäuremethylester zu extrahieren.
- In Kochsalzlösung (0,5 M NaCl) in jedes Röhrchen und Kappe zu füllen.
- Wirbel Proben für 1 min und zentrifugieren für 10 min bei 800 x g.
- Übertragen Sie die organische Phase (unten) bis mittlere saubere Röhrchen (16 x 125 mm Glasröhrchen mit PolyTetrafluorethylen (PTFE) -Flächen Schraubkappe).
- In Kochsalzlösung (0,5 M NaCl) in jedes Röhrchen und Kappe zu füllen.
- Wirbel Proben für 1 min und zentrifugieren für 10 min bei 800 x g.
- Entfernen wässrige (obere) Phase und wiederholen Sie die Schritte von 2,11 bis 2,12.
- Entfernen Sie das gesamte wässrige (obere) Phase.
- Wasserfreies Natriumsulfat (Na 2 SO 4) zu dem Lösungsmittel, Verschließe die Röhrchen und Wirbel für 1 min; Proben können nun bis zum nächsten Tag gelassen werden. An dieser Stelle Proben können über Nacht im Abzug belassen werden.
- Zentrifugieren für 2 Minuten bei 800 · g, um die Na & sub2; SO & sub4; -Salz im Boden zu verdichten.
- Übertragen Sie die organische Phase zu einem kleinen Glaseinwegrohr (13 x 100 mm Glasröhrchen mit Polytetrafluorethylen (PTFE) -Flächen Schraubkappe).
- Man dampft das Lösungsmittel zur Trockene unter Stickstoff und fahren mit dem Derivatisierungsschritt. Wenn nicht sofort verarbeitet, eingedampft Proben bei -20 ° C (Proben kann eine sein,lso vor dem Verdampfungsschritt gespeichert).
3. Herstellung von Derivaten für die Gaschromatographie
ACHTUNG: Führen Sie die Schritte 3.1.2 und 3.1.5 - 3.1.8 unter einer Abzugshaube; immer tragen Laborkittel, Schutzhandschuhe und Spritzschutzbrille.
- Trimethylsilylderivate
- Vorheizwärmetauscher Block auf 100 ° C.
- 100 ul Pyridin und 100 ul BSTFA (N, O-Bis-trimethylsilyl trifluoracetamid) in jedes Röhrchen und diese abschließen.
- Wärme Proben bei 100 ° C für 10 min.
- Lassen Proben abkühlen auf Raumtemperatur.
- Verdampfen Proben unter Stickstoff bei Raumtemperatur. Vermeiden Sie die Anwendung von Wärme, um Proben, sind Monomere sehr volatil in diesem Stadium.
- Gib 500 ul einer 1: 1 (V / V) Heptan: Toluol.
- Wirbel Proben für 1 min und zentrifugieren für 2 min bei 800 x g.
- Proben, die GC-Vials hinzufügen und fahren Sie mit GC / MS-Analyse.
- AcetylDerivate
Hinweis: Zur Acetylierung ändern Schritte 3.1.1-3.1.3 oben wie folgt (nicht im Video gezeigt); Schritte 3.1.4-3.1.8 sind die gleichen:- Vorheizwärmetauscher Block auf 60 ° C.
- 100 ul Pyridin und 100 ul Essigsäureanhydrid (Ac 2 O) in die Röhrchen.
- Wärme Proben 1 Stunde bei 60 ° C.
4. GC / MS-Analyse
- Verwenden Sie ein HP-5-Kapillarsäule (30 mx 0,25 mm x 0,25 um Filmdicke) oder gleichwertig (dh., 5% Diphenyl, 95% Dimethylpolysiloxan). Programmieren Sie die GC mit Helium-Trägergasstrom von 1,5 ml / min eingestellt und die Ofentemperatur von 150 bis 300 ° C bei 3 ° C / min programmiert.
- Verwenden Teileinspritzung (Splitverhältnis 1:10), und legen Massenspektrometer-Modus über 40 bis 600 amu (Elektronenstoß-Ionisation) scannen.
- Erstellen Sie eine Sequenztabelle einschließlich Lösungsmittel (blank), WT und Mutanten-Wiederholungen, jeder mit dem angegebenen Cutin Analyseverfahren.
- Last Lösungsmittelund Probenfläschchen auf dem Karussell, fügen Hexan Spritzenspülung Fläschchen in den Autosampler wenn nötig, und starten Sie die Sequenz. Nachdem die Sequenz vollendet ist, sind insgesamt Ionenchromatogramm Spuren für alle Proben zur Verfügung.
5. Datenanalyse
- Identifizieren Lipid-Polyester-Monomere durch den Vergleich der einzelnen Spitzenmassenspektrum zu veröffentlichten Massenspektren oder durch die Suche Kommerzielle Bibliothek, falls verfügbar.
- Für jedes identifizierte Peak im Gesamtionenstrom-Chromatogramm, verwenden ihre jeweiligen Retentionszeiten, die Bereiche auf der Integrationsergebnisse Tabelle aus der GC / MS-Software (Supplemental Abbildung 1) zu finden.
- Für jedes Monomer (Spalten AB), fügen Sie die Bereichswerte im Integrationstabelle (Supplemental Abbildung 1, Spalte D) festgestellt, dass die entsprechende Spalte für jeden replizieren Probe in der Excel-Tabelle von Monomeren (Supplemental Datei 2, Spalten CF), das ist eine Tabellenkalkulation, um Arabidopsis zu quantifizierenCutin TMSi Derivate. Verwenden STADT Datei-3, wenn acetylierten Derivaten anstelle vorbereitet.
- Fügen die Bereiche der internen Standards (IS) an den IS-Säulen (HK). Für jene Monomere, die nicht derivatisiert sind, nämlich Fettsäuremethylester (FAME) und Dicarbonsäuredimethylester (DCA DME), verwenden 17: 0 FAME (IS1), wie es für die Quantifizierung (violett schattierten Zellen in der Monomer-Tabelle; Supplemental Files 3.2). Für hydroxylierten Monomeren, einschließlich primäre Alkohole, Ferulasäure und ω-Hydroxysäuren, verwenden 15: 0 15-Hydroxy FAME (IS2), wie der Wahl für die Verbindung, die Quantifizierung (grün-shadded Zellen in der Monomer-Tabelle; Zusatzdateien 2/3) .
- In trockenen Flügelgewicht für jede Wiederholung, um Spalten AX-BA (Supplemental Datei 2) oder AQ-AT (Supplemental Datei-3); Alternativ scannen Blätter Flächen berechnen und fügen Bereich Werte in das Monomer Tabelle Monomers Lasten pro Einheit zum Ausdruck bringenOberfläche.
Ergebnisse
Die in dieser Handschrift beschriebenen Protokoll wird bis zu Lipid Polyester-Monomere bestimmen, eingestellt und minimiert die Beiträge von Nicht Cutin Lipide 10 Abbildung 1 zeigt einen Überblick über den Test, die insgesamt dauert zwischen 8 (dh Cutin oder Suberin.) -. 10 Tage (von der ersten Gewebeernte auf den Erhalt GC-Daten), je nachdem wie lange Proben trocknen gelassen.
Der ausgewählte basenkatalysierte Methanolyse (Abbildung 2) Verfahren, um Polyester zu depolymerisieren, wurde zuvor für Arabidopsis Samen, die sowohl Cutin und Suberin enthalten validiert. Die Gewebe werden zuerst homogenisiert und abschließend delipidierten um Lösungsmittel extrahierbaren Lipide zu entfernen. Der Rückstand Ausbeute nach der Extraktion, als Prozentsatz der anfänglichen Frischgewicht, ist in der Regel 6% für A. thaliana Col-0 Blättern. Zellwand angereicherte Reste sind in einem Vakuumexsikkator getrocknet und dann durch in ihre konstituierenden Methylester-Monomeren depolymerisiertbasenkatalysierte Trans. Zweistündigen Inkubation wurde als die kritische Zeit für die ordnungsgemäße Depolymerisation und Rückgewinnung von Lipid-Polyester-Komponenten erforderlich gewählt. Längere Inkubationszeiten führten zu einer Zunahme der 2-Hydroxysäuren; diese möglicherweise stammen aus Membran Sphingolipide 10.
Ein typisches Chromatogramm, wenn Arabidopsis-Wildtyp Blatt Cutin ist in Abbildung 3 gezeigt, für O -TMSi-Derivate (3A) und O-Acetyl-Derivate (3B). Jeder Peak wurde durch Vergleich mit Massenspektren aus der Literatur 7,8 und einer öffentlichen Datenbank 12 .Our Video-Protokoll zeigt, wie TMSi Derivate herzustellen identifiziert, aber Proben kann alternativ acetylierte Hydroxylgruppen derivatisieren. Silylierte Derivate sind gut für Identifikationszwecke, weil sie geben Diagnose-Massenspektren. Jedoch acetylierten Derivaten stabiler und eine gute Alternative zur Silylierungeinmal Monomere wurden identifiziert 10. , Zur Verwirklichung dieses Protokolls in den Labors, die nur GC Flammenionisationsdetektor (FID) gekoppelt ist, GC / FID Spuren entsprechend acetylierte Derivate von WT Blatt Cutin Monomeren und zu einem Homolog Reihe von Fettsäuremethylester-Standards werden auch gezeigt (Supplemental Abbildung 4).
Diese Methode ist qualitative und quantitative erkennt Unterschiede zwischen Proben, daher der Wert für Mutanten-Analyse. Die Mengen der einzelnen Monomeren werden nach der Methode des internen Standards zur Quantifizierung, dass sie Vergleiche von Monomer Fluss zwischen den Proben bestimmt. Es sollte klargestellt werden, jedoch, dass die Spitzengröße (total ion counts) möglicherweise nicht die Molverhältnisse der Monomeren in der Polyester reflektieren. Wir sind inklusive editierbare Tabellen von Monomeren zu Monomermengen in Arabidopsis Blatt Cutin als Fettsäuremethylester und TMSi Derivate (Supplemental Datei 1), oder Ass berechnen tyl-Derivate (Supplemental Datei 2) von Alkoholen. Diese Tabellen müssen möglicherweise angepasst werden, wenn Proben aus verschiedenen Organen oder Pflanzen extrahiert werden.
Als Beispiel haben wir analysiert haben Arabidopsis Thalia na Columbia (Col-0) Wildtyp-Blätter und zwei bisher dadurch Null-Mutante Allele des CYP86A2 / ATT1 Gen att1-1 (m-1) und att1-2 (m-2 ) 13,14. Cytochrom-P450-Monooxygenasen der CYP86A Familie codieren vermeintliche ω-Oxydasen und beteiligen sich an Suberin und Cutin Monomer-Biosynthese. Die Ergebnisse (Figur 4) zeigen, signifikante Verringerungen in den Lasten der drei Hauptlipid Monomere in den mutierten Blätter im Vergleich zu WT-Blätter. In Übereinstimmung mit vorhergesagten Funktion des Enzyms, 16: 0, 18: 2 und 18: 1 Dicarboxylate sind speziell in att1 Mutanten beeinflusst.
"Src =" / files / ftp_upload / 53.386 / 53386fig1.jpg "/>
Abbildung 1. Übersicht über die Lipid Polyester-Analyse. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
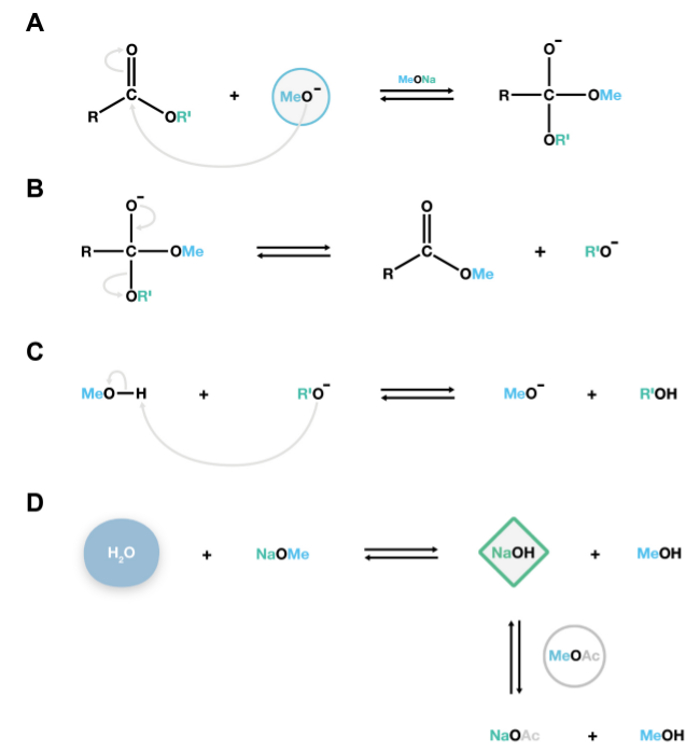
Figur 2. Mechanismus der NaOMe-katalysierte Transmethylierung Reaktion. Die nucleophilen Methoxidanion greifen die Carbonyl Kohlen von Lipid Polyester eine instabile tetraedrische Zwischenprodukt (A), die leicht dissoziiert in Fettsäuremethylester und Alkoholat-Anionen (B) zu bilden. Diese Alkoholate sind konjugierte Basen, und zur Reaktion mit Methanol, die Regenerierung der katalytisch aktiven Methoxidanion dadurch erhalt zusätzliche Depolymerisationsreaktionen (C). Wenn Wasser in die GegenwartSystem, wird es mit Natriummethoxid reagieren, um Natriumhydroxid, eine starke Basis, die irreversibel hydrolysiert Ester, um unerwünschte freie Fettsäuren produzieren zu bilden. Essigsäuremethylester wird als Co-Lösungsmittels 15 hinzugefügt, um kleine Mengen von Natriumhydroxid innerhalb des Systems (D) entfernen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
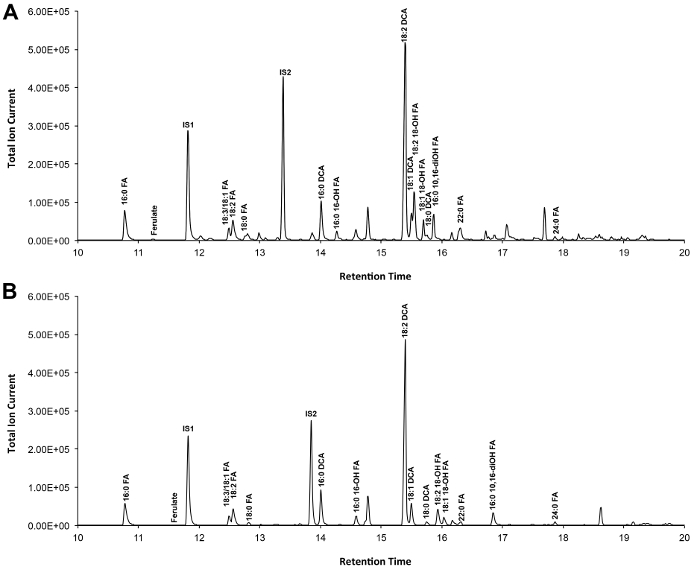
Abbildung 3. Repräsentative Gesamt Ionenchromatogramm von Wildtyp-Arabidopsis thaliana Blatt Cutin Monomeren. (A) O -trimethylsilyl (TMSi) ether und (B) Acetat-Hydroxyl-Derivate. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
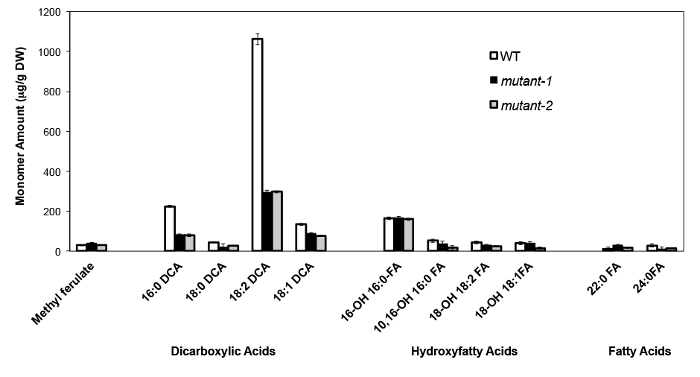
Abbildung 4. Cutin Monomerzusammensetzung von Arabidopsis thaliana WT und zwei Nullmutante Allele des CYP86A2-Gen. (Mutante-1 = att1-1; Mutant 2 = att1-2) Fehlerbalken stellen die Standardabweichung vom Mittelwert (n = 4) . Ab 13 angepasst ist, mit Erlaubnis von © Blackwell Publishing (2007). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
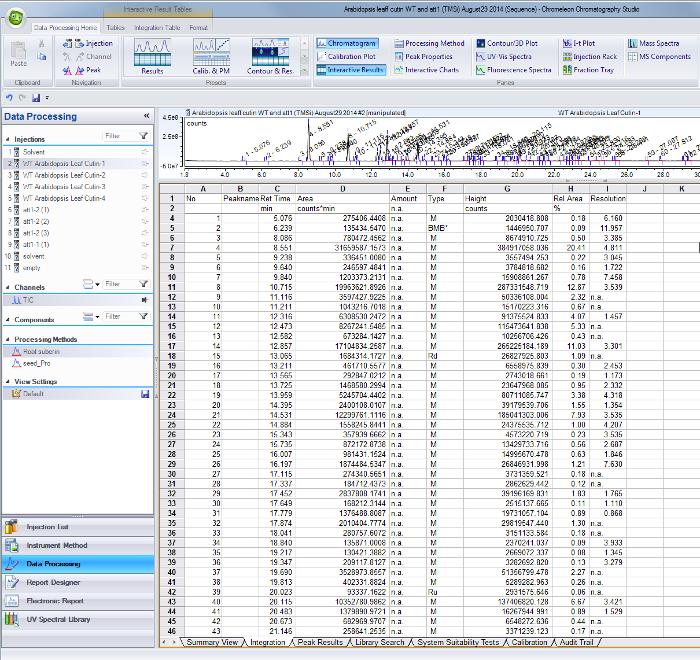
STADT Abbildung 1. Peak-Integrationsergebnisse Tabelle aus der GC / MS-Software. Peaks entsprechend dem ermittelten Monomere und internen Standards werden durch ihre retenti identifiziert pünktlich (Spalte C) und Flächenwerte sind in der Spalte tabellarisch D. Bitte klicken Sie hier, um diese Datei herunterzuladen.
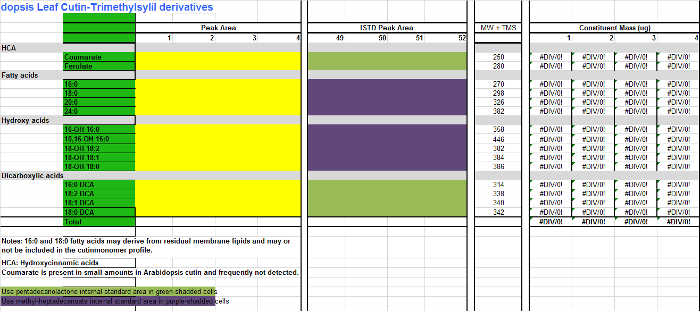
STADT Datei 2. Inhalts Arabidopsis Cutin Monomere (Trimethylsilylether-Derivate der Hydroxy-Fettsäuremethylester). Bitte klicken Sie hier, um diese Datei herunterzuladen.
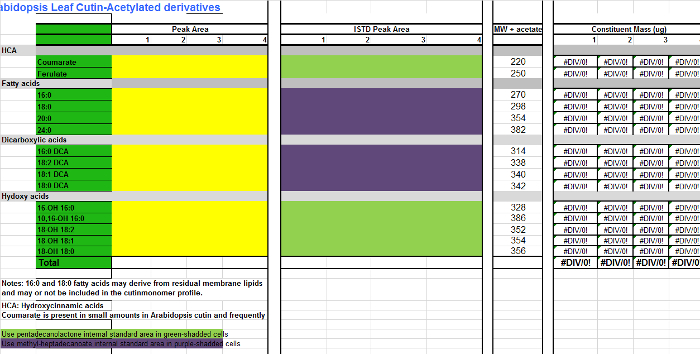
Zusätzliche Datei 3. Tabelle Arabidopsis Cutin Monomere (O-Acetyl-Derivate der Hydroxy-Fettsäuremethylester).com / files / ftp_upload / 53.386 / Supplemental_File_3_Cutin_template_Acetylated_derivatives.xlsx "target =" _ blank "> Bitte klicken Sie hier, um diese Datei herunterzuladen.
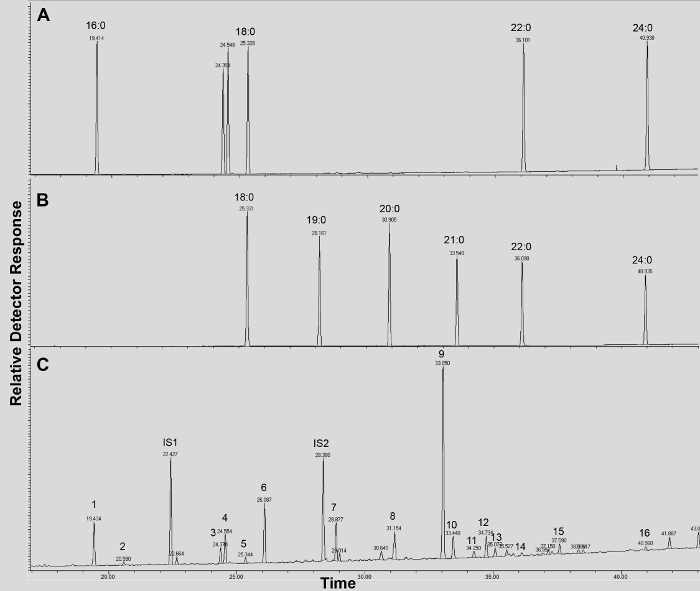
STADT Abbildung 4. GC / FID Spuren von (AB) Fettsäuremethylester (FAME) Retentionsindex-Standards (Peaks werden mit jedem gesättigten FAME Kettenlänge bezeichnet); und (C) acetyliert A. thaliana WT Blatt Cutin Monomeren. Zahlen Sie auf Spitzen entsprechen: 16: 0 FAME (1), Ferulat (2), 18: 3 FAME (3), 18: 1/18: 2 FAME (4), 18: 0 FAME (5), Sinapinsäure (6 ), 16: 0 DCA (7), 16-OH 16: 0 FAME (8), 18: 2 DCA (9), 18: 1 DCA (10) 18: 0 DCA (11), 18-OH-18: 2 FAME (12), 18-OH 18: 1 FAME (13), 20: 0 FAME (14), 10,16-Dioh 16: 0 FAME (15), 24: 0 FAME (16). DCA: dicarbonsäuredimethylester; FAME: Fettsäuremethylester; IS1: interner Standard 1, 17: 0 FAME; IS2: Innen standard 2, 15-OH 15: 0 FAME. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Im Gegensatz zu anderen Biopolymeren wie DNA und Proteine werden Pflanzenlipid Polyester nicht aus einer Vorlage hergestellt. Stattdessen ihre Kompositionen sind abhängig von der Spezifität der in den Geweben, die diese extrazellulären Polymeren machen vorhandenen Enzyme. Als solche chemischen Analysen der einzelnen Komponenten sind wichtig, um Lipidpolyestermasse zu verstehen.
Chemische Verfahren, um Esterbindungen zu spalten, umfassen Verseifung, Hydrogenolyse, sauer katalysierte Transmethylierung und basenkatalysierte Trans 2. Jede von ihnen hat Vorteile und Nachteile. Verseifung produziert freie Fettsäure-Hydroxy-Säuren, die Nebenreaktionen eingehen können. Hydrogenolyse mit Lithiumaluminiumhydrid (LiAlH 4) 16 für Cutin Analyse 7 verwendet. Hydrogenolyse reduziert funktionalisierten Kohlenstoffatomen zu Alkoholen und die ursprünglichen Strukturen müssen durch deuteriolysis mit Lithiumaluminiumdeuterid (LiAlD 4) zu entnehmen. DasNachteil dieser Vorgehensweise ist das Erfordernis hoher Auflösung GC / MS, den Grad der Deuterierung der Fett Polyolen Zuordnungen ihrer Strukturen bilden zu vergleichen. Säure-katalysierte Umesterung mit methanolischer Bortrifluorid (BF 3) ist mehrfach in Cutin und Suberin Depolymerisationen 8,17,18 verwendet, aber das Reagenz hat eine begrenzte Lagerfähigkeit und kann zu Artefakten aufgrund von Reaktionen 15 her einzuführen. Methanolischer Schwefelsäure ergibt auch Methylester von den Monomeren, aber mit größeren Anteilen von 2-Hydroxy-Fettsäuren, die vermutlich nicht wahr sind Lipidpolyesterkomponenten im Vergleich zu anderen Verfahren 10.
Die in diesem Protokoll beschrieben NaOMe-katalysierten Umesterungsverfahren produziert Fettsäuremethylester, die durch Silylierung der Hydroxylgruppen derivatisiert sind, wodurch charakteristische Massenspektren zur Identifizierung oder durch Acetylierung, stabilere Derivate von Hydroxylgruppen fo liefernr Quantifizierung. Ein Nachteil dieser Technik ist, dass die Hydrolyse in Konkurrenz Umesterung, wenn Wasser in der Reaktion vorhanden ist. Wasser reagiert mit NaOMe (den Katalysator) und erzeugt NaOH, was wiederum hydrolysiert Fettsäuremethylestern zu freien Säuren (2D) zu erhalten. Dies ist eine unerwünschte Nebenreaktion, weil zwei Peaks für jede Fettsäure vorhanden sein: einem Methylester und einem TMSi Esterderivat, so verkomplizieren die Analyse. Verwendung von wasserfreien Reagenzien und Zugabe von Methylacetat als ein Co-Lösungsmittel mit Verseifung konkurrieren somit entscheidenden Schritte zur Hydrolyse (2D) zu verhindern.
Cutin und Suberin enthalten zwischen 1 und 26% Glycerin 4. Jedoch wird dieses Monomer nicht durch die in diesem Protokoll beschriebenen Versuchsbedingungen festgestellt werden. Glycerin ist stark hydrophil und im Gegensatz zu den Fettsäuremethylester-Monomeren, während das wässrige Lösungsmittel-Waschschritte eliminiert werden. Diese Einschränkung auch einpplies zu anderen Cutin Depolymerisationsverfahren, aber Glycerin in der wässrigen Phase nach der Umesterung unter Verwendung eines enzymatischen Verfahrens erhalten bestimmt werden. Alternativ kann sie unter Verwendung von milderen Bedingungen ohne weitere Wasserentnahme quantifiziert werden (z. B. 0,05 M NaOMe), um alle Monomere zu detektieren, einschließlich Glycerin 19,20 .Obwohl zwecks Quantifizierung Glycerin nützlich milden Bedingungen in der Regel geben unvollständige Depolymerisation von Cutin und Suberin.
Wenn ein GC zu einem Flammenionisationsdetektor (FID) angeschlossen ist, verfügbar sind, können alle Wiederholungen in diesem Instrument zur quantitativen Zwecken ausgewertet werden, wonach Peaks einer repräsentativen Probe wurden durch GC / MS identifiziert. Alternativ können Monomere in den GC / FID Spuren identifiziert, wenn ihre Retentionsindizes bekannt sind. Der Flammenionisationsdetektor eine besonders hohe Empfindlichkeit und eine breite Palette der Verhältnismäßigkeit, der entscheidend für die Quantifizierung von größeren und kleineren Probenkomponenten istin einzelnen Läufen. Darüber hinaus ist es robust und einfach zu warten und zu bedienen 15.
Das beschriebene Protokoll ermöglicht die zuverlässige und reproduzierbare Isolierung, Identifizierung und Quantifizierung von pflanzlichen Lipid Polyestermonomere, wodurch die chemische Charakterisierung der Mutanten, die in der Zusammensetzung von einer oder mehreren Lipid Polyestermonomere abweichen. Das Verfahren ist skalierbar und kann leicht angepasst werden, um sowohl kleine als auch größere Mengen von verschiedenen Pflanzenmaterialien, einschließlich Wurzeln, Samen, Blätter, Stängel und Blüten zu verarbeiten. Massenspektraldaten von Lipid Polyestermonomere aus vielen Spezies wurden veröffentlicht z. B. 21-26 und stellen wertvolle Mittel zur unbekannten Monomere zu identifizieren, wenn eine Anpassung dieses Protokoll auf andere Gewebe und / oder Spezies. Dieses Verfahren ist anwendbar auf Untersuchungen der Biosynthese, Regelung und Verteilung von Lipid Polyestern in höheren Pflanzen.
Offenlegungen
No conflicts of interest declared.
Danksagungen
This work was supported by a Natural Sciences and Engineering Research (NSERC)-USRA grant to S.J., and by an NSERC-Discovery Grant to I.M. We thank Richard Bourgault, Meghan Rains, and Amanda Fluke for technical assistance. Seeds of att1-1 and att1-2 mutants were kindly provided by Dr. Jian-Min Zhou, Institute of Genetics and Developmental Biology, Beijing, China.
Materialien
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-propanol | Fisher Scientific | BPA451-4 | Solvent for delipidation |
| Anhydrous sodium sulfate | Fisher Scientific | S421500 | |
| Acetic anhydride | Sigma Aldrich | 320102 | Derivatization agent |
| BSTFA (N,O-bis(trimethylsilyl)-trifluoroacetamide) | Sigma-Aldrich | 15222 | Derivatization agent |
| Butylated hydroxytoluene (BHT) | Sigma-Aldrich | 101162 | Antioxidant |
| Calcium chloride, anhydrous | Fisher Scientific | C614-3 | Desiccation agent |
| Calcium suflate, anhydrous (DRIERITE- 8 MESH with indicator) | Acros Organics | 219090020 | Desiccation agent |
| Chloroform (Trichloromethane) | Fisher Scientific | C6074 | Organic solvent |
| Glacial acetic acid | Fisher Scientific | BP2401212 | Acidification agent |
| Helium carrier gas, compressed | Air Liquide | ALPHAGAZ1-UN1046 | Carrier gas, GC/MS |
| Heptane | Fisher Scientific | H3501 | Organic solvent |
| Hexanes | Fisher Scientific | H3024 | Organic solvent |
| Methanol | Fisher Scientific | A4124 | Organic solvent, transmethylation reactive |
| Methyl acetate | Sigma-Aldrich | 296996 | Organic solvent |
| Methyl heptadecanoate | Sigma-Aldrich | H4515 | Internal standard (1mg/mL stock) |
| Methylene dichloride (Dichloromethane) | Fisher Scientific | D374 | Organic solvent |
| Nitrogen, compressed | Air Liquide | ALPHAGAZ1-UN1044 | Carrier gas, GC-FID |
| Pentadecanolactone | Fluka | 76530 | Internal standard (1 mg/ml stock) |
| Pyridine | Sigma-Aldrich | 270970 | Co-solvent for derivatization |
| Sodium chloride | Fisher Scientific | BP358212 | Saline solution |
| Sodium methoxide (25wt.%) | Sigma-Aldrich | 156256 | Nucleophile |
| Toluene | FIsher Scientific | T2904 | Organic solvent |
| Plant Growth Supplies | |||
| Pro-Mix PGX | Premier Tech Horticulture Ltd | Pro-Mix PGX is recommended to grow Arabidopsis plants (Eddy, R. and Hahn, D.T., 2012,http://docs.lib.purdue.edu/pmag/2) Purdue Methods for Arabidopsis Growth. | |
| PermaNest Humidity Dome | Grower's Solution, LLC, Cookeville, TN | GD2211-24 | |
| Perma-Nest Plant Trays (22x11in) | Grower's Solution, LLC, Cookeville, TN | N/A | |
| Square greenhouse pots, 3.5 inch | Grower's Solution, LLC, Cookeville, TN | P86 | |
| General Purpose Plant Fertilizer, Plant-Prod 20-20-20 | Premier Tech Home and Garden In., Brantford, ON | N/A | |
| Glassware | |||
| 13 x 100 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-13100 | |
| 16 x 125 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-16125 | |
| 20 x 125 mm glass test tubes with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-20125 | |
| GC vial caps | National Scientific | C400051A | |
| GC vial microinserts | National Scientific | C4011631 | |
| GC vials | National Scientific | C40001 | |
| Disposable pasteur pipets | Fisher Scientific | 1367820B | |
| Flasks | Fisher Scientific | ||
| Equipment | |||
| Allegra X15R centrifuge | Beckman Coulter | ||
| Analytic balance | Fisher Scientific | ||
| Belly dancer | A shaker can be used for this purpose if Belly Dancer not available | ||
| DB-5 Capillary GC column | J&W Scientific, CA, USA; | 30 m x 0.25 mm x 0.25 μm film thickness | |
| Desiccator | |||
| Isotemp 202 water bath | Fisher Scientific | ||
| ISQ LT single quadupole mass spectrometer | Thermo Scientific | ||
| Heat block | Fisher Scientific | ||
| Nitrogen evaporator | |||
| Polytron homogenizer | Birkmann | ||
| Trace 1300 gas chromatograph | Thermo Scientific | ||
| Two-stage regulator | Air Liquide | Q1-318B-580 | |
| Vacuum desiccator | Fisher Scientific | ||
| Vortex mixer | Fisher Scientific |
Referenzen
- Kolattukudy, P. Biopolyester membranes of plants: cutin and suberin. Science. 208 (4447), 990-1000 (1980).
- Kolattukudy, P. E. Polyesters in higher plants. Adv. Biochem. Eng. Biot. 71, 1-49 (2001).
- Yeats, T. H., Rose, J. K. C. The formation and function of plant cuticles. Plant Physiol. 163 (1), 5-20 (2013).
- Pollard, M., Beisson, F., Li, Y., Ohlrogge, J. B. Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13 (5), 236-246 (2008).
- Beisson, F., Li-Beisson, Y., Pollard, M. Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15 (3), 329-337 (2012).
- Heredia, A. Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta. 1620 (1-3), 1-7 (2003).
- Bonaventure, G., Beisson, F., Ohlrogge, J., Pollard, M. Analysis of the aliphatic monomer composition of polyesters associated with Arabidopsis epidermis: occurrence of octadeca-cis-6, cis-9-diene-1, 18-dioate as the major component. Plant J. 40 (6), 920-930 (2004).
- Franke, R., et al. Apoplastic polyesters in Arabidopsis surface tissues - A typical suberin and a particular cutin. Phytochemistry. 66 (22), 2643-2658 (2005).
- Vogg, G., et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid -ketoacyl-CoA synthase. J. Exp. Bot. 55 (401), 1401-1410 (2004).
- Molina, I., Bonaventure, G., Ohlrogge, J., Pollard, M. The lipid polyester composition of Arabidopsis thaliana and Brassica napus seeds. Phytochemistry. 67 (23), 2597-2610 (2006).
- Li-Beisson, Y., et al. Acyl-lipid metabolism. The Arabidopsis Book. 11, e0161 (2013).
- Molina, I., Ohlrogge, J. B., Pollard, M. Deposition and localization of lipid polyester in developing seeds of Brassica napus and Arabidopsis thaliana. Plant J. 53 (3), 437-449 (2008).
- Xiao, F., et al. Arabidopsis CYP86A2 represses Pseudomonas syringae type III genes and is required for cuticle development. EMBO J. 23 (14), 2903-2913 (2004).
- Christie, W. W., Han, X. . Lipid Analysis - Isolation, Separation, Identification and Lipidomic Analysis. , 446 (2010).
- Walton, T. J., Kolattukudy, P. E. Determination of the structures of cutin monomers by a novel depolymerization procedure and combined gas chromatography and mass spectrometry. Biochemistry. 11 (10), 1885-1896 (1972).
- Matzke, K., Riederer, M. A comparative study into the chemical constitution of cutins and suberins from Picea abies (L.) Karst., Quercus robur L., and Fagus sylvatica L. Planta. 185 (2), 233-245 (1991).
- Riederer, M., Schönherr, J. Quantitative gas chromatographic analysis of methyl esters of hydroxy fatty acids derived from plant cutin. J. Chromatogr. 360, 151-161 (1986).
- Moire, L., Schmutz, A., Buchala, A., Yan, B., Stark, R., Ryser, U. Glycerol Is a Suberin Monomer. New Experimental Evidence for an Old Hypothesis. Plant Physiol. 119 (3), 1137-1146 (1999).
- Graça, J., Schreiber, L., Rodrigues, J., Pereira, H. Glycerol and glyceryl esters of omega-hydroxyacids in cutins. Phytochemistry. 61 (2), 205-215 (2002).
- Eglinton, G., Hunneman, D. H. Gas chromatographic-mass spectrometric studies of long chain hydroxy acids-I: The constituent cutin acids of apple cuticle. Phytochemistry. 7 (2), 313-322 (1968).
- Espelie, K. E., Köller, W., Kolattukudy, P. E. 9,16-dihydroxy-10-oxo-hexadecanoic acid, a novel component in citrus cutin. Chem. Phys. Lipids. 32 (1), 13-26 (1983).
- Holloway, P. J. Intracuticular lipids of spinach leaves. Phytochemistry. 13 (10), 2201-2207 (1974).
- Holloway, P. J., Deas, A. H. B. Epoxyoctadecanoic acids in plant cutins and suberins. Phytochemistry. 12 (7), 1721-1735 (1973).
- Holloway, P. J., Cutler, D. F., Alvin, K. L., Price, C. E. . The chemical constitution of plant cutins. , 45-85 (1982).
- Croteau, R., Fagerson, I. S. The constituent cutin acids of cranberry cuticle. Phytochemistry. 11 (1), 353-363 (1972).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten