Method Article
Isolamento e composicional Análise da cutícula vegetal lipídicas poliéster Monómeros
Neste Artigo
Resumo
Lipid polyesters constitute the structural components of two cell wall modifications, the plant cuticle and suberin-containing diffusion barriers. In this video, we describe a method to depolymerize cutin from whole delipidated leaves. The method can be applied to investigating mutants compromised in either cutin or suberin biosynthesis.
Resumo
Terrestrial plants produce extracellular aliphatic biopolyesters that modify cell walls of specific tissues. Epidermal cells synthesize cutin, a polyester of glycerol and modified fatty acids that constitutes the framework of the cuticle that covers aerial plant surfaces. Suberin is a related lipid polyester that is deposited on the cell walls of certain tissues, including the root endodermis and the periderm of tubers, tree bark and roots. These lipid polymers are highly variable in composition among plant species, and often differ among tissues within a single species. Here, we describe a detailed protocol to study the monomer composition of cutin in Arabidopsis thaliana leaves by sodium methoxide (NaOMe)-catalyzed depolymerisation, derivatization, and subsequent gas chromatography-mass spectrometry (GC/MS) analysis. This method can be used to investigate the monomers of insoluble polyesters isolated from whole delipidated plant tissues bearing either cutin or suberin. The method can by applied not only to characterize the composition of lipid polymers in species not previously analyzed, but also as an analytical tool in forward and reverse genetic approaches to assess candidate gene function.
Introdução
As plantas vasculares confiar em camadas extracelulares, que funcionam como barreiras impermeáveis entre os tecidos de plantas e o ambiente externo. Estas estruturas associadas da parede celular lipofílico restringir a infecção patogénica e regular o transporte passivo de gases, água e substâncias dissolvidas dentro e para fora dos tecidos da planta 1. Tais barreiras são a cutícula da planta, uma estrutura única para plantas sinapomórficas 2, e barreiras de difusão diferentes contendo suberina. A cutícula é uma camada oleof�lico sintetizado por células epidérmicas e ligado a eles por meio de uma camada péctico no lado extracelular da parede celular 3-5. É encerra os órgãos aéreos primárias de plantas superiores, funcionando como uma interface vital entre tecidos da planta e do meio ambiente.
Cutina, a matriz estrutural da cutícula, e suberina são dois poliésteres glicerolípido insolúveis associadas com ceras solvente 2,4-extraíveis. Estes l poliméricoIPIDs são compostas de derivados de ácidos gordos saturados e insaturados e de ambos são estruturalmente e funcionalmente semelhante. No entanto, eles são distinguíveis por diferentes características de sites de composição e deposição química.
Suberina é um poliéster alifático localizado no interior das paredes das células de certos tecidos internos e externos que formam uma parede secundária. Tecidos suberizadas incluem periderms de raízes, tubérculos e casca de árvore, endoderme raiz, camadas de revestimento de sementes, e feridas curadas 2. Ao contrário cutina, o poliéster suberina tipicamente contém álcoois, ácidos dicarboxílicos saturados e mono-insaturados, e uma grande proporção de monómeros de cadeia muito longa (C≥20).
Cutina é o mais abundante poliéster lípido em plantas vasculares 6, e é composto de glicerol e C16-C18 derivados de ácidos gordos interesterificada, tais como ácidos gordos hidroxi e hidroxi-4 epóxi substituído. Embora a composição de polímeros cutinavaria entre espécies tracheophyte, os monómeros primários mais predominantes são de 10, 16-di-hidroxi 16: 0, 18-hidroxi-9,10-epoxi-18: 0, e 9,10,18-tri-hidroxi-18: 0 ácidos gordos. Curiosamente, folha de Arabidopsis e cutina haste é composta principalmente de 18: 2 de ácido dicarboxílico 7,8.
Cutículas vegetais também apresentam uma considerável variabilidade em espessura, variando de poucos nanómetros a vários micrómetros 9. Uma vez que o isolamento cutícula é uma etapa trabalhosa e demorada, especialmente para cutículas folha muito fina, tais como aqueles da Arabidopsis thaliana 8, os métodos que não utilizam o isolamento cutícula foram desenvolvidos e validados 7,8. Aqui, nós descrevemos um protocolo detalhado para o estudo da composição de monómero de cutina em folhas de Arabidopsis thaliana por metóxido de sódio (NaOMe) catalisada por despolimerização e subsequente cromatografia em fase gasosa / espectrometria de massa (GC / MS) análise. Este protocolo oferece um método robusto para ensaiar a composition de poliésteres planta de lipídios nos tecidos delipidadas inteiros, e foi adaptado a partir de protocolos previamente relatados 7,10,11. Amostras de tecido integrais são primeiro homogeneizado e exaustivamente delipidadas, removendo lipídios solventes extraível incluindo cuticular e ceras epicuticulares, lípidos da membrana, e triacilgliceróis. Enriquecida resíduos de parede celular são então despolimerizados em seus constituintes monómeros de éster de metilo por metanólise catalisada por metóxido de sódio. Ésteres metílicos dos ácidos gordos são extraídos por acidificação, e os seus derivados para obter trimetilsililo ou acetilo derivados correspondentes. Resíduos derivatizados são altamente voláteis, e podem ser eluídas a partir de uma coluna de cromatografia em fase gasosa a uma temperatura razoável, sem alterar a sua conformação estrutural durante a análise de GC / MS.
Protocolo
Nota: Este protocolo foi adaptado de Bonaventure et al. (2004), Molina et al. (2006), Li et ai. (2013) 7,10,11. Passos 1-5 são sumariados na Figura 1.
Deslipidação 1. Tissue
Nota: Sempre lavar todos os vidros e tampas com clorofórmio, deixando secar sob exaustor, antes de usar.
CUIDADO: Executar homogeneização do tecido e todas as etapas de transferência solvente sob exaustor; sempre usar jaleco, luvas e óculos de segurança inicial para evitar o contato direto com produtos químicos e para proteger as amostras de contaminação.
- Banho de água Pré-aqueça e bloco de calor a 85 ° C.
- Pesar aproximadamente 0,5 g de cada amostra de folha em 20 mm x 125 mm tubos de ensaio de vidro previamente pesado com politetrafluoretileno (PTFE) tampas de rosca -faced. Incluem quatro repetições por amostra.
- Coloque 2-propanol num balão de Erlenmeyer (cerca de 125 ml; 25 ml por g de SAMPle). Adicionar 2,6-di-terc-butil-4-metilfenol (também conhecido como hidroxitolueno butilado, BHT) para uma concentração final de 0,01% (w / v).
Nota: Adicionar BHT a partir de um 5% (w / v) de solução de reserva em metanol (BHT ajuda a minimizar a oxidação de ácidos gordos insaturados). - Pré-aqueça solução de 2-propanol a 85 ° C em banho de água.
- Adicionar 12 ml de solvente quente de 2-propanol para cada tubo de amostra e calor durante 15 min a 85 ° C em bloco de calor. Este passo inativa lipases que podem ser libertadas a partir de células rompidas.
- Deixe os tubos arrefecer até à temperatura ambiente e triturar o tecido cuidadosamente com homogeneizador até obter uma suspensão homogénea.
- Coloque as amostras num agitador orbital e agitar durante 1-2 horas a 100 rpm e temperatura ambiente.
- Centrifugar durante 10 minutos a 800 xg e descartar o sobrenadante.
- Adicionar um volume igual de 2-propanol e agita-se durante 12 horas à temperatura ambiente.
- Centrifugar durante 10 minutos a 800 xg e descartar o sobrenadante.
- Adicionar 12 ml de CHCl 3: CH3OH (2: 1, v / v) até ao resíduo (25 ml por g de amostra) e agitar durante a noite a 100 rpm e temperatura ambiente.
- Centrifugar durante 10 minutos a 800 xg e descartar o sobrenadante.
- Adicionar 12 ml de CHCl 3: CH 3 OH (1: 2, v / v) até ao resíduo e agitar durante a noite a 100 rpm e temperatura ambiente.
- Centrifugar durante 10 minutos a 800 xg e remover o solvente.
- Deixe secar amostras sob exaustor durante a noite a temperatura ambiente.
- Secar o resíduo e, em seguida, colocar-se num exsicador de vácuo sobre CaCl2 anidro ou CaSO4 até peso constante (3-5 dias).
2. A despolimerização: metanólise com metóxido de sódio (Figura 2)
ATENÇÃO: Siga as etapas 2,3-2,4, 2,7-2,8, 2,10-2,11, 2,13-2,15 e 2,17-2,18 sob exaustor; sempre usar jaleco, luvas e óculos de segurança inicial.
- Pré-aqueça o bloco de calor a 60 ° C.
- Pesar tubos de ensaio contendo o resíduo seco (importante para cálculos posteriores).
- Adicionar padrões internos a cada tubo: 25 ωL heptadecanoato de metilo (1 mg / ml) e 25 ul ω-pentadecalactone (1 mg / ml de stock).
- Adicionar 0,9 ml de acetato de metilo, 1,5 mL de metóxido de sódio, e 3,6 ml de metanol a cada tubo e cap-los. Em alternativa, preparar uma mistura de reacção com estes três reagentes e adicionar alíquotas de 6 ml para cada amostra.
- Amostras de calor durante 2 horas a 60 ° C e periodicamente vórtice em intervalos de 15 min.
- Deixe as amostras arrefecer para a temperatura ambiente.
- Adicionar 10 ml de dicloreto de metileno (CH 2 Cl 2) e 1,5 ml de ácido acético glacial para extrair os ésteres metílicos dos ácidos gordos.
- Adicionar uma solução salina (NaCl 0,5 M) para encher cada tubo e a tampa.
- Amostras Vortex durante 1 min e centrifuga-se durante 10 min a 800 x g.
- Transferir a fase orgânica (inferior) para limpar tubos de tamanho médio (16 x 125 tubos de ensaio de vidro com poli mmtetrafluoroetileno (PTFE) tampa de rosca -faced).
- Adicionar uma solução salina (NaCl 0,5 M) para encher cada tubo e a tampa.
- Amostras Vortex durante 1 min e centrifuga-se durante 10 min a 800 x g.
- Remover fase aquosa (superior) e repita os passos de 2,11-2,12.
- Remova toda a fase aquosa (superior).
- Adicionar sulfato de sio anidro (Na 2 SO 4) para o solvente, tampão, e os tubos de vórtice durante 1 min; amostras pode agora ser deixada até ao dia seguinte. A esta amostras ponto pode ser deixada durante a noite sob a coifa.
- Centrifugar durante 2 minutos a 800 xg para compactar o Na 2 SO 4 sal na parte inferior.
- Transferir a fase orgânica para um tubo de vidro descartável pequena (13 x 100 mm tubos de ensaio de vidro com politetrafluoroetileno (PTFE) com tampa de rosca -faced).
- Evaporar o solvente à secura sob azoto e avançar para a etapa de derivação. Se não processado imediatamente, armazenar evaporada amostras a -20 ° C (amostras pode ser umlso armazenado antes do passo de evaporação).
3. Preparação de Derivados de Cromatografia Gasosa
ATENÇÃO: Siga as etapas 3.1.2 e 3.1.5 - 3.1.8 sob um exaustor; sempre usar jaleco, luvas e óculos de segurança inicial.
- Derivados trimetilsilílicos
- Pré-aqueça o bloco de aquecimento a 100 ° C.
- Adicionar 100 ul de piridina e 100 ml de BSTFA (N, O-bis-trimetilsilil-trif luoroacetamida) a cada tubo e cap-los.
- Amostras de aquecer a 100 ° C durante 10 min.
- Deixe as amostras arrefecer para a temperatura ambiente.
- Evapora-se as amostras sob azoto à temperatura ambiente. Evitar a aplicação de calor para amostras, os monómeros são altamente voláteis, nesta fase.
- Adicionar 500 ul de 1: 1 (v / v) de heptano: tolueno.
- Amostras Vortex durante 1 min e centrifuga-se durante 2 min a 800 x g.
- Adicionar amostras para frascos de GC e proceder à análise GC / MS.
- Acetilderivados
Nota: Para acetilação, modificar passos 3.1.1-3.1.3 acima da seguinte forma (não mostrado na vídeo); os passos 3.1.4-3.1.8 são os mesmos:- Pré-aqueça o bloco de calor a 60 ° C.
- Adicionar 100 ul de piridina e 100 ul de anidrido acético (Ac2O) para os tubos.
- Amostras de calor 1 hora a 60 ° C.
4. GC / MS Análise
- Usar uma coluna HP-5 capilar (30 mx 0,25 mm de espessura x 0,25 uM filme) ou equivalente (isto é., 5% de difenilo, 95% de dimetil polisiloxano). Programa de GC com o fluxo de gás transportador hélio fixado em 1,5 ml / min e a temperatura do forno programado para 150 a 300 ° C a 3 ° C / min.
- Use injeção de divisão (split proporção de 1:10) e definir espectrômetro de massa modo para digitalizar mais de 40-600 amu (elétron impacto de ionização).
- Criar uma tabela de seqüência incluindo solvente (em branco), WT e mutantes repetições, cada um usando o método de análise cutin indicado.
- Carga de solventee frascos de amostra sobre o carrossel, adicione-hexano para frascos de lavagem de seringas no amostrador automático, se necessário, e iniciar a sequência. Após a sequência estiver completa, dadas vestígios cromatograma iónico estão disponíveis para todas as amostras.
Análise 5. Dados
- Identificar monómeros de poliéster lipídico comparando espectro de massa de cada pico de espectros de massa publicado ou pesquisando uma biblioteca comercial, se disponível.
- Para cada um dos picos identificados no cromatograma total de corrente de iões, utilizar os seus respectivos tempos de retenção para encontrar as áreas na tabela de resultados de integração a partir do software GC / MS (Figura Suplementar 1).
- Para cada monômero (colunas AB), adicione os valores de área encontrados na tabela de integração (Figura Suplementar 1, coluna D) para a coluna correspondente para cada replicar amostra na tabela Excel de monómeros (Supplemental Arquivo 2, colunas CF), que é uma folha de cálculo para quantificar Arabidopsisderivados cutin EAS. Use Suplementar Arquivo 3 se derivados acetilados são preparados em vez disso.
- Adicione as áreas das normas internas (SI) para as colunas é (HK). Para os monómeros que não são derivatizados, ésteres metílicos ou seja, ácidos gordos (FAMEs), e os ésteres de dimetilo do ácido dicarboxilicos (DCA EMDs), utilizar 17: 0 FAME (IS1) como IS para a quantificação (células roxo-protegida na tabela de monómero; Suplementar Arquivos 2/3). Para monómeros hidroxilados, incluindo álcoois primários, ácido ferúlico e ácidos ω-hidroxi, utilizar 15: 0 15-hidroxi FAME (IS2), como é de escolha para a quantificação composto (células verdes-shadded na tabela de monómero; Suplementar Arquivos 2/3) .
- Adicione peso folha seca para cada replicar para colunas AX-BA (Supplemental arquivo 2) ou AQ-AT (Supplemental Arquivo 3); alternativamente, digitalizar folhas de calcular áreas de superfície e adicionar valores de área para a mesa de monômero para expressar cargas de monómeros por unidade deárea de superfície.
Resultados
O protocolo descrito no presente manuscrito está configurado para determinar monómeros de poliéster de lipídios, minimizando as contribuições de lípidos não Cutin 10 Figura 1 apresenta uma visão geral do ensaio, que toma por completo entre 8 (ie, cutin ou suberina.) -. 10 dias (a partir de colheita de tecido inicial a obtenção de dados de GC), dependendo de quanto tempo as amostras são deixadas a secar.
A metanólise catalisada por base seleccionada (Figura 2) Método para despolimerizar poliésteres foi previamente validado para as sementes de Arabidopsis, que contêm tanto cutina e suberina. Os tecidos são homogeneizados e exaustivamente primeiro delipidada para remover lípidos de solventes extraíveis. O rendimento resíduo após a extração, como porcentagem do peso fresco inicial, é normalmente de 6% para A. thaliana Col-0 folhas. Enriquecida resíduos de parede celular são secos num exsicador de vácuo e, em seguida, nos seus constituintes despolimerizado monómeros de éster de metilo decatalisada por base transmetilação. Duas horas de incubação foi escolhido como o tempo necessário para a despolimerização crítica e recuperação de componentes de poliéster de lípidos adequada. Tempos de incubação mais longos resultou em aumento de ácidos 2-hidroxi; estes potencialmente derivar de esfingolípidos membrana 10.
Um cromatograma típico de Arabidopsis do tipo selvagem se cutina folha é mostrada na Figura 3, para derivados S -TMSi éter (Figura 3A) e derivados de O-acetil (Figura 3B). Cada pico foi identificado por comparação com os espectros de massa a partir da literatura 7,8 e uma base de dados pública 12 .O nosso protocolo de vídeo mostra como preparar derivados de TMSI, mas as amostras podem, alternativamente, ser acetilado para derivatizar grupos hidroxilo. Derivados silanisados são bons para fins de identificação, porque eles dão espectros de massa de diagnóstico. No entanto, os derivados acetilados são mais estáveis e uma boa alternativa para a sililaçãomonômeros uma vez foram identificados 10. Para ajudar a implementar esse protocolo em laboratórios que têm apenas GC acoplado ao detector de ionização de chama (FID), GC / FID traços correspondentes a derivativos acetilados de WT monómeros folha cutina e para uma série homólogo de normas metílicos dos ácidos gordos éster são também mostrados (Figura Suplementar 4).
Este método é qualitativa e detecta diferenças quantitativas entre amostras, daí o seu valor para a análise mutante. As quantidades de monómeros individuais são determinadas usando o método do padrão interno de quantificação, permitindo comparações de abundância monómero entre as amostras. Deve esclarecer-se, no entanto, que o tamanho de pico (contagens totais de iões) podem não coincidir com as razões molares dos monómeros do poliéster. Estamos incluindo tabelas editáveis de monômeros para calcular os montantes de monômero em folha Arabidopsis cutin como ésteres de ácidos gordos e derivados metílicos EAS (Supplemental arquivo 1), ou ace Tyl (Supplemental derivados de arquivo 2) de álcoois. Estas tabelas podem ter de ser adaptados se amostras são extraídas a partir de órgãos ou de diferentes espécies de plantas.
Como exemplo, temos analisado Arabidopsis Thalia na Columbia (Col-0) folhas de tipo selvagem e dois alelos nulos-mutante anteriormente caracterizados do gene CYP86A2 / ATT1, att1-1 (m-1) e att1-2 (m-2 ) 13,14. Monooxigenases do citocromo P450 da subfamília CYP86A codificar supostos co-oxidases e participe de suberina e cutina biossíntese monômero. Os nossos resultados (Figura 4) demonstram as reduções significativas na quantidade de três principais monómeros lipídicas nas folhas mutantes em comparação com as folhas WT. Consistente com a função da enzima previsto, 16: 0, 18: 2, e 18: 1 dicarboxilatos foram especificamente afectados em mutantes ATT1.
"Src =" / files / ftp_upload / 53386 / 53386fig1.jpg "/>
Figura 1. Visão geral da análise de poliéster lipídico. Por favor clique aqui para ver uma versão maior desta figura.
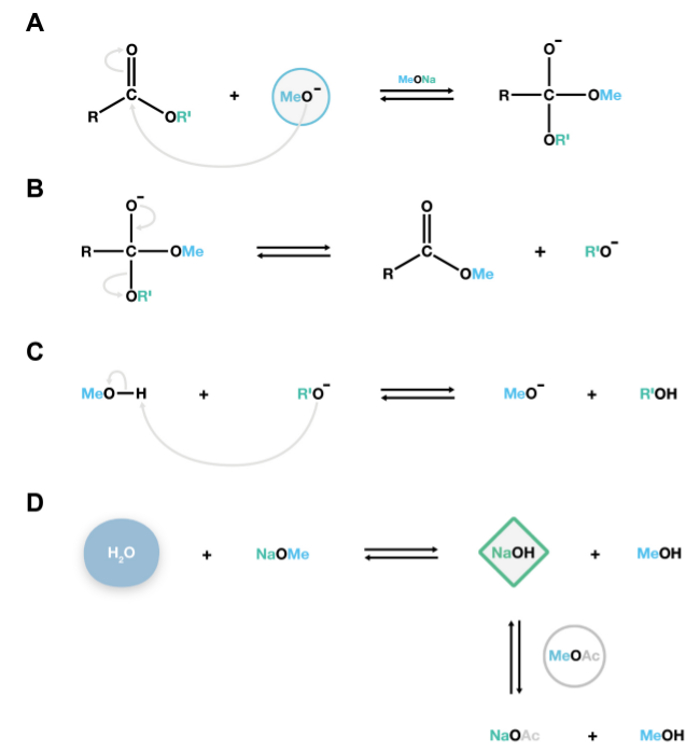
Figura 2. Mecanismo de transmetilação NaOMe a reacção catalisada. Os aniões metóxido nucleofílicos atacar o carbono cabonyl de poliésteres lipídicos para formar um intermediário tetraédrico instável (A), que dissocia-se facilmente em ésteres metílicos de ácidos gordos e de alcóxido aniões (B). Estes alcóxidos são bases conjugadas, e reagir com metanol, regenerando os aniões metóxido cataliticamente activas, sustentando assim as reacções de despolimerização adicionais (C). Se a água está presente nasistema, que irá reagir com metóxido de sódio para formar hidróxido de sódio, uma base forte que irreversivelmente hidrolisa para produzir ésteres de ácidos gordos livres indesejáveis. Acetato de metila é adicionado como um co-solvente 15 para remover pequenas quantidades de hidróxido de sódio dentro do sistema (D). Por favor clique aqui para ver uma versão maior desta figura.
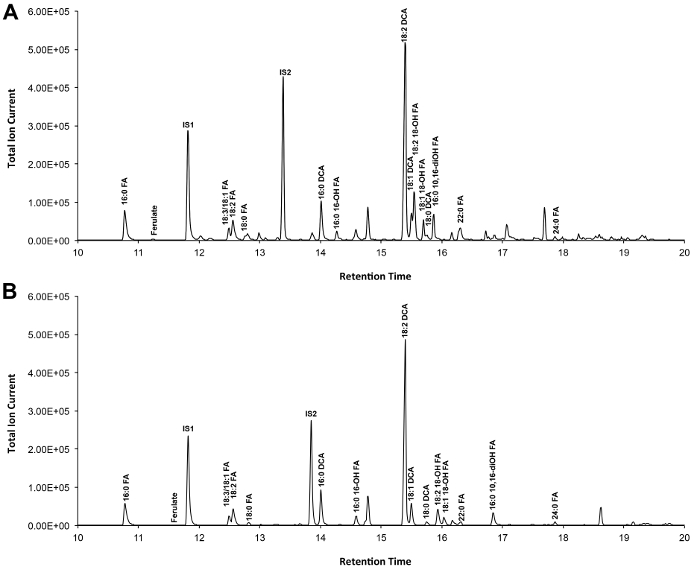
Figura 3. Representante cromatograma iónico total de tipo selvagem folha Arabidopsis thaliana monómeros cutina. (A) O trimetilsilílico (TMSi) éter e (B) derivados de hidroxila de etilo. Por favor clique aqui para ver uma versão maior desta figura.
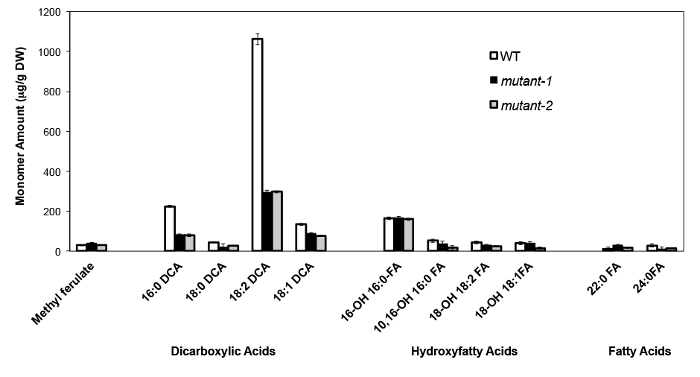
Figura 4. cutina composição de monómero de Arabidopsis thaliana WT e dois alelos mutantes nulos do gene CYP86A2. (Mutante-1 = att1-1; mutante-2 = att1-2) As barras de erro representam o desvio padrão da média (n = 4) . Adaptado a partir de 13, com a permissão de © Blackwell Publishing (2007). Por favor clique aqui para ver uma versão maior desta figura.
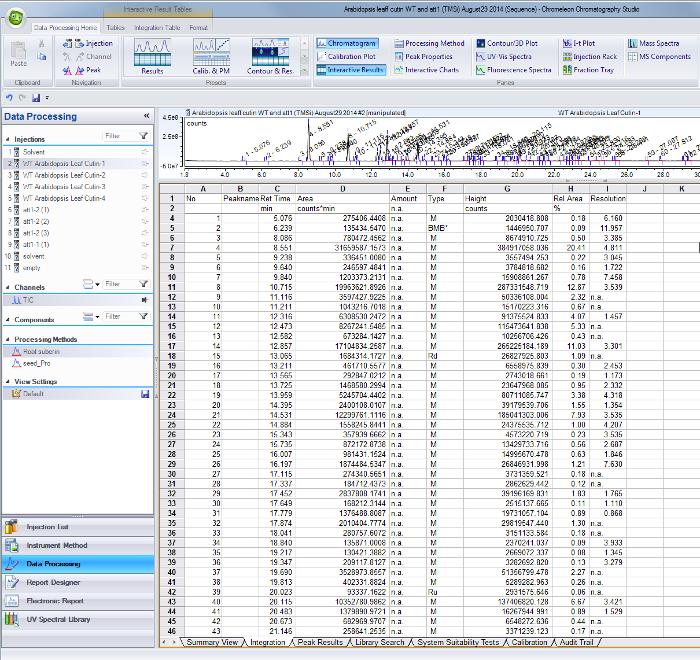
Figura Suplementar 1. Pico resultados de integração tabela do software de GC / MS. Os picos correspondentes a monómeros identificados e os padrões internos são identificados pela sua retenti a tempo (coluna C) e valores de área estão tabulados na coluna D. Por favor, clique aqui para fazer o download deste arquivo.
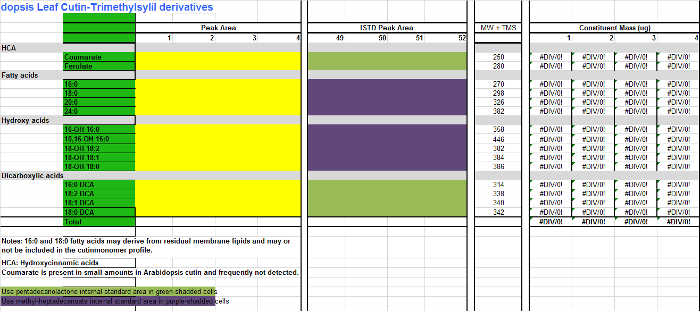
Suplementar Arquivo 2. Tabela de Arabidopsis monómeros Cutin (derivados trimetilsililico de ésteres metílicos dos ácidos gordos hidroxi). Por favor clique aqui para fazer o download deste arquivo.
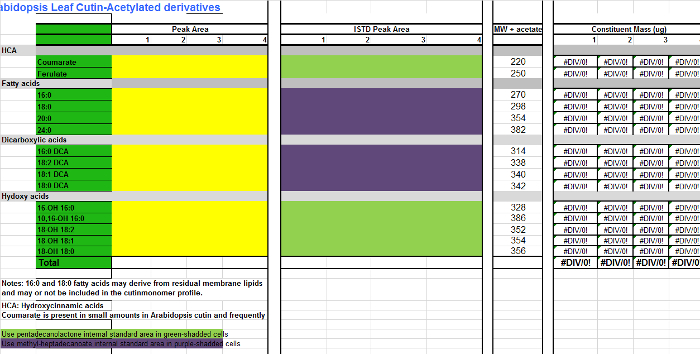
Suplementar Tabela 3. Ficheiro de Arabidopsis monómeros cutina (derivados de O-acetil de ésteres metílicos de ácidos hidroxi-gordos).com / arquivos / ftp_upload / 53386 / "target =" _ blank Supplemental_File_3_Cutin_template_Acetylated_derivatives.xlsx "> Por favor clique aqui para fazer o download deste arquivo.
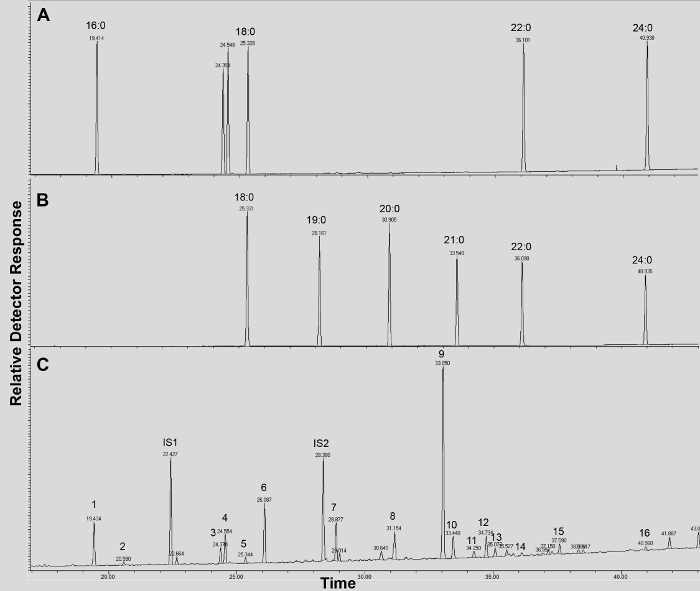
Suplementar Figura 4. GC / FID vestígios de (AB) de éster metílico de ácido gordo (FAME) padrões de índice de retenção (picos são rotulados com cada comprimento de cadeia saturada FAME); e (C) A. acetilado folha WT thaliana monómeros cutina. Os números no pico correspondem a: 16: 0 FAME (1), ácido ferúlico (2), 18: 3 FAME (3), 18: 1/18: 2 FAMEs (4), 18: 0 FAME (5), sinapate (6 ), 16: 0 DCA (7), 16-OH 16: 0 FAME (8), 18: 2 DCA (9), 18: 1 DCA (10) 18: 0 DCA (11), 18-OH 18: 2 FAME (12), 18-OH 18: 1 FAME (13), 20: 0 FAME (14), 10,16-DIOH 16: 0 FAME (15), 24: 0 FAME (16). DCA: éster dimetílico do ácido dicarboxílico; FAME: éster metílico de ácidos gordos; IS1: padrão interno 1, 17: 0 FAME; IS2: st internoAndard 2, 15-OH 15: 0 FAME. Por favor clique aqui para fazer o download deste arquivo.
Discussão
Ao contrário de outros biopolímeros, tais como proteínas e ADN, poliésteres planta de lípidos não são feitas a partir de um molde. Em vez disso, as composições dependem da especificidade das enzimas presentes nos tecidos que formam estes polímeros extracelulares. Como tais análises, química do componente de componentes são essenciais para compreender a composição de poliéster de lípidos.
Os métodos químicos para clivar ligações éster incluem saponificação, hidrogenólise, transmetilação catalisada por ácido, e catalisada por base transmetilação 2. Cada um deles tem vantagens e desvantagens. Saponificação produz ácidos gordos hidroxi livres que podem sofrer reações secundárias. A hidrogenólise com hidreto de alumínio e lítio (LiAlH4) 16 foi utilizado para a análise cutina 7. A hidrogenólise reduz carbonos funcionalizados para álcoois e as estruturas originais precisam de ser inferida por deuteriolysis com deutereto de alumínio e lítio (LiAlD 4). odesvantagem desta abordagem é a exigência de alta resolução GC / MS para comparar o grau de deuteriation dos polióis gordos obtidos para fazer atribuições das suas estruturas. Transesterificação catalisada por ácido com metanol trifluoreto de boro (BF3) tem sido freqüentemente utilizada em cutina e suberina depolymerizations 8,17,18, mas o reagente tem uma vida útil limitada e pode introduzir artefactos devido a reacções secundárias 15. Ácido sulfúrico metanólico também produz ésteres metílicos dos monómeros mas com maiores proporções de ácidos gordos de 2-hidroxi, que presumivelmente não são verdadeiros componentes de poliéster lípido, em comparação com outros métodos 10.
O método de transesterificação catalisada NaOMe descrito neste protocolo produz ésteres metílicos de ácidos gordos que são derivatizados por sililação de grupos hidroxilo, fornecendo espectros de massa característico para a identificação, ou por acetilação para proporcionar derivados mais estáveis de grupos hidroxilo foR quantificação. Uma desvantagem desta técnica é que a hidrólise compete com a transesterif icação, quando a água está presente na reacção. A água reage com NaOMe (o catalisador) e produz NaOH, que por sua vez hidrolisa ésteres metílicos de ácidos gordos para se obter os ácidos livres (Figura 2D). Esta é uma reacção colateral indesejável porque dois picos irá estar presente para cada ácido gordo: um éster de metilo e um derivado de éster TMSi, complicando assim a análise. Usando reagentes anidros e a adição de acetato de metilo como um co-solvente para competir com saponificação são assim passos cruciais para prevenir a hidrólise (Figura 2D).
Cutin e suberina conter entre 1 e 26% de glicerol 4. No entanto, este monómero não será detectado por as condições experimentais descritas neste protocolo. O glicerol é altamente hidrofílico e, ao contrário dos monómeros de éster de metilo de ácidos gordos, será eliminada durante os passos de solvente de lavagem aquosas. Esta limitação também umpplies a outros métodos de despolimerização cutina, glicerol, mas pode ser determinada na camada aquosa obtida após transesterificação utilizando um método enzimático. Alternativamente, ele pode ser quantificada usando condições mais suaves (por exemplo., 0,05 M NaOMe) sem nova extracção da água para detectar todos os monómeros, incluindo glicerol 19,20 .Embora útil para a finalidade de quantificação glicerol, condições suaves geralmente dar incompleto de despolimerização e cutina suberina.
Se um GC acoplado a um detector de ionização de chama (FID) está disponível, todas as repetições podem ser analisados no presente instrumento, para fins quantitativos, depois de picos de uma amostra representativa foram identificados por GC / MS. Como alternativa, os monômeros em GC / FID traços podem ser identificados, se os seus índices de retenção são conhecidos. O detector de ionização de chama tem especialmente elevada sensibilidade e uma ampla gama de proporcionalidade, que é crítica para a quantificação de componentes principais e secundárias amostrasem corridas individuais. Além disso, é robusto e fácil de manter e operar 15.
O protocolo descrito permite a fiável e reprodutível isolamento, identificação e quantificação dos monómeros de poliéster de lípidos de plantas, permitindo a caracterização de mutantes química que diferem na composição de um ou mais monómeros de poliéster de lípidos. O procedimento é expansível, ele pode ser facilmente adaptada para processar tanto pequenas quantidades a granel e de diversos materiais de planta, incluindo sementes, raízes, folhas, caules e flores. Dados de espectrometria de massa de monómeros de poliéster de lipídios de muitas espécies têm sido publicados por ex., 21-26 e constituem recursos valiosos para identificar monómeros desconhecidos quando adaptar este protocolo para outros tecidos e / ou espécies. Este método é aplicável para a biossíntese de investigações, regulação e de distribuição de poliésteres de lípidos em plantas superiores.
Divulgações
No conflicts of interest declared.
Agradecimentos
This work was supported by a Natural Sciences and Engineering Research (NSERC)-USRA grant to S.J., and by an NSERC-Discovery Grant to I.M. We thank Richard Bourgault, Meghan Rains, and Amanda Fluke for technical assistance. Seeds of att1-1 and att1-2 mutants were kindly provided by Dr. Jian-Min Zhou, Institute of Genetics and Developmental Biology, Beijing, China.
Materiais
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-propanol | Fisher Scientific | BPA451-4 | Solvent for delipidation |
| Anhydrous sodium sulfate | Fisher Scientific | S421500 | |
| Acetic anhydride | Sigma Aldrich | 320102 | Derivatization agent |
| BSTFA (N,O-bis(trimethylsilyl)-trifluoroacetamide) | Sigma-Aldrich | 15222 | Derivatization agent |
| Butylated hydroxytoluene (BHT) | Sigma-Aldrich | 101162 | Antioxidant |
| Calcium chloride, anhydrous | Fisher Scientific | C614-3 | Desiccation agent |
| Calcium suflate, anhydrous (DRIERITE- 8 MESH with indicator) | Acros Organics | 219090020 | Desiccation agent |
| Chloroform (Trichloromethane) | Fisher Scientific | C6074 | Organic solvent |
| Glacial acetic acid | Fisher Scientific | BP2401212 | Acidification agent |
| Helium carrier gas, compressed | Air Liquide | ALPHAGAZ1-UN1046 | Carrier gas, GC/MS |
| Heptane | Fisher Scientific | H3501 | Organic solvent |
| Hexanes | Fisher Scientific | H3024 | Organic solvent |
| Methanol | Fisher Scientific | A4124 | Organic solvent, transmethylation reactive |
| Methyl acetate | Sigma-Aldrich | 296996 | Organic solvent |
| Methyl heptadecanoate | Sigma-Aldrich | H4515 | Internal standard (1mg/mL stock) |
| Methylene dichloride (Dichloromethane) | Fisher Scientific | D374 | Organic solvent |
| Nitrogen, compressed | Air Liquide | ALPHAGAZ1-UN1044 | Carrier gas, GC-FID |
| Pentadecanolactone | Fluka | 76530 | Internal standard (1 mg/ml stock) |
| Pyridine | Sigma-Aldrich | 270970 | Co-solvent for derivatization |
| Sodium chloride | Fisher Scientific | BP358212 | Saline solution |
| Sodium methoxide (25wt.%) | Sigma-Aldrich | 156256 | Nucleophile |
| Toluene | FIsher Scientific | T2904 | Organic solvent |
| Plant Growth Supplies | |||
| Pro-Mix PGX | Premier Tech Horticulture Ltd | Pro-Mix PGX is recommended to grow Arabidopsis plants (Eddy, R. and Hahn, D.T., 2012,http://docs.lib.purdue.edu/pmag/2) Purdue Methods for Arabidopsis Growth. | |
| PermaNest Humidity Dome | Grower's Solution, LLC, Cookeville, TN | GD2211-24 | |
| Perma-Nest Plant Trays (22x11in) | Grower's Solution, LLC, Cookeville, TN | N/A | |
| Square greenhouse pots, 3.5 inch | Grower's Solution, LLC, Cookeville, TN | P86 | |
| General Purpose Plant Fertilizer, Plant-Prod 20-20-20 | Premier Tech Home and Garden In., Brantford, ON | N/A | |
| Glassware | |||
| 13 x 100 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-13100 | |
| 16 x 125 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-16125 | |
| 20 x 125 mm glass test tubes with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-20125 | |
| GC vial caps | National Scientific | C400051A | |
| GC vial microinserts | National Scientific | C4011631 | |
| GC vials | National Scientific | C40001 | |
| Disposable pasteur pipets | Fisher Scientific | 1367820B | |
| Flasks | Fisher Scientific | ||
| Equipment | |||
| Allegra X15R centrifuge | Beckman Coulter | ||
| Analytic balance | Fisher Scientific | ||
| Belly dancer | A shaker can be used for this purpose if Belly Dancer not available | ||
| DB-5 Capillary GC column | J&W Scientific, CA, USA; | 30 m x 0.25 mm x 0.25 μm film thickness | |
| Desiccator | |||
| Isotemp 202 water bath | Fisher Scientific | ||
| ISQ LT single quadupole mass spectrometer | Thermo Scientific | ||
| Heat block | Fisher Scientific | ||
| Nitrogen evaporator | |||
| Polytron homogenizer | Birkmann | ||
| Trace 1300 gas chromatograph | Thermo Scientific | ||
| Two-stage regulator | Air Liquide | Q1-318B-580 | |
| Vacuum desiccator | Fisher Scientific | ||
| Vortex mixer | Fisher Scientific |
Referências
- Kolattukudy, P. Biopolyester membranes of plants: cutin and suberin. Science. 208 (4447), 990-1000 (1980).
- Kolattukudy, P. E. Polyesters in higher plants. Adv. Biochem. Eng. Biot. 71, 1-49 (2001).
- Yeats, T. H., Rose, J. K. C. The formation and function of plant cuticles. Plant Physiol. 163 (1), 5-20 (2013).
- Pollard, M., Beisson, F., Li, Y., Ohlrogge, J. B. Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13 (5), 236-246 (2008).
- Beisson, F., Li-Beisson, Y., Pollard, M. Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15 (3), 329-337 (2012).
- Heredia, A. Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta. 1620 (1-3), 1-7 (2003).
- Bonaventure, G., Beisson, F., Ohlrogge, J., Pollard, M. Analysis of the aliphatic monomer composition of polyesters associated with Arabidopsis epidermis: occurrence of octadeca-cis-6, cis-9-diene-1, 18-dioate as the major component. Plant J. 40 (6), 920-930 (2004).
- Franke, R., et al. Apoplastic polyesters in Arabidopsis surface tissues - A typical suberin and a particular cutin. Phytochemistry. 66 (22), 2643-2658 (2005).
- Vogg, G., et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid -ketoacyl-CoA synthase. J. Exp. Bot. 55 (401), 1401-1410 (2004).
- Molina, I., Bonaventure, G., Ohlrogge, J., Pollard, M. The lipid polyester composition of Arabidopsis thaliana and Brassica napus seeds. Phytochemistry. 67 (23), 2597-2610 (2006).
- Li-Beisson, Y., et al. Acyl-lipid metabolism. The Arabidopsis Book. 11, e0161 (2013).
- Molina, I., Ohlrogge, J. B., Pollard, M. Deposition and localization of lipid polyester in developing seeds of Brassica napus and Arabidopsis thaliana. Plant J. 53 (3), 437-449 (2008).
- Xiao, F., et al. Arabidopsis CYP86A2 represses Pseudomonas syringae type III genes and is required for cuticle development. EMBO J. 23 (14), 2903-2913 (2004).
- Christie, W. W., Han, X. . Lipid Analysis - Isolation, Separation, Identification and Lipidomic Analysis. , 446 (2010).
- Walton, T. J., Kolattukudy, P. E. Determination of the structures of cutin monomers by a novel depolymerization procedure and combined gas chromatography and mass spectrometry. Biochemistry. 11 (10), 1885-1896 (1972).
- Matzke, K., Riederer, M. A comparative study into the chemical constitution of cutins and suberins from Picea abies (L.) Karst., Quercus robur L., and Fagus sylvatica L. Planta. 185 (2), 233-245 (1991).
- Riederer, M., Schönherr, J. Quantitative gas chromatographic analysis of methyl esters of hydroxy fatty acids derived from plant cutin. J. Chromatogr. 360, 151-161 (1986).
- Moire, L., Schmutz, A., Buchala, A., Yan, B., Stark, R., Ryser, U. Glycerol Is a Suberin Monomer. New Experimental Evidence for an Old Hypothesis. Plant Physiol. 119 (3), 1137-1146 (1999).
- Graça, J., Schreiber, L., Rodrigues, J., Pereira, H. Glycerol and glyceryl esters of omega-hydroxyacids in cutins. Phytochemistry. 61 (2), 205-215 (2002).
- Eglinton, G., Hunneman, D. H. Gas chromatographic-mass spectrometric studies of long chain hydroxy acids-I: The constituent cutin acids of apple cuticle. Phytochemistry. 7 (2), 313-322 (1968).
- Espelie, K. E., Köller, W., Kolattukudy, P. E. 9,16-dihydroxy-10-oxo-hexadecanoic acid, a novel component in citrus cutin. Chem. Phys. Lipids. 32 (1), 13-26 (1983).
- Holloway, P. J. Intracuticular lipids of spinach leaves. Phytochemistry. 13 (10), 2201-2207 (1974).
- Holloway, P. J., Deas, A. H. B. Epoxyoctadecanoic acids in plant cutins and suberins. Phytochemistry. 12 (7), 1721-1735 (1973).
- Holloway, P. J., Cutler, D. F., Alvin, K. L., Price, C. E. . The chemical constitution of plant cutins. , 45-85 (1982).
- Croteau, R., Fagerson, I. S. The constituent cutin acids of cranberry cuticle. Phytochemistry. 11 (1), 353-363 (1972).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados