Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Diseksiyon ve Threespine Stickleback Brankial İskelet Düz montaj
Bu Makalede
Özet
The branchial skeleton, including gill rakers, pharyngeal teeth, and branchial bones, serves as the primary site of food processing in most fish. Here we describe a protocol to dissect and flat-mount this internal skeleton in threespine sticklebacks. This method is also applicable to a variety of other fish species.
Özet
The posterior pharyngeal segments of the vertebrate head give rise to the branchial skeleton, the primary site of food processing in fish. The morphology of the fish branchial skeleton is matched to a species' diet. Threespine stickleback fish (Gasterosteus aculeatus) have emerged as a model system to study the genetic and developmental basis of evolved differences in a variety of traits. Marine populations of sticklebacks have repeatedly colonized countless new freshwater lakes and creeks. Adaptation to the new diet in these freshwater environments likely underlies a series of craniofacial changes that have evolved repeatedly in independently derived freshwater populations. These include three major patterning changes to the branchial skeleton: reductions in the number and length of gill raker bones, increases in pharyngeal tooth number, and increased branchial bone lengths. Here we describe a detailed protocol to dissect and flat-mount the internal branchial skeleton in threespine stickleback fish. Dissection of the entire three-dimensional branchial skeleton and mounting it flat into a largely two-dimensional prep allows for the easy visualization and quantification of branchial skeleton morphology. This dissection method is inexpensive, fast, relatively easy, and applicable to a wide variety of fish species. In sticklebacks, this efficient method allows the quantification of skeletal morphology in genetic crosses to map genomic regions controlling craniofacial patterning.
Giriş
çeşitlilik inanılmaz bir miktar özellikle balıklar arasında, omurgalılar arasında baş iskeleti var. Birçok durumda bu çeşitlilik, farklı beslenme stratejileri 1 kolaylaştırır - 4, ve her ikisi de dış ve iç kraniofasyal desenlendirme büyük değişiklikler içerebilir. brankiyal iskelet bir balık boğaz dahili olarak yer alan ve ağız boşluğu en çevreler. brankiyal iskelet solungaçları destekleyen ön dördü 5 seri homolog segmentleri, oluşmaktadır. Birlikte bu beş segment balık ve onların yiyecek 5 arasında bir arayüz olarak işlev görür. solungaç diken, yutak dişleri ve brankiyal kemikleri de dahil olmak üzere özellikleri çok sayıda varyasyon yiyecek farklı türlerde etkili yiyecek arama katkıda bulunur.
Sticklebacks kuzey yarımkürede boyunca tatlı su gölleri ve dereleri kolonize atalarının okyanus formları sonra bir adaptif radyasyon uğramıştır. diyet kaymasıtatlı daha büyük av için okyanusta küçük zooplankton birkaç kraniofasyal özellikleri 6 dramatik trofik değişmesine neden olmuştur. Birçok çalışma Sticklebacks 7 dış kraniofasial farklılıkları odaklanmış olsa da - 13, önemli kraniofasial değişiklikler iç brankiyal iskelette defalarca gelişmeye. Morfolojik farklı dikenli popülasyonlar arasındaki verimli melezler oluşturma yeteneği brankiyal iskeletine evrimleşmiş değişikliklerin genetik temelini eşleştirmek için mükemmel bir fırsat sağlar.
ekolojik öneme sahip biri tropik özelliği solungaç diken, brankiyal kemiklerin anterior ve posterior yüzleri satır ve av öğeleri filtrelemek için kullanılan periyodik dermal kemiklerin desenleme olduğunu. Genellikle küçük av öğeleri beslemek balıklar daha uzun ve daha yoğun aralıklı solungaç büyük yırtıcı 14,15 beslenen balıklara oranla diken sahip olma eğilimindedir. solungaç diken varyasyon bildirilmiştir hem within ve türler 14-19 arasında ve solungaç havalandırma makinesi desenlendirme yönleri trofik nişler ve fitness 16 katkıda bulunur. Araştırma Yıllar yoğun threespine Sticklebacks 17 solungaç raker numarası ve uzunluk varyasyonu belgeledi - 21; Ancak, bu çalışmalar genellikle solungaç diken ilk satırında odaklanmak. Son çalışmalar, bir veya bir tek solungaç havalandırma makinesi anlamak için satır daha çalışmanın önemini vurgulayarak 23 ve uzunluk 24 aralık brankiyal iskelet 22,23 genelinde ve solungaç Tarak tek satır boyunca solungaç havalandırma makinesi sayısının genetik kontrol modüler göstermiştir solungaç raker azaltma gelişimsel genetik temeli.
hem ekolojik ve biyomedikal önemi ikinci trofik özellik faringeal dişlerin desenleme olduğunu. Balıklarda Diş yutak dişleri olarak da bilinir, hem sözlü çene ve brankiyal iskeletinde yer olabilir. Ağız diş p amacıyla kullanılır27 - yutak dişleri çiğneme ve av manipülasyon 25 için kullanılır ise rey yakalamak. Her iki takım ortak gelişimsel mekanizmaları aracılığıyla oluşturur ve homolog 28 gelişimsel olarak kabul edilir. Bazen böyle zebrafish, eksikliği ağız ve dorsal faringeal dişler 29 diğer türler birden dişli ceratobranchials, pharyngobranchials varken gibi türler, ve basihyal dişli ve 30 hypobranchials sayede ilginç modülerlik oluşur. Sticklebacks olarak, yutak dişleri ön beşinci ceratobranchial ve dorsal üzerinde ventral bulundu ve posterior 31 pharyngobranchials edilir. Dikenli beslenme ile ilgili Kinematik sözlü çene öncelikle av yakalama ve yutak çenesine çiğneme bırakarak emme besleme 9 kolaylaştırılması kullanılır gösteriyor. Çiklitlerinde, alt yutak çene morfolojisi dramatik 32,33 değişir ve adaptif ve trofik niş 34 ile korelasyon olduğu gösterilmiştir. Çokple tatlısu dikenli popülasyonları ventral faringeal diş sayısı 23,35,36 dramatik artışlar meydana gelmiştir. Son çalışmalar bu evrimleşmiş diş kazanç gelişimsel genetik temeli tatlısu Sticklebacks 36 iki bağımsız toplumlarında büyük ölçüde farklı olduğunu ortaya koymuştur. Memeli dişlerin aksine, balık yetişkin yaşam 37 boyunca sürekli dişlerini yeniden. Bu daha önce açıklanan yüksek dişli tatlı su popülasyonlarının ikisi de rejenerasyon 36 genetik temelini incelemek için nadir bir omurgalı sistemi sağlayarak, hızlandırılmış protez oranını gelişmiştir.
Tatlısu Sticklebacks defalarca gelişti üçüncü trofik özellik artık sırasıyla 38 epibranchial ve ceratobranchial kemikler, üst ve alt çene solungaç kemeri segmental homologları vardır. Uzun brankiyal kemikleri daha geniş bir yanak boşluğu görüşmek ve muhtemelen daha büyük av öğeleri c olmak için izin verdiği için uyarlanabilironsumed. Ayrıca, diğer balıklarda, epibranchial kemikler dorsal faringeal diş plakaları 25 depresyon açısından önemlidir. solungaç diken ve yutak dişleri gibi, brankiyal kemikler kolayca görselleştirmek veya ölçmek zordur, bu nedenle iç ve vardır.
Burada incelemek için detaylı bir protokol mevcut ve önemli kraniofasyal özelliklerin çeşitli kolay görselleştirme ve sayılmasına olanak tanıyan, brankiyal iskeleti düz monte edin. Bu protokol, dikenli diseksiyon açıklanmış olsa da, aynı yöntem, diğer balıkların çeşitli çalışır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm balık çalışmaları California-Berkeley Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (protokol numarası R330) tarafından onaylandı. Ötenazi% 0.1 sodyum bikarbonat 39 ile tamponlanmış% 0.025 Tricaine-S daldırma kullanılarak gerçekleştirilmiştir. Bütün aşamalar oda sıcaklığında gerçekleştirilir.
1. Hazırlık
Not: sıkıca kapatabilir ve yatay döşenebilir konik tüpler veya sintilasyon şişeleri adımları 1.1-1.5 gerçekleştirin. Balıklar sürekli sarsılmış olması gerekir, fakat nazikçe tersini veya boyama çözeltisine balık her tarafını ortaya çıkarmak ve leke eşit dokuya nüfuz sağlamak için tüpler veya şişelere raf sallayarak mümkün olduğunca sık çözüm karıştırmak kalkmayın. sıvı ağır çalkalayıcı kıracak gibi bir çalkalama platformunda balık büyük bir toplu koymayın.
- gece boyunca,% 10 nötral tamponlu formalin (NBF), etanol içinde depolanmış ya da taze ötanazi balık ya da balık düzeltildi. Alternatif olarak,% 4 paraformaldehid kullanımı1x PBS çözeltisi yerine% 10 NBF aldehit.
Not: DNA ayıklanması ise, etanol içinde fiksasyon ve saklamak için önce kuyruk veya göğüs yüzgeçleri küçük bir bölümünü klibi. - 2 saat boyunca (yani ~ pH 7.0) kimyasal bir kaput düzgün düzeltmenin atınız ve musluk suyu ile değiştirin. genellikle, asidik olabilir ve kemik kirecini gibi de-iyonize su kullanmayın.
- 24 saat boyunca su içinde% 1 KOH% 0.008 Alizarin Kırmızısı S su ve leke balık çıkarın. Balık az 20 mm standart uzunluk için% 0.004 Alizarin Kırmızı S. (daha sonra seyreltilmiş olabilir Alizarin Kırmızı S 100x (% 0.8) stok solüsyonu olun) kullanın.
- Bir kaç saat musluk suyunda leke (başlık uygun çöp bidonuna koyarak) ve yer balık çıkarın. su ile durulama çoğunlukla netleşene kadar gerektiği gibi suyu değiştirin.
- % 50 gliserol, hafif takas ve sonraki diseksiyon için% 0.25 KOH içine su ve yer balık çıkarın.
Not: Bu boyama protokolü daha önce tarif edilen yöntemler 40,41 modifiye edilir.
Not: İlgili kafa iskelet morfolojisi bir inceleme için Şekil 1'e bakınız.

Şekil 1:. Stickleback kafa iskelet morfolojisi Alizarin Kırmızı bir rodamin B filtre kümesi altında floresan ile görüntülenmiş threespine dikenli kafasını boyandı. Faydalı morfolojisi etiketlenmiştir: Op = opercle, Subop = suboperkülün, BSRs = branchiostegal ışınları, Ameliyat öncesi = preopercle, Infraorb 1-3 = infraorbital 1-3 (diğer adıyla circumorbitals veya suborbitals), Dent = dentary, PREMAX = premaxilla, Max = maksilla Nas = burun, Lat. ethm = yanal etmoid, Psph = parasphenoid, Fron = frontal kemik. Dikenli kafa iskeletinin daha ayrıntılı bilgi için (1974) 31 Anker bkz. Büyük halini görmek için tıklayınızbu figür.
- Balık düz (Şekil 2A) Lay ve göz kapsayan membran delinme için ~ 45 ° 'lik açıyla gözün yan içine keskin 5. saatçilik forseps yerleştirin.
- Uzak bir yoğurt kapağı (Şekil 2B) soyma benzer göz, gelen membran soyun.
- Gözün arkasındaki açık forseps yerleştirin gözün arkasındaki optik sinirin tutunmasını ve göz (Şekil 2C) çıkarın. o melanin sızıntısı gibi göz delmeyin. delinmiş ise, melanin sonraki adımlarda sırasında uzak yıkanabilir.
- diğer tarafta tekrarlayın.
- Posterior itibaren opercle flep altında küçük bir diseksiyon makas bıçak yerleştirin sürükleme makas bıçak dorsal opercle üstünde, daha sonra göz soket (Şekil 2B) aracılığıyla yumuşak dokuyu kesti. opercle kemiğe dorsal kesin.
- Frontal kemik (göz soket dorsal) (Şekil 2E) kesin.
- t etrafında orta hat parasphenoid kemik kesmekgöz çukurları (Şekil 2F) o merkezi.
- Rakip tarafta tekrarlayın opercle kesti.
- Opercle altında forseps yerleştirin ve yavaşça hala (Şekil 2G - H) bağlı herhangi bir yumuşak doku kırparak, vücuttan uzak yüzünü soymak. solungaç diken ilk satırı bozmak için özen gösterin.
- Dış dermal opercle, preopercle, suboperkülün dahil olmak üzere tüm hyoid iskeleti ve; forseps ile, uzak soyulması ve ön kraniofasyal iskelet (dentary, premaxilla ve maksilla dahil olmak üzere tüm çene çıkarırken orta hat basihyal gelen her iki tarafta ceratohyals ayırmak branchiostegal ışınları ve altta yatan dorsal ve ventral endochondral elemanları ve burun, yan etmoid dahil kafatasının ön kısmı ve infraorbital kemikler,) Şekil 1 ve 2I bakın.
- Pelvik dikenler vücuttan dışarı katlanabilir ve forseps tutun o kapmak için bir tutamak olarak hizmet verebilirne zaman f mevcut. Dikenler yerine kilitleyin. Kilidi açmak için, yavaşça doğrudan uzak balık vücuttan forseps ile omurga çekin, sonra yavaşça balık karşı düz omurga basın posterior viraj.
- Ekle dışında brankiyal iskeletinin (- K Şekil 2J) bağlı kalan kasları ve bağları alay, öne ve sürükle forseps (sadece gut tüp altında) brankiyal iskeletine forseps posterior ve ventral kapattı.
- Anterior yönde (Şekil 2L) bir posterior ventral braincase dorsal brankiyal iskeleti bağlama kasları kazınması, kapalı forseps ipuçlarını kullanarak.
- Karşı tarafın 2.9'a ve 2.10 tekrarlayın.
- Bağırsak tüp tabanını kavrayın ve brankiyal iskelet ve bağırsak tüp (Şekil 2M - N) çıkarmak için öne doğru çekin.
- (Beşinci ceratobranchial sonuna Şekil 2O dik kesme posterior yaparak bağırsak tüpü ayırın ).
- Brankiyal iskeletin sırt tarafında braincase kalan kemik parçaları çıkardıktan sonra, dorsal diş plakalarının ikili kümeleri arasında dorsal kesim (posterior anterior kesme) (- D Şekil 3A) yapmak için brankiyal sepetin içine makas yerleştirin. Emin olun kesme dorsal diş plakaları zarar vermemek için ortalanır.
- Brankiyal iskeleti (Şekil 3E) açılması ile yardımcı olmak için brankiyal iskeletin (bağırsak borusunun ön ucu) arka ucundaki lastik bağırsak lümeninde iki sığ yan keser.
- balık ve bir kavanoza tüm doku parçaları yerleştirin ve başka temizleme gerekli ise yumuşak temizleme, ya da% 100 gliserol devam% 50 gliserol,% 0.25 KOH içeren bir mikrosantrifüj tüpü içine brankiyal iskelet yerleştirin. benzersiz bir tanımlayıcı ile etiket kavanoz ve tüpler böylece izlenebilir. Gerekli temizleme miktarı 40 m üzerinde (çoğunlukla balık, büyük bir yetişkin balık büyüklüğünün bir fonksiyonudurstandart boyda m), tipik olarak ek takas gerektirir.

Şekil 2:. Stickleback brankiyal iskelet diseksiyonu Alizarin Kırmızı diseksiyon için threespine dikenli balık hazır boyandı. Göz geniş açıklıkta gelen depigmente edilir. Mavi oklar hareket yönünü gösterir. (A), dikenli kafasının yanal görünüşüdür, ön sağ etmektir. (B) göz kaplayan zarın çıkarılması. Gözün (C) çıkarılması. (D) dorsal opercle üzerinde kesti. (E) Cephe kemik kesim. (F) Parasphenoid kesti. (G - I) yüz iskeletinin çıkarılması. Ventral brankiyal iskelet yumuşak doku bağlantılarının (J) Sökme. (K - L) dorsal brankiyal iskelet bağlantılarının kaldırılması. ( M - N) brankiyal iskeletinin çıkarılması. (O) brankiyal iskeletinden bağırsak tüpü ayırın. Daha fazla bilgi için adımları 2.16 ile 2.1 bakınız. Ölçek çubuğu = 5 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
3. Brankial İskelet Yeniden boyama (Gerekli ise)
- solungaç iskelet koyu ya da açık dokuya daha fazla leke için,% 50 gliserol,% 0.25 KOH çözeltisi çıkarın ve iki kez% 1 KOH (bir çalkalama platformunda yatay çalkalama sırasında, ikinci bir 24 saat yıkama, ardından bir ila beş dakikalık bir yıkama) ile yıkayın.
- 24 saat boyunca% 1 KOH içinde 0.008% Alizarin Kırmızı S% 1 KOH ve yeniden leke çıkarın.
- leke çıkarın ve 24 saat süreyle% 1 KOH ile değiştirin.
- KOH çözeltisi çıkarın ve% 50 gliserol,% 0.25 KOH ile değiştirin.
4. Brankial Skeleton Montaj
- Brankial iskeleti kaldırsırt tarafında bir 22 mm x 60 mm cam kapak slip altına yakın% 50 gliserol,% 0.25 KOH veya% 100 gliserol ve yerden (Şekil 3F) yukarı bakacak. branşiyal iskeletin üstüne% 50 gliserol,% 0.25 KOH veya% 100 gliserol birkaç damla ekleyin. Bir mikrosantrifüj tüp içinde% 50 gliserol,% 0.25 KOH% 100 gliserol, değişim çözümden geçiş ve> 5 dakika boyunca önceden doku dengelenmesi montaj sallamak durumunda.
- ayırıcılar olarak hareket etmek kapak kayma her iki ucunda kil modelleme ve yerin iki küçük topları dışarı rulo.
- Gevşek ön brankiyal iskeleti (Şekil 3G) düzleştirmek için yeterli basınçla üstünde ikinci bir lamel yerleştirin.
- Peel, dorsal diş plakalar dahil sol dorsal kapağını açmak düzleştirmek ve lamelleri (Şekil 3H) arasında slayt.
- Sağ dorsal flep ile tekrarlayın tekniği ve lamel (Şekil 3H) kenarından uzak tüm brankiyal iskeleti itin.
- değiştirmekdoğal, forseps ile açık hem dorsal flep tutun ve dikkatli bir şekilde tek bir hareketle brankiyal iskelet düzleşme, üzerine lamel yerleştirin.
- yerçekimi brankiyal iskelet geri kapatmak için izin vermez Alternatif olarak, dışarı yanal her dorsal yüzü eğimlendirme, bir kapak kayma ters brankiyal iskeleti monte edin. Sonra ikinci 22 mm x 60 mm cam kapak slip ile kaplayın ve hazırlık ters.
Not: Farklı montaj teknikleri iyi ya da kötü her birey için çalışmak eğilimindedir. Her deneyin ve en rahat hissettiği bakın.
- Hafif brankiyal iskeleti tutmak için yeterli kil topları düzleştirmek için üst lamel düz monte edilmiş basın, ancak örnek ezmek için özen gösterin.
- Montaj işlemi sırasında, ceratobranchials döndürmek ve diken bir satır gizleyebilir. lamelleri ve yeniden yönlendirme ceratobranchials veya tüm brankiyal iskelet arasındaki forseps kaydırarak bu sorunu.
- Mağaza ro slayt tepsilerde düz prepsom sıcaklığı. % 100 gliserol monte, prepler en az on yıl için köprülü lamelleri arasında saklanabilir. Temiz forseps ve izopropanol veya etanol ve kapak ipuçları makas.
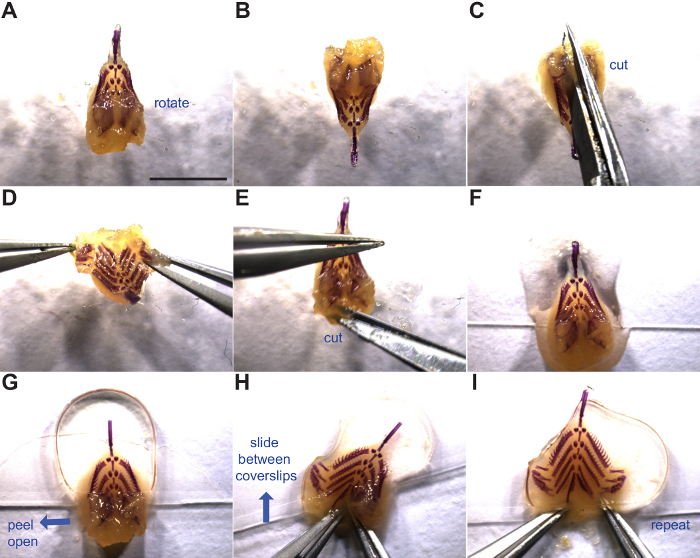
Şekil 3:. Daire brankiyal iskelet Manipülasyon montaj ve brankiyal iskeletin montajı gösterilmiştir. Mavi oklar hareket yönünü gösterir. (A) Brankial iskelet dorsal yüzü yukarı. Dorsal diş plakaları arasında - (B D) Rotasyon ve kesi. Yumuşak dokuda (E) Yanal kesim daha bağırsak borusunun tabanını açmak için. Montaj için hazır bir lamel altına yerleştirilen (F) Brankial iskelet. (Dorsal diş plakaları üzerinde) brankiyal iskeletin ön yarısında yerleştirilen (G) İkinci lamel. (H - I)dorsal diş plaka kanatlarını açarak ve iki kapak fişleri arasında kaydırarak brankiyal iskeletin düz montaj. Daha fazla bilgi için adımları 4,6 ile 4.1 bakınız. Ölçek çubuğu = 5 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Önemli trofik özelliklerin çeşitli ölçülebilir bir disseke ve düz monte brankiyal iskelet Bu protokol sonuçları (Şekil 4). Dorsal görünümünde, solungaç diken, tüm faringeal diş plakaları, ve neredeyse tüm brankiyal kemiklerin tüm satırları kolayca görüntülendi ve 22 sayısal olabilir - 24,35,36,38,42. Alizarin Kırmızı S diğer belirteçleri (örneğin, transgenik GFP 42) ve görselle?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
The branchial skeleton is a complex set of bones in the throat of a fish that manipulates, filters, and masticates food items on their way to the esophagus. Many interesting trophic traits including the patterning of gill rakers, pharyngeal teeth, and branchial bones vary across and within species. The majority of these traits are difficult to near impossible to accurately measure with the branchial skeleton in situ (e.g., gill raker length, branchial bone length). This flat-mounting protocol places all...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was funded in part by NIH R01 #DE021475 to CTM and an NSF Graduate Research Fellowship to NAE. Thanks to Miles Johnson for assistance with imaging and Priscilla Erickson for critical reading of the manuscript.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Potassium Hydroxide (KOH) | EMD | PX1480-1 | |
| Glycerol | Sigma-Aldrich | G7893-4L | |
| 10% Neutral Buffered Formalin (NBF) | Azer Scientific | NBF-4-G | |
| Alizarin Red S | EMD | AX0485-3 | |
| Microscope Cover Glasses 22 mm x 60 mm | VWR | 16004-350 | |
| 100 mm x 10 mm Glass Petri Dish | Kimble Chase | 23064-10010 | To dissect samples on |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Can be poured into glass or plastic Petri dishes to make dissecting plates |
| Modeling Clay | Sargent Art | 22-4000 | 1 lb cream |
| Scintillation Vials (case of 500) | Wheaton | 986586 | Borosilicate Glass with Screw Cap |
| Forceps-Dumont #5 Inox (Biologie tip) | FST | 11252-20 | Dumostars are an alternative |
| Dissecting Scissors | FST | 15003-08 | Alternate sizes are available depending on size of sample |
| Dissecting Microscope | Leica | S6E with KL300 LED | Many other models work nicely, having a flat base helps |
| Microcentrifuge Tubes 1.7 ml | Denville | C2170 | |
| Cardboard slide tray | Fisher | 12-587-10 |
Referanslar
- Cooper, W. J., Westneat, M. W. Form and function of damselfish skulls: rapid and repeated evolution into a limited number of trophic niches. BMC Evol. Biol. 9 (24), (2009).
- Albertson, R. C., Kocher, T. D. Genetic and developmental basis of cichlid trophic diversity. Heredity. 97 (3), 211-221 (2006).
- Martin, C. H., Wainwright, P. C. Trophic novelty is linked to exceptional rates of morphological diversification in two adaptive radiations of cyprinodon pupfish. Evolution. 65 (8), 2197-2212 (2011).
- Wainwright, P. C., et al. The evolution of pharyngognathy: A phylogenetic and functional appraisal of the pharyngeal jaw key innovation in labroid fishes and beyond. Syst. Biol. 61 (6), 1001-1027 (2012).
- Sibbing, F. Food capture and oral processing. Cyprinid Fishes. , 377-412 (1991).
- Bell, M., Foster, S. The Evolutionary Biology of the Threespine Stickleback. , Oxford University Press. New York. (1994).
- Kimmel, C. B., et al. Evolution and development of facial bone morphology in threespine sticklebacks. Proc. Natl. Acad. Sci. U. S. A. 102 (16), 5791-5796 (2005).
- Mcgee, M. D., Wainwright, P. C. Convergent evolution as a generator of phenotypic diversity in threespine stickleback. Evolution. 67 (4), 1204-1208 (2013).
- McGee, M. D., Schluter, D., Wainwright, P. C. Functional basis of ecological divergence in sympatric stickleback. BMC Evol. Biol. 13, 277(2013).
- McGuigan, K., Nishimura, N., Currey, M., Hurwit, D., Cresko, W. A. Quantitative genetic variation in static allometry in the threespine stickleback. Integr. Comp. Biol. 50 (6), 1067-1080 (2010).
- Caldecutt, W. J., Bell, M. A., Buckland-Nicks, J. A. Sexual dimorphism and geographic variation in dentition of threespine stickleback, Gasterosteus aculeatus. Copeia. 2001 (4), 936-944 (2001).
- Berner, D., Moser, D., Roesti, M., Buescher, H., Salzburger, W. Genetic architecture of skeletal evolution in european lake and stream stickleback. Evolution. 68 (6), 1792-1805 (2014).
- Jamniczky, H. a, Barry, T. N., Rogers, S. M. Eco-evo-devo in the study of adaptive divergence: examples from threespine stickleback (Gasterosteus aculeatus). Integr. Comp. Biol. 55 (1), 166-178 (2015).
- Magnuson, J., Heitz, J. Gill raker apparatus and food selectivity among mackerels, tunas, and dolphins. Fish. Bull. 69 (2), 361-370 (1971).
- Kahilainen, K. K., et al. The role of gill raker number variability in adaptive radiation of coregonid fish. Evol. Ecol. 25 (3), 573-588 (2011).
- Arnegard, M. E., et al. Genetics of ecological divergence during speciation. Nature. 511 (7509), 307-311 (2014).
- Gross, H. P., Anderson, J. M., Gross, H. P., Anderson, J. Geographic variation in the gillrakers and diet of European threespine sticklebacks, Gasterosteus aculeatus. Copeia. 1984 (1), 87-97 (1984).
- Hagen, D., Gilbertson, L. Geographic variation and environmental selection in Gasterosteus aculeatus L in the Pacific Northwest, America. Evolution. 26 (1), 32-51 (1972).
- McPhail, J. D. Ecology and evolution of sympatric sticklebacks (Gasterosteus): morphological and genetic evidence for a species pair in Enos Lake, British Columbia. Can. J. Zool. 62 (7), 1402-1408 (1984).
- Schluter, D., McPhail, J. D. Ecological character displacement and speciation in sticklebacks. Am. Nat. 140 (1), 85-108 (1992).
- Robinson, B. Trade offs in Habitat-specific foraging efficiency and the nascent adaptive divergence of sticklebacks in lakes. Behaviour. 137 (7), 865-888 (2000).
- Glazer, A. M., Cleves, P. A., Erickson, P. A., Lam, A. Y., Miller, C. T. Parallel developmental genetic features underlie stickleback gill raker evolution. Evodevo. 5 (1), (2014).
- Miller, C. T., Glazer, A. M., et al. Modular skeletal evolution in sticklebacks is controlled by additive and clustered quantitative trait loci. Genetics. 197 (1), 405-420 (2014).
- Glazer, A. M., Killingbeck, E. E., Mitros, T., Rokhsar, D. S., Miller, C. T. Genome assembly improvement and mapping convergently evolved skeletal traits in sticklebacks with Genotyping-by-Sequencing. G3. 5, 1463-1472 (2015).
- Wainwright, P. Functional morphology of the pharyngeal jaw apparatus. Fish Physiol. Fish Biomech. , 77-102 (2006).
- Hulsey, C. D., Fraser, G. J., Streelman, J. T. Evolution and development of complex biomechanical systems: 300 million years of fish jaws. Zebrafish. 2 (4), 243-257 (2005).
- Lauder, G. Functional design and evolution of the pharyngeal jaw apparatus in euteleostean fishes. Zool. J. Linn. Soc. 77, 1-38 (1983).
- Fraser, G. J., et al. An ancient gene network is co-opted for teeth on old and new jaws. PLoS Biol. 7 (2), e1000031(2009).
- Stock, D. Zebrafish dentition in comparative context. J. Exp. Zool. B. Mol. Dev. Evol. 308, 523-549 (2007).
- Liem, K., Greenwood, P. A functional approach to the phylogeny of the pharyngognath teleosts. Am. Zool. 21 (1), 83-101 (1981).
- Anker, G. C. Morphology and kinetics of the head of the stickleback, Gasterosteus aculeatus. Trans. Zool. Soc. London. 32 (5), 311-416 (1974).
- Meyer, A. Morphometrics and allometry in the trophically polymorphic cichlid fish, Cichlusomu citrinelfum: Alternative adaptations and ontogenetic changes in shape. J. Zool., Lond. 221, 237-260 (1990).
- Huysseune, A. Phenotypic plasticity in the lower pharyngeal jaw dentition of Astatoreochromis alluaudi (Teleostei: Cichlidae). Arch. Oral Biol. 40 (11), 1005-1014 (1995).
- Muschick, M., Indermaur, A., Salzburger, W. Convergent Evolution within an adaptive radiation of cichlid fishes. Curr. Biol. 22 (24), 2362-2368 (2012).
- Cleves, P. A., et al. Evolved tooth gain in sticklebacks is associated with a cis-regulatory allele of Bmp6. Proc. Natl. Acad. Sci. 111 (38), 13912-13917 (2014).
- Ellis, N. A., et al. Distinct developmental and genetic mechanisms underlie convergently evolved tooth gain in sticklebacks. Development. (142), 2442-2451 (2015).
- Tucker, A. S., Fraser, G. J. Evolution and developmental diversity of tooth regeneration. Semin. Cell Dev. Biol. 25-26, 71-80 (2014).
- Erickson, P. A., Glazer, A. M., Cleves, P. A., Smith, A. S., Miller, C. T. Two developmentally temporal quantitative trait loci underlie convergent evolution of increased branchial bone length in sticklebacks. Proc. R. Soc. B. 281, (2014).
- Leary, S., et al. AVMA Guidelines for the Euthanasia of Animals. , American Veterinary Medical Association. Schaumburg, IL. (2013).
- Bell, M. A. Evolutionary phenetics and genetics. Evol. Genet. Fishes. , 431-528 (1984).
- Taylor, W. R., Van Dyke, G. C. Revised procedures for staining and clearing small fishes and other vertebrates for bone and cartilage study. Cybium. 9 (2), 107-119 (1985).
- Erickson, P. A., et al. A 190 base pair, TGF-β responsive tooth and fin enhancer is required for stickleback Bmp6 expression. Dev. Biol. 401 (2), 310-323 (2015).
- Miller, C. T., et al. cis-Regulatory changes in Kit ligand expression and parallel evolution of pigmentation in sticklebacks and humans. Cell. 131 (6), 1179-1189 (2007).
- Aigler, S. R., Jandzik, D., Hatta, K., Uesugi, K., Stock, D. W. Selection and constraint underlie irreversibility of tooth loss in cypriniform fishes. Proc. Natl. Acad. Sci. U. S. A. 111 (21), 7707-7712 (2014).
- Pasco-Viel, E., et al. Evolutionary trends of the pharyngeal dentition in Cypriniformes (Actinopterygii Ostariophysi). PLoS One. 5 (6), e11293(2010).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır