JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
해부와 큰가시 고기 아가미 해골의 평면 장착
요약
The branchial skeleton, including gill rakers, pharyngeal teeth, and branchial bones, serves as the primary site of food processing in most fish. Here we describe a protocol to dissect and flat-mount this internal skeleton in threespine sticklebacks. This method is also applicable to a variety of other fish species.
초록
The posterior pharyngeal segments of the vertebrate head give rise to the branchial skeleton, the primary site of food processing in fish. The morphology of the fish branchial skeleton is matched to a species' diet. Threespine stickleback fish (Gasterosteus aculeatus) have emerged as a model system to study the genetic and developmental basis of evolved differences in a variety of traits. Marine populations of sticklebacks have repeatedly colonized countless new freshwater lakes and creeks. Adaptation to the new diet in these freshwater environments likely underlies a series of craniofacial changes that have evolved repeatedly in independently derived freshwater populations. These include three major patterning changes to the branchial skeleton: reductions in the number and length of gill raker bones, increases in pharyngeal tooth number, and increased branchial bone lengths. Here we describe a detailed protocol to dissect and flat-mount the internal branchial skeleton in threespine stickleback fish. Dissection of the entire three-dimensional branchial skeleton and mounting it flat into a largely two-dimensional prep allows for the easy visualization and quantification of branchial skeleton morphology. This dissection method is inexpensive, fast, relatively easy, and applicable to a wide variety of fish species. In sticklebacks, this efficient method allows the quantification of skeletal morphology in genetic crosses to map genomic regions controlling craniofacial patterning.
서문
다양성의 놀라운 양이 특히 물고기들, 척추 동물 중 머리 골격에 존재합니다. 대부분의 경우 이러한 다양성은 다른 공급 전략 1 용이 - 4, 모두 외부 및 내부 두개 안면 패턴에 큰 변화를 포함 할 수있다. 아가미 골격은 물고기의 목에 내부에 위치하여 구강의 대부분을 둘러싸고있다. 아가미 골격은 아가미를 지원하는 전방 네있는 5 직렬로 동종 세그먼트로 구성되어 있습니다. 함께이 다섯 세그먼트는 물고기와 음식 (5) 사이의 인터페이스로 작동합니다. 아가미 레이커, 인두 이빨과 아가미 뼈를 포함하여 특성의 다수의 변화는 다양한 종류의 음식에 효율적 꼴에 기여한다.
큰가시 고기과는 북반구에 걸쳐 민물 호수와 시내 식민지 조상의 해양 양식 후 적응 방사선을받은. 다이어트의 변화민물에서 더 큰 먹이에 바다에서 작은 동물성 플랑크톤에서 여러 두개 안면 특성 (6)에 극적인 영양 변화를 가져왔다. 많은 연구가 큰가시 고기과 7 외부 두개 안면의 차이에 초점을 맞추고 있지만 - 13 중요한 두개 안면의 변화는 내부 아가미 골격에 반복적으로 진화. 형태 학적으로 구별 큰가시 고기 집단 사이의 비옥 한 하이브리드를 만들 수있는 능력은 아가미 골격에 진화 변화의 유전 적 기초를지도 할 수있는 좋은 기회를 제공한다.
생태 학적 의미 중 하나는 영양 특성은 아가미 레이커, 아가미 뼈의 전방 및 후방 얼굴 라인과 먹이 항목을 필터링하는 데 사용되는주기적인 피부 뼈의 패턴입니다. 일반적으로 작은 먹이 항목을 먹고 물고기는 더 이상 더 조밀하게 이격 아가미가 더 큰 먹이 14,15 먹이 물고기에 비해 레이커 경향이있다. 아가미 레이커의 변화가보고 된 적이 모두 within 종 14-19 사이, 그리고 아가미 레이커 패턴의 양상은 영양 틈새 시장 및 피트니스 (16)에 기여한다. 연구의 수십 년은 광범위하게 threespine 큰가시 고기과 (17)의 아가미 레이커 번호와 길이의 변화 문서화 - (21); 그러나, 이러한 연구는 일반적으로 아가미 레이커의 첫 번째 행에 초점을 맞춘다. 최근 작품은 하나 하나의 아가미 레이커가 이해하는 행보다 더 많은 공부의 중요성을 강조 (23)과 길이 (24) 간격 아가미 골격 (22, 23)에서와 아가미 레이커의 단일 행에 걸쳐 아가미 레이커 수의 유전자 제어 모듈을 보여 주었다 아가미 레이커 감소의 발달 유전 적 기초.
모두 생태 및 생물 의학 의미의 두 번째 영양 특성은 인두 치아의 패턴입니다. 물고기에서 치아 인두 이빨 공지 모두 경구 턱과 아가미 골격 중에 위치 할 수있다. 구강 치아 페이지에 주로 사용된다27 - 인두 치아 저작 및 먹이 조작 (25)에 사용하는 동안 레이 캡처. 두 세트는 공유 발달 메커니즘을 통해 형성과 상동 (28) 발달로 간주됩니다. 때때로 이러한 일부 제브라 피쉬, 부족으로 구강 및 인두 등의 치아 (29) 다른 종의 여러 톱니 ceratobranchials, pharyngobranchials있는 동안 같은 종, 그리고 basihyal 톱니와 30 hypobranchials있다 흥미 모듈화가 발생합니다. 큰가시 고기과에, 인두 치아 앞쪽에 다섯 번째 ceratobranchial과 등쪽에 복부 발견하고 후방은 31 pharyngobranchials 있습니다. 큰가시 고기 공급에 운동학은 구강 턱은 주로 먹이 캡처 및 인두 턱에 저작을 떠나 흡입 공급 (9)을 용이하게 사용됩니다 보여줍니다. 시클리드에서 하부 인두 턱 형태 극적 32,33를 가변 적응 및 영양 틈새 (34) 상관 관계가 밝혀졌다. 멀티PLE 담수 큰가시 고기의 인구는 복부 인두 치아 번호 23,35,36에서 극적인 증가를 진화했다. 최근 작업이 진화 치아 이득의 발달 유전 적 근거는 민물 큰가시 고기과 (36)의 두 개의 독립적으로 파생 된 인구에서 크게 구별 있음을 보여 주었다. 포유 동물의 치아와는 달리, 물고기는 성인 생활 (37)를 통해 지속적으로 자신의 치아를 재생. 이러한 전술 높은 치형 민물 인구 모두 재생 (36)의 유전 적 기초를 연구하는 희귀 척추 제공 시스템, 가속 보철물 속도 진화 해왔다.
민물 큰가시 고기과에 반복적으로 진화하고 세 번째 영양 특성은 더 이상 각각 38 epibranchial 및 ceratobranchial 뼈, 상부 및 하부 턱의 아가미 아치 분절 동족체이다. 긴 아가미 뼈는 더 큰 구강을 부여하고 가능성이 더 큰 먹이 항목을 다 할 수 있도록하기위한 적응이다onsumed. 또한, 다른 물고기에, epibranchial 뼈는 등쪽 인두 치아 플레이트 (25)의 우울증 중요하다. 아가미 레이커와 인두 치아처럼, 아가미 뼈는 쉽게 시각화 또는 정량화하기 어려운, 따라서 내부입니다.
여기에서 우리는 해부 자세한 프로토콜을 제시하고 중요한 두개 안면 특성의 다양한 쉽게 시각화 및 정량화를 허용, 아가미 골격을 평면 마운트합니다. 이 프로토콜은 큰가시 고기의 해부를 설명하지만,이 같은 방법은 다른 물고기의 다양한 작동합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 물고기 작품은 캘리포니아 버클리 대학의 기관 동물 관리 및 사용위원회 (프로토콜 번호 R330)에 의해 승인되었다. 안락사 0.1 % 중탄산 나트륨 39 % 완충 0.025 Tricaine-S에 침지하여 수행 하였다. 모든 단계는 실온에서 수행된다.
1. 준비
참고 : 단단히 밀봉 할 수 있고 수평으로 배치 할 원뿔 튜브 또는 섬광 유리 병에 단계 1.1-1.5를 수행합니다. 물고기는 지속적으로 동요 될 필요가 조심스럽게 반전 또는 염색 액에 물고기의 모든면을 노출하고 얼룩이 균등하게 조직을 통과 할 수 있도록 튜브 또는 튜브의 랙을 흔들어 가능한 한 자주 솔루션을 혼합하려고하지 않습니다. 액체의 무거운 무게가 통을 깰 것 같은 플랫폼 통에 물고기의 큰 배치를 두지 마십시오.
- 하룻밤 10 % 중성 완충 포르말린 (NBF)와 에탄올에 저장하거나 갓 안락사 생선이나 생선을 수정합니다. 대안 적으로, 4 % 파라 포름을 사용1X PBS 용액 대신에 10 % NBF에서 알데히드.
주 : DNA를 추출하는 경우에는 에탄올에 고정 및 저장 전에 꼬리 지느러미 또는 가슴의 일부를 클립. - 2 시간 동안 (즉, ~의 pH 7.0) 화학 후드에서 제대로 수정 폐기 및 수돗물로 교체합니다. 종종 산성 수 있으며 뼈 석회 수있는 탈 이온수를 사용하지 마십시오.
- 24 시간 동안 물에 1 % KOH에 0.008 % 알리자린 레드 S 물과 얼룩 물고기를 제거합니다. 물고기보다 20mm 표준 길이를 들면, 0.004 % 알리자린 레드 S.는 (다음 희석 될 수있다 알리자린 레드 S의 100 배 (0.8 %) 원액을 확인)를 사용합니다.
- 몇 시간 동안 수돗물에 얼룩 (후드에서 적절한 폐기 용기에 넣어)과 장소 물고기를 제거합니다. 물 린스는 대부분 깨끗해질 때까지 필요에 따라 물을 변경합니다.
- 50 % 글리세롤, 가벼운 청소 및 후속 해부 0.25 %의 KOH에 물과 장소 물고기를 제거합니다.
참고 :이 염색 프로토콜은 앞서 설명한 방법 40, 41에서 수정됩니다.
참고 : 관련 머리 골격 형태의 검토를 위해 그림 1을 참조하십시오.

그림 1 :. 큰가 머리 골격 형태 알리자린 레드는 로다 민 B 필터 세트에서 형광 이미징 큰가시 고기의 머리를 염색. 유용한 형태는 표지 할 것 : 연산 = opercle, Subop = subopercle, BSRs = branchiostegal 광선, 수술 전 = preopercle, Infraorb 1-3 = 눈꺼풀 1-3 (또한 circumorbitals 또는 suborbitals), 덴트는 = 치골, Premax = premaxilla, 최대 = 상악을 , 나스 = 코, 위도. ethm = 측면 사골, Psph = parasphenoid, 프론트 = 정면 뼈. 큰가시 고기의 머리 골격에 대한 자세한 설명은, (1974) 31하기 Anker를 참조하십시오. 의 더 큰 버전을 보려면 여기를 클릭하십시오이 그림.
- 물고기 평면 (그림 2A)을 놓고 눈을 덮고있는 막에 구멍을 위해 ~ 45 ° 각도로 눈의 측면에 날카로운 # 5 시계의 집게를 삽입합니다.
- 거리 요구르트 뚜껑 (도 2b)을 박리 유사한 눈으로부터 막을 벗겨.
- 눈 뒤에 열린 집게를 삽입 눈 뒤에있는 시신경을 붙잡고, 및 눈 (그림 2C)를 제거합니다. 이 멜라닌을 누출로 눈에 구멍을하지 마십시오. 구멍이있는 경우, 멜라닌 이후 단계에서 씻겨 할 수 있습니다.
- 반대편에 반복합니다.
- 후방에서 시작하여, opercle 플랩 아래에 하나의 작은 해부 가위 블레이드를 배치, 드래그 가위 블레이드는 등쪽 opercle 위, 그 다음 눈 소켓 (그림 2D)까지 연부 조직을 잘라. opercle 뼈에 지느러미를 잘라.
- 정면 뼈 (눈 소켓에 지느러미) (그림 2E)을 잘라.
- t 주위의 중간 선 parasphenoid 뼈를 잘라눈 소켓 (그림 2 층)의 그는 센터.
- 반대 측의 반복 opercle 잘라.
- opercle에서 집게를 삽입하고 천천히 여전히 (그림 2G - H)에 연결된 모든 연부 조직을 트리밍, 멀리 몸에서 얼굴을 떼어. 아가미 레이커의 첫 번째 행을 방해하지 않도록주의하십시오.
- 외부 피부 opercle, preopercle, subopercle 포함한 전체 설골 골격을하고, 핀셋으로 벗겨과 전방 두개 안면 골격 (치골, premaxilla 및 상악 포함한 전체 턱을 분리 할 때 중간 선 basihyal에서 양쪽에 ceratohyals를 분리 branchiostegal 광선 및 기본 지느러미와 복부 연골 요소와 코, 측면 사골을 포함한 두개골의 앞쪽 부분과 눈꺼풀 뼈)도 1 및도 2I를 참조하십시오.
- 골반 쪽은 몸에서 밖으로 접을 수 있으며, 집게 보류 O를 잡아에 대한 핸들 역할을 할 수때 F 본. 등뼈는 제자리에 고정. 잠금을 해제하려면, 부드럽게 직접 거리에 물고기의 몸에서 집게로 척추를 당겨 부드럽게 물고기에 평평 척추를 눌러 뒤쪽으로 구부리십시오.
- 삽입 떨어져 아가미 골격 (- K 그림 2J)에 부착 된 나머지 근육과 인대를 괴롭 히고, 전방 및 드래그 집게 (단지 장 관 아래) 아가미 골격에 집게 후방과 복부를 마감했다.
- 전방 방향 (그림 2L)에 후방에서 복부 braincase에 지느러미 아가미 골격을 부착 근육을 멀리 긁어, 닫힌 포셉의 팁을 사용.
- 반대 측에 2.9와 2.10를 반복합니다.
- 장내 튜브의 기반을 잡고 아가미 골격과 창자 관 (그림 2M - N)을 제거하기 위해 전방으로 잡아 당깁니다.
- (다섯 번째 ceratobranchial의 끝에도 2O을 수직 절단 후방을 만들어 장내 튜브를 분리 ).
- 아가미 골격의 등 쪽의 braincase에서 남아있는 뼈 조각을 제거한 후, 지느러미 치아 판의 양측 세트 사이에 지느러미 절단 (후방에 전방 절단) (- D 그림 3A)를 만들기 위해 아가미 바구니에 가위를 삽입합니다. 확인 컷은 지느러미 치아 판의 손상을 방지하기 위해 중앙에.
- 아가미 골격 (그림 3E)를 개방을 지원하기 위해 아가미 골격 (창자 관의 앞쪽 끝)의 후방 끝 부분에있는 고무 장 루멘에서 두 개의 얕은 측면 상처를 확인합니다.
- 물고기와 항아리에 모든 조직의 조각을 놓고 더 이상 청소가 필요하지 않은 경우 부드러운 청산, 또는 100 % 글리세롤을 계속 50 % 글리세롤, 0.25 %의 KOH와 microcentrifuge 관에 아가미 골격을 배치합니다. 고유 식별자와 라벨 항아리와 튜브는 그래서 그들은 추적 할 수 있습니다. 필요한 정화 량은 40m 이상 (대체로 물고기 큰 성어의 크기의 함수 인표준 길이 m)는 일반적으로 추가적인 청소가 필요합니다.

그림 2 :. 큰가 아가미 골격 해부 알리자린 레드 해부에 대한 큰가시 고기 생선 준비 스테인드. 눈은 광범위한 청산에서 탈색된다. 파란색 화살표는 동작 방향을 나타낸다. (A) 큰가 헤드의 측면도, 전방 우측이다. (B) 눈을 덮는 막 제거. 눈의 (C)를 제거. (D) 지느러미는 opercle 위에 잘라. (E) 정면 뼈를 잘라. (F) Parasphenoid 절단. (G - I) 안면 골격의 제거. 복부 아가미 골격 연조직 연결 (J) 제거. (K - L) 등의 아가미 골격 연결 제거. (<강한> M - N) 아가미 골격의 제거. (O) 아가미 골격에서 장 튜브를 분리합니다. 자세한 내용은 단계 2.16 통해 2.1를 참조하십시오. 스케일 바 = 5 mm이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 아가미 해골 다시 염색 (필요한 경우)
- 아가미 골격 어둡거나 명확한 조직을 더 얼룩, 50 % 글리세롤, 0.25 %의 KOH 용액을 제거하고 배 1 % KOH (플랫폼 통에 수평으로 흔들어 섞으면 두 번째 24 시간 세척 한 다음 1 ~ 5 분 세척)으로 씻는다.
- 24 시간 동안 1 % KOH에서 0.008 % 알리자린 레드 S와 1 % KOH 다시 얼룩을 제거합니다.
- 얼룩을 제거하고 24 시간 동안 1 % KOH로 교체합니다.
- KOH 용액을 제거하고 50 % 글리세롤, 0.25 % KOH로 교체합니다.
4. 아가미 해골 장착
- 아가미 골격을 제거등쪽면이 22mm X 60mm 유리 커버 슬립 하단 50 % 글리세롤, 0.25 % KOH 또는 100 % 글리세롤과 장소에서 (그림 3 층)이 위를 향. 아가미 골격 위에 50 % 글리세롤, 0.25 %의 KOH 또는 100 % 글리세롤 몇 방울을 추가한다. 미세 원심 관에 50 % 글리세롤, 0.25 % KOH 100 % 글리세롤, 변화 솔루션에서 전환과> 5 분 전에 조직을 평형 설치에 흔들합니다.
- 스페이서의 역할을 커버 슬립의 양쪽 끝에서 모델링 점토와 장소의 두 개의 작은 공을 굴립니다.
- 느슨하게 앞쪽 아가미 골격 (그림 3G)를 평평하게하기에 충분한 압력으로 상단에 두 번째 coverslip에 배치합니다.
- 껍질, 지느러미 치아 플레이트를 포함 왼쪽 지느러미 플랩을 열고 평평하고, 커버 슬립 (그림 3H) 사이에 슬라이드.
- 오른쪽 지느러미 플랩 반복 기술과는 커버 슬립 (그림 3I)의 가장자리에서 떨어져 전체 아가미 골격을 누릅니다.
- 바꾸다기본적으로, 집게로 열린 두 지느러미 플랩을 잡고 조심스럽게 한 부드러운 움직임의 아가미 골격을 평평하게,에 coverslip에 배치합니다.
- 중력은 아가미 골격가 다시 닫습니다 허용하지 않도록 또는 밖으로 측면 각 지느러미 쪽을 플레잉, 하나의 커버 슬립에 거꾸로 아가미 골격을 탑재합니다. 그런 다음 두 번째 22mm X 60mm 유리 커버 슬립으로 커버하고 준비를 반전.
참고 : 다른 장착 기술이 좋든 나쁘 든 각 개인에 대한 작업을하는 경향이있다. 각 시도하고 가장 편안한 느낌을 확인.
- 가볍게 아가미 골격을 유지하기에 충분 점토 공을 평평하게하기 위해 상단 커버 슬립에 평평하게 탑재 눌러하지만, 시료를 분쇄하지 않도록주의.
- 장착 과정 ceratobranchials는 회전 레이커 행을 가릴 수있다. 커버 슬립 다시 배향 ceratobranchials 또는 전체 아가미 골격 사이에 집게를 밀어이를 해결.
- 쇼핑몰 소유주에 슬라이드 트레이에 평평하게 준비합니다톰 온도. 100 % 글리세롤에 장착 준비합니다 적어도 십년 가교 된 커버 사이에 저장 될 수있다. 청소 집게, 이소프로판올, 에탄올 및 커버 팁 가위.
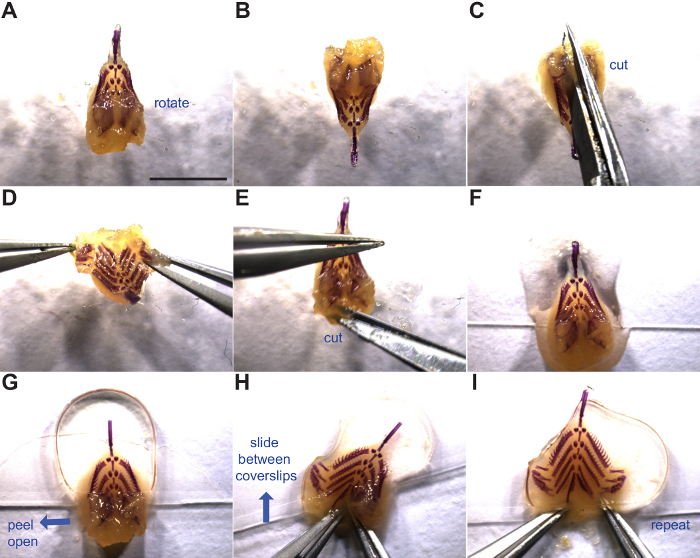
그림 3 :. 플랫 아가미 골격 조작을 장착하고 아가미 골격의 설치가 표시됩니다. 파란색 화살표는 동작 방향을 나타낸다. (A) 아가미 골격 등의 측면입니다. 지느러미 치아 판 사이 - (B D) 회전과 절개. 부드러운 조직 (E) 측면 컷은 또한 창자 관의 기반을 엽니 다. 설치를위한 준비 커버 슬립의 하단에 위치 (F) 아가미 골격. (지느러미 치아 플레이트 위) 아가미 골격의 앞쪽 절반에 위치 (G) 두 번째 커버 슬립. (H - I)지느러미 치아 판 플랩을 열고 두 커버 전표 사이에 밀어 아가미 골격의 평면 장착. 자세한 내용은 단계 4.6을 통해 4.1을 참조하십시오. 스케일 바 = 5 mm이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
중요한 영양 특성의 다양한 정량화 할 수있는 해부와 평면 탑재 아가미 골격이 프로토콜 결과 (그림 4). 지느러미보기에서 아가미 레이커, 모든 인두 치아 판, 거의 모든 아가미 뼈의 모든 행은 쉽게 시각화, 22 정량화 할 수있다 - 24,35,36,38,42합니다. 알리자린 레드 S는 다른 마커 (예, 유전자 변형 GFP 42) 및 시각화하는 ...
Access restricted. Please log in or start a trial to view this content.
토론
The branchial skeleton is a complex set of bones in the throat of a fish that manipulates, filters, and masticates food items on their way to the esophagus. Many interesting trophic traits including the patterning of gill rakers, pharyngeal teeth, and branchial bones vary across and within species. The majority of these traits are difficult to near impossible to accurately measure with the branchial skeleton in situ (e.g., gill raker length, branchial bone length). This flat-mounting protocol places all...
Access restricted. Please log in or start a trial to view this content.
공개
The authors have nothing to disclose.
감사의 말
This work was funded in part by NIH R01 #DE021475 to CTM and an NSF Graduate Research Fellowship to NAE. Thanks to Miles Johnson for assistance with imaging and Priscilla Erickson for critical reading of the manuscript.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Potassium Hydroxide (KOH) | EMD | PX1480-1 | |
| Glycerol | Sigma-Aldrich | G7893-4L | |
| 10% Neutral Buffered Formalin (NBF) | Azer Scientific | NBF-4-G | |
| Alizarin Red S | EMD | AX0485-3 | |
| Microscope Cover Glasses 22 mm x 60 mm | VWR | 16004-350 | |
| 100 mm x 10 mm Glass Petri Dish | Kimble Chase | 23064-10010 | To dissect samples on |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Can be poured into glass or plastic Petri dishes to make dissecting plates |
| Modeling Clay | Sargent Art | 22-4000 | 1 lb cream |
| Scintillation Vials (case of 500) | Wheaton | 986586 | Borosilicate Glass with Screw Cap |
| Forceps-Dumont #5 Inox (Biologie tip) | FST | 11252-20 | Dumostars are an alternative |
| Dissecting Scissors | FST | 15003-08 | Alternate sizes are available depending on size of sample |
| Dissecting Microscope | Leica | S6E with KL300 LED | Many other models work nicely, having a flat base helps |
| Microcentrifuge Tubes 1.7 ml | Denville | C2170 | |
| Cardboard slide tray | Fisher | 12-587-10 |
참고문헌
- Cooper, W. J., Westneat, M. W. Form and function of damselfish skulls: rapid and repeated evolution into a limited number of trophic niches. BMC Evol. Biol. 9 (24), (2009).
- Albertson, R. C., Kocher, T. D. Genetic and developmental basis of cichlid trophic diversity. Heredity. 97 (3), 211-221 (2006).
- Martin, C. H., Wainwright, P. C. Trophic novelty is linked to exceptional rates of morphological diversification in two adaptive radiations of cyprinodon pupfish. Evolution. 65 (8), 2197-2212 (2011).
- Wainwright, P. C., et al. The evolution of pharyngognathy: A phylogenetic and functional appraisal of the pharyngeal jaw key innovation in labroid fishes and beyond. Syst. Biol. 61 (6), 1001-1027 (2012).
- Sibbing, F. Food capture and oral processing. Cyprinid Fishes. , 377-412 (1991).
- Bell, M., Foster, S. The Evolutionary Biology of the Threespine Stickleback. , Oxford University Press. New York. (1994).
- Kimmel, C. B., et al. Evolution and development of facial bone morphology in threespine sticklebacks. Proc. Natl. Acad. Sci. U. S. A. 102 (16), 5791-5796 (2005).
- Mcgee, M. D., Wainwright, P. C. Convergent evolution as a generator of phenotypic diversity in threespine stickleback. Evolution. 67 (4), 1204-1208 (2013).
- McGee, M. D., Schluter, D., Wainwright, P. C. Functional basis of ecological divergence in sympatric stickleback. BMC Evol. Biol. 13, 277(2013).
- McGuigan, K., Nishimura, N., Currey, M., Hurwit, D., Cresko, W. A. Quantitative genetic variation in static allometry in the threespine stickleback. Integr. Comp. Biol. 50 (6), 1067-1080 (2010).
- Caldecutt, W. J., Bell, M. A., Buckland-Nicks, J. A. Sexual dimorphism and geographic variation in dentition of threespine stickleback, Gasterosteus aculeatus. Copeia. 2001 (4), 936-944 (2001).
- Berner, D., Moser, D., Roesti, M., Buescher, H., Salzburger, W. Genetic architecture of skeletal evolution in european lake and stream stickleback. Evolution. 68 (6), 1792-1805 (2014).
- Jamniczky, H. a, Barry, T. N., Rogers, S. M. Eco-evo-devo in the study of adaptive divergence: examples from threespine stickleback (Gasterosteus aculeatus). Integr. Comp. Biol. 55 (1), 166-178 (2015).
- Magnuson, J., Heitz, J. Gill raker apparatus and food selectivity among mackerels, tunas, and dolphins. Fish. Bull. 69 (2), 361-370 (1971).
- Kahilainen, K. K., et al. The role of gill raker number variability in adaptive radiation of coregonid fish. Evol. Ecol. 25 (3), 573-588 (2011).
- Arnegard, M. E., et al. Genetics of ecological divergence during speciation. Nature. 511 (7509), 307-311 (2014).
- Gross, H. P., Anderson, J. M., Gross, H. P., Anderson, J. Geographic variation in the gillrakers and diet of European threespine sticklebacks, Gasterosteus aculeatus. Copeia. 1984 (1), 87-97 (1984).
- Hagen, D., Gilbertson, L. Geographic variation and environmental selection in Gasterosteus aculeatus L in the Pacific Northwest, America. Evolution. 26 (1), 32-51 (1972).
- McPhail, J. D. Ecology and evolution of sympatric sticklebacks (Gasterosteus): morphological and genetic evidence for a species pair in Enos Lake, British Columbia. Can. J. Zool. 62 (7), 1402-1408 (1984).
- Schluter, D., McPhail, J. D. Ecological character displacement and speciation in sticklebacks. Am. Nat. 140 (1), 85-108 (1992).
- Robinson, B. Trade offs in Habitat-specific foraging efficiency and the nascent adaptive divergence of sticklebacks in lakes. Behaviour. 137 (7), 865-888 (2000).
- Glazer, A. M., Cleves, P. A., Erickson, P. A., Lam, A. Y., Miller, C. T. Parallel developmental genetic features underlie stickleback gill raker evolution. Evodevo. 5 (1), (2014).
- Miller, C. T., Glazer, A. M., et al. Modular skeletal evolution in sticklebacks is controlled by additive and clustered quantitative trait loci. Genetics. 197 (1), 405-420 (2014).
- Glazer, A. M., Killingbeck, E. E., Mitros, T., Rokhsar, D. S., Miller, C. T. Genome assembly improvement and mapping convergently evolved skeletal traits in sticklebacks with Genotyping-by-Sequencing. G3. 5, 1463-1472 (2015).
- Wainwright, P. Functional morphology of the pharyngeal jaw apparatus. Fish Physiol. Fish Biomech. , 77-102 (2006).
- Hulsey, C. D., Fraser, G. J., Streelman, J. T. Evolution and development of complex biomechanical systems: 300 million years of fish jaws. Zebrafish. 2 (4), 243-257 (2005).
- Lauder, G. Functional design and evolution of the pharyngeal jaw apparatus in euteleostean fishes. Zool. J. Linn. Soc. 77, 1-38 (1983).
- Fraser, G. J., et al. An ancient gene network is co-opted for teeth on old and new jaws. PLoS Biol. 7 (2), e1000031(2009).
- Stock, D. Zebrafish dentition in comparative context. J. Exp. Zool. B. Mol. Dev. Evol. 308, 523-549 (2007).
- Liem, K., Greenwood, P. A functional approach to the phylogeny of the pharyngognath teleosts. Am. Zool. 21 (1), 83-101 (1981).
- Anker, G. C. Morphology and kinetics of the head of the stickleback, Gasterosteus aculeatus. Trans. Zool. Soc. London. 32 (5), 311-416 (1974).
- Meyer, A. Morphometrics and allometry in the trophically polymorphic cichlid fish, Cichlusomu citrinelfum: Alternative adaptations and ontogenetic changes in shape. J. Zool., Lond. 221, 237-260 (1990).
- Huysseune, A. Phenotypic plasticity in the lower pharyngeal jaw dentition of Astatoreochromis alluaudi (Teleostei: Cichlidae). Arch. Oral Biol. 40 (11), 1005-1014 (1995).
- Muschick, M., Indermaur, A., Salzburger, W. Convergent Evolution within an adaptive radiation of cichlid fishes. Curr. Biol. 22 (24), 2362-2368 (2012).
- Cleves, P. A., et al. Evolved tooth gain in sticklebacks is associated with a cis-regulatory allele of Bmp6. Proc. Natl. Acad. Sci. 111 (38), 13912-13917 (2014).
- Ellis, N. A., et al. Distinct developmental and genetic mechanisms underlie convergently evolved tooth gain in sticklebacks. Development. (142), 2442-2451 (2015).
- Tucker, A. S., Fraser, G. J. Evolution and developmental diversity of tooth regeneration. Semin. Cell Dev. Biol. 25-26, 71-80 (2014).
- Erickson, P. A., Glazer, A. M., Cleves, P. A., Smith, A. S., Miller, C. T. Two developmentally temporal quantitative trait loci underlie convergent evolution of increased branchial bone length in sticklebacks. Proc. R. Soc. B. 281, (2014).
- Leary, S., et al. AVMA Guidelines for the Euthanasia of Animals. , American Veterinary Medical Association. Schaumburg, IL. (2013).
- Bell, M. A. Evolutionary phenetics and genetics. Evol. Genet. Fishes. , 431-528 (1984).
- Taylor, W. R., Van Dyke, G. C. Revised procedures for staining and clearing small fishes and other vertebrates for bone and cartilage study. Cybium. 9 (2), 107-119 (1985).
- Erickson, P. A., et al. A 190 base pair, TGF-β responsive tooth and fin enhancer is required for stickleback Bmp6 expression. Dev. Biol. 401 (2), 310-323 (2015).
- Miller, C. T., et al. cis-Regulatory changes in Kit ligand expression and parallel evolution of pigmentation in sticklebacks and humans. Cell. 131 (6), 1179-1189 (2007).
- Aigler, S. R., Jandzik, D., Hatta, K., Uesugi, K., Stock, D. W. Selection and constraint underlie irreversibility of tooth loss in cypriniform fishes. Proc. Natl. Acad. Sci. U. S. A. 111 (21), 7707-7712 (2014).
- Pasco-Viel, E., et al. Evolutionary trends of the pharyngeal dentition in Cypriniformes (Actinopterygii Ostariophysi). PLoS One. 5 (6), e11293(2010).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유