Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Вскрытие и Flat-крепление трёхиглая колюшка жаберных Skeleton
В этой статье
Резюме
The branchial skeleton, including gill rakers, pharyngeal teeth, and branchial bones, serves as the primary site of food processing in most fish. Here we describe a protocol to dissect and flat-mount this internal skeleton in threespine sticklebacks. This method is also applicable to a variety of other fish species.
Аннотация
The posterior pharyngeal segments of the vertebrate head give rise to the branchial skeleton, the primary site of food processing in fish. The morphology of the fish branchial skeleton is matched to a species' diet. Threespine stickleback fish (Gasterosteus aculeatus) have emerged as a model system to study the genetic and developmental basis of evolved differences in a variety of traits. Marine populations of sticklebacks have repeatedly colonized countless new freshwater lakes and creeks. Adaptation to the new diet in these freshwater environments likely underlies a series of craniofacial changes that have evolved repeatedly in independently derived freshwater populations. These include three major patterning changes to the branchial skeleton: reductions in the number and length of gill raker bones, increases in pharyngeal tooth number, and increased branchial bone lengths. Here we describe a detailed protocol to dissect and flat-mount the internal branchial skeleton in threespine stickleback fish. Dissection of the entire three-dimensional branchial skeleton and mounting it flat into a largely two-dimensional prep allows for the easy visualization and quantification of branchial skeleton morphology. This dissection method is inexpensive, fast, relatively easy, and applicable to a wide variety of fish species. In sticklebacks, this efficient method allows the quantification of skeletal morphology in genetic crosses to map genomic regions controlling craniofacial patterning.
Введение
Невероятное количество разнообразия существует в головном скелета у позвоночных, особенно у рыб. Во многих случаях это разнообразие облегчает различные стратегии кормления 1 - 4, и может включать в себя основные изменения внешней и внутренней краниофациальной кучность. Бранхиогенная скелет находится внутри в горле рыбы и окружает большую часть ротовой полости. Бранхиальных скелет состоит из 5 последовательно гомологичных участков, передней четыре из которых поддерживают жабры. Вместе эти пять сегментов функционируют в качестве связующего звена между рыбами и их пищей 5. Изменение множества признаков, включая жаберных тычинок, глоточных зубов, и жаберных костей способствуют эффективному нагула на различных видах пищи.
Колюшками подверглись адаптивную радиацию после исконных форм океанической колонизировали пресноводные озера и ручьи по всему Северному полушарию. Сдвиг в рационеот мелкого зоопланктона в океане крупную добычу в пресной воде привело к резкому изменению трофической в нескольких краниофациальных 6 черт. Хотя многие исследования были сосредоточены на внешних краниофациальных различий в колюшками 7 - 13, важные краниофациальные изменения развиваются неоднократно во внутренней жаберной скелета. Способность создавать плодовитые гибриды между морфологически различных популяций колюшки дает прекрасную возможность сопоставить генетическую основу эволюционировали изменений в жаберного скелета.
Одна трофическая черта экологического значения является структурирование жаберных тычинок, периодических кожных костей, что линия передней и задней грани жаберных костей и используются для фильтрации кормовых объектов. Рыба , которая , как правило , питаются мелкими КБУ , как правило, длиннее и более плотно расположенных жаберных тычинок по сравнению с рыбами , которые питаются большей добычей 14,15. Различия в жаберных тычинок было сообщено как шithin и между видами 14-19, а также аспекты жаберной Грабли кучность способствуют трофических ниш и фитнеса 16. Десятилетия исследований широко документированы число жаберных занижения и изменение длины в трехиглой колюшками 17 - 21; Тем не менее, эти исследования, как правило, сосредоточены на первом ряду жаберных тычинок. Недавние исследования показали , модульность в генетическом контроле числа жаберных Грабли через жаберной скелет 22,23 и через один ряд в жаберной граблями интервалы между 23 и длину 24 подчеркивает важность изучения более чем ряд один или один жаберных тычинка , чтобы понять развития генетической основой сокращения жаберных грабли.
Вторая трофическая черта как экологической и биомедицинской значение имеет структурирование глоточных зубов. Зубы у рыб могут быть расположены и в полости рта челюсти и в жаберной скелета, известный как глоточных зубов. Оральные зубов используются в основном для рв то время как захватить Рей глоточные зубы используются для жевания и жертвы манипуляции 25 - 27. Оба множества образуют через общие механизмы развития и считаются онтогенетически гомологичными 28. Интересная модульность происходит в результате чего некоторые виды, такие как данио, отсутствие полости рта и спинного глоточной зубов 29 в то время как другие виды имеют несколько зубчатыми ceratobranchials, pharyngobranchials, а иногда и зубчатым basihyal и hypobranchials 30. В колюшки, глоточные зубы встречаются вентрально на пятом ceratobranchial и дорсально на переднем и заднем pharyngobranchials 31. Кинематика по кормлению колюшки показывают пероральная челюсти используется в основном для захвата добычи и облегчения всасывания кормление 9 оставляя жевание в глоточной челюсти. В цихлид, нижняя челюсть морфология глоточной резко меняется 32,33 , и было показано , чтобы быть адаптивными и коррелировало с трофической ниши 34. многоPLE популяции пресноводной колюшки развивались резкое увеличение вентральной глоточной числу зубьев 23,35,36. Недавние исследования показали , что генетическая основа развития этого эволюционировала усиления зуба в значительной степени различны в двух независимо друг от друга популяциях пресноводных колюшки 36. В отличие от зубов млекопитающих, рыб регенерировать свои зубы непрерывно на протяжении всей взрослой жизни 37. Оба этих ранее описанных высоких популяций пресноводных зубчатыми развивались ускоренными темпами замены зуба, обеспечивая редкую систему позвоночных для изучения генетической основы регенерации 36.
Третья трофическая черта , которая развивалась неоднократно в пресноводных колюшки больше epibranchial и ceratobranchial кости, жаберные дуги сегментные гомологи верхней и нижней челюсти, соответственно 38. Более длинные кости жаберные придают большую щечной полости и, вероятно, являются адаптивными для обеспечения возможности более крупные объекты добычи, чтобы быть сonsumed. Кроме того, в других рыб, epibranchial кости имеют важное значение для депрессии зубных пластин спинной глоточной 25. Как жаберных тычинок и глоточных зубов, жаберных кости являются внутренними и, таким образом, трудно легко визуализировать или количественно.
Здесь мы представляем подробный протокол рассекать и телевизор с плоским смонтировать жаберный скелет, что позволяет легко визуализировать и количественно оценить разнообразие важных краниофациальных черт. В то время как этот протокол описывает колюшковые рассечение, этот же метод работает на множестве других рыб.
Access restricted. Please log in or start a trial to view this content.
протокол
Вся рыба работа была одобрена Institutional Animal Care и использования комитета Калифорнийского университета в Беркли (номер протокола R330) путем. Эвтаназии проводили с использованием погружения в 0.025% Tricaine-S забуференный 0,1% -ным раствором бикарбоната натрия 39. Все этапы выполняются при комнатной температуре.
1. Подготовка
Примечание: Выполните шаги 1.1-1.5 в конические пробирки или сцинтилляционные флаконы, которые могут запечатывать и плотно укладывать горизонтально. Рыбы не должны быть постоянно встряхивают, но попробуйте перемешать раствор как можно чаще аккуратно переворачивая или встряхивая стойку пробирки или флаконы, чтобы выставить все стороны рыбы к красящим раствором и позволяют пятно равномерно проникать в ткани. Не ставьте крупную партию рыбы на платформе шейкера, как тяжелый вес жидкости нарушит шейкер.
- Фикс либо свежую эвтаназии рыбу или рыбу, хранящуюся в этаноле с 10% нейтральном буферном растворе формалина (НСБ) в течение ночи. В качестве альтернативы, используйте 4% параформаальдегид в 1X PBS растворе вместо 10% NBF.
Примечание: Если извлечение ДНК, клип небольшую часть хвостового или грудные плавники, предшествующих фиксации и хранения в этаноле. - Утилизацию закрепить должным образом в химической капот и заменить водопроводной водой (то есть ~ рН 7,0) в течение 2 часов. Избегайте использования деионизированной воды, как это часто может быть кислой и может декальцинировать кость.
- Удалите воду и пятна рыбы с 0,008% ализарина Red S в 1% КОН в воде в течение 24 часов. Для рыбы менее 20 мм стандартной длины, используйте 0,004% Ализарин Red S. (Сделать 100x (0,8%) исходного раствора ализарин Red S, который затем может быть разбавлен).
- Удалить пятно (помещение в соответствующий контейнер с отходами в капот) и поместите рыбу в водопроводной воде в течение нескольких часов. Изменение воду по мере необходимости, пока промывочная вода не в основном ясно.
- Удалить воду и поместить рыбу в 50% глицерина, 0,25% KOH для легкой очистки и последующего расчленения.
Примечание: Этот протокол окрашивания изменяется от ранее описанных методов 40,41.
Примечание: На рисунке 1 обзор соответствующей головки скелетной морфологии.

Рисунок 1:. Голова Колюшка морфология скелета ализарин красный окрашенных трехиглой голову колюшки визуализируют с помощью флуоресценции при наборе родамина B фильтра. Полезная морфология маркирован: Op = opercle, Subop = subopercle, BSR, = Жаберные лучи, Preop = Предкрышечная, Infraorb 1-3 = Подглазничных 1-3 (также называемые circumorbitals или suborbitals), Dent = нижнечелюстных, Premax = ргаетахШаге, Макс = максилла , Nas = назальный, лат. ETHM = боковая решетчатая, Psph = РагазрпепоЫеит, Фрон = лобная кость. Для более подробного описания колюшки головы скелета см Anker (1974) 31. Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версиюэта фигура.
- Положите рыбу плоской (рис 2A) и вставьте щипцов Sharp # 5 часовщика в сторону глаза при ~ 45 ° , чтобы проколоть мембрану , покрывающую глаз.
- Очистите мембрану от глаза, подобно пилинга йогурт крышки (рис 2B).
- Вставьте открытые щипцов позади глаз, ухватиться зрительного нерва позади глаза, и удалить глаз (рис 2С). Не прокалывать глаз, как это будет протекать меланин. Если проколот, меланин может быть смыты в течение последующих шагов.
- Повторите с другой стороны.
- Начиная с задней, поместите одну маленькую рассечения ножницами лезвие под opercle лоскута, сопротивление ножничные лезвие спинке выше opercle, затем разрезать мягкие ткани до глазницы (рис 2D). Обрежьте дорсальнее opercle кости.
- Обрежьте лобную кость ( от спины к глазнице) (Рисунок 2E).
- Обрежьте средней линии РагазрпепоЫеит кости вокруг тон центр глазных впадин (рис 2F).
- Повторите opercle разрез на противоположной стороне.
- Вставьте щипцов под opercle и медленно корка лицо от тела, обрезка любой мягкой ткани все еще прикрепленную (рис 2G - H). Будьте осторожны, чтобы не нарушать первый ряд жаберных тычинок.
- С помощью пинцета, снять ceratohyals с обеих сторон от средней линии basihyal во время отслаивания и удаление передней черепно-лицевой скелет (всю челюсть в том числе нижнечелюстных, ргаетахШаге и челюстей; весь подъязычную каркаса, включающего внешнюю дермального opercle, предкрышечной, subopercle, и Жаберные лучи и лежащие в основе спинного и брюшного эндохондральный элементов, а также передняя часть черепа , включая носовые, боковые решетчатой и Подглазничных кости см на рисунках 1 и 2i).
- Брюшные колючки можно сложить из тела, и может служить в качестве ручки для щипцов ухватиться Oе если он присутствует. Шипы встанут на место. Чтобы разблокировать, осторожно потяните позвоночник с пинцетом непосредственно от тела рыбы, а затем аккуратно согнуть кзади нажать позвоночник плоской против рыбы.
- Вставьте закрытым пинцетом заднюю и вентральнее жаберной скелета (чуть ниже кишечной трубки) и перетащите щипцов кпереди, дразня друг от друга оставшиеся мышцы и связки , прикрепленные к жаберного скелета (рис 2J - K).
- Используя кончики закрытых щипцов, соскрести мышцы , крепящие спинной жаберный скелет к вентральной черепной коробкой в задней к передней направлении (рис 2 л).
- Повторите 2.9 и 2.10 на противоположной стороне.
- Возьмитесь за основание кишечной трубки и потяните вперед , чтобы удалить жаберный скелет и кишечной трубки (рис 2М - N).
- Отделить кишечной трубки путем перпендикулярную резки кзади от конца пятого ceratobranchial (рис 2O ).
- После удаления оставшихся костных фрагментов из черепной коробкой на спинной стороне жаберного скелета, вставьте ножницы в жаберной корзины , чтобы сделать спинной разрез (резка спереди назад) между двусторонними комплектами спинные зуба пластин (рис 3А - D). Обеспечить разрез по центру, чтобы не повредить спинной зуб пластины.
- Сделайте две мелкие боковые разрезы в каучуковых просвет кишечника на заднем конце жаберного скелета (передний конец кишечной трубки) , чтобы помочь с открытием жаберный скелет (рис 3E).
- Поместите рыбу и все кусочки ткани в банку и поместите жаберный скелет в микроцентрифужных пробирку с 50% глицерина, 0,25% KOH продолжать нежную очистку, или 100% глицерина, если не требуется дальнейшего посредничества. Этикетка банки и пробирки с уникальным идентификатором, таким образом они могут быть отслежены. Сумма клиринга требуется в значительной степени зависит от размера рыбы, большой взрослой рыбы (более 40 мм в стандартной длины), как правило, требуют дополнительной очистки.

Рис . 2: Колюшка бранхиогенная скелет рассечение Ализарин Красный окрашивали трёхиглая колюшка рыбы готовы к рассечение. Глаз депигментированная от обширной поляне. Синие стрелки указывают направление движения. (A) Боковой вид колюшки головы, передняя находится справа. (B) Удаление мембраны , покрывающей глаз. (С) Удаление глаза. (D) Спинной вырезать над opercle. (Е) лобной кости порез. (F) парасфеноид вырезать. (G - I) Удаление лицевого скелета. (J) Удаление брюшных жаберных скелета соединения мягких тканей. (K - L) Удаление спинных жаберных соединений скелета. (<сильный> M - N) Удаление жаберного скелета. (O) Отделить кишечной трубки от жаберного скелета. См шаги 2.1 через 2.16 для более подробной информации. Шкала бар = 5 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
3. Жаберный Скелет Повторное окрашивание (в случае необходимости)
- Для того, чтобы окрасить жаберный скелет темнее или сбросит ткани больше, удалить 50% глицерина, 0,25% -ного раствора КОН и промывают 1% -ного раствора КОН дважды (один пять минут стирки с последующей второй промывкой 24 ч при встряхивании в горизонтальном положении на платформе шейкера).
- Удалить 1% KOH и повторно пятно с 0,008% ализарина Red S в 1% КОН в течение 24 часов.
- Удалите пятна и заменить 1% КОН в течение 24 часов.
- Удалить раствор KOH и заменить 50% глицерина, 0,25% -ного раствора КОН.
4. Монтаж жаберных Skeleton
- Удалить жаберный скелетот 50% глицерина, 0,25% КОН или 100% глицерина и места вблизи дна х 60 мм покровным стеклом 22 мм с дорсальной стороной вверх (рис 3F). Добавьте несколько капель 50% глицерина, 0,25% КОН или 100% глицерина в верхней части жаберной скелета. Если переход от 50% глицерина, 0,25% KOH до 100% глицерина, изменение раствора в микроцентрифужных трубки и встряхивают в течение> 5 мин до монтажа уравновешиваться ткани.
- Раскатать два маленьких шариков пластилина и место на обоих концах покровным выступать в качестве разделителей.
- Неплотно разместить второй покровное на вершине с достаточным давлением , чтобы разгладить передний жаберный скелет (рис 3G).
- Пил открыть левый спинной щиток , включая спинных зуба пластин, придавить, и слайд между покровные (рис 3Н).
- Повторите прием с правым спинным щитком и толкать весь жаберный скелет от края покровного стекла (рис 3I).
- вносить измененияизначально, держать оба спинных закрылки открытые с пинцетом и аккуратно поместите покровное на, уплощение жаберный скелет одним плавным движением.
- В качестве альтернативы, смонтировать жаберный скелет вверх-вниз на одном покровным, splaying каждый спинной стороне вбок так, сила тяжести не позволяет бранхиогенная скелет, чтобы закрыть резервную копию. Затем накрыть второй 22 мм х 60 мм скольжением стеклянной крышкой и инвертировать преп.
Примечание: Различные методы монтажа, как правило, работают лучше или хуже для каждого человека. Попробуйте каждый и посмотреть, что чувствует себя наиболее комфортно.
- Слегка нажмите на верхнюю покровного выравниваться глиняные шары достаточно, чтобы держать жаберный скелет монтируется плоский, но будьте осторожны, чтобы не раздавить образца.
- В процессе монтажа, ceratobranchials может вращать и скрывать ряд тычинок. Способ устранения этого, сдвинув щипцов между покровные и переориентация на ceratobranchials или всего жаберной скелета.
- Хранить в плоские подготавливает лотках скольжения на роом температура. Установленный в 100% глицерина, Preps может храниться между мостиком покровные, по крайней мере, десять лет. Чистые щипцы и ножницы с изопропаноле или этаноле и советы крышку.
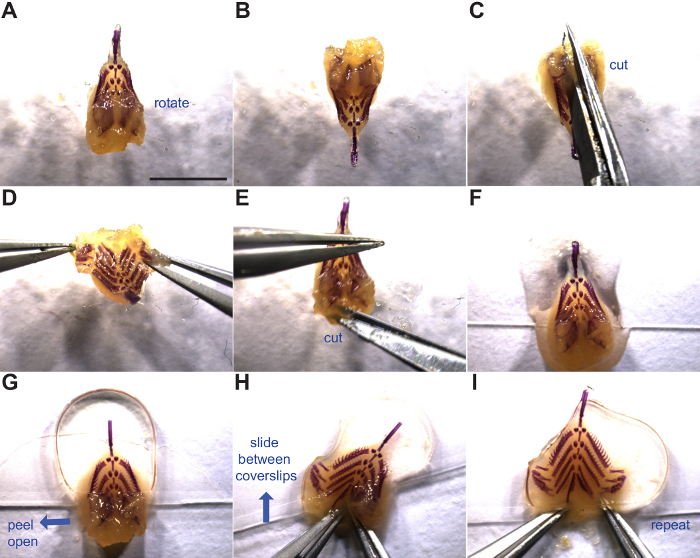
Рис . 3: Плоский монтаж жаберный скелет манипуляция и монтаж жаберного скелета показан. Синие стрелки указывают направление движения. (A) Жаберный скелет спинной стороной вверх. (B - D) Вращение и надрез между дорсальной зуба пластин. (E) Боковой вырез в мягких тканях , чтобы еще больше открыть основание кишечной трубки. (F) , Жаберный скелет помещается в нижней части покровным готов к установке. (G) Во- вторых покровное размещены на передней половине жаберного скелета (выше спинных пластин зуба). (H - I)Плоский монтаж жаберного скелета, открыв створки спинной зуб пластины и скольжения между двумя покровных стеклах. См шаги 4.1 через 4.6 для более подробной информации. Шкала бар = 5 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Это приводит протокол в расчлененный и плоской смонтированного жаберной скелета (рисунок 4) , где можно количественно определить целый ряд важных трофических черт. С спинной стороны , все ряды жаберных тычинок, все глоточной зубных пластин, и почти все жабе...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
The branchial skeleton is a complex set of bones in the throat of a fish that manipulates, filters, and masticates food items on their way to the esophagus. Many interesting trophic traits including the patterning of gill rakers, pharyngeal teeth, and branchial bones vary across and within species. The majority of these traits are difficult to near impossible to accurately measure with the branchial skeleton in situ (e.g., gill raker length, branchial bone length). This flat-mounting protocol places all...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was funded in part by NIH R01 #DE021475 to CTM and an NSF Graduate Research Fellowship to NAE. Thanks to Miles Johnson for assistance with imaging and Priscilla Erickson for critical reading of the manuscript.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Potassium Hydroxide (KOH) | EMD | PX1480-1 | |
| Glycerol | Sigma-Aldrich | G7893-4L | |
| 10% Neutral Buffered Formalin (NBF) | Azer Scientific | NBF-4-G | |
| Alizarin Red S | EMD | AX0485-3 | |
| Microscope Cover Glasses 22 mm x 60 mm | VWR | 16004-350 | |
| 100 mm x 10 mm Glass Petri Dish | Kimble Chase | 23064-10010 | To dissect samples on |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Can be poured into glass or plastic Petri dishes to make dissecting plates |
| Modeling Clay | Sargent Art | 22-4000 | 1 lb cream |
| Scintillation Vials (case of 500) | Wheaton | 986586 | Borosilicate Glass with Screw Cap |
| Forceps-Dumont #5 Inox (Biologie tip) | FST | 11252-20 | Dumostars are an alternative |
| Dissecting Scissors | FST | 15003-08 | Alternate sizes are available depending on size of sample |
| Dissecting Microscope | Leica | S6E with KL300 LED | Many other models work nicely, having a flat base helps |
| Microcentrifuge Tubes 1.7 ml | Denville | C2170 | |
| Cardboard slide tray | Fisher | 12-587-10 |
Ссылки
- Cooper, W. J., Westneat, M. W. Form and function of damselfish skulls: rapid and repeated evolution into a limited number of trophic niches. BMC Evol. Biol. 9 (24), (2009).
- Albertson, R. C., Kocher, T. D. Genetic and developmental basis of cichlid trophic diversity. Heredity. 97 (3), 211-221 (2006).
- Martin, C. H., Wainwright, P. C. Trophic novelty is linked to exceptional rates of morphological diversification in two adaptive radiations of cyprinodon pupfish. Evolution. 65 (8), 2197-2212 (2011).
- Wainwright, P. C., et al. The evolution of pharyngognathy: A phylogenetic and functional appraisal of the pharyngeal jaw key innovation in labroid fishes and beyond. Syst. Biol. 61 (6), 1001-1027 (2012).
- Sibbing, F. Food capture and oral processing. Cyprinid Fishes. , 377-412 (1991).
- Bell, M., Foster, S. The Evolutionary Biology of the Threespine Stickleback. , Oxford University Press. New York. (1994).
- Kimmel, C. B., et al. Evolution and development of facial bone morphology in threespine sticklebacks. Proc. Natl. Acad. Sci. U. S. A. 102 (16), 5791-5796 (2005).
- Mcgee, M. D., Wainwright, P. C. Convergent evolution as a generator of phenotypic diversity in threespine stickleback. Evolution. 67 (4), 1204-1208 (2013).
- McGee, M. D., Schluter, D., Wainwright, P. C. Functional basis of ecological divergence in sympatric stickleback. BMC Evol. Biol. 13, 277(2013).
- McGuigan, K., Nishimura, N., Currey, M., Hurwit, D., Cresko, W. A. Quantitative genetic variation in static allometry in the threespine stickleback. Integr. Comp. Biol. 50 (6), 1067-1080 (2010).
- Caldecutt, W. J., Bell, M. A., Buckland-Nicks, J. A. Sexual dimorphism and geographic variation in dentition of threespine stickleback, Gasterosteus aculeatus. Copeia. 2001 (4), 936-944 (2001).
- Berner, D., Moser, D., Roesti, M., Buescher, H., Salzburger, W. Genetic architecture of skeletal evolution in european lake and stream stickleback. Evolution. 68 (6), 1792-1805 (2014).
- Jamniczky, H. a, Barry, T. N., Rogers, S. M. Eco-evo-devo in the study of adaptive divergence: examples from threespine stickleback (Gasterosteus aculeatus). Integr. Comp. Biol. 55 (1), 166-178 (2015).
- Magnuson, J., Heitz, J. Gill raker apparatus and food selectivity among mackerels, tunas, and dolphins. Fish. Bull. 69 (2), 361-370 (1971).
- Kahilainen, K. K., et al. The role of gill raker number variability in adaptive radiation of coregonid fish. Evol. Ecol. 25 (3), 573-588 (2011).
- Arnegard, M. E., et al. Genetics of ecological divergence during speciation. Nature. 511 (7509), 307-311 (2014).
- Gross, H. P., Anderson, J. M., Gross, H. P., Anderson, J. Geographic variation in the gillrakers and diet of European threespine sticklebacks, Gasterosteus aculeatus. Copeia. 1984 (1), 87-97 (1984).
- Hagen, D., Gilbertson, L. Geographic variation and environmental selection in Gasterosteus aculeatus L in the Pacific Northwest, America. Evolution. 26 (1), 32-51 (1972).
- McPhail, J. D. Ecology and evolution of sympatric sticklebacks (Gasterosteus): morphological and genetic evidence for a species pair in Enos Lake, British Columbia. Can. J. Zool. 62 (7), 1402-1408 (1984).
- Schluter, D., McPhail, J. D. Ecological character displacement and speciation in sticklebacks. Am. Nat. 140 (1), 85-108 (1992).
- Robinson, B. Trade offs in Habitat-specific foraging efficiency and the nascent adaptive divergence of sticklebacks in lakes. Behaviour. 137 (7), 865-888 (2000).
- Glazer, A. M., Cleves, P. A., Erickson, P. A., Lam, A. Y., Miller, C. T. Parallel developmental genetic features underlie stickleback gill raker evolution. Evodevo. 5 (1), (2014).
- Miller, C. T., Glazer, A. M., et al. Modular skeletal evolution in sticklebacks is controlled by additive and clustered quantitative trait loci. Genetics. 197 (1), 405-420 (2014).
- Glazer, A. M., Killingbeck, E. E., Mitros, T., Rokhsar, D. S., Miller, C. T. Genome assembly improvement and mapping convergently evolved skeletal traits in sticklebacks with Genotyping-by-Sequencing. G3. 5, 1463-1472 (2015).
- Wainwright, P. Functional morphology of the pharyngeal jaw apparatus. Fish Physiol. Fish Biomech. , 77-102 (2006).
- Hulsey, C. D., Fraser, G. J., Streelman, J. T. Evolution and development of complex biomechanical systems: 300 million years of fish jaws. Zebrafish. 2 (4), 243-257 (2005).
- Lauder, G. Functional design and evolution of the pharyngeal jaw apparatus in euteleostean fishes. Zool. J. Linn. Soc. 77, 1-38 (1983).
- Fraser, G. J., et al. An ancient gene network is co-opted for teeth on old and new jaws. PLoS Biol. 7 (2), e1000031(2009).
- Stock, D. Zebrafish dentition in comparative context. J. Exp. Zool. B. Mol. Dev. Evol. 308, 523-549 (2007).
- Liem, K., Greenwood, P. A functional approach to the phylogeny of the pharyngognath teleosts. Am. Zool. 21 (1), 83-101 (1981).
- Anker, G. C. Morphology and kinetics of the head of the stickleback, Gasterosteus aculeatus. Trans. Zool. Soc. London. 32 (5), 311-416 (1974).
- Meyer, A. Morphometrics and allometry in the trophically polymorphic cichlid fish, Cichlusomu citrinelfum: Alternative adaptations and ontogenetic changes in shape. J. Zool., Lond. 221, 237-260 (1990).
- Huysseune, A. Phenotypic plasticity in the lower pharyngeal jaw dentition of Astatoreochromis alluaudi (Teleostei: Cichlidae). Arch. Oral Biol. 40 (11), 1005-1014 (1995).
- Muschick, M., Indermaur, A., Salzburger, W. Convergent Evolution within an adaptive radiation of cichlid fishes. Curr. Biol. 22 (24), 2362-2368 (2012).
- Cleves, P. A., et al. Evolved tooth gain in sticklebacks is associated with a cis-regulatory allele of Bmp6. Proc. Natl. Acad. Sci. 111 (38), 13912-13917 (2014).
- Ellis, N. A., et al. Distinct developmental and genetic mechanisms underlie convergently evolved tooth gain in sticklebacks. Development. (142), 2442-2451 (2015).
- Tucker, A. S., Fraser, G. J. Evolution and developmental diversity of tooth regeneration. Semin. Cell Dev. Biol. 25-26, 71-80 (2014).
- Erickson, P. A., Glazer, A. M., Cleves, P. A., Smith, A. S., Miller, C. T. Two developmentally temporal quantitative trait loci underlie convergent evolution of increased branchial bone length in sticklebacks. Proc. R. Soc. B. 281, (2014).
- Leary, S., et al. AVMA Guidelines for the Euthanasia of Animals. , American Veterinary Medical Association. Schaumburg, IL. (2013).
- Bell, M. A. Evolutionary phenetics and genetics. Evol. Genet. Fishes. , 431-528 (1984).
- Taylor, W. R., Van Dyke, G. C. Revised procedures for staining and clearing small fishes and other vertebrates for bone and cartilage study. Cybium. 9 (2), 107-119 (1985).
- Erickson, P. A., et al. A 190 base pair, TGF-β responsive tooth and fin enhancer is required for stickleback Bmp6 expression. Dev. Biol. 401 (2), 310-323 (2015).
- Miller, C. T., et al. cis-Regulatory changes in Kit ligand expression and parallel evolution of pigmentation in sticklebacks and humans. Cell. 131 (6), 1179-1189 (2007).
- Aigler, S. R., Jandzik, D., Hatta, K., Uesugi, K., Stock, D. W. Selection and constraint underlie irreversibility of tooth loss in cypriniform fishes. Proc. Natl. Acad. Sci. U. S. A. 111 (21), 7707-7712 (2014).
- Pasco-Viel, E., et al. Evolutionary trends of the pharyngeal dentition in Cypriniformes (Actinopterygii Ostariophysi). PLoS One. 5 (6), e11293(2010).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены