È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Dissezione e Flat-montaggio del Threespine Stickleback branchiale scheletro
In questo articolo
Riepilogo
The branchial skeleton, including gill rakers, pharyngeal teeth, and branchial bones, serves as the primary site of food processing in most fish. Here we describe a protocol to dissect and flat-mount this internal skeleton in threespine sticklebacks. This method is also applicable to a variety of other fish species.
Abstract
The posterior pharyngeal segments of the vertebrate head give rise to the branchial skeleton, the primary site of food processing in fish. The morphology of the fish branchial skeleton is matched to a species' diet. Threespine stickleback fish (Gasterosteus aculeatus) have emerged as a model system to study the genetic and developmental basis of evolved differences in a variety of traits. Marine populations of sticklebacks have repeatedly colonized countless new freshwater lakes and creeks. Adaptation to the new diet in these freshwater environments likely underlies a series of craniofacial changes that have evolved repeatedly in independently derived freshwater populations. These include three major patterning changes to the branchial skeleton: reductions in the number and length of gill raker bones, increases in pharyngeal tooth number, and increased branchial bone lengths. Here we describe a detailed protocol to dissect and flat-mount the internal branchial skeleton in threespine stickleback fish. Dissection of the entire three-dimensional branchial skeleton and mounting it flat into a largely two-dimensional prep allows for the easy visualization and quantification of branchial skeleton morphology. This dissection method is inexpensive, fast, relatively easy, and applicable to a wide variety of fish species. In sticklebacks, this efficient method allows the quantification of skeletal morphology in genetic crosses to map genomic regions controlling craniofacial patterning.
Introduzione
Una quantità incredibile di diversità esiste nello scheletro testa tra i vertebrati, soprattutto tra i pesci. In molti casi questa diversità facilita differenti strategie di alimentazione 1 - 4, e può comportare importanti modifiche sia modello craniofacciale esterna e interna. Lo scheletro branchiale è situato internamente nella gola di un pesce e circonda la maggior parte della cavità buccale. Lo scheletro branchiale comprende 5 segmenti omologhi serialmente, anteriore quattro delle quali supportano branchie. Insieme, queste cinque segmenti funzionano da interfaccia tra i pesci e il loro cibo 5. Variazione in una moltitudine di tratti, tra cui branchiospine, denti faringei, e le ossa branchiali contribuire a foraggiare efficace su diversi tipi di cibo.
Spinarelli sono stati sottoposti a una radiazione adattativa dopo forme ancestrali oceaniche colonizzati laghi d'acqua dolce e torrenti in tutto l'emisfero settentrionale. Il cambiamento nella dietadal piccolo zooplancton nell'oceano di grande preda in acqua dolce ha provocato drammatica variazione trofico in diversi tratti cranio-facciali 6. Mentre molti studi si sono concentrati sulle differenze cranio esterni in spinarelli 7 - 13, importanti cambiamenti cranio-facciali evolvono più volte nello scheletro branchiale interna. La possibilità di creare ibridi fecondi tra le popolazioni spinarello morfologicamente distinte offre un'eccellente opportunità per mappare la base genetica delle modifiche si sono evoluti per lo scheletro branchiale.
Una caratteristica trofico di importanza ecologica è il patterning di branchiospine, ossa dermiche periodici che costeggiano le facce anteriore e posteriore delle ossa branchiali e sono utilizzati per filtrare prede. I pesci che in genere si nutrono di piccoli oggetti preda tendono ad avere più a lungo e più densamente spaziati Gill rakers rispetto ai pesci che si nutrono sulla preda più grande 14,15. Variazione branchiospine stato segnalato sia wntro e tra le specie 14-19, e gli aspetti di Gill raker patterning contribuiscono a nicchie trofiche e fitness 16. Decenni di ricerche hanno ampiamente documentato numero Gill raker e variazione di lunghezza in spinarelli threespine 17 - 21; Tuttavia, questi studi in genere si concentrano sulla prima fila di branchiospine. Studi recenti hanno dimostrato modularità nel controllo genetico del numero branchiali raker attraverso lo scheletro branchiale 22,23 e attraverso una singola riga in branchiali raker spaziatura 23 e lunghezza 24 mettendo in evidenza l'importanza di studiare più di remare uno o un singolo rastrello branchia per capire il sviluppo basi genetiche della riduzione Gill raker.
Un secondo tratto trofico sia di importanza ecologica e biomedica è il patterning di denti faringei. Denti in pesci possono essere posizionati sia nella mascella orale e nello scheletro branchiale, noto come i denti faringei. denti orali sono utilizzati principalmente per prey catturare mentre denti faringei sono utilizzati per la masticazione e la preda manipolazione 25 - 27. Entrambi i gruppi si formano tramite meccanismi di sviluppo condivisi e sono considerati evolutivamente omologa 28. Modularità Interessante si verifica per cui alcune specie, come zebrafish, mancanza orale e della faringe dorsale denti 29, mentre le altre specie hanno più ceratobranchials dentate, pharyngobranchials, e talvolta dentate basihyal e hypobranchials 30. In spinarelli, denti faringei si trovano ventrale al quinto ceratobranchial e dorsalmente sul anteriore e posteriore pharyngobranchials 31. Cinematica di alimentazione stickleback mostrano la mascella orale viene utilizzato principalmente per la cattura la preda e facilitare l'alimentazione di aspirazione 9 lasciando la masticazione alla mascella faringea. In ciclidi, inferiore faringeo mascella morfologia varia notevolmente 32,33 e ha dimostrato di essere adattivo e correlato con nicchia trofica 34. MultiPLE popolazioni stickleback d'acqua dolce si sono evoluti gli aumenti drammatici nella ventrale faringea numero di denti 23,35,36. Studi recenti hanno dimostrato che la base genetica evolutiva di questo guadagno dente evoluto è in gran parte distinta in due popolazioni derivate indipendentemente spinarelli d'acqua dolce 36. A differenza di denti di mammiferi, pesci rigenerare i denti continuamente per tutta la vita adulta 37. Entrambe queste popolazioni di acqua dolce dentate alti precedentemente descritti si sono evoluti un tasso di sostituzione dei denti accelerato, fornendo un sistema di vertebrati rara per studiare le basi genetiche della rigenerazione 36.
Una terza caratteristica trofica che si è evoluta più volte in spinarelli d'acqua dolce è più ossa epibranchial e ceratobranchial, le branchiali omologhi arco ribassato della mascella superiore e inferiore, rispettivamente 38. Più lunghe ossa branchiali conferiscono una grande cavità orale e probabilmente sono adattativi per consentire prede più grandi per essere Consumed. Inoltre, in altri pesci, ossa epibranchial sono importanti per la depressione delle lastre dei denti dorsale faringei 25. Come rastrelli branchiali e denti faringei, le ossa branchiali sono interni e, quindi, difficile da visualizzare o quantificare facilmente.
Qui vi presentiamo un protocollo dettagliato per sezionare e TV a montare lo scheletro branchiale, consentendo una facile visualizzazione e la quantificazione di una varietà di importanti caratteristiche cranio-facciali. Mentre questo protocollo descrive una dissezione stickleback, questo stesso metodo funziona su una varietà di altri pesci.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti i lavori di pesce è stato approvato dal Comitato Istituzionale cura degli animali e l'uso della University of California-Berkeley (numero di protocollo R330). L'eutanasia è stata effettuata utilizzando immersione in 0,025% tricaine-S tamponata con 0,1% di bicarbonato di sodio 39. Tutte le fasi sono eseguite a temperatura ambiente.
1. Preparazione
Nota: Eseguire i passi 1.1-1.5 in tubi conici o fiale di scintillazione in grado di sigillare ermeticamente ed essere fissate in orizzontale. I pesci non devono essere costantemente scosso, ma cercare di miscelare la soluzione più spesso possibile capovolgendo delicatamente o agitando il rack di tubi o fiale per esporre tutti i lati del pesce alla soluzione colorante e consentire macchia di penetrare il tessuto in modo uniforme. Non posizionare una grande partita di pesce su un agitatore piattaforma, come il peso del liquido si romperà lo shaker.
- Fissare o pesce appena eutanasia o pesce conservato in etanolo al 10% neutra tamponata formalina (NBF) durante la notte. In alternativa, utilizzare il 4% Paraformaldeide in soluzione PBS 1x invece del 10% NBF.
Nota: se l'estrazione del DNA, clip di una piccola porzione di caudale o pinne pettorali prima della fissazione e conservare in etanolo. - Smaltire correttamente fix in una cappa chimica e sostituire con acqua di rubinetto (cioè ~ pH 7,0) per 2 ore. Evitare di utilizzare acqua deionizzata come spesso può essere acido e può decalcificazione ossea.
- Rimuovere l'acqua e pesce macchia con 0,008% Alizarina Rossa S in 1% KOH in acqua per 24 ore. Per il pesce meno di 20 mm di lunghezza standard, utilizzare 0.004% Alizarina Rossa S. (Fai un 100x (0,8%) soluzione madre di Alizarina Rossa S che possono poi essere diluita).
- Rimuovere macchia (mettendo in idoneo contenitore per rifiuti in cappuccio) e il luogo di pesce in acqua di rubinetto per pochi ore. Cambiare l'acqua, se necessario fino a quando l'acqua di risciacquo è per lo più chiara.
- Rimuovere l'acqua e il luogo di pesce in glicerolo al 50%, 0,25% KOH per la compensazione mite e la successiva dissezione.
Nota: Questo protocollo di colorazione viene modificato dai metodi descritti in precedenza 40,41.
Nota: Vedere la Figura 1 per una revisione delle pertinenti testa morfologia scheletrica.

Figura 1:. Stickleback testa morfologia scheletrica Alizarina Rossa macchiato testa Spinarello ripreso con fluorescenza sotto un set di filtri rodamina B. morfologia Utile è etichettato: Op = opercolo, Subop = subopercle, BSRS = branchiostegi raggi, preop = preopercolo, Infraorb 1-3 = infraorbitale 1-3 (chiamati anche circumorbitals o suborbitals), Dent = dentario, Premax = premaxilla, Max = mascellare , Nas = nasale, Lat. ETHM = etmoide laterale, Psph = parasphenoid, Fron = osso frontale. Per una descrizione più dettagliata della testa di scheletro spinarello, vedere Anker (1974) 31. Si prega di cliccare qui per vedere una versione più grandequesta figura.
- Appoggiare il pesce piatto (Figura 2A) e inserire pinze taglienti # 5 orologiai nel lato dell'occhio ad un angolo di ~ 45 ° per forare la membrana che ricopre l'occhio.
- Peel la membrana distanza dall'occhio, simile alla pelatura un coperchio yogurt (Figura 2B).
- Inserire una pinza aperta dietro l'occhio, afferrare del nervo ottico dietro l'occhio, e rimuovere l'occhio (Figura 2C). Non forare l'occhio in quanto perderà melanina. Se forato, la melanina può essere lavato via durante le fasi successive.
- Ripetere sull'altro lato.
- A partire dal posteriore, posizionare una piccola lama da dissezione forbice sotto il lembo opercolo, lama trascinare forbice dorsale sopra opercolo, quindi tagliare i tessuti molli fino alla cavità oculare (Figura 2D). Tagliare dorsale all'osso opercolo.
- Tagliare l'osso frontale (dorsale alla cavità oculare) (Figura 2E).
- Tagliare l'osso parasphenoid linea mediana intorno tegli centro delle orbite (Figura 2F).
- taglio opercolo Ripetere sul lato opposto.
- Inserire una pinza sotto l'opercolo e sbucciare lentamente la faccia lontano dal corpo, tagliare qualsiasi tessuto molle ancora attaccato (Figura 2G - H). Fare attenzione a non interrompere la prima fila di branchiospine.
- Con una pinza, staccare i ceratohyals su entrambi i lati del basihyal linea mediana, mentre staccando e rimuovendo lo scheletro cranio anteriore (l'intera mascella compreso il dentario, premaxilla, e della mascella, l'intero scheletro ioide compreso il opercolo dermico esterno, preopercolo, subopercle, e raggi branchiostegi e dorsale alla base e gli elementi endochondral ventrali, e la parte anteriore del cranio, compresi il naso, etmoide laterali e ossa infraorbitale, vedi figure 1 e 2I).
- spine pelvico possono essere ripiegati fuori dal corpo, e può servire come una maniglia per pinze per afferrare hold of quando presente. Spine bloccano in posizione. Per sbloccare, tirare delicatamente colonna vertebrale con una pinza direttamente via dal corpo di pesce, poi flettere leggermente posteriormente a premere schiena piatta contro il pesce.
- Inserire chiuso pinza posteriore e ventrale di scheletro branchiale (appena al di sotto del tubo intestinale) e pinze trascinare anteriormente, prendere in giro a parte i restanti muscoli e legamenti attaccati allo scheletro branchiale (Figura 2J - K).
- Utilizzando la punta delle pinze chiuse, raschiare via i muscoli connessi dorsale scheletro branchiale alla scatola cranica ventrale in un posteriore in direzione anteriore (Figura 2L).
- Ripetere 2.9 e 2.10 sul lato opposto.
- Afferrare la base del tubo intestinale e tirare anteriormente per rimuovere lo scheletro e intestino branchiale tubo (Figura 2 M - N).
- Separare il tubo intestinale effettuando un taglio perpendicolare posteriore alla fine del quinto ceratobranchial (Figura 2O ).
- Dopo aver rimosso eventuali frammenti ossei rimanenti dalla scatola cranica sul lato dorsale dello scheletro branchiale, inserire le forbici nel cestello branchiale per fare un taglio dorsale (taglio anteriore a posteriore) tra i set bilaterali di piatti dorsale dei denti (Figura 3A - D). Assicurarsi taglio è centrato per evitare di danneggiare le piastre dorsali dei denti.
- Fare due tagli laterali poco profonde nel lume intestinale gommose alla fine posteriore dello scheletro branchiale (estremità anteriore del tubo intestinale) per assistere con l'apertura dello scheletro branchiale (Figura 3E).
- Mettere pesce e tutti i pezzi di tessuto in un vaso e posizionare lo scheletro branchiale in una provetta con il 50% glicerolo, 0,25% KOH continuare compensazione dolce, o 100% glicerolo, se non è necessaria un'ulteriore compensazione. vasetti di etichette e tubi con un identificatore univoco in modo che possano essere monitorati. La quantità di compensazione previsto è in gran parte una funzione della dimensione del pesce, grandi pesci adulti (oltre 40 mm di lunghezza standard) in genere richiedono ulteriore compensazione.

Figura 2:. Stickleback branchiale scheletro dissezione Alizarina Rossa macchiato pesci Spinarello pronto per la dissezione. L'occhio è depigmented da un'ampia radura. Le frecce blu indicano la direzione del moto. (A) Vista laterale della testa spinarello, anteriore è a destra. (B) La rimozione della membrana che ricopre l'occhio. (C) La rimozione dell'occhio. (D) dorsale taglio sopra il opercolo. Taglio dell'osso (E) frontale. (F) Parasphenoid tagliato. (G - I) Rimozione dello scheletro facciale. (J) Rimozione delle connessioni dei tessuti molli scheletro branchiale ventrali. (K - L) Rimozione di dorsali connessioni scheletro branchiali. ( M - N) Rimozione dello scheletro branchiale. (O) Separare il tubo intestinale dallo scheletro branchiale. Vedere i punti da 2.1 a 2.16 per maggiori dettagli. Barra di scala = 5 mm. Clicca qui per vedere una versione più grande di questa figura.
3. branchiale scheletro Re-colorazione (se necessario)
- Per colorare la più scura scheletro branchiale o tessuto chiaro più, rimuovere il 50% glicerolo, soluzione di KOH 0,25% e lavare con 1% KOH due volte (un lavaggio cinque minute seguito da un secondo lavaggio 24 ore agitando orizzontalmente su un agitatore piattaforma).
- Rimuovere 1% KOH e ri-macchia con 0,008% Alizarina Rossa S in 1% KOH per 24 ore.
- Rimuovere macchia e sostituirlo con 1% KOH per 24 ore.
- Rimuovere la soluzione KOH e sostituirla con glicerolo al 50%, 0,25% KOH.
4. Montaggio branchiale scheletro
- Rimuovere scheletro branchialedal 50% glicerolo, 0,25% KOH o 100% glicerolo e posto vicino al fondo di un 22 mm x 60 millimetri copertura in vetro antiscivolo con lato dorsale rivolto verso l'alto (Figura 3F). Aggiungere qualche goccia di glicerolo al 50%, 0,25% KOH o 100% glicerolo in cima scheletro branchiale. Se la transizione dal 50% glicerolo, 0,25% KOH al 100% glicerolo, soluzione cambiamento in una provetta e agitare per> 5 min prima del montaggio per equilibrare il tessuto.
- Stendete due piccole sfere di plastilina e posto su una delle estremità del vetrino di agire come distanziatori.
- Liberamente posizionare un secondo vetrino in cima con una pressione sufficiente per appiattire lo scheletro branchiale anteriore (Figura 3G).
- Peel aprire lo sportello dorsale sinistra tra cui lastre dei denti dorsali, appiattire, e scorrevole tra le lamelle (Figura 3H).
- Ripetere la tecnica con diritto lembo dorsale e spingere intero scheletro branchiale lontano dal bordo del vetrino (Figura 3I).
- alterarenativamente, tenere entrambi i lembi dorsali aperti con una pinza e con attenzione inserire il vetrino su, appiattendo lo scheletro branchiale in un unico movimento fluido.
- In alternativa, montare lo scheletro branchiale a testa in giù su un vetrino, dispiegamento ogni lato dorsale lateralmente in modo gravità non permette lo scheletro branchiale per chiudere il backup. Poi coprire con il secondo 22 mm x 60 millimetri copertura in vetro antiscivolo e capovolgere prep.
Nota: diverse tecniche di montaggio tendono a lavorare meglio o peggio per ogni individuo. Prova ogni e vedere che cosa si sente più comodo.
- Premere leggermente sulla parte superiore vetrino per appiattire le palle d'argilla abbastanza per mantenere lo scheletro branchiale montato piatta, ma fare attenzione a non schiacciare il campione.
- Durante il processo di montaggio, ceratobranchials possono ruotare e oscurare una fila di rakers. Porre rimedio a questo da una pinza tra i coprioggetti e ri-orientare il ceratobranchials o l'intero scheletro branchiale scorrevole.
- Conservare prepara piatto in vassoi di diapositive a rotemperatura om. Montato in 100% glicerolo, preparazioni possono essere memorizzati tra lamelle a ponte per almeno un decennio. pinze pulite e forbici con isopropanolo o etanolo e suggerimenti copertura.
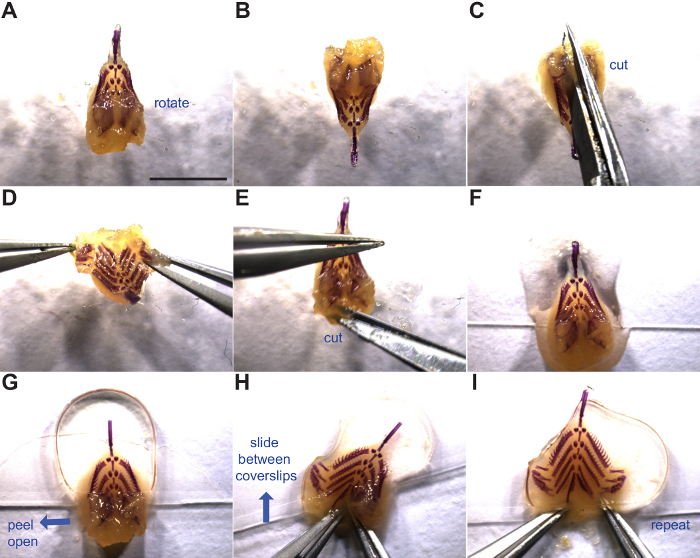
Figura 3:. Piatto di montaggio branchiale scheletro di manipolazione e di montaggio dello scheletro branchiale è mostrato. Le frecce blu indicano la direzione del moto. (A) branchiale scheletro dorsale verso l'alto. (B - D) Rotazione e incisione tra le piastre dorsali dente. (E) taglio laterale in tessuto molle per aprire ulteriormente la base del tubo intestinale. (F) branchiale scheletro posta sul fondo di un coprioggetto pronto per il montaggio. (G) Seconda coprioggetto posto sulla metà anteriore dello scheletro branchiale (sopra piastre dente dorsali). (H - I)montaggio piatto dello scheletro branchiale aprendo sportelli piastra dorsale denti e scorrevole tra due vetrini. Vedere i passaggi 4.1 tramite 4.6 per maggiori dettagli. Barra di scala = 5 mm. Clicca qui per vedere una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Questo protocollo si traduce in uno scheletro branchiale montato sezionato e piatta (Figura 4), dove una serie di importanti caratteristiche trofiche può essere quantificato. Dal punto di vista dorsale, tutte le righe di branchiospine, tutte le lastre della faringe denti, e quasi tutte le ossa branchiali possono essere facilmente visualizzati e quantificati 22 - 24,35,36,38,42. Alizarina Rossa S reagisce anche su rodamina o f...
Access restricted. Please log in or start a trial to view this content.
Discussione
The branchial skeleton is a complex set of bones in the throat of a fish that manipulates, filters, and masticates food items on their way to the esophagus. Many interesting trophic traits including the patterning of gill rakers, pharyngeal teeth, and branchial bones vary across and within species. The majority of these traits are difficult to near impossible to accurately measure with the branchial skeleton in situ (e.g., gill raker length, branchial bone length). This flat-mounting protocol places all...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was funded in part by NIH R01 #DE021475 to CTM and an NSF Graduate Research Fellowship to NAE. Thanks to Miles Johnson for assistance with imaging and Priscilla Erickson for critical reading of the manuscript.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Potassium Hydroxide (KOH) | EMD | PX1480-1 | |
| Glycerol | Sigma-Aldrich | G7893-4L | |
| 10% Neutral Buffered Formalin (NBF) | Azer Scientific | NBF-4-G | |
| Alizarin Red S | EMD | AX0485-3 | |
| Microscope Cover Glasses 22 mm x 60 mm | VWR | 16004-350 | |
| 100 mm x 10 mm Glass Petri Dish | Kimble Chase | 23064-10010 | To dissect samples on |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Can be poured into glass or plastic Petri dishes to make dissecting plates |
| Modeling Clay | Sargent Art | 22-4000 | 1 lb cream |
| Scintillation Vials (case of 500) | Wheaton | 986586 | Borosilicate Glass with Screw Cap |
| Forceps-Dumont #5 Inox (Biologie tip) | FST | 11252-20 | Dumostars are an alternative |
| Dissecting Scissors | FST | 15003-08 | Alternate sizes are available depending on size of sample |
| Dissecting Microscope | Leica | S6E with KL300 LED | Many other models work nicely, having a flat base helps |
| Microcentrifuge Tubes 1.7 ml | Denville | C2170 | |
| Cardboard slide tray | Fisher | 12-587-10 |
Riferimenti
- Cooper, W. J., Westneat, M. W. Form and function of damselfish skulls: rapid and repeated evolution into a limited number of trophic niches. BMC Evol. Biol. 9 (24), (2009).
- Albertson, R. C., Kocher, T. D. Genetic and developmental basis of cichlid trophic diversity. Heredity. 97 (3), 211-221 (2006).
- Martin, C. H., Wainwright, P. C. Trophic novelty is linked to exceptional rates of morphological diversification in two adaptive radiations of cyprinodon pupfish. Evolution. 65 (8), 2197-2212 (2011).
- Wainwright, P. C., et al. The evolution of pharyngognathy: A phylogenetic and functional appraisal of the pharyngeal jaw key innovation in labroid fishes and beyond. Syst. Biol. 61 (6), 1001-1027 (2012).
- Sibbing, F. Food capture and oral processing. Cyprinid Fishes. , 377-412 (1991).
- Bell, M., Foster, S. The Evolutionary Biology of the Threespine Stickleback. , Oxford University Press. New York. (1994).
- Kimmel, C. B., et al. Evolution and development of facial bone morphology in threespine sticklebacks. Proc. Natl. Acad. Sci. U. S. A. 102 (16), 5791-5796 (2005).
- Mcgee, M. D., Wainwright, P. C. Convergent evolution as a generator of phenotypic diversity in threespine stickleback. Evolution. 67 (4), 1204-1208 (2013).
- McGee, M. D., Schluter, D., Wainwright, P. C. Functional basis of ecological divergence in sympatric stickleback. BMC Evol. Biol. 13, 277(2013).
- McGuigan, K., Nishimura, N., Currey, M., Hurwit, D., Cresko, W. A. Quantitative genetic variation in static allometry in the threespine stickleback. Integr. Comp. Biol. 50 (6), 1067-1080 (2010).
- Caldecutt, W. J., Bell, M. A., Buckland-Nicks, J. A. Sexual dimorphism and geographic variation in dentition of threespine stickleback, Gasterosteus aculeatus. Copeia. 2001 (4), 936-944 (2001).
- Berner, D., Moser, D., Roesti, M., Buescher, H., Salzburger, W. Genetic architecture of skeletal evolution in european lake and stream stickleback. Evolution. 68 (6), 1792-1805 (2014).
- Jamniczky, H. a, Barry, T. N., Rogers, S. M. Eco-evo-devo in the study of adaptive divergence: examples from threespine stickleback (Gasterosteus aculeatus). Integr. Comp. Biol. 55 (1), 166-178 (2015).
- Magnuson, J., Heitz, J. Gill raker apparatus and food selectivity among mackerels, tunas, and dolphins. Fish. Bull. 69 (2), 361-370 (1971).
- Kahilainen, K. K., et al. The role of gill raker number variability in adaptive radiation of coregonid fish. Evol. Ecol. 25 (3), 573-588 (2011).
- Arnegard, M. E., et al. Genetics of ecological divergence during speciation. Nature. 511 (7509), 307-311 (2014).
- Gross, H. P., Anderson, J. M., Gross, H. P., Anderson, J. Geographic variation in the gillrakers and diet of European threespine sticklebacks, Gasterosteus aculeatus. Copeia. 1984 (1), 87-97 (1984).
- Hagen, D., Gilbertson, L. Geographic variation and environmental selection in Gasterosteus aculeatus L in the Pacific Northwest, America. Evolution. 26 (1), 32-51 (1972).
- McPhail, J. D. Ecology and evolution of sympatric sticklebacks (Gasterosteus): morphological and genetic evidence for a species pair in Enos Lake, British Columbia. Can. J. Zool. 62 (7), 1402-1408 (1984).
- Schluter, D., McPhail, J. D. Ecological character displacement and speciation in sticklebacks. Am. Nat. 140 (1), 85-108 (1992).
- Robinson, B. Trade offs in Habitat-specific foraging efficiency and the nascent adaptive divergence of sticklebacks in lakes. Behaviour. 137 (7), 865-888 (2000).
- Glazer, A. M., Cleves, P. A., Erickson, P. A., Lam, A. Y., Miller, C. T. Parallel developmental genetic features underlie stickleback gill raker evolution. Evodevo. 5 (1), (2014).
- Miller, C. T., Glazer, A. M., et al. Modular skeletal evolution in sticklebacks is controlled by additive and clustered quantitative trait loci. Genetics. 197 (1), 405-420 (2014).
- Glazer, A. M., Killingbeck, E. E., Mitros, T., Rokhsar, D. S., Miller, C. T. Genome assembly improvement and mapping convergently evolved skeletal traits in sticklebacks with Genotyping-by-Sequencing. G3. 5, 1463-1472 (2015).
- Wainwright, P. Functional morphology of the pharyngeal jaw apparatus. Fish Physiol. Fish Biomech. , 77-102 (2006).
- Hulsey, C. D., Fraser, G. J., Streelman, J. T. Evolution and development of complex biomechanical systems: 300 million years of fish jaws. Zebrafish. 2 (4), 243-257 (2005).
- Lauder, G. Functional design and evolution of the pharyngeal jaw apparatus in euteleostean fishes. Zool. J. Linn. Soc. 77, 1-38 (1983).
- Fraser, G. J., et al. An ancient gene network is co-opted for teeth on old and new jaws. PLoS Biol. 7 (2), e1000031(2009).
- Stock, D. Zebrafish dentition in comparative context. J. Exp. Zool. B. Mol. Dev. Evol. 308, 523-549 (2007).
- Liem, K., Greenwood, P. A functional approach to the phylogeny of the pharyngognath teleosts. Am. Zool. 21 (1), 83-101 (1981).
- Anker, G. C. Morphology and kinetics of the head of the stickleback, Gasterosteus aculeatus. Trans. Zool. Soc. London. 32 (5), 311-416 (1974).
- Meyer, A. Morphometrics and allometry in the trophically polymorphic cichlid fish, Cichlusomu citrinelfum: Alternative adaptations and ontogenetic changes in shape. J. Zool., Lond. 221, 237-260 (1990).
- Huysseune, A. Phenotypic plasticity in the lower pharyngeal jaw dentition of Astatoreochromis alluaudi (Teleostei: Cichlidae). Arch. Oral Biol. 40 (11), 1005-1014 (1995).
- Muschick, M., Indermaur, A., Salzburger, W. Convergent Evolution within an adaptive radiation of cichlid fishes. Curr. Biol. 22 (24), 2362-2368 (2012).
- Cleves, P. A., et al. Evolved tooth gain in sticklebacks is associated with a cis-regulatory allele of Bmp6. Proc. Natl. Acad. Sci. 111 (38), 13912-13917 (2014).
- Ellis, N. A., et al. Distinct developmental and genetic mechanisms underlie convergently evolved tooth gain in sticklebacks. Development. (142), 2442-2451 (2015).
- Tucker, A. S., Fraser, G. J. Evolution and developmental diversity of tooth regeneration. Semin. Cell Dev. Biol. 25-26, 71-80 (2014).
- Erickson, P. A., Glazer, A. M., Cleves, P. A., Smith, A. S., Miller, C. T. Two developmentally temporal quantitative trait loci underlie convergent evolution of increased branchial bone length in sticklebacks. Proc. R. Soc. B. 281, (2014).
- Leary, S., et al. AVMA Guidelines for the Euthanasia of Animals. , American Veterinary Medical Association. Schaumburg, IL. (2013).
- Bell, M. A. Evolutionary phenetics and genetics. Evol. Genet. Fishes. , 431-528 (1984).
- Taylor, W. R., Van Dyke, G. C. Revised procedures for staining and clearing small fishes and other vertebrates for bone and cartilage study. Cybium. 9 (2), 107-119 (1985).
- Erickson, P. A., et al. A 190 base pair, TGF-β responsive tooth and fin enhancer is required for stickleback Bmp6 expression. Dev. Biol. 401 (2), 310-323 (2015).
- Miller, C. T., et al. cis-Regulatory changes in Kit ligand expression and parallel evolution of pigmentation in sticklebacks and humans. Cell. 131 (6), 1179-1189 (2007).
- Aigler, S. R., Jandzik, D., Hatta, K., Uesugi, K., Stock, D. W. Selection and constraint underlie irreversibility of tooth loss in cypriniform fishes. Proc. Natl. Acad. Sci. U. S. A. 111 (21), 7707-7712 (2014).
- Pasco-Viel, E., et al. Evolutionary trends of the pharyngeal dentition in Cypriniformes (Actinopterygii Ostariophysi). PLoS One. 5 (6), e11293(2010).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon