Method Article
Ökaryotik Hücrelerde gelen ekstrakromozomal dairesel DNA genom Arıtma
Bu Makalede
Özet
This paper presents a sensitive method called Circle-Seq for purifying extrachromosomal circular DNA (eccDNA). The method encompasses column purification, removal of remaining linear chromosomal DNA, rolling-circle amplification and high-throughput sequencing. Circle-Seq is applicable to genome-scale screening of eukaryotic eccDNA and studying genome instability and copy-number variation.
Özet
Ekstrakromozomal dairesel DNA'lar (eccDNAs) Saccharomyces cerevisiae'de yaygın genetik elemanlar ve hem de diğer ökaryotlarda bildirilmektedir. EccDNAs çok hücreli organizmalarda somatik hücreler arasında ve tek hücreli ökaryotlar evrimi genetik varyasyon katkıda bulunur. eccDNA tespit edilmesi için hassas yöntemler bu elemanlar genom stabilite ve ne çevreye ve biyolojik faktörlerin ökaryotik hücrelerde bunların oluşumuna neden nasıl etkilediğini açıklık için ihtiyaç vardır. Bu video Çember-Seq denilen duyarlı eccDNA-arıtma yöntemi sunar. yöntem dairesel DNA, lineer kromozomal DNA, eccDNA haddeleme daire amplifikasyon, derin sıralama ve haritalama kalan çıkarılması sütun arıtma kapsar. Kapsamlı eksonükleaz tedavi yeterli doğrusal kromozomal DNA bozulması için gerekli oldu. tarafından yuvarlanma daire amplifikasyon adımine-height:. Normal; "10 10 hücrelerinin üç S. cerevisiae CEN.PK popülasyonlar üzerinde Çember-Seq yönteminin> doğrusal DNA üzerinde dairesel DNA için zenginleştirilmiş φ 29 polimeraz Doğrulama 1 kilobaz daha büyük boyutlarda eccDNA profilleri yüzlerce tespit . ASP3-1, COS111, CUP1, RSC30, HXT6, S288c ve CEN.PK DNA daireselleştiğini bu odakta suşları arasında muhafaza edilir önerir hem de dairesel DNA HXT7 genler. Özetle tekrarlanan bulgular, Çember-Seq yöntem geniş vardır ökaryotlarda ve belirli eccDNA türlerini tespit etmek için eccDNA genom ölçekli tarama uygulaması.
Giriş
Bu büyük hücre popülasyonunda tek bir DNA molekülü değişiklikleri tespit gerektirdiği için, erken ya da geçici kromozomal amplifikasyonu algılama zordur. Kromozom kopya sayısı varyasyonları (CNVs) genellikle varyasyonu 1,2 oluşturulan mekanizmanın delil olarak sadece son CNV yapısını bırakarak, onların kurulmasından sonra iyi tespit edilir. Algılama ve genomik düzenlenmeleri devam eden süreçleri aydınlatmak olabilir KNV oluşumunun erken dönemlerinde ekstrakromozomal dairesel DNA (eccDNA) geri kazanılması.
Daha önce, eccDNA de novo buluş, elektron mikrograflar 3, metafaz kromozomlarda 4 veya iki boyutlu jel elektroforezi 5 Giemsa lekelemesi uygulanmıştır. Bu yöntemler, dairesel DNA sekansı ile ilgili çok az ya da hiç bir bilgi sağlar. Böyle Güney yerinde hybridizatio PCR 8, ters 6,7 veya floresan kurutma olarak hedeflenen tekniklern 9 yalnızca belirli eccDNA elemanları hakkında kanıt sağlar. Bu yöntemlerden hiçbiri, bir hücre popülasyonunda var olan tüm eccDNA türleri dizisini sağlar.
Hücrelerin bir havuzda genomik ayrışmanın genom dizileme ve / veya fayans dizileri 10,11 ile karakterize edilebilir. Bilinen DNA arındırma yöntemleri ile silme veya amplifikasyon algılama genellikle mutasyona uğramış alel hücre popülasyonu 12,13 en azından% 0.1-1 temsil gerektirir. Asentrik eccDNAs dolayı sentromer olmaması ve çoğaltma DNA sentezinin muhtemel olmaması, bir hücre kültüründe daha geçici olması beklenmektedir. En eccDNAs tahminen düşük miktarlarda bulunan ve sekanslar, genom benzediği Böylece, alternatif bir DNA ekstraksiyon yöntemleri eccDNAs tespit etmek için gereklidir.
Birkaç dairesel DNA saflaştırma teknikleri kromozomlar ve dairesel DNA arasındaki yapısal farklılıkları istismar. örneğin, yüksek hızlı ultracentrifug içinsezyum klorür gradyanlar tirme, insan HeLa kanser hücre hattı 14 350-3000 baz çifti (bp), büyük eccDNAs izole etmek için kullanılır. Ancak, yüksek hız sedimantasyon hızı 15 ve eccDNA verim değiştirerek, nick, süper dairesel DNA yapılarının omurgasını kırmak ya da olabilir. Dutta ve arkadaşları de novo fare dokularından ve tavuk kültürler ve insan hücreleri 16,17 dairesel DNA genom ölçekli tanımlama için bir yöntem geliştirdi. Bu yöntem plazmid saflaştırma ve enzimatik reaksiyonların ve DNA ekstraksiyon birkaç tur izledi sakaroz Ultrasantrifügasyon tarafından homojenize dokudan çekirdeklerin çekilmesidir. Bunların protokolü öncelikle 200-400 bp'lik eccDNAs, adı microDNAs tanımlar. Dutta ve arkadaşları da Saccharomyces cerevisiae gelen microDNAs saflaştırılması çalıştı, ancak bu maya türlerinin 16 microDNA kayıt koyamadık.
Biz yeni bir yöntem için geliştirdiğimizÇember-Seq denilen maya eccDNA de novo tespiti. Bu yöntem bütün genleri taşımak için yeterince büyük ve 86 kilobaz (kb) mitokondriyal DNA (mtDNA) gibi büyük dairesel DNA molekülleri için genom ölçekli anketler sağlar. Yuvarlak-Seq yöntemi ökaryotik maya hücreleri için optimize edilmiş ve derin dizilemesi ile birlikte, iyi kurulmuş bir prokaryotik plazmid saflaştırma yöntemi 18,19 geliştirilmiştir. Çember-Seq yaklaşım, 1756 farklı eccDNAs, tüm 1'den büyük kb kullanarak, on S'den saptandı cerevisiae S288c 20 nüfustur. Bir boyut kesme bütün genleri taşımak için yeterince büyük olduğunu eccDNA odaklanmak için seçildi. Yuvarlak-Seq çok hassas olduğu; Bu hücreler 20 bin içinde tek eccDNA tespit edildi. Bu çalışmada, daire-Seq yalıtmak ve başka S. üç biyolojik çoğaltır 294 eccDNAs tanımlamak için kullanıldı cerevisiae maya cinsi, CEN.PK. Veri eccDNA yaygın bir genetik eleme olduğunu ortaya koymaktadırS. nt cerevisiae suşları.
Protokol
Not: dairesel DNA saflaştırma ve dizileme yöntemi (daire-Seq) bir genel görünüşü Şekil 1'de gösterilmiştir.
1. Yetiştirme, Hücre Hasat ve Plazma Membran bozulması
- Maya Pepton Dekstroz, 50 ml tam bir besin ortamı (YPD) içine bir O / N kültüründen (örneğin Saccharomyces cerevisiae), maya hücreleri inoküle. 1-3 x 10 5 hücre / ml 'lik bir düşük bir başlangıç hücre yoğunluğu ya da yaklaşık olarak 0.01 OD 600 bir optik yoğunlukta inoküle.
- Hücreler, yaklaşık 24 saat veya OD 600> 10.0 bir optik yoğunluk 48 sonra yaklaşık olarak 1 x 10 10 hücrelerin maksimum hücre yoğunluğu ulaşana kadar dakika (rpm), 150 mermi ajitasyon ile 30 ° C 'de inkübe hücreleri.
NOT: düşük hücre konsantrasyonları kullanılabilir gibi kültür süresi önemli değildir.
- Hücreler, yaklaşık 24 saat veya OD 600> 10.0 bir optik yoğunluk 48 sonra yaklaşık olarak 1 x 10 10 hücrelerin maksimum hücre yoğunluğu ulaşana kadar dakika (rpm), 150 mermi ajitasyon ile 30 ° C 'de inkübe hücreleri.
- 50 ml konik tüp geçmek kültürü transfer santrifüj ile hücreler pelet800 xg 3 dakika ve supernatant atın.
- 3 dakika boyunca 800 x g'de santrifüj ile hücreler yeniden pelet ve supernatant atın, 10 mM Tris-Cl, 1 mM EDTA, pH 8.0 25 mi tampon solüsyonu ile pelet yıkayın.
- bir plasmid sütun saflaştırma kiti temin 1.2 ml yeniden süspansiyon tamponunda hücre pelletini.
- İsteğe bağlı adım: dairesel DNA elemanlarının 20 arıtılması için kontrol olarak son derece sulandırılmış plazmidler ekleyin.
Not: Mevcut veri kümesinde, bir 7.7 ul plazmit karışımı 10 10 hücreleri ihtiva eden her bir örnek için uygulanmıştır. plazmid stok karışımı farklı konsantrasyonlarda üç plazmid oluşuyordu; 0.01 ng / numune 38 ng / numune de pBR322, pUC19 0.5 ng / numune de, ve pUG72. - Toplam süspansiyon hacmi: 3 oranında 2 ml iki mikro santrifüj tüplerine hücre süspansiyonu transfer her biri bir 1, 0.5 mm cam boncuklar ile takviye edilmiştir.
- Plazma hücresi bozmaya 10 dakika vorteksleyin, maksimum hızda, her tüpMembranlar. 30 saniye için 268 x g'de santrifüj ile boncuk pelet ve yeni bir tüpe mikrosantrfuj tübüne 1.2 mL birleştirilmiş süpernatant aktarın.
Not: Alternatif 0.6 mi yeniden süspansiyon tamponu çözeltisi içinde Hücrelerin yerinden oynaması için zymolyase kullanarak, 1.6-1.7 adım. Zymolyase on adet 35 ° C'de 1.5 saat içerisinde 5 x 10 7 hücre bozabilir.
Kolon Kromatografisi 2. EccDNA Zenginleştirme
- plazmid kolon saflaştırılması için bir kit protokolü uygulayın. Kısaca, 1.2 mi alkalin çözelti ile her bir örnek tedavi yavaşça karıştırın ve oda sıcaklığında 3 dakika kuluçkalayın.
- 1.2 mi nötralizasyon tampon ekleme 5 dakika boyunca 9650 x g'de yumuşak ve santrifüj karıştırın.
- 1 mi, dengeleme çözeltisi ile dengelenmiş bir sütun üzerine çözelti yük ve sıvı yerçekimi ile sütun dolaşmasını sağlar.
- 4 ml yıkama çözeltisi ile sütun yıkayın. çözelti, reçine geçtikten sonra, dikkatli bir şekilde 0.3 ml elüsyon şekilde eklemedökülmesinden 0.35 mi kolonu boş hacim çok değiştirmek için kullanılır.
- 1 mi yıkama çözeltisi ile yeni bir toplama tüpüne DNA Zehir 0.8 mi çöktürme karışımı ekleyerek çökelti DNA. 10 dakika boyunca 9650 x g'de santrifüjleyin.
- 5 ila 15 dakika boyunca 5 dakika hava Kuru 9650 xg'de 0.5 mi,% 70 etanol, santrifüj ile DNA pelet yıkayıp 25 ul steril su içinde saflaştırılmış DNA çözülür.
NOT: Suda DNA sadece kısa süreli depolama tavsiye edilir. Tercihen, adım 3'e doğrudan geçin.
3. Sindirim Doğrusal kromozomal DNA'nın kalan
- İsteğe bağlı adım: ekzonükleaz ile doğrusal DNA spesifik sindirimi kolaylaştırmak gibi Notl gibi nadir kesici endonükleaz ile saflaştırılmış DNA tedavisi için. 5 ug DNA için, 50 ul toplam hacim 1 birim Notl, 5 ul 10x sindirim tampon ve steril su kullanın. 16 saat ve ısı 37 ° C 'de reaksiyon inkübe 5 dakika boyunca 80 ° C' de endonükleaz etkisiz hale getirirler.
- 20 eklebirim ekzonükleaz (2 ul), 4 ul ATP (25 mM), 34 ul steril su ve 50 ul Endonükleaz'a klivaj DNA'ya doğrudan 10 ul 10x reaksiyon tamponu ATP-bağımlı Eksonükleaz kullanılarak 100 ul 1x reaksiyon hacmi ulaşmak kiti.
- 5 gün veya daha fazla, 37 ° C de, doğrusal tek sarmallı ve çift sarmallı DNA hidrolizi gerçekleştirmek. Ek bir 4 ul ATP (25 mM), 0.6 ul 10 x reaksiyon tamponu ve 1 x reaksiyon hacmi enzimatik sindirim, DNA devam her 24 saatte egzonükleaz 20 birimleri ekleyin.
- Lineer DNA çıkarılmasından sonra eksonükleaz ile muamele edilen çözelti örnek 2 ul aktin geni ACT1 20 bir kromozom işaretleyici kullanılarak niceliksel polimeraz zincir reaksiyonu (qPCR), kromozom lineer DNA kaldırılması teyit etmek için.
- Her 20 ul qPCR reaksiyon hacmi 2 ul eksonükleaz ile muamele edilmiş numune, 150 nM ACT1 primerleri 5'-TCCGTCTGGATTGGTGGTTCTA-3 've 5'-TGGACCACTTTCGTC içerirGTATTC-3 ',% 2 (hacim / hacim) dimetil sülfoksit ve 10 | il yeşil fluoresan ana karışımı.
- Reaksiyon koşulunu kullanın; 95 ° C'de 15 saniye 45 döngü, 60 ° C'de 30 saniye, ardından 95 ° C'de 3 dakika,.
NOT: Bu gen kopya sayısı değişimleri, böylece eccDNA Act1 taşıyan olmamalıdır 21-23 zararlı olduğundan ACT1 lineer DNA için özellikle uygun bir belirtecidir. - qPCR DNA parçalanması analizinde alternatifleri, standart PCR (4.3) ya da propidyum iodid koyulaştırması (4.4) vardır.
- ACT1 primerleri 5'-TGGATTCTGGTATGTTCTAGC-3 've-GAACGACGTGAGTAACACC-3 5' 'PCR şablon olarak 2 ul eksonükleaz ile muamele edilmiş numune kullanılır. Pozitif ACT1 kontrol olarak, genomik S. ng 50-100 kullanın şablon olarak S. cerevisiae bir DNA. PCR reaksiyon koşulları; 95 ° C'de, 56 ° C'de 30 saniye ve 72 ° C'de 1 dakika 30 saniye 35 döngü, ardından 95 ° C'de 3 dakika,.
- Jel electrophore Run PCR reaksiyonları0.5 ug% 1 agaroz üzerinde sis / ml etidyum bromür. 0.8 kb ACT1 bandı için arayın.
- yokluğu veya lineer DNA varlığı, önce, ve DNA amplifikasyonundan sonra, propidyum iyodür boyaması yolu ile kontrol edilebilir.
- 20 mM propidyum iyodid stokunun 1.000 H2O ile seyreltilmiş çözelti bir 1: 1 hacim: 1, her bir DNA numunesi karıştırın. Oda sıcaklığında 10-20 dakika süreyle karanlıkta çözüm bırakın ve 663-738 nm ve 5 ila 30 saniye arasında bir pozlama zamanında kırmızı uyarma floresan filtre kullanarak 100x büyütmede floresan mikroskobu ile DNA boyama analiz. DNA boyama kontrol olarak kullanımı maya ve / veya ø29 amplifikatörlü plazmid genomik DNA ø29-amplifikasyonuna tabi tutulabilir.
- Isı 30 dakika boyunca 70 ° C'de ekzonükleaz çözeltisi etkisiz hale getirirler.
4. DNA amplifikasyonu
- Saflaştırılmış yükseltmek ve ø29 DNA polimeraz 24-26 anlaşmanın ile adım 3.5) den eccDNA zenginleştirilmişpolimeraz, üretici protokolüne ing.
- Kısaca, 5 ul denatürasyon tamponu ile eccDNA zenginleştirilmiş 5 ul karıştırın.
- Oda sıcaklığında 3 dakika sonra, 10 ul nötralizasyon tampon eklemek. İyice karıştırın ve 29 ul reaksiyon tamponu ve 1 ul ø29 DNA polimeraz içeren 30 ul ana karışımı ekleyin. (72 saat kadar), 16 saat ya da daha fazla süreyle 30 ° C 'de reaksiyon inkübe edin. Grup 3 dakika boyunca 65 ° C sıcaklıkta ø29 DNA polimeraz etkisiz hale getirirler.
5. Sıralama ve Veri Analizi
- 300 bp bir ortalama hedef pik boyutuna odaklanmış ultrasonikatör ile yükseltilmiş eccDNA kayma. 130 ul DNA örneği için aşağıdaki ayarları kullanın: 450W tepe yoğunluğu gücü, 60 sn tedavi,% 30 görev faktörü, patlama başına 200 devir, sıcaklık 7 ° C.
- parçalanmış kütüphane hazırlanması için uygun bir yöntem kullanılarak, dizileme için kütüphanelerin sentezi için okur barkod indeksi etiketleri ve adaptörleri ekleyin.
- 141-nükleotid tek-uçlu yüksek verimli bir dizi platformunda okur örneğin, derin sıralama çalıştırın.
- Harita soruşturma altında maya referans genomuna okur ve izin birden fazla bölgelere eşleştirmek için okur. Örneğin, bir serbestçe kullanılabilir iş akışı sistemi 27,28 ve kısa okuma hizalama haritalama yazılımı 29 kullanın.
- Tespit boşlukları 20 olmadan, örneğin, birden fazla ardışık yedi okur okur bitişik (> 1 kb) ile farazi eccDNAs bölgeleri okur.
NOT: Yazılım kullanılabilir eşlenen keşfetmek için 27,28 ilgi genomik bölgelerde okur.
Sonuçlar
Yuvarlak-Seq yöntemi üç S doğrulamak için Hücreler, on kuşaktır YPD ayrı büyütüldü sonra 1 10 x 10 hücre cerevisiae CEN.PK popülasyonları elenmiştir. Daha önce 20 (veriler gösterilmemiştir), tarif edildiği gibi kromozomal doğrusal DNA kaldırılması, bir qPCR ACT1 sinyalinin olmaması ile de teyit edilmiştir. Saflaştırılmış ve zenginleştirilmiş eccDNA 68 milyon kadar sıralandı okur (141 nükleotid tek uçlu okur) ve CEN.PK113-7D referans genom (sürüm 19 Haziran 2012) çizilmiştir. C1, C2 ve C4 adlı üç örnekten varsayılan eccDNAs kayıtları okur uzun 1 kb daha bitişik tarafından eşlenen genomik bölgelere ayrıldı. 10.000 Monte Carlo simülasyonları dayanarak, bitişik tarafından eşlenen her bölgenin önemi 1 kb tahmin edilmiştir daha uzun okur. Bu 79, 159 ve 56 bölge büyük olasılıkla eccDNA dizileri (p <0.1, Dataset 1) olarak şerh edilmiştir itibaren. Kaydedilen contiguo sayısıUS> 1 kb örnekler, bundan başka (Şekil 2) dizisi olsaydı daha eccDNA elemanları kaydedilmiş açardı sekansı derinliğinin bir fonksiyonu olarak artan okur. Beklendiği gibi, daire-Seq yöntem çeşitli kromozom XII 2μ plazmid gibi bilinen dairesel DNA elemanları, mitokondriyal DNA, ribozomal RNA gen bir dizi okuma ekstre edilmiş ve numuneler çivili üç iç kontrol plazmidler arasında pBR322, pUC19 ve pUG72 sadece kolon saflaştırılması (Şekil 3) önce.
Video bitişik bir örnek kromozom IV HXT7 _ARS432_ HXT6 mahaline eşleştirilmiş okur göstermektedir. Daha önce, [HXT6 / 7 daire] On S288c popülasyonları (1 x 10 10 hücreleri her biri) ve dairesel bir DNA yapısında daire-DİZ ile tespit edilmiştir ters PCR analizi 20 ile teyit edilmiştir. [HXT6 / 7 ciDairesel], aynı zamanda, üç CEN.PK popülasyonu (Şekil 4A), her kaydedilmiştir. Ayrıca, CEN.PK arasında, kopya numuneler arasında yaygın eccDNA genlerin en S288c veri setleri (Şekil 4B) ile ilgili eccDNA genleri çakışan.
dairesel DNA saflaştırma, 30 ug genomik DNA, iki numune, her biri için daire-Seq protokol özgüllük test etmek için, test edildi. Bir numune, daire-Seq protokol ile saflaştırıldı her iki numuneden 100 ng plazmid DNA ve eccDNA ile takviye edilmiştir. Sütun ayrılmasından sonra, ürün eldesi plazmid (GD) plazmid ile numune için 1.60,% (480 ng) (GD + P) olmayan bir örnek için% 1.27 oranında (380 ng) idi. Ekzonükleaz tedavisinin etkileri. 29 saat, ACT1 karşı PCR kullanılarak 72 saat sonra, doğrusal DNA içeriği açısından test edildi Resim örnekler (veriler gösterilmemiştir) Act1 amplifiye içeriyordu. Her bir eksonükleaz ile muamele edilmiş numunenin bir kısmı ayrıca bir olduø29 tarafından mplified polimeraz ve enzimatik reaksiyonların ürünleri propidyum iyodid lekeleme (Şekil 5A-C) ve agaroz jel elektroforezi (Şekil 5G) ile analiz edilmiştir. Ekzonükleaz tedavi sonrası örnekleri az propidyum iyodin-leke (Şekil 5A-B) göstermektedir. Ø29 - tek genomik DNA ile amplifiye numune, kontrol numunesininkinden (Şekil 5E) 'e benzer iplik benzeri yapılar (Şekil 5C) saptandı. Ø29 - eklenen plazmid vardı güçlendirilmiş numune plazmid kontrolü (Şekil 5F) benzeyen odakları (Şekil 5D) saptandı. görüntüleri ø29 polimeraz doğrusal DNA üzerinde dairesel DNA için zenginleştirilmiş belirtti. En doğrusal kromozomal DNA, 29 saat ekzonükleaz tedavisi (Şekil 5A-B, G) sonra numunelerden çıkarıldı. Ancak, geniş eksonükleaz 100'den fazla saat tedavi ve kullanarak 100'den fazla adet oldu güçlendirilmiş numuneler yine 72 saat eksonükleaz tedavi (Şekil 5C-D) sonra iplik benzeri yapıların bir arka plan gösterdi - ø29 olarak, tüm kromozomal doğrusal DNA kaldırmak gerekiyordu.
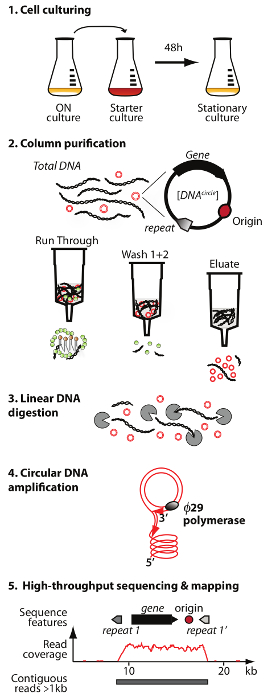
. Kolon kromatografisi, çıkan fraksiyonunda doğrusal kromozomal DNA kalan 3) sindirim, 4) amplifikasyon 1) hücre kültürü, 2) saflaştırma ve eccDNA zenginleşmesine: Çember-Sıra yöntemin Şekil 1. Anahat protokolü 5 adım vardır ø29 DNA polimerazın ve yüksek oranda zenginleştirilmiş eccDNA 5) sıralama ve haritalama DNA S. okur cerevisiae referans genom. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
p_upload / 54239 / 54239fig2.jpg "/>
Şekil 2. bitişik dizi derinliğinin fonksiyonu olarak> 1 kb okur. EccDNA 1 10 x 10 hücreleri (eşlenen okur milyon) sekansı derinliğinin bir fonksiyonu olarak artış. Gösterilen: haploid CEN.PK S. biyolojik kopyaların 10 10 hücre bölünmesi ile ayrılmış cerevisiae nüfuslar (C1, C2, C4). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
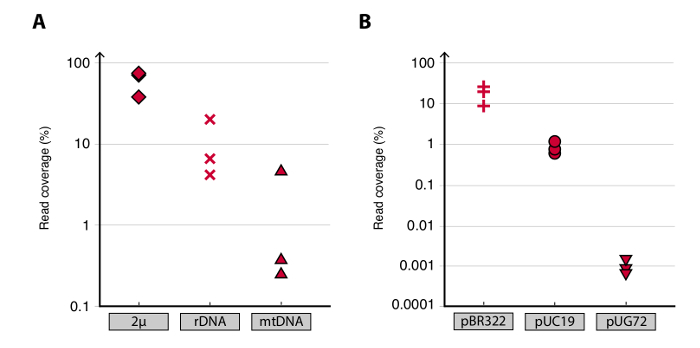
Bilinen dairesel DNA elemanlarının Şekil 3. tespiti. (AB) CEN.PK Biyolojik plazmidler için yüzde okuma kapsama araziler (yoğunluğu okuyun) Dağılım C1, C2 ve C4 çoğaltır. Vardı Haritalı (A) endojen maya plazmid okur: 2P; [RDNA daire] (Kromozom XII ribozomal RNA genlerinin); ve mitokondriyal DNA (mitokondriyal DNA). (B) Benzersiz plazmidler kontrol eşleştirilmiş okur. Kontrol plazmidler kolon saflaştırılması önce numuneleri içine çivili edildi. Hücre başına Plazmid oranları: pBR322 (artı işaretleri) 1: 1, pUC19 (daireler) 1:50, ve pUG72 (üçgenler) 1: 2,500.
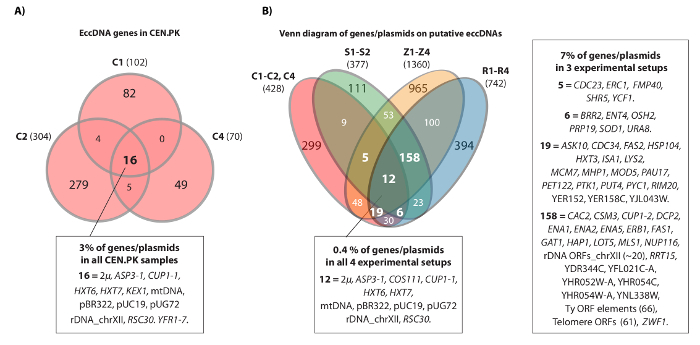
CEN.PK ve S288c Şekil 4. Ortak eccDNA elemanları. (A) Venn şeması 476 arasında örtüşme görüntüleme Üç CEN.PK örnekleri (C1, C2, C4) 294 eccDNA elemanları genler. 16 ortak örtüşen eccDNA genleri / plazmidler (tüm gen isimleri Dataset 1 olan) açıklamalı. S1-S2, R1-R4: 10 S288c örnekleri putatif eccDNAs üzerinde kayıtlı tüm genlerin göre (B), üç CEN.PK örnekleri (C1, C2, C4) arasında varsayılan eccDNAs üzerinde kayıtlı tüm genlerin Venn diyagramı,Z1-Z4 (referans 20). genler / plasmidler ve 2 türü arka ve ya 3 ya da daha fazla deney düzeneğinde, en az üst üste farazi eccDNA bölgeleri 13 biyolojik çoğaltır (S1-S2, R1-R4, Z1-Z4, C1-C3) 'da gösterilmiştir. Cı örnekleri, CEN.PK; R ve Z'nin örnekleri, S288c BY4741; S örnekleri, S288c M3750. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
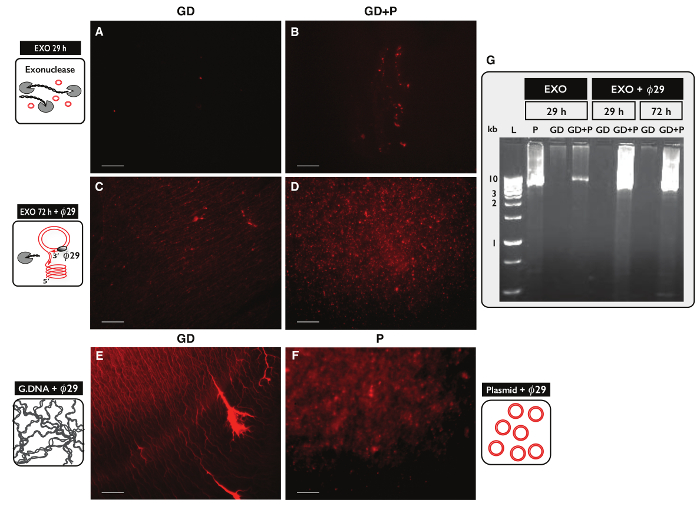
Şekil eksonükleaz sonra DNA örneklerinin 5. Görselleştirme ve ø 2 9 tedavisi. DNA (AF) Propidium iyodür boyama. Ölçek çubuğu, 10 mikron. (A, C ve E), genomik DNA ile numuneler (GD); (B ve D) GD artı plazmid (GD + P) ile örnekler. ( 29 saat ekzonükleaz muameleden sonra> AB) (ekzo 29 H) Ong; Ø29 polimeraz amplifikasyonu takiben 72 saat ekzonükleaz muameleden sonra (CD) (ekzo 72 saat + ø29). (E) e sonra Genomik DNA kontrolü: ø29 polimeraz büyütmesi; (F) plazmid kontrolü (5.5 kb) sonra 29 polimeraz amplifikasyonu; (G ø) agaroz jel elektroforezi. L, 1 kb belirteçleri;: Soldan P, EXO 29 saat sonra plazma kontrolü (5.5 kb); GD, EXO 29 saat sonra (A gibi örnek); GD + P, EXO 29 saat sonra (B olarak örnek); GD ve GD + P, EXO sonra 29 saat + ø29; GD ve GD + P, EXO sonra 72 saat + ø29 (CD gibi örnek). Tablo S1 görün Daha fazla ayrıntı için. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
aset 1 "src =" / files / ftp_upload / 54239 / 54239dataset1.jpg "/>
CEN.PK. DataSet 1. Potansiyel DNA daireselleştiğini bölgeleri bu dosyayı indirmek için tıklayınız.
Dizi verileri olan gösterilmektedir ve 348 bölgeleri için analiz eder. Sütunlar AD, eccDNA haritalama vardır. farazi eccDNA tespit edildiği, numune, bir (soldan ilk sütun); B, kromozom; CD, başlangıç ve bitiş varsayılan eccDNAs koordinatları. EH, eccDNA içeriği. E, özerk bölgede (ARS) dizisi çoğaltılıyor; F, bölgede tam geni; G, bölgede bulunan bir genin bir parçası; H, gen BLASTN tanımlanan. IO, EccDNA kapsamı ve p-değerleri. Ben, bp içinde benzersiz açıklamalı dizisi ile en uzun bölge; J, tüm okuma sayısıdır eşlenen; K, tüm eşlenen kapsamı eşleştirilmiş bir milyon okur (FPKM) dan kb başına parçalarından okur; Monte Carlo simülasyonları tesadüfen oluşması ile karşılaştırıldığında varsayılan eccDNA L, p-değeri; un M, sayıiquely okur eşlenen; NO; K ve L sadece benzersiz eşlenen kullanma gibi (UFPKM) okur. Haritalama için parametreler okur ve 20 açıklandığı gibi Monte Carlo simülasyonları idi.
Tartışmalar
Çember-Seq yöntem dizisi düzey çözünürlüğe sahip maya hücrelerinden eccDNA genom ölçekli algılanmasını sağlar. yöntemi, yoğun girdap veya pipetleme gerektirmez ve bir sonraki aşamada ekzonükleaz sindirimine yol açar eccDNA kırılma sınırlamak için yer çekimi ile sütun ayrımı kullanan etmez hafif eccDNA saflaştırılmasıdır. Yöntemin bu özellikler gen dizilerini içeren büyük eccDNAs tespit edilmesi için önemli olabilir. Çember-Sıra tam genlerin (Dataset 1) olmak üzere çok sayıda eccDNAs algıladı. Aynı zamanda 86-kb maya mitokondrial DNA tespit edildi. Böylece, bu protokol, büyük dairesel DNA elemanları saflaştırılmasını kolaylaştırır. minimumda DNA ekstraksiyon adım sayısını tutulması eccDNA kaybı riskini azaltır ve verimi en üst düzeye çıkarır. kontrol sonuçlarına göre, ani yüksek voltajlı plazmidler, daire-Dizi 2500 hücrelerinden tek dairesel DNA tespit edilmesi, son derece duyarlıdır. Ayrıca, bu tür 2P gibi bol endojen plazmidler kaldırma; plazmid veya mitokondriyal DNA önemli ölçüde hassasiyeti artırmak olabilir. Maya kültürlerinden 2P sertleştirilmesi 30 tarif edilmiştir. Seçenek olarak ise, 2μ ve mitokondriyal DNA ayrılması, SwaI gibi nadir kesici endonükleaz ile elde edilebilir. Ancak, restriksiyon enzim adım diğer ilgi eccDNAs hedef ve toplam eccDNA verimi sınırlayabilir.
eccDNA tespiti için kritik adım uygun bir derinliğe kadar Lineer DNA (aşama 3) ve DNA dizi analizi (aşama 5) çıkarılması idi. Bir hücre popülasyonundan eccDNAs çoğunluğu kaydetmek için, derin sıralama 20 gerekli olabilir. dairesel DNA kavşak eşleştirilmiş uç vermesi beklenen diskordan o haritayı okur olarak eşleştirilmiş sonu sıralama, eccDNA tespiti bile daha fazla güven vermelidir. Bu farklılıklar dairesel DNA yapılarının keşif destek ve potansiyel ek eccDNA algılama filtre olarak kullanılabilir.
Çember-Seq yöntem üç bağımsız S. kullanılarak doğrulandı cerevisiae CEN.PK popülasyonları. Tespit dizileri daha önce eccDNAs, endojen plazmidleri rapor ve katkılı plasmidlerin ve ayrıştırılması eccDNAs (Veri kümesi 1) yüzlerce dahildir. Bu bulgular S. önceki Çember-Seq veri setleri destek cerevisiae S288c 20. CEN.PK ve S288c popülasyonları yaygın birçok eccDNAs bulunması, bu noktalar, dairesel elemanlar (Şekil 4) biri için bir eğilime sahip olduğunu gösterir. Biz daha önce diğer gerilme geçmişlerindeki [GAP1 dairenin] kanıtı bulunmamıştır olsa [GAP1 daire], CEN.PK arka 8 azot sınırlı koşullar altında zenginleştirilmiş olduğunu göstermiştir. S288c ve CEN.PK hem CUP1-1 RSC30, ASP3-1, COS111 ve HXT6 HXT7 loci ile ilgili eccDNA bölgesinin bulunması, DNA daire haline için yatkınlık con olduğunu göstermektedirmaya suşları arasında görev yaptı. [HXT6 / 7 daire], [ASP3-1 daire], [COS111 daire] ve [CUP1-1 RSC30 daire] hücrelere veya eğer seçici avantaj kazandırmaz eğer onların varlığı sadece yüksek oranlarda bir etkisi olduğunu göstermiştir gerekmektedir DNA daireselleştiğini.
Birlikte ele alındığında, sonuçlar daire-Seq kilobaz-boy eccDNAs tespit edilmesi için uygundur ve tam genleriyle eccDNAs belirlenmesi için avantaj olduğunu göstermektedir. Çember-Seq maya eccDNAs tüm genom ölçekli ekranlar sağlayan son derece hassas bir yöntemdir. Çember-Seq yöntem gen silme ve büyütmeleri üreten eccDNA rolünü aydınlatılması amacıyla yeni bir araştırma alanı açabilir. DNA, mimarisi ve yapısı, büyük ölçüde daha yüksek ökaryotlar ökaryotik mayadan korunmuş olduğu göz önüne alındığında, daire-Seq yöntem olup, prensip olarak, applicabl olmalıdırküçük değişiklikler ile, tüm ökaryotik hücrelerde e. Şu anda, bu yöntem megabaz büyüklüğünde eccDNAs arıtmak için özelliği henüz gösterilecek olmakla birlikte, herhangi bir sınırlama olması görünmemektedir. Buna ek olarak, bir haddeleme-çember amplifikasyonu metodu 31 kullanan ø29 DNA polimeraz, kullanımı eccDNA miktar daha zor hale küçük eccDNAs karşı bir önyargı oluşturur. Çember-Seq insan somatik hücrelerinden çift dakika dairesel DNA üzerinde çalışmalar için uygun hale tam genleri taşımak için yeterince büyük eccDNAs algılar. Proto-onkogenler bu elemanların 32-37 güçlendirilmiş zaman çift dakikada kansere katkıda bulunabilir. germ hücrelerinde eccDNAs Çalışmaları germline mutasyon oranlarını ölçmek ve hayvancılık, örneğin sperm kalitesini değerlendirmek için kullanılabilir. Böylece, daire-Seq gen telif içeren hastalıkların yeni bir anlayış genetik varyasyon kopya sayısı varyasyonu şeklinde ortaya hangi oranda içgörüler verim ve kurşun potansiyeline sahipnumara varyasyonu 38-40.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
Thanks to Kenn D. Møller and Claus Sternberg (DTU) for technical assistance and to Tue S. Jørgensen for quantitative PCR analysis.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bacto peptone | BD Difco | 211677 | Alternative product can be used. |
| Brilliant III SYBR Green PCR Master Mix | Agilent Technologies | 600882 | For qPCR analysis. Alternative product can be used. |
| Dextrose (D-glucose) | Carl Roth | HN06.4 | Alternative product can be used. |
| Disruptor Beads, 0.5 mm | Scientific Industries, Inc. | SI-BG05 | Glass beads to disrupt plasma cell membranes. Alternative product can be used. |
| Ethidium bromide | Carl Roth | 2218.2 | Agarose gel stain for detecting DNA/RNA. |
| GeneJet plasmid miniprep kit | Thermo Fisher | K0502 | Plasmid purifcation from bacteria. Alternative product can be used |
| NotI, FastDigest | Life Technologies - Thermo Fisher Scientific, USA | FD0594 | Endonuclease. Alternative product can be used. |
| Plasmid Mini AX kit | A&A Biotechnology, Poland | 010-50 | Plasmid purifcation kit used to purify eccDNA. |
| Plasmid-Safe ATP-dependent DNase kit | Epicentre, USA | E3105K | ATP-dependent exonuclease kit. Alternative product can be used. |
| Propidium iodide | Sigma-Aldrich, USA | 81845 | Alternative product can be used. |
| pUG6 plasmid | EUROSCARF, Germany | P30114 | Marker gene: loxP-PAgTEF1-kanMX-TAgTEF1-loxP. Plasmid requests: Please contact Dr. Peter Philippsen@unibas.ch |
| QIAGEN genomic-tip 100/G | Qiagen, USA | 13343 | Genomic DNA purifcation from yeast. Alternative product can be used. |
| REPLI-g Mini Kit protocol | Qiagen, USA | 150023 | Amplification of eccDNA by the phi29 polymerase |
| Yeast extract | BD Difco | 210929 | Alternative product can be used. |
| Zymolyase 100T (Lyticase, Yeast Lytic Enzyme) | Nordic BioSite, Sweden | Z1004-3 | Alternative product can be used. |
| Data access to sequence files | European Nucleotide Archive | EccDNA dataset from Saccharomyces cerevisiae CEN.PK113-7D. Study accession number PRJEB9684. 2nd accession number is ERP010820. Locus tag prefix is BN2032. | |
| Strains | |||
| Saccharomyces cerevisiae CEN.PK113-7D | Genotype MATa MAL2-8c SUC2 | ||
| Saccharomyces cerevisiae yeast deletion library pool | EUROSCARF, Germany | S288c BY4741 pool of 4400 viable single-gene deletion mutants disrubted by KanMX module. Genotypes MATa his3∆1 leu2∆0 met15∆0 ura3∆0 genexxx::KanMX. | |
| Equipments | |||
| DNA Spectrophotometer | NanoDrop 1000 Spectrophotometer, Thermo Fisher | Measuring DNA concentration. Alternative product can be used. | |
| Fluorescence microscopy | Nikon Optronics Magnafire. Red excitation fluorescence filter, 663-738 nm. | Alternative product can be used. | |
| Robotic library-build system | Apollo 324, IntegenX Inc. | DNA library preparation. Alternative product can be used. | |
| Sequencing platform | Illumina HiSeq 2000 platform, Illumina Inc. | DNA sequencing. Alternative product can be used. | |
| Ultrasonicator | Covaris LE220, microTUBE AFA Fiber tubes | Alternative product can be used. | |
| Methods | |||
| 2% YPD media | Mix 10 g Dextrose, 10 g Yeast extract, 20 g Bacto peptone and add H2O to a total volume of 1000 ml and autoclave. | ||
| Circle-Seq test on genomic DNA | Genomic DNA was purified (Qiagen) from a pool of the yeast deletion library (Euroscarf). The DNA concentration was measured by nanodrop and 30 µg genomic DNA was pipetted into two micro centrifuge tubes. One micro centrifuge tube was supplemented with 100 nanogram plasmid (pUG6). The DNA samples were purified by Circle-Seq, omitting the protocol steps 1.1-1.3 and 1.5-1.7. The eluted DNA concentrations were measured by nanodrop and the entire DNA yield from sample GD and GD+P was treated with exonuclease for a period of 29 hours. A 10% fraction was collected for phi29-amplification and PCR analysis, while the remaining DNA was subjected to 72 hour exonuclease treatment. The samples were analyzed for linear DNA content by PCR, using the ACT1 gene as chromosomal marker. A 5% fraction of each of the exonuclease treated samples was amplified by the phi29 DNA polymerase for 16 hours (Qiagen). The presence of DNA in each sample was examined by loading an equal amount (7 µl) in wells on an 0.5 µg/ml ethidium-bromide 0.9% agarose gel after running gel-electrophoresis. | ||
| Mapping software | Bowtie2 aligner, John Hopkins University | Ultrafast short read alignment. Reference: Langmead B, Salzberg S. Fast gapped-read alignment with Bowtie 2. Nature Methods. 2012, 9:357-359. | |
| Propidium iodide stain | Images of propidium iodine stained DNA were captured by fluorescence microscopy at 100x magnification (100x/1.30 oil, Nikon) in the RFP channel (red excitation fluorescence filter, 663-738 nm) using identical exposition time (5 seconds). | ||
| Workflow bioinformatic system | Galaxy, Open source. | A free web-based platform for data intensive biomedical research. References: Goecks, J, Nekrutenko, A, Taylor, J and The Galaxy Team. Galaxy: a comprehensive approach for supporting accessible, reproducible, and transparent computational research in the life sciences. Genome Biol. 2010 Aug 25;11(8):R86. Blankenberg D, Von Kuster G, Coraor N, Ananda G, Lazarus R, Mangan M, Nekrutenko A, Taylor J. "Galaxy: a web-based genome analysis tool for experimentalists". Current Protocols in Molecular Biology. 2010 Jan; Chapter 19:Unit 19.10.1-21. Giardine B, Riemer C, Hardison RC, Burhans R, Elnitski L, Shah P, Zhang Y, Blankenberg D, Albert I, Taylor J, Miller W, Kent WJ, Nekrutenko A. "Galaxy: a platform for interactive large-scale genome analysis." Genome Research. 2005 Oct; 15(10):1451-5. | |
Referanslar
- Kugelberg, E., Kofoid, E., et al. The Tandem Inversion Duplication in Salmonella enterica.: Selection Drives Unstable Precursors to Final Mutation Types. Genetics. 185 (1), 65-80 (2010).
- Reams, A. B., Kofoid, E., Savageau, M., Roth, J. R. Duplication Frequency in a Population of Salmonella enterica. Rapidly Approaches Steady State With or Without Recombination. Genetics. 184 (4), 1077-1094 (2010).
- Smith, C. A., Vinograd, J. Small polydisperse circular DNA of HeLa cells. Journal of Molecular Biology. 69 (2), 163-178 (1972).
- Carroll, S. M., DeRose, M. L., et al. Double Minute Chromosomes Can Be Produced from Precursors Derived from a Chromosomal Deletion. Molecular and cellular biology. 8 (4), 1525-1533 (1988).
- Cohen, S., Yacobi, K., Segal, D. Extrachromosomal Circular DNA of Tandemly Repeated Genomic Sequences in Drosophila. Genome research. 13 (6A), 1133-1145 (2003).
- Horowitz, H., Haber, J. E. Identification of Autonomously Replicating Circular Subtelomeric Y' Elements in Saccharomyces cerevisiae. Molecular and cellular biology. 5 (9), 2369-2380 (1985).
- Moore, I. K., Martin, M. P., Dorsey, M. J., Paquin, C. E. Formation of Circular Amplifications in Saccharomyces cerevisiae by a Breakage-Fusion-Bridge Mechanism. Environmental and molecular mutagenesis. 36 (2), 113-120 (2000).
- Gresham, D., Usaite, R., Germann, S. M., Lisby, M., Botstein, D., Regenberg, B. Adaptation to diverse nitrogen-limited environments by deletion or extrachromosomal element formation of the GAP1 locus. Proceedings of the National Academy of Sciences of the United States of America. 107 (43), 18551-18556 (2010).
- Windle, B., Draper, B. W., Yin, Y. X., O'Gorman, S., Wahl, G. M. A central role for chromosome breakage in gene amplification, deletion formation, and amplicon integration. Genes & development. 5 (2), 160-174 (1991).
- Gresham, D., Ruderfer, D. M., et al. Genome-Wide Detection of Polymorphisms at Nucleotide Resolution with a Single DNA Microarray. Science. 311 (5769), 1932-1936 (2006).
- Kidd, J. M., Cooper, G. M., et al. Mapping and sequencing of structural variation from eight human genomes. Nature. 453 (7191), 56-64 (2008).
- Gresham, D., Desai, M. M., Botstein, D., Dunham, M. J. The Repertoire and Dynamics of Evolutionary Adaptations to Controlled Nutrient-Limited Environments in Yeast. PLoS Genetics. 4 (12), 1-19 (2008).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic Variation and the Fate of Beneficial Mutations in Asexual Populations. Genetics. 188 (3), 647-661 (2011).
- van Loon, N., Miller, D., Murnane, J. P. Formation of extrachromosomal circular DNA in HeLa cells by nonhomologous recombination. Nucleic Acids Research. 22 (13), 2447-2452 (1994).
- Vinograd, J., Lebowitz, J. Physical and Topological Properties of Circular Dna. Journal of General Physiology. 49 (6P2), 103 (1966).
- Shibata, Y., Kumar, P., et al. Extrachromosomal MicroDNAs and Chromosomal Microdeletions in Normal Tissues. Science. 336 (6077), 82-86 (2012).
- Dillon, L. W., Kumar, P., et al. Production of Extrachromosomal MicroDNAs Is Linked to Mismatch Repair Pathways and Transcriptional Activity. Cell Reports. 11 (11), 1749-1759 (2015).
- Li, L. L., Norman, A., Hansen, L. H., Sørensen, S. J. Metamobilomics - our knowledge on the pool of plasmid encoded traits in natural environments using high-throughput sequencing. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 18, 5-7 (2012).
- Brown Kav, A., Sasson, G., Jami, E., Doron-Faigenboim, A., Benhar, I., Mizrahi, I. Insights into the bovine rumen plasmidome. Proceedings of the National Academy of Sciences of the United States of America. 109 (14), 5452-5457 (2012).
- Møller, H. D., Parsons, L., Jørgensen, T. S., Botstein, D., Regenberg, B. Extrachromosomal circular DNA is common in yeast. Proceedings of the National Academy of Sciences of the United States of America. , 201508825 (2015).
- Drubin, D. G., Miller, K. G., Botstein, D. Yeast Actin-Binding Proteins - Evidence for a Role in Morphogenesis. The Journal of cell biology. 107 (6), 2551-2561 (1988).
- Magdolen, V., Drubin, D. G., Mages, G., Bandlow, W. High levels of profilin suppress the lethality caused by overproduction of actin in yeast cells. FEBS letters. 316 (1), 41-47 (1993).
- Sandrock, T. M., Brower, S. M., Toenjes, K. A., Adams, A. Suppressor analysis of fimbrin (Sac6p) overexpression in yeast. Genetics. 151 (4), 1287-1297 (1999).
- Blanco, L., Bernad, A., Lázaro, J. M., Martìn, G., Garmendia, C., Salas, M. Highly Efficient DNA Synthesis by the Phage ø29 DNA Polymerase. The Journal of biological chemistry. 264 (15), 8935-8940 (1989).
- Dean, F. B. Rapid Amplification of Plasmid and Phage DNA Using Phi29 DNA Polymerase and Multiply-Primed Rolling Circle Amplification. Genome research. 11 (6), 1095-1099 (2001).
- Hutchison, C. A., Smith, H. O., Pfannkoch, C., Venter, J. C. Cell-free cloning using ø29 DNA polymerase. Proceedings of the National Academy of Sciences of the United States of America. 102 (48), 17332-17336 (2005).
- Goecks, J., Nekrutenko, A., Taylor, J., Galaxy Team, T. Galaxy: a comprehensive approach for supporting accessible, reproducible, and transparent computational research in the life sciences. Genome Biology. 11 (8), 86 (2010).
- Giardine, B., Riemer, C., et al. Galaxy: A platform for interactive large-scale genome analysis. Genome research. 15 (10), 1451-1455 (2005).
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357 (2012).
- Tsalik, E. L., Gartenberg, M. R. Curing Saccharomyces cerevisiae of the 2 micron plasmid by targeted DNA damage. Yeast. 14 (9), 847-852 (1998).
- Norman, A., Riber, L., Luo, W., Li, L. L., Hansen, L. H., Sørensen, S. J. An Improved Method for Including Upper Size Range Plasmids in Metamobilomes. PLoS ONE. 9 (8), e104405 (2014).
- Storlazzi, C. T., Lonoce, A., et al. Gene amplification as double minutes or homogeneously staining regions in solid tumors: Origin and structure. Genome research. 20 (9), 1198-1206 (2010).
- Von Hoff, D. D., Needham-VanDevanter, D. R., Yucel, J., Windle, B. E., Wahl, G. M. Amplified human MYC localized to replicating submicroscopic circular DNA molecules. Proceedings of the National Academy of Sciences of the United States of America. 85 (13), 4804-4808 (1988).
- Raymond, E., Faivre, S., et al. Effects of hydroxyurea on extrachromosomal DNA in patients with advanced ovarian carcinomas. Clinical cancer research : an official journal of the American Association for Cancer Research. 7 (5), 1171-1180 (2001).
- Shimizu, N. Extrachromosomal Double Minutes and Chromosomal Homogeneously Staining Regions as Probes for Chromosome Research. Cytogenetic and genome research. 124 (3-4), 3-4 (2009).
- Eckhardt, S. G., Dai, A., Davidson, K. K., Forseth, B. J., Wahl, G. M., Von Hoff, D. D. Induction of differentiation in HL60 cells by the reduction of extrachromosomally amplified c-myc. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6674-6678 (1994).
- Vogt, N., Lefèvre, S. -. H., et al. Molecular structure of double-minute chromosomes bearing amplified copies of the epidermal growth factor receptor gene in gliomas. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11368-11373 (2004).
- Ahn, K., Gotay, N., et al. High rate of disease-related copy number variations in childhood onset schizophrenia. Molecular psychiatry. 19 (5), 568-572 (2013).
- Girirajan, S., Johnson, R. L., et al. Global increases in both common and rare copy number load associated with autism. Human molecular genetics. 22 (14), 2870-2880 (2013).
- Vogt, N., Gibaud, A., Lemoine, F., de la Grange, P., Debatisse, M., Malfoy, B. Amplicon rearrangements during the extrachromosomal and intrachromosomal amplification process in a glioma. Nucleic Acids Research. , (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır