Method Article
3D Baskı Teknolojisini kullanan Histoloji ile MRG Birleştirme: Beyin için Protokol Kesit
Bu Makalede
Özet
Bu protokolün genel amacı doğru özelleştirilmiş 3D baskılı beyin sahipleri ve dilimleme kutuları oluşturulması yoluyla histoloji bölümleri ile manyetik rezonans görüntüleme (MRG) görüntü hacimleri hizalamak.
Özet
Magnetic resonance imaging (MRI) allows for the delineation between normal and abnormal tissue on a macroscopic scale, sampling an entire tissue volume three-dimensionally. While MRI is an extremely sensitive tool for detecting tissue abnormalities, association of signal changes with an underlying pathological process is usually not straightforward. In the central nervous system, for example, inflammation, demyelination, axonal damage, gliosis, and neuronal death may all induce similar findings on MRI. As such, interpretation of MRI scans depends on the context, and radiological-histopathological correlation is therefore of the utmost importance. Unfortunately, traditional pathological sectioning of brain tissue is often imprecise and inconsistent, thus complicating the comparison between histology sections and MRI. This article presents novel methodology for accurately sectioning primate brain tissues and thus allowing precise matching between histology and MRI. The detailed protocol described in this article will assist investigators in applying this method, which relies on the creation of 3D printed brain slicers. Slightly modified, it can be easily implemented for brains of other species, including humans.
Giriş
In vivo MRI provides a noninvasive and sensitive measure of tissue integrity at the macroscopic level. Changes in MRI signal intensity seen in vivo are outcome measures in many ongoing clinical trials.1 While the intensity changes seen via MRI can identify areas of abnormality in the context of the whole brain, they are often not sufficiently specific to differentiate pathological processes. This is especially true of dynamic processes involving multiple pathologies. For example, in multiple sclerosis (MS) or its animal model, experimental autoimmune encephalomyelitis (EAE), inflammation, edema, myelin degradation, axonal destruction, gliosis, and neuronal death overlap. 2, 3 To obtain the necessary specificity regarding the underlying pathology, context must be taken into account, together with knowledge of the histology of the MRI-identified abnormal tissues.
However, even in well-controlled animal experiments, matching histology with in vivo MRI is fundamentally challenging for various reasons. First, the difference in dimensional scales between histology sections and MRI is of several orders of magnitude.4 Second, for proper comparison, the orientation of MRI slice plane must match the sectioning plane of the brain tissue when cut. Due to the shape of the brain, it is very difficult to make consistently straight and accurate cuts when the brain is sitting on a flat surface. Third, the large size of the brain relative to a potentially small area of interest (lesion, tumor, etc.) creates a "needle-in-a-haystack" scenario for the pathologist processing the tissue. Fourth, even when the target tissue is found, it is commonly processed in such a way as to render virtually impossible an association with the original MRI data. Finally, traditional pathological sectioning of brain tissue is often imprecise and inconsistent, further complicating the comparison between histology sections and MRI images.
Previous attempts to overcome these challenges relied on the use of deformational algorithms to coregister the data and/or placement of fiducial markers within or around the tissue as a reference.5, 6, 7, 8 The former approach requires complex computational models that are particularly susceptible to complications due to data formatting, imaging artifacts, and changes caused by tissue processing.4 On the other hand, the latter approach introduces the possibility of contaminating or otherwise harming the tissue itself.9
The approach described here improves the transition between modalities through the use of postmortem MRI to bridge the gap between in vivo MRI and histology. Postmortem MRI provides three-dimensional (3D) images of the brain at higher resolution than can be achieved in vivo and furthermore provides the data needed for producing a morphologically accurate model of the brain surface. This digital model can then be used to create a 3D-printed custom holder for the brain. With careful positioning, the brain holder allows for precise, MRI-oriented brain sectioning, reducing the need for complex mathematical algorithms, and enables a focus on specific regions for targeted sampling.
Our laboratory recently introduced new methods for creating custom brain holders and slicers using postmortem MRI and 3D-printing technology for human10 and marmoset brains.4 The two methods allow for a more accurate correlation between MRI and histology in a research setting, and ultimately allow a deeper understanding of the specific pathology underlying MRI abnormalities. Carefully designed experiments, in which the brain is sampled repeatedly over time in vivo, can provide context for interpretation of the pathology, which in turn can add specificity to interpretation of the MRI. Here, we present a modified protocol in a unified framework that can be applied to any brain tissue, whether it derive from nonhuman primates, rodents, or humans. We provide detailed instructions, and a corresponding video, for the marmoset sectioning. Although the overall protocol applies to any type of brain, due to differences in MRI acquisition and tissue size, as well as the challenges encountered when dealing with specific brain types, there are some differences in the approach depending on the type of brain being processed. In this presentation, sections with "human" will denote differences in protocol specific to the human brain.
Protokol
Tüm hayvan taşıma ve burada tarif edilen prosedürler Ulusal Nörolojik Bozukluklar Enstitüsü ve İnme Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmış bir protokol uyarınca yapıldı. Brain EAE geliştirmek bağlı ortak marmosetlerde (Callithrix jacchus) toplanmıştır. 11 Brain 3 hafta ve% 4 paraformaldehit transcardial perfüzyon ile kurban edildikten sonra bir yıl arasında 10% formalin içinde bekletildi.
1. Postmortem MR Hazırlama ve Toplama
- marmoset Beyin
- ~ 30 florlanmış bir yağ, parafin ml, ve marmoset beyin pamuk gazlı bir iş istasyonu, 50 ml'lik bir santrifüj tüpü, küçük spatülleri, hazırlayın.
- 20 mi işaretine kadar flüorinlenmiş yağı ve gazlı bez ile tüp doldurun. Yol boyunca hava kabarcıklarını çıkarmak için gazlı bez sıkıştırır.
- Bir kağıt havlu ile beynin yüzeyine hafifçe kuru formalin. alt kısmına doğru ön kutup beyin yerleştirintüp. Dikkatle konumunu düzeltmek için iki tarafın etrafında daha fazla gazlı bez kullanılarak tüp içinde beyin sabitleyin. Ek MRI taramaları kurulumu için bir MR beyin beşik yaratma yöntemi için ek bölüm 11'e bakın.
- gazlı bez ve florlu yağ borunun kalan doldurun. Dikkatle yol boyunca hava kabarcıkları. Kapağı Güvenli ve parafin ile tüp mühür.
- interhemisferik fissür doğrultusunda kapağını işaretleyin. Bir kağıt havlu tüp sarın ve işareti üst merkezi ile bobin takın.
- 2B eko T2 dönmeye kazanır. Parametreleri Tablo 1 'de verilmiştir.
- Mipav 10 anatomik 150 mikron T2 ağırlıklı satın almalar açın ve 6. edinimi kayıt olun.
NOT: siteye Powell'ın arayarak Brent arama algoritması ile serbestlik 9 derece, pencereli sinc enterpolasyon, normalize çapraz korelasyon maliyet fonksiyonu ile optimize edilmiş otomatik kayıt 3.5d algoritmasıdır. Rotasyonlar +10 den örneklenmiştir6; 1 ° artan 5 derece artan kaba rotasyonlar ve ince rotasyonlar ile -10 °. Sonra kayıtlı görüntüleri ortalama: Kamu, Görüntü hesap-Toplu görüntüleri, ortalama.
- İnsan beyni
- Ortabeyin düzeyinde bir kesim kullanarak beyin sapından ön beyin ayırın. 10 hemisfer de orta hatta aşağı bir kesim ile ayrılabilir.
- bir ucunda bir hemisferik kubbe ve diğer ucunda bir ağız ile birlikte silindirik bir tüp içinde ön beyin yerleştirin.
- ağız yoluyla florlu yağ ile tüp doldurun. emzikli aracılığıyla ~ 30 dk hafif bir emme kullanarak hava kabarcıklarını çıkarın.
- 3D T1 MPRAGE edinin. Parametreleri Tablo 1 'de verilmiştir.
2. Beyin Yüzey ayıklanıyor: Mipav 7.2
- koronal yönde MRG açın.
- Dönüşümü, resample Algoritmalar, Dönüşüm araçları seçin. Kullanıcı tanımlı boyutu seçin ve isot için resampleRopic vokseller: 0.1 x 0.1 x 0.1 mm. Brain_MRI_Resampled olarak resampled MR kaydedin. İnsan: Resample vokseller 0.3 x 0.3 x 0.3 mm izotropik için.
- Algoritmalar, filtreler (uzamsal), Doğrusal Olmayan gürültü azaltma seçin. Tamam'a tıklayın, varsayılan ayarları kullanın.
- Görüntüler arama tablosunu seçin ve çift eşik butonuna tıklayın. tüm beyni kapsayacak şekilde grafikte kaydırıcıyı sürükleyin.
- Algoritmalar, Segmentasyon, Eşik, Eşik kullanarak min / max seçin. "Alt limit" kutusuna (sadece ölçek altında) yoğunluk grafiğin sol alt köşesinde bulunan değeri girin. çıkış görüntü türü için de "ikili" seçiniz ve işaretini kaldırın "invert eşiği."
- Algoritmalar morfolojik seçin delikleri doldurun. "2.5D içinde Süreci." Kontrol
- Bu tam beynin MR olduğundan, doldurulması gereken Beyin ve korteks arasında bazı boş boşluk yoktur. İnsan beyni: bu adımı atlayın.
- hat VOI kullanarak, bir bağlantı çizmeken dıştaki noktasında beynin her iki tarafta arka beyin korteks arasındadır. beyin ile bu devam ediyor.
- VOI, VOI dönüşüm, ikili maske Tüm seçin. Seç Utilities, Görüntü hesap. Seçin VEYA operatör açılır menüden ve beyin maskesini seçin. "Hedef resim türü teşvik" ı seçin
- Algoritmalar morfolojik seçin delikleri doldurun. Giriş "2.5D Süreç"
- Brain_Model.nii ikili maske kaydedin.
- Algoritmalar, Özü yüzeyini (yürüyen küp) seçin. Seç maske görüntüsü, Brain_Model.ply olarak kaydedin.
3. Dilim yerler seçilmesi: Mipav 7.2
- faiz veya başlama pozisyonu doku tanımlayın. amaçlanan döşeme kalınlığı hesaplayın. ipek maymun beyninde, bölüm başına 30 MR dilimleri ve bıçak boşluğu başına 5 MRG dilimleri, sayma ~ 3.5 mm plaka sonuçlanan 0,5 mm bıçak boşlukları ile 3 mm bölümleri oluşturur. İnsan beyni: Bölüm başına 20 MR dilimler ve 4 MRI slBıçak boşluğu başına buzlar, ~ 7.2 mm plaka sonuçlanan 1,2 mm bıçak boşlukları ile 6 mm bölümleri oluşturur.
- İlk bıçak boşluğu yerde, "kutu VOI" üzerine tıklayın ve ardından beynin üzerinde bir kutu çizin. seçmek için kutunun içini tıklatın. Kopya ve bıçak boşluğu karşılık gelen her MRG dilim için kontur yapıştırın.
- kesit kalınlığı karşılık gelen MR dilim sayısına göre atlayabilirsiniz ve kopyalayıp sonraki bıçak boşluğu karşılık gelen konturu yapıştırın. beyin aracılığıyla bu işlemi tekrarlayın.
- VOI, VOI Dönüşüm, İkili Maske Tüm seçin. Blade_Gaps.nii olarak kaydedin.
- Algoritmalar, Özü Yüzey (yürüyüş küpleri), Maske görüntü, Blade_Gaps.ply seçin.
4. MR Blade Harita Oluşturma: Mipav 7.2
- Brain_MRI_Resampled ve Blade_Gaps.nii görüntüleri açın.
- Seçilen Blade_Gaps.nii görüntü seçin Yardımcı, Görüntü Matematik ile. Görüntü türü ve Çarp teşvik seçin.değer olarak 10.000 girin.
- Seç Utilities, Görüntü Hesaplama. Ekle seçin ve sonra görüntü açılan kutudan Brain_MRI_Resampled resmi seçin. Hedef resim türü teşvik seçin.
- Brain_BladeMap.nii olarak bu görüntüyü kaydetmek.
- Triplanar görünümünde tıklayarak, beyin dilimlenmiş olacak konumları üç ortogonal görünümler görülebilir.
5. Beyin ve Blade Gap Yüzeyler İthalat: Netfabb Profesyonel
- Bölüm seçin kısmını ekleyin. Dosyaları Brain_Model.ply ve Blade_Gaps.ply seçin
- beyin seçin ve onarım moduna tıklayın. Onarım modunda:
- Kabuk seçim butonuna tıklayın ve sonra beyinde tıklayın.
- Diğer kafesleri seçmek için geçiş seçim düğmesine tıklayın. Diğer kafesleri silmek için Kaldır üzerine tıklayın.
- tıklayın Onar uygulayın ve eski bir parçası kaldırın.
- Sağ beynin tıklayın. Seç hareket. Tıklakökeni düğmesini. görünen XYZ parametreleri kaydediniz. Bu çeviri parametreleri Mipav kurmak bıçak konumlandırma korumak için gereklidir. Çevir tıklayın. Sonra pencereyi kapatın. (Kereden fazla çevirmek tıklayın etmeyin. Yine aynı parametreleri kullanarak çevirmek olacaktır.)
- Blade_Gaps modeli seçin. Sağ tarafında tıklayın ve Taşı seçeneğini belirleyin. XYZ parametreleri kutulara önceden kaydedilmiş XYZ değerleri girin. Şimdi Çevir tıklayın ve pencereyi kapatın.
- Brain_Model modelini seçin ve Onarım moduna tıklayın. Onarım modunda:
- Kabuk seçim butonuna tıklayın ve sonra beyinde tıklayın.
- Sağ tıklayın ve Smooth Triangles seçin. 4-5 tekrarlamalar girin. Önlemek hacim daralma kontrol edin. İnsan beyni: 1-2 tekrarlamalar.
- sağ tıklayın, Triangles azaltın seçin. Hedef üçgen sayısında 200000 girin ve Yürüt tıklayın.
- Otomatik tamir, Standart onarım tıklayın. Sonra tıklayın Onarım uygulayın
- Sağ, Adlandır'ı tıklatın. Smoothed_Brain_Model olarak düzeltti beyin yeniden adlandırın.
- Smoothed_Brain_Model seçin. Sağ tıklayın, İhracat, STL.
6. Düzenleme Beyin Konturlar: Meshmixer
- Meshmixer içine Smoothed_Brain_Model alın.
- örgü ayarlamalar yapmak için heykel ve seçim araçlarını kullanın. Düzenlemeler şunlardır:
- Sağlam pürüzsüz Şekillendirici araçlarını kullanın. hat VOIs karşılık alanını Smooth. İnsan beyni: bu adımı atlayın.
- kutuda yüz aşağı olacak korteks yüzey düzeltilmelidir.
- hasırlar ve düzenleme sürecinde yaratılmış olabilecek küçük divots uzak pürüzsüz.
- Analiz, Müfettiş, AutoRepair Tümünü seç.
- Smoothed_Edited_Brain_Model olarak Smoothed_Brain_Model ihracat.
7. Beyin Dilimleme Kutusu Oluşturma: Netfabb Profesyonel
- Bölüm seçin Part ekleyin. fil seçine Smoothed_Edited_Brain_Model.
- Bölüm seçin Part ekleyin. Sonra STL dosyası Beyin Dilimleme Parts_Marmoset seçin ve açmak için tıklayın. İnsan beyni: Beyin Dilimleme Parts_Human (İlave kod dosyaları).
- Sağ tarafında tıklayın ve parçaları Genişletilmiş, Kabuklar seçin. tek tek her parçasını seçip onları doğru yeniden adlandırmak için tıklayın. (Bir nesneye sonraki göze tıklamak gizler veya görünür hale getirir.) Büyük bir kutu Ana, küçük bir kutu Sub ve kesme kutusu Box_Cutout, Altıgen şekil Blade_Holder_Main, küçük yassı kutu Mikroskobik Blade ve yarı yeniden adlandırma tüp nesne Cradle. İnsan beyni: hayır Blade_Holder_Main, Mikroskobik Blade veya Cradle.
- Main, Sub, Blade, Blade_Holder_Main, Mikroskobik Blade ve Cradle gizlemek ve tüm altı ve Box_Cutout seçmek için shift-select kullanın. Sadece Box_Cutout ve Smoothed_Edited_Brain_Model görünür, ancak Smoothed_Edited_Brain_Model seçilmemelidir.
- Tıklayın ve beyne görece kutu konumunu ayarlamak için seçilen parçaları sürükleyin.
- Kutunun merkezinde beyin yerleştirin. kutuda yeterince derin beyin sıkıca kavradı edilecek Böl, ama çok derin değil doğru yerleştirilmesi önlemek çıkıntılar oluşturmak için.
- konumlandırılmış sonra, beyin kutusu kontur çıkıntılar için test edilebilir. Box_Cutout ve Smoothed_Edited_Brain_Model seçin. Boolean İşlemi seçin.
- O kırmızı açmak için Smoothed_Edited_Brain_Model tıklayın.
- Boole Çıkarma seçin ve hesaplamalar uygulanır.
- güvenli bir şekilde kutunun içine konuyor beyin dokusu önleyecek çıkıntılar için beyin kutusunu işaretleyin. Bu çıkıntılar varsa o kutunun içinde daha az derin, bu yüzden beyin ayarlayın. Beyin istenilen derinlikte ve mesafelerinde isemevcut, çıkıntılar kaldırmak için bir çözüm için ek bölüm 10 bakın.
- Blade_Gaps modeli seçin. Sağ tıklayın, Taşı seçeneğini belirleyin. sonra pencereyi kapatın, pozisyon Z değerini kaydedin. Bu en arka bıçak boşluğu konumu olacaktır.
- Beyin Dilimleme Parça gelen Bıçak STL seçin. Sağ tıklayın, Taşı seçeneğini belirleyin.
- Mutlak çeviri seçin. 7,8'den Z değerini girin. X ve Y değerleri için, geçerli konum parametresi kutularından gelen değeri girin
- Bıçak STL seçin. sağ tıklayın, Kopyala düğmesini tıklatın.
- parçaları düzenleyin edin. toplam sayımında bıçakların toplam sayısını girin. Z sayısı kutunun içine aynı numarasını girin. Z boşluğa levha kalınlığını girin. Yinelenen tıklayın. kütük kalınlığı değiştiğinde, bıçak ağızları ayrı ayrı yerleştirilmiş olması gerekir. (Anterior posterior hareketli) Önceki her yeni bıçak çoğaltmakBu bölüm için bölüm kalınlığına eşit z boşluk.
- Mikroskobik Blade için adım 7.9 ve 7.10 tekrarlayarak dilimleme makinesi bıçaklar tam olarak aynı aralıklarla Mikroskobik Blade parçaları yerleştirin. İnsan beyni: bu adımı atlayın.
- Blade_Holder_Main kısmı ile birlikte Mikroskobik Blade seçin ve Boole İşletme seçin.
- Kırmızı bunları vurgulamak için Mikroskobik Blade tüm bıçakları seçin. Boole Çıkarma tıklayın ve hesaplamalar uygulanır.
- Seç Onarım modu. Genişletilmiş onarımı gerçekleştirmek. onarım uygulamak seçin ve eski bir parçası kaldırın.
- Bölüm Bıçak Tutucu yeniden adlandırın. STL olarak görev aktarın.
- Smoothed_Edited_Brain_Model, önceki adımda oluşturduğunuz Blade modelleri tüm ve Alt ve Main-select Shift. Boole operasyon tıklayın.
- Se Main kırmızı hariç tüm parçaları olunOnları çildiğinde ve yeşil kutusunun altında oku tıklatarak kırmızı taşımak için.
- hesaplamalar uygulamak seçin Boolean Çıkarma seçin ve.
- onarım moduna tıklayın. Onarım modunda:
- çıkıntılar ve keskin noktaları için kutuyu işaretleyin. Bunlar Netfabb veya Meshmixer içinde düzeltti edilebilir.
- Otomatik onarım, Genişletilmiş onarım tıklayın. Sonra onarım uygulamak ve eski bir parçası kaldırmak
- Sağ tamir beyin kutusuna tıklayın ve Beyin Dilimleme Kutu yeniden adlandırın. Bir STL olarak ihracat.
8. Ultimaker 2 Beyin Dilimleme Kutusu Yazdırma
- Marmoset Beyin: Cura
- Cura içine Beyin Dilimleme Kutusu alın.
- Döndür seçin ve yatağa düz yani kutuyu döndürmek için daireyi sürükleyin.
- 0.1 mm tabaka çözünürlük,% 50 dolum yoğunluğu, Raft: Yazdırma ayarlarını yapın.
- SD karta kaydet Aracı Yolu seçin. (Baskı süresi ~ 12 saat).
- İthalat Blade Tutucu içindeCura ve böylece yuva tarafta ve altıgen yüz XZ veya YZ düzleminde olduğunu döndürün.
- nesneyi çoğaltın.
- 0.2 mm tabaka çözünürlük,% 20 dolgu yoğunluğu, Ağız: Yazdırma ayarlarını yapın.
- SD karta kaydet Aracı Yolu seçin. (Baskı süresi ~ 3 saat)
- İnsan beyni: Cura
- Cura içine Beyin Dilimleme Box ithalat ve 8.1.2 gibi döndürün.
- Yazdırma ayarlarını ayarlayın: 0,2 mm tabaka çözünürlüğü,% 30-35 dolgu yoğunluğu, Raft.
- SD karta kaydet takım yolunu seçin. (Tek yarıküre kutusu için ~ 70 saat baskı süresi.)
- Ultimaker 2 On
- plakayı oluşturmak için tutkal sopa tutkal ince bir tabaka sürün.
- SD kart takın. baskı seçin ve bölümünü seçin.
9. Beyin Kesme
- marmoset Beyin
- Sabit beyin, beyin dilimleme makinesi, iki bıçaklı sahipleri, mikrotom bıçaklar, florlu yağ 1 ml, f bir iş istasyonu hazırlayınlat cımbız, koruyucu eldiven ve gömme kasetleri.
- bıçak tutucular yuvaların içine yeni mikrotom bıçakları yerleştirin. Her bıçağın eğimli kenar aynı yöne baktığından emin olun. Mikrotom bıçakları kullanırken koruyucu eldiven giyin.
- formalin beyin çıkarın ve yavaşça kurulayın.
- dilimleme makinesi içine beyin yerleştirin. fluorlu yağ birkaç damla kolay konumlandırma sağlamak için beyin ve dilimleyici uygulanabilir. Emin beyin yerine sıkıca olduğundan emin olun.
- İlgili bıçak yuvalarına bıçaklı bıçak tutucular yerleştirin.
- Bıçak sahiplerine aşağı doğru sıkıca bastırın ve beyin kesmek için yavaş denge basınç uygulayın.
- Beynin ön başlayarak, her seferinde, her levha, bir çıkarın. Bu levha kendisi çıkarmadan önce bir levha önünde mikrotom bıçağı giderilmesine yardımcı olur. Her levhanın ön / arka yönüne çok dikkat edin.
- Anterior An fotoğraf çekmekHer levhanın d arka yüzeyi. Posterior levhalar büyük olasılıkla ayrı parçalar bulunur, bu yüzden gömme için parçalara yönüne dikkat edecek. Bir gömme kasetine her kütüğü yerleştirin ve% 10 formalin çözeltisi içine hepsini koymak.
- İnsan beyni
- Dikkatle kutuya beynin uyum testi.
- Beyin yavaş yavaş, açılı bir kesim kullanılarak bir ucundan başlayarak ama sıkıca dilimleme dilimleyin. Her bıçak boşluğu yoluyla beyne kesin.
- sayısı ve her levhanın ön / arka yönlendirmeye yakından ilgilenerek, bir anda her levha biri çıkarın.
- Her levhanın ön ve arka yüzeyi fotoğraflar çekin. mühürlü% 10 formalin torbalarda döşeme yerleştirin. Doku blokları plaka kesilmiş ve gömmek için kasetler içerisine yerleştirilecektir olacaktır.
Beyin Box 10. Çıkarma Çıkmalar (Ek bölüm)
- dilimleri çekerek: Meshmixer
- Smoothed_Edit İthalated_Brain_Model.
- Düzenle'yi seçin, dilim olun. Yap dilimleri:
- Yığın 3D, Z, 1-2 mm kalınlık girmek seçin. Compute tıklayın. Dilimler yüklediğinizde, Kabul tıklayın.
- korteksin alt kısmına yakın Büyük alanlar ile 1 ya da 2 dilim seçin. Bu dilimler Alt kutunun seviyesinin altında olması gerekir.
- Brain_Slice_ # gibi bu dilimlerin her biri ihracat.
- çıkıntılar kaldırmak kadar dilimleri uzatılması Netfabb Profesyonel
- Brain_Slice_ # dilim alın.
- (Işaretli ise işaretini parçaları düzenlemek) her Brain_Slice_ # çoğaltın.
- Sağ her Brain_Slice_ # basıp Ölçeği bir kopyasını tıklayın.
- Işaretini kaldırın Sabit ölçekleme oranı. O Alt kutusunun alt seviyesine ulaşacak şekilde daha sonra Y yönünde beyin dilim büyütmek.
- Bu dilimler Brain_Slice_Big_ # yeniden adlandırın.
- Y konumu o kontrolbölümünde sağ tıklayarak ve seçerek hareket orijinal Brain_Slice_ # f. Orijinal Brain_Slice_ # dilimleri her biri için Y konumunu kaydedin.
- Hesaplama gerçekleştirin: Brain_Slice_ # [y konumu] - (Brain_Slice_Big_ # [y boyutu] - Brain_Slice _ # [y boyut])
- Bireysel Brain_Slice_Big_ # Her seçin, sağ tıklayın ve hareket seçin.
- Y çeviri parametre kutusuna 10.2.6 hesaplanan değeri girin. X ve Z çeviri parametreler için, geçerli konum parametresi kutularına bulunan değerleri girin. Mutlak yapıldı seçin. tıklayın Çevir ve pencereyi kapatın.
NOT: kutusu yaparken Brain_Slice_Big_ # dilimleri beyin ve bıçaklar ile birlikte çıkarılır.
- Y çeviri parametre kutusuna 10.2.6 hesaplanan değeri girin. X ve Z çeviri parametreler için, geçerli konum parametresi kutularına bulunan değerleri girin. Mutlak yapıldı seçin. tıklayın Çevir ve pencereyi kapatın.
Ek Tarama 11. Marmoset Beyin MR Cradle
- Beyin MR Cradle oluşturma
- Cr emin olun üst yüzeyiniAdle Box_Cutout aynı yükseklikte yer almaktadır. beşiğinde derinliği ve beyin pozisyonu dilimleme makinesi için olduğu gibi kurulum olmalıdır.
- Shift-select Smoothed_Edited_Brain_Model ve Cradle seçin.
- Boole işlemi seçin. kırmızı, daha sonra çıkartma işlemini seçmek vurgulamak için beyin seçin. Sonra hesaplamalar uygulanır. (Ayrıca varsa Brain_Slice_Big_ # dilim seçin.)
- dilimleme makinesi için daha önce yapıldığı gibi beşiği kontur herhangi bir keskin noktaları kaldırmak için onarım moduna girin. Genişletilmiş onarım seçin. onarım uygulayın ve eski bir parçası kaldırın.
- Sağ parçası MR Beyin Cradle yeniden adlandırmak için tıklayın. , STL Dışa Aktar'ı seçin.
- beşiği yazdırma: Cura
- Cura içine MR Beyin Cradle İthalat ve beyin kesme ile düz kısmı yukarı bakacak şekilde döndürün.
- 0.1 mm tabaka çözünürlük,% 100 dolgu yoğunluğu, Raft: Yazdırma ayarlarını yapın.
- SD karta kaydet takım yolunu seçin. (Baskı süresi ~ 10 saat)
- 8.3 açıklandığı gibi Ultimaker 2 yazdırın.
- yuvasını kullanarak Kazanılması yüksek çözünürlüklü T2 * MRG
- Bir kağıt havlu ile beynin yüzeyine hafifçe kuru formalin.
- dilimleme makinesi için tarif edildiği gibi beşiğinde beyin yerleştirin.
- 50 ml santrifüj tüpüne beyin ve yuvasını kaydırın. florlu yağ ile ağzına kadar doldurun.
- Yavaşça hava kabarcıkları beyne kaçmak için izin tüp sıkmak. Orada şekillendirme hava kabarcıklarını engellemek için tüp kapağının yerleşsin içine Cap Ekle yerleştirin. Kapağı Güvenli ve parafin ile tüp mühür.
- Daha önce tarif edildiği gibi bobin halinde tüp yerleştirin. 3D T2 * parametreleri Tablo 1'de verilmiştir.
- Mipav 18 anatomik 100 mikron T2 * -ağırlıklı satın almalar açın ve 10 inci edinimi kayıt olun. Kayıt parametreleri 1.1.7 aynıdır. Kayıtlı görüntüleri ortalama: Utilities, Görüntü hesap-Toplu görüntüleri, ortalama.
Sonuçlar
Bu yöntemin akışı beyin dilimlenmiş sonra, plakların yüzeysel yüzeylerin MR görüntüleri ve resimler arasında görsel bir karşılaştırma birden plaka üzerinde iyi bir yönlendirme maçı (Şekil 2) gösteren Şekil 1'de özetlenmiştir. levhalar parafine gömülü sonra, bir mikrotom üzerinde kesitlere ayrıldı ve boyanır. yüksek çözünürlüklü postmortem MR ve lekeli histoloji bölümleri arasında daha kapsamlı karşılaştırma marmoset beynin bütün yapılar arasında bir doğru ve tutarlı maç (Şekil 3) göstermektedir.
MS bu hayvan modelinde, hayvanlar serebral beyaz cevher yayılmış beyaz cevher lezyonları gelişir. Bu lezyonlar MR yaparak noninvaziv tespit edilebilir. Şekil 4 MRG bulguları patolojik alt tabakayı aydınlatmak için bu tekniğin yeteneğini gösterir. In vivo MR tespit Küçük lezyonlar olabilirpostmortem MR ve histoloji hem izlenebilir. ilavelerde gösterildiği gibi, lezyonlar içinde demiyelinizasyon (çevre dokuya kıyasla hiperintensitesi) MR sinyal değişikliği sürüş ana bileşenlerinden biridir. Histoloji ve postmortem MR da in vivo MR (Şekil 4) üzerinde cevapsız lezyonları gösterebilir.
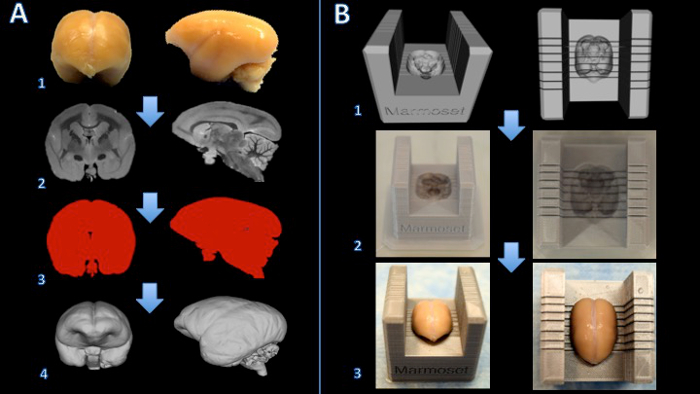
Bir marmoset beyin dilimleyici kutusu oluşturmak için 1. iş akışı Şekil. Beyin formalin (A1) ve T2 ağırlıklı MR kenar başına 150 mikron (A2) izotropik vokseller ile kazanılır ile sabittir. Görüntüler işlenir ve bir ikili maske (A3) oluşturmak için eşiklenir edilir. Yüzey daha sonra 3D modelleme yazılımı (A4) işlenir. Bir dilimleyici şablonuna ve beyin modeli arasında bir Boole çıkarma beyin dilimleme makinesi (B1) bir dijital modelini oluşturur. Beyin dilimleyici kutusu 3D yazıcı (B2) yazılıdır. Beyin sonra dilimleyici kutusuna sıkıca yerleştirilirKesme (B3). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
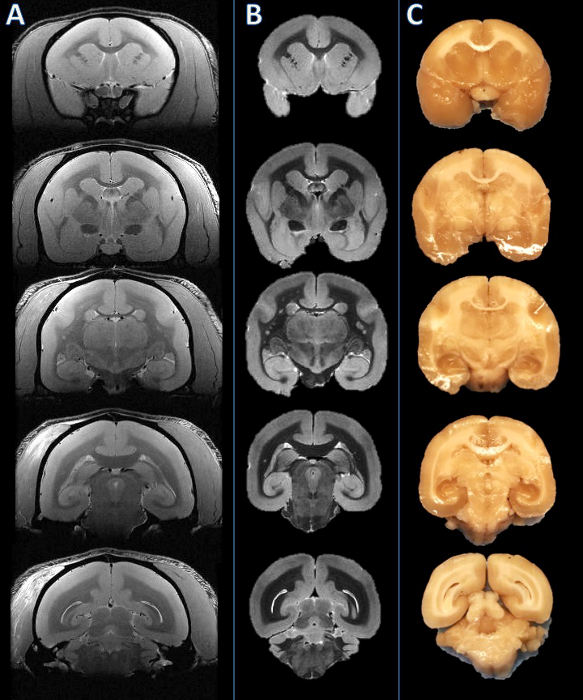
Şekil 2. Soldan sağa: in vivo MRI, postmortem MR ve doku döşeme fotoğrafı. Dilimleme uçaklar tekabül eden in vivo MR dilim (A) ile karşılaştırıldığında görsel postmortem MR (B) dayalı olarak kurulmuş ve bulundu. Daha sonra beyin kesilir ve elde edilen levhalar uyumlu (C) olduğu tespit edildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
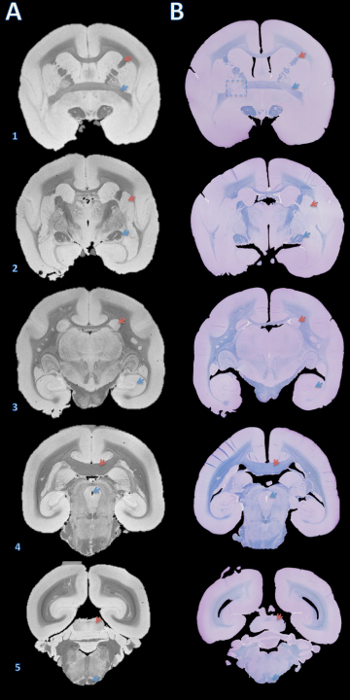
Şekil 3. Yüksek çözünürlüklü postmortem MR ve histolojibölüm eşleştirme. Levhalar 4 um bölüme bir mikrotom ile kesilmiş, ve hızlı mavi ve mor kresil (B) ile boyanmış parafin içine gömülmüştür. Kesitler daha sonra görsel 100 mikron T2 * beyin yapıları (A) dayalı MRG -ağırlıklı ile eşleştirildi. Bu Görüntüyü elde etmek için Ayrıntılar protokol ve Tablo 1. Beyin yapılarının ek bölümünde şunlardır: (1) kırmızı ok = iç kapsül, mavi ok = ön komissür; (2) kırmızı ok = putamen, mavi ok = optik sistem; (3) kırmızı ok = kaudat, mavi ok = hipokampus; (4) kırmızı ok = korpus kallosum, mavi ok = serebral su kemeri; (5) kırmızı ok = aşağı kollikulus, mavi ok = piramidal sistem. B1 kesikli kutu, ya beyin kesme veya parafine sırasında bir hata solda ön komissürün uyumsuzluğu yol Y ekseni etrafında hafif bir rotasyon nedeniyle bir dilim gösterir. Bir görmek için buraya tıklayınızBu rakamın daha büyük bir versiyonu.
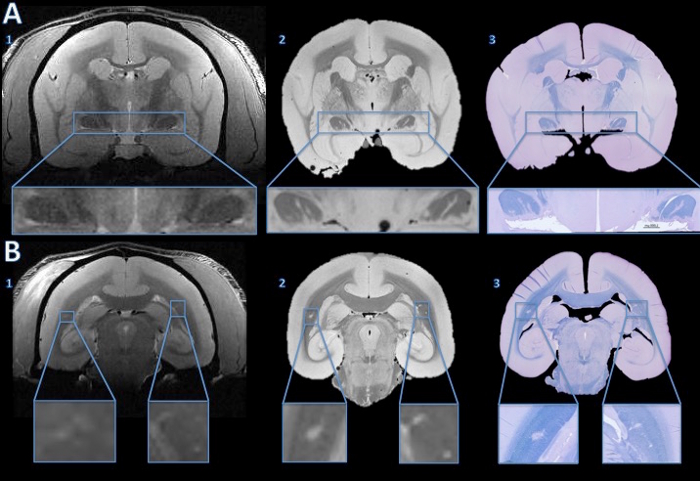
Şekil 4. histoloji bölümüne in vivo MR gelen lezyonlar izleniyor. In vivo MR ya optik yolu (A1) lezyonları önermek için anormal hiperintensitesi sinyalinin hiçbir inandırıcı kanıt gösterdi. Ancak, yüksek çözünürlüklü postmortem MR hem optik yolları (A2) açık hiper yoğun çizgiler görünüyor. 4 mikron histoloji bölümünün hızlı mavi / mor cresyl leke ex vivo MR görülen hiperintens alanlar (A3) demiyelinize olduğunu göstermektedir. Serebral beyaz cevherde, in vivo MR ince bilateral hiperintensitesi (B1, ilavelerde büyütülmüş) gösterir. hiperintens alanlar yüksek çözünürlüklü postmortem MR (B2) daha açıktır. 4 um'lik histoloji bölümünün LFB leke Bu alanlar (B3) demiyelinize olduğunu göstermektedir. Bazal i ile karşılaştırıldığında sonran vivo MR ve hemotoksilin-ve-eozin boyama, sağ taraf anatomik bir anormallik, bir miyelin kaybetmiş lezyon olduğu belirlenmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Yan kod dosyaları. Brain_Slicer_Parts_Marmoset.stl: Bu dosyayı indirmek için tıklayınız. Brain_Slicer_Parts_Human.stl: Bu dosyayı indirmek için tıklayınız. Cap_Insert.stl: Bu dosyayı indirmek için tıklayınız.
Tartışmalar
Burada özetlenen protokol MRG ve histoloji bölümleri arasında doğru bir karşılaştırma sağlar. protokol, marmosetler ve kemirgenler olarak insanlara veya küçük hayvanların beyinlerinde uygulanabilir birleşik biçiminde sunulmaktadır. büyük (insan) özgü ve beyinleri vurgulanır (insan dışı primat ve kemirgen), küçük ve beraberindeki video ve şekillerde farklılıklar biz marmoset uygulamayı göstermektedir. yaklaşım, basit olmasına rağmen, bu yöntem birçok adım hem de yazılımın çeşitli türleri kullanılmasını gerektirir. Ayrıca, potansiyel olarak bu yöntemin doğruluğunu etkileyen çeşitli sorunlar söz önemlidir.
In vivo MR görüntü kalitesi önemli bir faktördür. MRG ve dijitalleşen histoloji görüntüleri arasında görüntü çözünürlüğünde eşitsizliği en aza indirmek için, mümkün olan en küçük MR voksel boyutu kullanılmalıdır. Bu kavram aynı zamanda postmortem MR görüntü kalitesi için de geçerlidir. artarkenpostmortem MRG kazanım süresi hazırlık böyle hava kabarcıkları ile ilgili odak sinyal terkinde gibi görüntü eserler tanıtabilirsiniz, çok daha yüksek görüntü çözünürlüğü sağlar. Bu eserler dokusunu belirsiz yanı sıra konturu etkileyebilir. Dahası, postmortem MR doku boyutları tespit süreci ve süresine göre etkilenme olasılığı vardır. In vivo, ex vivo MR maçı yakından edinimi sırasında dilim geometri kurulumunda anatomik yerlerinden kullanarak yaklasık edilebilir olsa da, doğrusal olmayan bir kayıt hala bu iki MR görüntüleri eşleşen bir doğruluk yüksek derecede ulaşmak için gerekli olacaktır.
Beyin tutucu ve dilimleme makinesi tasarımı da çok önemli bir adımdır. Beynin dijital model yaratırken, bir yumuşatma algoritması biraz sabit beyne modeli göreceli büyütür olduğu uygulanır. Bu, tutucu ve dilimleme makinesi içine beynin kolay takılmasını sağlar ve tutucu keskin kenarları azaltır ve# 39; ın kontur. Model çok büyükse Ancak, (örneğin, daha fazla% 5), beyin postmortem MR ve / veya kesit sırasında hareket edebilir. Bir diğer önemli nokta Beyincik düzgün 3D baskılı nesnenin içine yerleştirilir ve böylece beyin modelinin tasarımını adapte etmektir. Beyincik otopside beyin çekimi sırasında zarar görmüşse, bu özellikle zor olabilir.
Beyin dilimleme makinesi ve tutucu yazdırırken, 3D yazıcı türü de dikkatle seçilmelidir. Bazı çoklu püskürtmeli yazıcılar destek malzemesi çıkarmak için bir fırın kullanarak post-processing gerektirir. bu yazıcıların su geçirmez ve masaüstü erimiş birikim modelleme (FDM) yazıcılara göre nispeten daha dayanıklı nesneleri üretmek mümkün olmakla birlikte, ısıtma işlemi beyin kontur mükemmel dik olmayan bıçak boşlukları oluşturarak, biraz kutuyu çözgü destekleri kaldırın.
Beyin kesit işlemi başka önemli bir adımdır. th kesme öncee levhalar halinde tüm beyin, beyin, beyin dilimleme makinesi içinde sıkıca oturuyor emin olmak için önemlidir: hafif basınç beynin üzerine tatbik edilir hiçbir hareket olmamalıdır. Bu mümkün bıçakları araştırmacılar tarafından belirlenen kesin bir yerde beyin aracılığıyla kesmek için yapacaktır. keserken sürekli, dengeli basınç hem bıçak sahiplerine uygulanmalıdır. Bıçakların netlik ve doku sertliğine bağlı olarak, hafif çapraz kesim hareketi düz kesim yüzeylerini korumak için avantajlı olabilir.
parafin gömme işlemi de MRG ve histoloji arasındaki hiza bir kaynak olabilir. Doku levha gömme işlemi sırasında kaset karşı düz oturan değilse, microtome kesme düzleminin ve levhanın yüzey yeri arasında bir eğim olacak. Bu, tüm doku maruz kaldığı düz uçağı bulmak için kullanılamaz bölümleri kesme gerektirecektir. eğilmelerini düzeltmek için bir yolduryüksek izotropik çözünürlüklü postmortem MR görüntüleme düzlemin açısını değiştirerek gereğidir. Ancak, bu genellikle anizotropik çözünürlük (genellikle kalın koronal dilim) ile kazanılır in vivo MR gerçekleştirmek neredeyse imkansızdır.
Son olarak, doku, yanı sıra (kırışıklık, çatlama, katlama) slaytlar hazırlanması sırasında formalin sabitleme dönemi ve parafine (büzülme) sırasında bazı deformasyon yaşayabilirsiniz. Bu deformasyonlar bazıları Slaytlarınıza aktarmadan önce bir su banyosunda 4-5 mikron bölümleri koyarak düzeltilebilir. Diğer deformasyonlar kısmen postmortem MR görüntüleri histolojik dijital görüntülerin deforme olabilen görüntü coregistration yaparak çözülebilir. Bununla birlikte, dikkatli ve yetenekli uygulama ile deformasyonları en aza bölümleri histoloji için MRG hacimleri eşleşen en etkili yaklaşımdır.
Sonuç olarak, burada sunulan metodoloji inv sağlarestigators doğru MRG bulguları altta yatan patolojiyi değerlendirmek için. Daha genel olarak, tanımlanması ve / veya iltihap veya remiyelinizasyon gibi belirli patolojik süreçler, hedef araştırmalar için yeni MR biyobelirteçlerini doğrulamak için umut verici bir yaklaşımdır.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
The Intramural Research Program of NINDS supported this study. We thank the NIH Functional Magnetic Resonance Imaging Facility. We thank Jennifer Lefeuvre and Cecil Chern-Chyi Yen for assistance with postmortem MRI acquisition. We thank John Ostuni and the Section on Instrumentation Core Facility for assistance with 3D printing. Figure 1 of this work used snapshots from MeshLab, a tool developed with the support of the 3D-CoForm project.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 7T/30cm USR AVIII Bruker MRI | Bruker Biospin | ||
| 38 mm Bruker Biospin volume coil | Bruker Biospin | ||
| Fomblin | Solvay Solexis | ||
| 50 ml Falcon Centrifuge Tubes, Polypropylene, Sterile | Corning | 21008-951 | |
| Fisherbrand Gauze Sponges | Fisher Scientrific | 13-761-52 | |
| Parafilm M All-Purpose Laboratory Film | Bemis | ||
| Leica RM2235 rotary microtome | Leica | ||
| Leica Disposable Blades, low profile (819) | Leica | ||
| Cresyl Violet Acetate, 0.1% Aqueous | Electron Microscopy Sciences | 26089-01 | |
| Luxol Fast Blue, 0.1% in 95% Alcohol | Electron Microscopy Sciences | 26056-15 | |
| ETOH | |||
| Ultimaker 2 Extended | Ultimaker | ||
| .75 kg Official Ultimaker Branded PLA Filament, 2.85 mm, Silver Metallic | Ultimaker | ||
| Axio Observer.Z1 | Zeiss | ||
| Zen 2 (Blue Edition) | Zeiss | ||
| Netfabb Professional 5.0.1 | Netfabb | http://www.netfabb.com/professional.php | |
| Meshmixer 10.9.332 | Autodesk | http://www.meshmixer.com/download.html | |
| Mipav 7.2 | NIH CIT | http://mipav.cit.nih.edu | |
| Cura | Ultimaker | https://ultimaker.com/en/products/cura-software |
Referanslar
- Evans, A. C., Frank, J. A., Antel, J., Miller, D. H. The role of MRI in clinical trials of multiple sclerosis: comparison of image processing techniques. Ann Neurol. 41 (1), 125-132 (1997).
- 't Hart, B. A., van Kooyk, Y., Geurts, J. J. G., Gran, B. The primate autoimmune encephalomyelitis model; a bridge between mouse and man. Ann Clin Transl Neurol. 2 (5), 581-593 (2015).
- Ontaneda, D., Hyland, M., Cohen, J. A. Multiple sclerosis: new insights in pathogenesis and novel therapeutics. Annu Rev Med. 63, 389-404 (2012).
- Guy, J. R., Sati, P., Leibovitch, E., Jacobson, S., Silva, A. C., Reich, D. S. Custom fit 3D-printed brain holders for comparison of histology with MRI in marmosets. J Neurosci Methods. 257, 55-63 (2016).
- Breen, M. S., Lazebnik, R. S., Wilson, D. L. Three-dimensional registration of magnetic resonance image data to histological sections with model-based evaluation. Ann Biomed Eng. 33 (8), 1100-1112 (2005).
- Dauguet, J., et al. Three-dimensional reconstruction of stained histological slices and 3D non-linear registration with in-vivo MRI for whole baboon brain. J Neurosci Methods. 164 (1), 191-204 (2007).
- McGrath, D. M., Vlad, R. M., Foltz, W. D., Brock, K. K. Technical note: fiducial markers for correlation of whole-specimen histopathology with MR imaging at 7 tesla. Med Phys. 37, 2321-2328 (2010).
- Schormann, T., Zilles, K. Three-Dimensional linear and nonlinear transformations: An integration of light microscopical and MRI data. Hum Brain Mapp. 6, 339-347 (1998).
- Jiang, L., et al. Combined MR, fluorescence and histology imaging strategy in a human breast tumor xenograft model. NMR Biomed. 26 (3), 285-298 (2013).
- Absinta, M., et al. Postmortem magnetic resonance imaging to guide the pathologic cut: individualized, 3-dimensionally printed cutting boxes for fixed brains. J Neuropathol Exp Neurol. 73 (8), 780-788 (2014).
- Gaitán, M. I., et al. Perivenular brain lesions in a primate multiple sclerosis model at 7-tesla magnetic resonance imaging. Mult Scler. 20 (1), 64-71 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır