Method Article
Utilizzando la tecnologia di stampa 3D per unire RM con Istologia: Un protocollo per Brain Sezioni
In questo articolo
Riepilogo
L'obiettivo generale di questo protocollo è quello di allineare con precisione magnetici volumi di immagini di risonanza (MRI) con sezioni istologia attraverso la creazione di supporti cervello 3D-stampati personalizzati e scatole affettatrice.
Abstract
Magnetic resonance imaging (MRI) allows for the delineation between normal and abnormal tissue on a macroscopic scale, sampling an entire tissue volume three-dimensionally. While MRI is an extremely sensitive tool for detecting tissue abnormalities, association of signal changes with an underlying pathological process is usually not straightforward. In the central nervous system, for example, inflammation, demyelination, axonal damage, gliosis, and neuronal death may all induce similar findings on MRI. As such, interpretation of MRI scans depends on the context, and radiological-histopathological correlation is therefore of the utmost importance. Unfortunately, traditional pathological sectioning of brain tissue is often imprecise and inconsistent, thus complicating the comparison between histology sections and MRI. This article presents novel methodology for accurately sectioning primate brain tissues and thus allowing precise matching between histology and MRI. The detailed protocol described in this article will assist investigators in applying this method, which relies on the creation of 3D printed brain slicers. Slightly modified, it can be easily implemented for brains of other species, including humans.
Introduzione
In vivo MRI provides a noninvasive and sensitive measure of tissue integrity at the macroscopic level. Changes in MRI signal intensity seen in vivo are outcome measures in many ongoing clinical trials.1 While the intensity changes seen via MRI can identify areas of abnormality in the context of the whole brain, they are often not sufficiently specific to differentiate pathological processes. This is especially true of dynamic processes involving multiple pathologies. For example, in multiple sclerosis (MS) or its animal model, experimental autoimmune encephalomyelitis (EAE), inflammation, edema, myelin degradation, axonal destruction, gliosis, and neuronal death overlap. 2, 3 To obtain the necessary specificity regarding the underlying pathology, context must be taken into account, together with knowledge of the histology of the MRI-identified abnormal tissues.
However, even in well-controlled animal experiments, matching histology with in vivo MRI is fundamentally challenging for various reasons. First, the difference in dimensional scales between histology sections and MRI is of several orders of magnitude.4 Second, for proper comparison, the orientation of MRI slice plane must match the sectioning plane of the brain tissue when cut. Due to the shape of the brain, it is very difficult to make consistently straight and accurate cuts when the brain is sitting on a flat surface. Third, the large size of the brain relative to a potentially small area of interest (lesion, tumor, etc.) creates a "needle-in-a-haystack" scenario for the pathologist processing the tissue. Fourth, even when the target tissue is found, it is commonly processed in such a way as to render virtually impossible an association with the original MRI data. Finally, traditional pathological sectioning of brain tissue is often imprecise and inconsistent, further complicating the comparison between histology sections and MRI images.
Previous attempts to overcome these challenges relied on the use of deformational algorithms to coregister the data and/or placement of fiducial markers within or around the tissue as a reference.5, 6, 7, 8 The former approach requires complex computational models that are particularly susceptible to complications due to data formatting, imaging artifacts, and changes caused by tissue processing.4 On the other hand, the latter approach introduces the possibility of contaminating or otherwise harming the tissue itself.9
The approach described here improves the transition between modalities through the use of postmortem MRI to bridge the gap between in vivo MRI and histology. Postmortem MRI provides three-dimensional (3D) images of the brain at higher resolution than can be achieved in vivo and furthermore provides the data needed for producing a morphologically accurate model of the brain surface. This digital model can then be used to create a 3D-printed custom holder for the brain. With careful positioning, the brain holder allows for precise, MRI-oriented brain sectioning, reducing the need for complex mathematical algorithms, and enables a focus on specific regions for targeted sampling.
Our laboratory recently introduced new methods for creating custom brain holders and slicers using postmortem MRI and 3D-printing technology for human10 and marmoset brains.4 The two methods allow for a more accurate correlation between MRI and histology in a research setting, and ultimately allow a deeper understanding of the specific pathology underlying MRI abnormalities. Carefully designed experiments, in which the brain is sampled repeatedly over time in vivo, can provide context for interpretation of the pathology, which in turn can add specificity to interpretation of the MRI. Here, we present a modified protocol in a unified framework that can be applied to any brain tissue, whether it derive from nonhuman primates, rodents, or humans. We provide detailed instructions, and a corresponding video, for the marmoset sectioning. Although the overall protocol applies to any type of brain, due to differences in MRI acquisition and tissue size, as well as the challenges encountered when dealing with specific brain types, there are some differences in the approach depending on the type of brain being processed. In this presentation, sections with "human" will denote differences in protocol specific to the human brain.
Protocollo
Tutto gestione e le procedure descritte nel presente documento animali sono stati eseguiti in base ad un protocollo approvato dal National Institute of Neurological Disorder and Stroke cura degli animali e del Comitato Usa. Brains sono stati raccolti da uistitì comuni (Callithrix jacchus) indotte a sviluppare EAE. 11 Brains sono stati conservati in formalina al 10% tra il 3 settimane e un anno dopo l'eutanasia da perfusione transcardial del 4% paraformaldeide.
1. Postmortem MRI Preparazione e Acquisition
- marmoset cervello
- Preparare una workstation con garza di cotone, 50 ml provetta da centrifuga, piccole spatole, ~ 30 ml di un olio fluorurato, paraffina, e il cervello marmoset.
- Riempire il tubo con l'olio fluorurato e garze alla tacca 20 ml. Comprimere la garza per rimuovere le bolle d'aria lungo la strada.
- formalina delicatamente secca dalla superficie del cervello con un tovagliolo di carta. Inserire il cervello con polo frontale verso il fondoil tubo. Fissare adeguatamente il cervello nel tubo utilizzando più garza intorno ai lati per fissare la sua posizione. Fare riferimento alla sezione supplementare 11 per un metodo di creazione di una culla di risonanza magnetica cerebrale per l'installazione di risonanza magnetica aggiuntivi.
- Riempire il resto del tubo con garza e olio fluorurato. Rimuovere con attenzione le bolle d'aria lungo la strada. Fissare il tappo e sigillare il tubo con paraffina.
- Segnare il tappo in linea con la fessura interemisferica. Avvolgere il tubo in un tovagliolo di carta e inserirla nella bobina con il marchio top-center.
- Acquisire 2D girare T2 eco. I parametri sono riportati nella tabella 1.
- Aprire le 10 anatomiche 150 micron acquisizioni T2-weigted in Mipav e registrarsi per il 6 ° di acquisizione.
NOTA: La registrazione è un algoritmo di registrazione 3.5D automatico ottimizzato con 9 gradi di libertà, finestrato interpolazione sinc, normalizzata funzione di cross costo di correlazione, con chiamate algoritmo di ricerca del Brent di una Powell. Le rotazioni sono state campionate da +106; a -10 ° con rotazioni grossolani incrementali 5 gradi e le rotazioni sottili di incremento 1 °. Poi la media delle immagini registrate: Utilità, Immagine immagini calcolatrice-Bulk, media.
- Cervello umano
- Separare proencefalo dal tronco cerebrale mediante taglio a livello del mesencefalo. 10 Gli emisferi possono anche essere separati con un taglio lungo la linea mediana.
- Posizionare proencefalo in un tubo cilindrico con una cupola emisferica ad una estremità e un beccuccio all'altra estremità.
- Riempire il tubo con un olio fluorurato attraverso il beccuccio. Rimuovere le bolle d'aria con aspirazione delicata per ~ 30 minuti attraverso il beccuccio.
- Acquisire 3D T1-MPRAGE. I parametri sono riportati nella tabella 1.
2. Estrazione del cervello Superficie: Mipav 7.2
- Aprire la risonanza magnetica con l'orientamento coronale.
- Selezionare Algoritmi, Strumenti di trasformazione, Transform, Resample. Selezionare dimensione definita dall'utente e ricampionare a isotvoxel ropic: 0,1 x 0,1 x 0,1 mm. Salvare la risonanza magnetica ricampionata come Brain_MRI_Resampled. Umano: ricampionamento per isotropa voxel 0,3 x 0,3 x 0,3 mm.
- Selezionare Algoritmi, Filtri (spaziale), la riduzione del rumore non lineare. Utilizzare le impostazioni predefinite, fare clic su OK.
- Selezionare Visualizza tabella di ricerca e fare clic sul pulsante a doppia soglia. Trascina il cursore sul grafico per coprire l'intero cervello.
- Selezionare Algoritmi, segmentazione, Soglia, Soglia utilizzando min / max. Inserire il valore che si trova nell'angolo in basso a sinistra del grafico intensità (appena al di sotto della scala) nella casella "limite inferiore". Selezionare "binario" in per il tipo di immagine di output e deselezionare "soglia invertito."
- Selezionare Algoritmi, morfologica, riempire i fori. Check "Processo in 2.5D."
- Poiché si tratta di una risonanza magnetica del cervello pieno, c'è qualche spazio vuoto tra romboencefalo e la corteccia che ha bisogno di essere riempito. Il cervello umano: saltare questo passaggio.
- Utilizzando la linea VOI, disegnare in un collegamentotra il romboencefalo e la corteccia su entrambi i lati del cervello nel punto più laterale. Continuare questo attraverso il cervello.
- Selezionare la conversione VOI, VOI, tutto per maschera binaria. Selezionare Utilità, calcolatrice immagine. Selezionare o dal menu a discesa dell'operatore e selezionare la maschera cervello. Selezionare "Promuovere destinazione tipo di immagine"
- Selezionare Algoritmi, morfologica, riempire i fori. Check "Processo in 2.5D"
- Salvare la maschera binario come Brain_Model.nii.
- Selezionare Algoritmi, superficie estratto (cubetti di marcia). Seleziona immagine maschera, Salva con nome Brain_Model.ply.
3. Selezione fetta Sedi: Mipav 7.2
- Identificare tessuto di interesse o posizione di partenza. Calcolare lo spessore della lastra previsto. In marmoset cervello, contando 30 MRI fette per sezione, e 5 fette di risonanza magnetica per interspazio lame, crea 3 sezioni mm con lacune lama 0,5 mm, con conseguente ~ lastre da 3,5 mm. Il cervello umano: 20 fette di risonanza magnetica per sezione, e 4 MRI slghiacci per interspazio lame, crea 6 sezioni mm con lacune lama 1,2 mm, con conseguente ~ lastre 7.2 mm.
- Presso la sede del primo interspazio lame, cliccare su "scatola VOI" e quindi disegnare una casella sopra il cervello. Fare clic all'interno della casella per selezionarla. Copiare e incollare il contorno per ogni fetta risonanza magnetica corrispondente al gap lama.
- Skip avanti per il numero di fette MRI corrispondenti allo spessore della sezione e copiare e incollare il contorno corrispondente al successivo lame. Ripetere questo processo attraverso il cervello.
- Selezionare VOI, VOI conversione, tutto per maschera binaria. Salva come Blade_Gaps.nii.
- Selezionare Algoritmi, estratto di superficie (cubetti di marcia), l'immagine Maschera, Blade_Gaps.ply.
4. Creazione di MRI lama Mappa: Mipav 7.2
- Aprire il Brain_MRI_Resampled e le immagini Blade_Gaps.nii.
- Con l'immagine Blade_Gaps.nii selezionata, selezionare Utilità, Immagine Math. Selezionare Promuovere tipo di immagine e si moltiplicano.Inserire 10.000 come valore.
- Selezionare Utilità, Calcolatrice immagine. Selezionare Aggiungi, quindi selezionare l'immagine Brain_MRI_Resampled dalla casella immagine discesa. Selezionare Promuovere destinazione tipo di immagine.
- Salva questa immagine come Brain_BladeMap.nii.
- Cliccando sulla vista Triplanar, i luoghi in cui verrà affettato il cervello può essere visto in tre viste ortogonali.
5. Importazione del cervello e Blade Gap Superfici: Netfabb professionale
- Selezionare parte, Aggiungi parte. Scegliere i file e Brain_Model.ply Blade_Gaps.ply
- Selezionare il cervello e cliccare su modalità di riparazione. In modalità di riparazione:
- Fare clic sul pulsante di selezione della shell, e quindi fare clic sul cervello.
- Fare clic sul pulsante di selezione di commutazione per selezionare le altre maglie. Clicca su Rimuovi per eliminare le altre maglie.
- Fare clic su Applica riparazione, e rimuovere la parte vecchia.
- Fare clic destro sul cervello. Selezionare mossa. Clicca sulPer il tasto origine. Registrare i parametri XYZ che appaiono. Questi parametri di traduzione sono necessarie per mantenere il posizionamento della lama istituito nel Mipav. Fare clic su Traduci. Poi chiudere la finestra. (Non fare clic tradurre più di una volta. Si tradurrà ancora una volta utilizzando gli stessi parametri.)
- Selezionare il modello Blade_Gaps. Fare clic destro sulla parte e selezionare Sposta. Inserire i valori XYZ registrati in precedenza nei parametri scatole XYZ. Ora clicca Tradurre e chiudere la finestra.
- Selezionare il modello Brain_Model e cliccare su modalità di riparazione. In modalità di riparazione:
- Fare clic sul pulsante di selezione della shell, e quindi fare clic sul cervello.
- Fare clic destro e selezionare Triangoli Smooth. Inserisci 4-5 iterazioni. Controllare il volume Prevenire restringimento. Il cervello umano: 1-2 iterazioni.
- Tasto destro del mouse, selezionare Riduci triangoli. Inserisci 200000 nel conteggio triangolo di destinazione e fare clic su Esegui.
- Clicca sulla riparazione automatica, la riparazione di default. Quindi fare clic su Applica Repair
- Tasto destro del mouse, Rinomina. Rinominare il cervello levigata come Smoothed_Brain_Model.
- Selezionare Smoothed_Brain_Model. Fare clic destro, Export, STL.
6. Modifica del cervello contorni: Meshmixer
- Importare il Smoothed_Brain_Model in Meshmixer.
- Utilizzare gli strumenti di scultura e di selezione per apportare modifiche alla maglia. Modifiche includono:
- Utilizzare strumenti di scolpire, robusto lisce. Smooth l'area corrispondente alla linea VOI. Il cervello umano: saltare questo passaggio.
- Lisciare la superficie della corteccia che si faccia in giù nella scatola.
- Smooth via piccole zolle che potrebbero essere stati creati nel processo di meshing e la modifica.
- Selezionare Analisi, ispettore, AutoRepair tutti.
- Esportare il Smoothed_Brain_Model come Smoothed_Edited_Brain_Model.
7. Creazione del cervello affettatrice Box: Netfabb professionale
- Selezionare Parte, Aggiungi Part. Scegliere il file Smoothed_Edited_Brain_Model.
- Selezionare Parte, Aggiungi Part. Quindi selezionare il file STL cervello affettatrice Parts_Marmoset e scegliere Apri. Cervello umano: cervello affettatrice Parts_Human (file di codice supplementari).
- Fare clic destro sulla parte e selezionare estese, conchiglie alle parti. Selezionare ogni parte singolarmente e fare clic destro per rinominarli. (Cliccando sul occhio accanto a un oggetto nasconde o rende visibile.) Rinominare la grande scatola principale, la piccola scatola Sub, e la scatola di taglio Box_Cutout, la Hexagon forma Blade_Holder_Main, la piccola scatola piatta Microtome Lama, e la mezza oggetto Cradle tubo. Il cervello umano: no Blade_Holder_Main, Microtome Blade, o culla.
- Hide principale, secondaria, Lama, Blade_Holder_Main, Microtome Lama, e culla e l'uso del cambio di selezione per selezionare tutti e sei e il Box_Cutout. Solo il Box_Cutout e la Smoothed_Edited_Brain_Model dovrebbe essere visibile, ma il Smoothed_Edited_Brain_Model non dovrebbe essere selezionata.
- Fare clic e trascinare le parti selezionate per regolare la posizione di dialogo relativa al cervello.
- Posizionare il cervello nel centro area. Postion il cervello abbastanza in profondità nella casella a essere saldamente afferrato, ma non troppo in profondità per creare sporgenze che impediscono il corretto posizionamento.
- Una volta posizionato, il contorno scatola cervello può essere testato per sporgenze. Selezionare il Box_Cutout e la Smoothed_Edited_Brain_Model. Selezionare booleano operazione.
- Clicca sul Smoothed_Edited_Brain_Model per trasformarlo rosso.
- Selezionare booleana Sottrazione, e applicare i calcoli.
- Selezionare la casella del cervello per sporgenze che potrebbero impedire il tessuto cerebrale di essere immessi in modo sicuro nella scatola. Se questi sbalzi sono presenti, regolare il cervello quindi è meno in profondità all'interno della scatola. Se il cervello è alla profondità e sporgenze desideratosono presenti, fare riferimento alla sezione supplementare 10 per una soluzione per rimuovere le sporgenze.
- Selezionare il modello Blade_Gaps. Fare clic destro, selezionare Sposta. Registrare il valore Z di posizione, quindi chiudere la finestra. Questa sarà la posizione del gap lame più posteriore.
- Selezionare l'STL Lama che è venuto da l'affettatrice parti del cervello. Fare clic destro, selezionare Sposta.
- Selezionare traslazione assoluta. Inserire il valore Z dal 7.8. Per i valori X e Y, immettere il valore corrispondente dalle scatole dei parametri posizione attuale
- Selezionare l'STL Blade. Tasto destro del mouse, fare clic su Duplica.
- Controllare Disporre le parti. Inserire il numero totale di lame nel conteggio totale. Immettere lo stesso numero nella casella numero Z. Inserire lo spessore della lastra nella fessura Z. Fare clic su Duplica. Se lo spessore della lastra è stata variata, dovranno essere posizionati singolarmente le lame. Duplicare ogni nuova lama dalla precedente (passando da posteriore ad anteriore)con la distanza z uguale allo spessore sezione per tale sezione.
- Posizionare le parti Microtome lama esattamente gli stessi intervalli come le lame nel affettatrice ripetendo il passaggio 7.9 e 7.10 per il microtomo Blade. Il cervello umano: saltare questo passaggio.
- Selezionare Microtome lama insieme alla parte Blade_Holder_Main e selezionare operazione booleana.
- Selezionare tutte le lame di Microtome Lama per evidenziarli rosso. Clicca su booleana Sottrazione, e applicare i calcoli.
- Selezionare la modalità di ripristino. Eseguire una riparazione esteso. Selezionare Applica la riparazione, e rimuovere la parte vecchia.
- Rinominare il Titolare parte della lama. Esportare la parte come STL.
- Maiusc-select Smoothed_Edited_Brain_Model, tutti i modelli blade creati nel passaggio precedente, e il Sub e Main. Clicca su operazione booleana.
- Fare tutte le parti tranne rosso principale di SEli nando e cliccando sulla freccia sotto la casella verde per spostarli in rosso.
- Selezionare booleano sottrazione e quindi selezionare applicare calcoli.
- Clicca su modalità di ripristino. In modalità di riparazione:
- Selezionare la casella di sporgenze e spigoli acuti. Questi possono essere appianate in Netfabb o Meshmixer.
- Fare clic riparazione automatica, riparazione esteso. Quindi applicare la riparazione e rimuovere la parte vecchia
- Fare clic destro sulla scatola del cervello riparato e rinominarlo cervello affettatrice Box. Esporta come STL.
8. Stampa del cervello affettatrice Box sul Ultimaker 2
- Marmoset Cervello: Cura
- Importare il cervello affettatrice Box in Cura.
- Selezionare Ruota e trascinare il cerchio per ruotare la scatola, quindi è piatta sul letto.
- Regolare le impostazioni di stampa: Risoluzione del livello di 0,1 millimetri, il 50% di densità di riempimento, zattera.
- Selezionare Salva Strumento Percorso per scheda SD. (Stampa tempo ~ 12 h.)
- Holder Importa Lama ina Cura e ruotarla in modo gli slot sono ai lati e la faccia esagonale è nel piano XZ o YZ.
- Duplicare l'oggetto.
- Regolare le impostazioni di stampa: Risoluzione del livello di 0,2 millimetri, il 20% di densità di riempimento, all'orlo.
- Selezionare Salva Strumento Percorso per scheda SD. (Tempo di stampa ~ 3 h)
- Cervello umano: Cura
- Importare il cervello affettatrice Box in Cura e ruotare come in 8.1.2.
- Regolare le impostazioni di stampa: risoluzione 0,2 millimetri strato, il 30-35% della densità di riempimento, Zattera.
- Selezionare Salva percorso utensile su scheda SD. (Tempo di stampa ~ 70 h per scatola singolo emisfero.)
- Sulla Ultimaker 2
- Applicare un sottile strato di colla stick colla per costruire piatto.
- Inserire la scheda SD. Selezionare Stampa e selezionare la parte.
9. Taglio del cervello
- marmoset cervello
- Preparare una stazione di lavoro con il cervello fisso, l'affettatrice cervello, due supporti lame, lame microtomo, 1 ml di olio fluorurato, fpinzette lat, guanti protettivi, e cassette incorporamento.
- Posizionare nuove lame microtomo nelle fessure i titolari della lama. Assicurarsi che il bordo smussato di ciascuna pala è rivolto nella stessa direzione. Indossare guanti protettivi quando si maneggiano le lame del microtomo.
- Rimuovere il cervello da formalina e delicatamente asciugare.
- Mettere il cervello in affettatrice. Alcune gocce di olio fluorurato possono essere applicati al cervello e affettatrice per consentire un facile posizionamento. Assicurarsi che il cervello è saldamente in posizione.
- Posizionare i supporti lama con le lame nei corrispondenti slot blade.
- Spingere verso il basso i supporti lama con fermezza e applicare una pressione lenta equilibrio per tagliare attraverso il cervello.
- Rimuovere ogni lastra, uno alla volta, a partire dalla parte anteriore del cervello. Aiuta a rimuovere la lama microtomo davanti una lastra prima di rimuovere la lastra stessa. Prestare particolare attenzione all'orientamento anteriore / posteriore di ogni lastra.
- Scattare foto del anterod superficie posteriore di ogni lastra. Le lastre posteriori molto probabilmente contengono pezzi separati, in modo da prestare attenzione all'orientamento dei pezzi per l'incorporamento. Mettere ogni lastra in una cassetta embedding e metterli tutti in una soluzione di formalina al 10%.
- Cervello umano
- verificare con attenzione la misura del cervello nella scatola.
- Tagliate il cervello a partire da una estremità con un taglio angolato, lentamente ma con fermezza affettare. Tagliare il cervello attraverso ogni varco lama.
- Rimuovere ogni lastra, uno alla volta, prestando attenzione al numero e anteriore / posteriore orientamento ogni lastra.
- Scattare foto della superficie anteriore e posteriore di ogni lastra. Posizionare le lastre in sigillati 10% sacchi di formalina. blocchi di tessuto saranno tagliati dalle lastre e poste in cassette per l'incorporamento.
10. Rimozione sporgenze a Brain Box (Sezione integrativa)
- Tirando fuori fette: Meshmixer
- Importare il Smoothed_Edited_Brain_Model.
- Selezionare Modifica, Make fette. In fette marca:
- Selezionare Stacked 3D, Z, immettere lo spessore di 1-2 mm. Fare clic su Calcola. Quando le fette di carico, fare clic su Accetta.
- Selezionare 1 o 2 fette con grandi perimetri nella parte inferiore della corteccia. Queste fette dovrebbero essere al di sotto del livello della scatola secondaria.
- Esportare ciascuna di queste fette come Brain_Slice_ #.
- Estendendo le fette fino a rimuovere le sporgenze: Netfabb professionale
- Importare i Brain_Slice_ # fette.
- Duplicare ogni Brain_Slice_ # (deselezionare organizzare le parti se selezionata).
- Fai clic destro su una copia di ogni Brain_Slice_ # e selezionare Scala.
- Deseleziona rapporto di scala fissa. Poi scalare la fetta cervello nella direzione Y in modo che raggiungerà il livello del fondo della scatola Sub.
- Rinominare queste fette Brain_Slice_Big_ #.
- Controllare la posizione Y of il Brain_Slice_ originale # facendo clic destro sulla parte e selezionando mossa. Registrare la posizione Y per ciascuna delle Brain_Slice_ # fette originali.
- Eseguire il calcolo: Brain_Slice_ # [posizione y] - (Brain_Slice_Big_ # [size y] - Brain_Slice _ # [size y])
- Selezionare le Brain_Slice_Big_ # singolarmente, fare clic destro e selezionare Sposta.
- Inserire il valore calcolato dal 10.2.6 nella casella del parametro di traduzione Y. Per i parametri X e Z di traduzione, immettere i valori situati nelle caselle dei parametri posizione corrente. Selezionare assoluta Traduzione. Clicca sul Tradurre e chiudere la finestra.
NOTA: Le fette # Brain_Slice_Big_ saranno sottratti con il cervello e le lame quando si effettua la casella.
- Inserire il valore calcolato dal 10.2.6 nella casella del parametro di traduzione Y. Per i parametri X e Z di traduzione, immettere i valori situati nelle caselle dei parametri posizione corrente. Selezionare assoluta Traduzione. Clicca sul Tradurre e chiudere la finestra.
11. Marmoset MRI del cervello culla per la scansione aggiuntive
- Creazione del Cradle MRI del cervello
- Assicurarsi che la superficie superiore del CrADLE è alla stessa altezza del Box_Cutout. La profondità e la posizione del cervello nella culla dovrebbero essere impostate come lo è per l'affettatrice.
- Maiusc-select per selezionare la Smoothed_Edited_Brain_Model e culla.
- Selezionare operazione booleana. Selezionare il cervello per evidenziarlo rosso, quindi selezionare la sottrazione booleana. Quindi applicare i calcoli. (Selezionare anche le fette # Brain_Slice_Big_ se applicabile).
- Entrare in modalità di riparazione per rimuovere eventuali punti taglienti nel contorno culla come fatto in precedenza per l'affettatrice. Selezionare riparazione esteso. Applicare la riparazione, e rimuovere la parte vecchia.
- Tasto destro del mouse per rinominare la parte del cervello di MRI culla. Selezionare Export, STL.
- Stampa la culla: Cura
- Importare la risonanza magnetica del cervello culla in Cura e ruotarlo in modo che la parte piatta con il ritaglio cervello è rivolto verso l'alto.
- Regolare le impostazioni di stampa: Risoluzione del livello di 0,1 millimetri, 100% di densità di riempimento, zattera.
- Selezionare Salva percorso utensile su scheda SD. (Tempo di stampa ~ 10 h)
- Stampa sul Ultimaker 2 come descritto in 8.3.
- L'acquisizione di alta risoluzione T2 * MRI usando la culla
- formalina delicatamente secca dalla superficie del cervello con un tovagliolo di carta.
- Posizionare il cervello in base come descritto per l'affettatrice.
- Far scorrere il cervello e culla in provetta da centrifuga da 50 ml. Riempire fino all'orlo con olio fluorurato.
- Premere delicatamente il tubo per consentire le bolle d'aria per sfuggire dal cervello. Inserire il Cap Inserire nella inserto del tappo della provetta per evitare la formazione di bolle d'aria da lì. Fissare il tappo, e sigillare il tubo con paraffina.
- Mettere la provetta a serpentina come precedentemente descritto. parametri 3D T2 * sono riportati nella tabella 1.
- Aprire le 18 anatomiche 100 micron T2 * pesate acquisizioni in Mipav e registrarsi per il 10 ° di acquisizione. parametri di registrazione sono gli stessi come in 1.1.7. Nella media le immagini registrate: Utilities, Immagine immagini calcolatrice-Bulk, media.
Risultati
Il flusso di lavoro di questo metodo è riassunto nella figura 1. Una volta che il cervello è a fette, un confronto visivo tra le immagini RM e le immagini delle superfici superficiali delle lastre mostra una buona partita orientamento su più lastre (Figura 2). Dopo le lastre vengono inclusi in paraffina, sono sezionati con un microtomo e colorate. Un confronto più approfondito tra l'alta risoluzione post-mortem RM e sezioni istologia colorate dimostra partite accurata e coerente in tutte le strutture del cervello marmoset (Figura 3).
In questo modello animale di SM, gli animali sviluppano lesioni della materia bianca sparsi in tutto il materia bianca cerebrale. Queste lesioni possono essere rilevati in maniera non invasiva eseguendo la risonanza magnetica. Figura 4 dimostra la capacità di questa tecnica per chiarire il substrato patologico dei risultati MRI. Piccole lesioni rilevate alla risonanza magnetica in vivo puòessere monitorati sia post-mortem MRI e istologia. Come mostrato in incastri, demielinizzazione all'interno delle lesioni è uno dei principali componenti di guida la variazione del segnale MR (iperintensità rispetto al tessuto circostante). L'istologia e post mortem RM può anche mostrare le lesioni perse sul in vivo MRI (Figura 4).
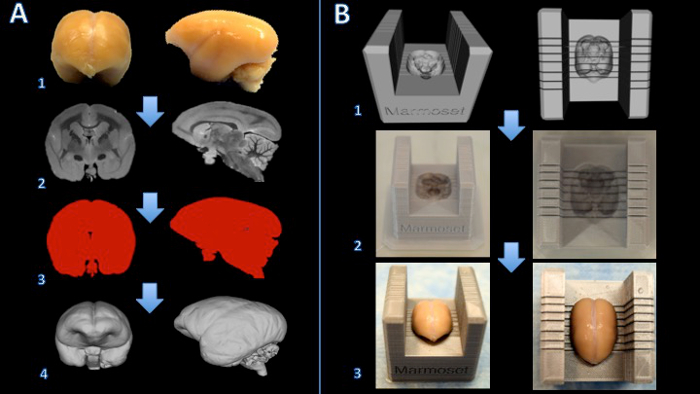
Figura 1. Flusso di lavoro per la creazione di una casella di affettatrice marmoset cervello. Il cervello è fissato in formalina (A1) e una risonanza magnetica pesata in T2 viene acquisito con voxel isotropico di 150 micron per bordo (A2). Le immagini vengono elaborati e thresholded per creare una maschera binaria (A3). La superficie viene poi reso in software di modellazione 3D (A4). Una sottrazione booleana tra un modello di affettatrice e il modello di cervello crea un modello digitale del affettatrice cerebrale (B1). La scatola affettatrice cervello è stampato su una stampante 3D (B2). Il cervello viene poi collocato saldamente nel box affettatrice pertaglio (B3). Clicca qui per vedere una versione più grande di questa figura.
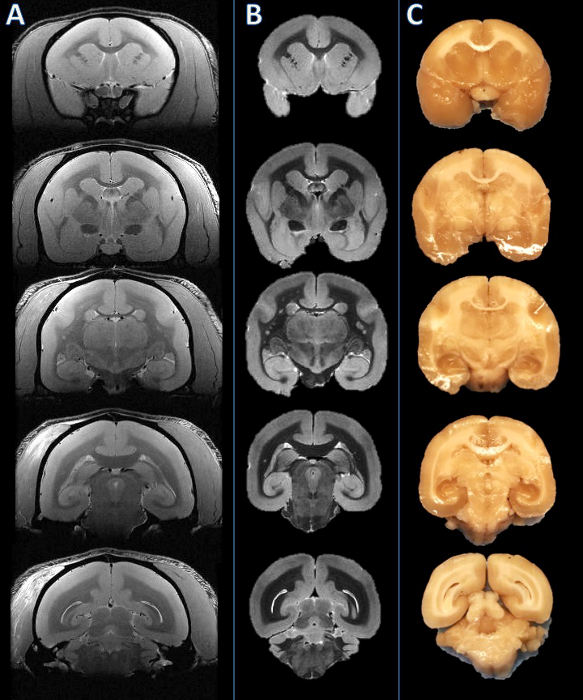
Figura 2. Da sinistra a destra: In vivo MRI, risonanza magnetica post-mortem, e la fotografia lastra tessuti. Piani di tranciatura sono stati stabiliti in base l'autopsia MRI (B) e visivamente rispetto al corrispondente vivo MRI slice in (A). Il cervello è stato poi tagliato, e le lastre risultanti sono stati trovati per essere coerente (C). Clicca qui per vedere una versione più grande di questa figura.
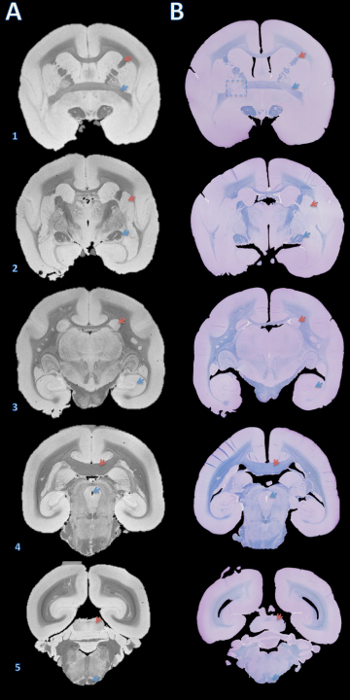
Figura 3. ad alta risoluzione post-mortem MRI e istologiasezione corrispondente. Le lastre sono stati inclusi in paraffina, tagliare con un microtomo in 4 sezioni micron, e colorati con veloce blu-violetto e cresil (B). Le sezioni sono state poi visivamente abbinati con il T2 pesate 100 micron * MRI sulla base di strutture cerebrali (A). Dettagli per l'acquisizione di questa immagine si trovano nella sezione supplementare del protocollo e Tabella 1. strutture cerebrali: (1) la freccia rossa = capsula interna, freccia blu = commissura anteriore; (2) la freccia rossa = putamen, freccia blu = tratto ottico; (3) la freccia rossa = caudato, freccia blu = ippocampo; (4) la freccia rossa = corpo calloso, freccia blu = acquedotto cerebrale; (5) freccia rossa = collicolo inferiore, freccia blu = tratto piramidale. Il riquadro tratteggiato in B1 indica una fetta in cui, sia durante il taglio cerebrale o paraffina, un errore causato una leggera rotazione attorno all'asse Y, che porta alla mancata corrispondenza della commissura anteriore sinistra. Clicca qui per visualizzare ungrande versione di questa figura.
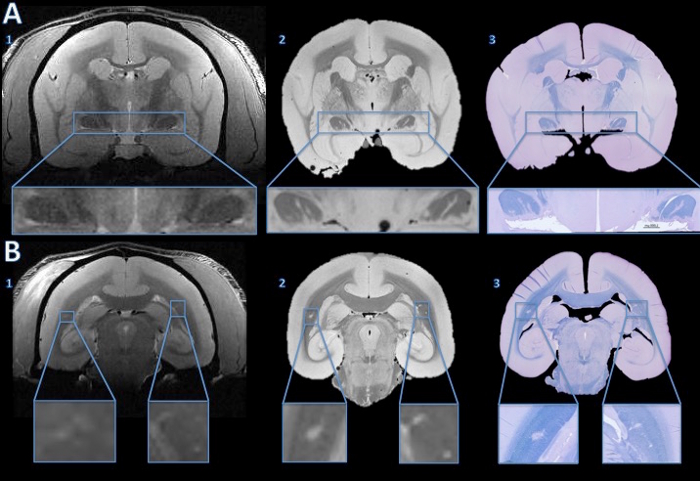
Figura 4. Monitoraggio lesioni da risonanza magnetica in vivo alla sezione istologica. La risonanza magnetica in vivo hanno mostrato alcuna prova convincente del segnale di iperintensità anomalo per suggerire lesioni in entrambe le vie ottiche (A1). Tuttavia, l'alta risoluzione MRI post mortem mostra chiari iper linee intense in entrambi i tratti ottici (A2). Il blu / violetto cresolo macchia veloce di una sezione istologica 4 micron mostra che le aree iperintense visto sulla ex vivo MRI sono demyelinated (A3). Nella sostanza bianca cerebrale, la risonanza magnetica in vivo mostra sottile iperintensità bilaterale (B1, ampliato nelle inserti). Le aree iperintense sono più evidenti in alta risoluzione postmortem MRI (B2). La macchia LFB di una sezione istologica 4 micron mostra che queste aree sono demielinizzati (B3). Dopo i confronti con i basalen vivo risonanza magnetica e una macchia hemotoxylin-e-eosina, il lato destro è stata determinata da una anomalia anatomica, non una lesione demyelinated. Clicca qui per vedere una versione più grande di questa figura.

File di codice supplementare. Brain_Slicer_Parts_Marmoset.stl: Fare clic qui per scaricare questo file. Brain_Slicer_Parts_Human.stl: Fare clic qui per scaricare questo file. Cap_Insert.stl: Fare clic qui per scaricare questo file.
Discussione
Il protocollo qui delineato permette un confronto preciso tra la risonanza magnetica e le sezioni istologia. Il protocollo è presentato in un formato unificato che può essere applicato al cervello umano o piccoli animali, come marmoset o roditori. Differenze specifiche per grandi (umana) e piccole (primati non umani e roditori) cervelli sono evidenziati, e nel video che accompagna e le cifre dimostrano che l'applicazione nel marmoset. Anche se il metodo è semplice, il metodo richiede molti passaggi e l'uso di diversi tipi di software. Inoltre, diversi problemi potenzialmente influenzano l'accuratezza di questo metodo sono importanti da menzionare.
La qualità dell'immagine del in vivo MRI è un fattore importante. Per ridurre al minimo la disparità nella risoluzione delle immagini tra RM e immagini digitalizzate istologia, dovrebbe essere usata la dimensione più piccola possibile MRI voxel. Questo concetto vale anche per la qualità delle immagini della risonanza magnetica post-mortem. Mentre l'aumentotempo di acquisizione a risonanza magnetica post-mortem permette risoluzione molto più elevata, la preparazione può introdurre artefatti come perdite di segnale focali relativi a bolle d'aria. Tali manufatti possono oscurare zone del tessuto nonché incidere suo contorno. Inoltre, le dimensioni del tessuto sulla post-mortem MRI sono suscettibili di essere interessate dal processo di fissazione e durata. Mentre in vivo per ex vivo partita risonanza magnetica può essere strettamente approssimato utilizzando punti di repere anatomici in configurazione geometria fetta durante l'acquisizione, la registrazione non lineare sarebbe ancora necessario per raggiungere un più alto grado di precisione in corrispondenza queste due immagini MRI.
Il disegno del titolare cervello e affettatrice è anche un passo cruciale. Nel creare il modello digitale del cervello, un algoritmo di smoothing viene applicato che un po 'allarga il modello relativo al cervello fisso. Ciò consente un facile inserimento del cervello nel relativo supporto e affettatrice e riduce spigoli vivi nel supporto &# 39; s contorno. Tuttavia, se il modello è troppo grande (ad esempio, più del 5%), il cervello potrebbe spostarsi durante l'autopsia MRI e / o sezionamento. Un altro punto importante è quello di adattare il design del modello cervello in modo che il cervelletto sia correttamente posizionato all'interno dell'oggetto 3D stampata. Questo può essere particolarmente difficile quando il cervelletto è stato danneggiato durante l'estrazione del cervello durante l'autopsia.
Quando si stampa l'affettatrice cervello e supporto, del tipo di stampante 3D deve essere scelto con attenzione. Alcune stampanti multi-getto richiedono post-elaborazione utilizzando un forno per rimuovere il materiale di supporto. Mentre queste stampanti possono produrre oggetti che sono a tenuta stagna e relativamente più durevole stampanti tavolo fusa Deposition Modeling (FDM), il processo di riscaldamento per rimuovere supporti possono leggermente deformarsi casella, creando lacune lama non perfettamente perpendicolari al contorno cervello.
Il processo cerebrale di sezionamento è un altro passo fondamentale. Prima di tagliare °e intero cervello in lastre, è importante accertarsi che il cervello è seduto saldamente all'interno del affettatrice cervello: ci dovrebbero essere movimento quando leggera pressione viene applicata sulla cervello. In questo modo sarà possibile per le lame per tagliare attraverso il cervello nella posizione esatta impostata dagli investigatori. Un continuo, a pressione equilibrata dovrebbe essere applicato a entrambi i titolari della lama durante il taglio. A seconda della nitidezza delle lame e la rigidità del tessuto, un leggero movimento di taglio trasversale potrebbe essere vantaggioso per mantenere la superficie di taglio piane.
Il processo di paraffina-embedding può anche essere una fonte di disallineamento tra risonanza magnetica e l'istologia. Se la lastra di tessuto non è seduto piatto contro la cassetta durante il processo di incorporazione, ci sarà una inclinazione tra il piano di taglio del microtomo e il luogo superficie della lastra. Ciò richiederà taglio sezioni inutilizzabili per trovare una superficie piana in cui tutto il tessuto è esposto. Un modo per correggere l'inclinazioneè cambiando l'angolo del piano visualizzazione su l'autopsia MRI ad alta isotropo risoluzione. Tuttavia, questo è quasi impossibile da eseguire sul vivo MRI in che di solito è acquisito con risoluzione anisotropo (tipicamente spesse fette coronali).
Infine, il tessuto può sperimentare alcuni deformazione durante il periodo in formalina fissazione e paraffina (ritiro), nonché durante la preparazione dei vetrini (pieghevoli, screpolature, rughe). Alcune di queste deformazioni possono essere corretti mettendo i 4-5 sezioni micron in un bagno d'acqua prima di trasferire su vetrini. Altre deformazioni possono essere in parte risolti eseguendo deformabile immagine coregistrazione delle immagini digitalizzate istologiche alle immagini MRI post mortem. Tuttavia, riducendo al minimo le deformazioni con un'attenta e qualificata la pratica è l'approccio più efficace per corrispondenza volumi risonanza magnetica per Istologia sezioni.
In conclusione, la metodologia qui presentata consente investigators di valutare con precisione la patologia sottostante dei risultati di risonanza magnetica. Più in generale, si tratta di un approccio promettente per l'identificazione e / o convalidare biomarcatori MRI innovativi per studi di ricerca che hanno come target processi patologici specifici, come infiammazioni o rimielinizzazione.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
The Intramural Research Program of NINDS supported this study. We thank the NIH Functional Magnetic Resonance Imaging Facility. We thank Jennifer Lefeuvre and Cecil Chern-Chyi Yen for assistance with postmortem MRI acquisition. We thank John Ostuni and the Section on Instrumentation Core Facility for assistance with 3D printing. Figure 1 of this work used snapshots from MeshLab, a tool developed with the support of the 3D-CoForm project.
Materiali
| Name | Company | Catalog Number | Comments |
| 7T/30cm USR AVIII Bruker MRI | Bruker Biospin | ||
| 38 mm Bruker Biospin volume coil | Bruker Biospin | ||
| Fomblin | Solvay Solexis | ||
| 50 ml Falcon Centrifuge Tubes, Polypropylene, Sterile | Corning | 21008-951 | |
| Fisherbrand Gauze Sponges | Fisher Scientrific | 13-761-52 | |
| Parafilm M All-Purpose Laboratory Film | Bemis | ||
| Leica RM2235 rotary microtome | Leica | ||
| Leica Disposable Blades, low profile (819) | Leica | ||
| Cresyl Violet Acetate, 0.1% Aqueous | Electron Microscopy Sciences | 26089-01 | |
| Luxol Fast Blue, 0.1% in 95% Alcohol | Electron Microscopy Sciences | 26056-15 | |
| ETOH | |||
| Ultimaker 2 Extended | Ultimaker | ||
| .75 kg Official Ultimaker Branded PLA Filament, 2.85 mm, Silver Metallic | Ultimaker | ||
| Axio Observer.Z1 | Zeiss | ||
| Zen 2 (Blue Edition) | Zeiss | ||
| Netfabb Professional 5.0.1 | Netfabb | http://www.netfabb.com/professional.php | |
| Meshmixer 10.9.332 | Autodesk | http://www.meshmixer.com/download.html | |
| Mipav 7.2 | NIH CIT | http://mipav.cit.nih.edu | |
| Cura | Ultimaker | https://ultimaker.com/en/products/cura-software |
Riferimenti
- Evans, A. C., Frank, J. A., Antel, J., Miller, D. H. The role of MRI in clinical trials of multiple sclerosis: comparison of image processing techniques. Ann Neurol. 41 (1), 125-132 (1997).
- 't Hart, B. A., van Kooyk, Y., Geurts, J. J. G., Gran, B. The primate autoimmune encephalomyelitis model; a bridge between mouse and man. Ann Clin Transl Neurol. 2 (5), 581-593 (2015).
- Ontaneda, D., Hyland, M., Cohen, J. A. Multiple sclerosis: new insights in pathogenesis and novel therapeutics. Annu Rev Med. 63, 389-404 (2012).
- Guy, J. R., Sati, P., Leibovitch, E., Jacobson, S., Silva, A. C., Reich, D. S. Custom fit 3D-printed brain holders for comparison of histology with MRI in marmosets. J Neurosci Methods. 257, 55-63 (2016).
- Breen, M. S., Lazebnik, R. S., Wilson, D. L. Three-dimensional registration of magnetic resonance image data to histological sections with model-based evaluation. Ann Biomed Eng. 33 (8), 1100-1112 (2005).
- Dauguet, J., et al. Three-dimensional reconstruction of stained histological slices and 3D non-linear registration with in-vivo MRI for whole baboon brain. J Neurosci Methods. 164 (1), 191-204 (2007).
- McGrath, D. M., Vlad, R. M., Foltz, W. D., Brock, K. K. Technical note: fiducial markers for correlation of whole-specimen histopathology with MR imaging at 7 tesla. Med Phys. 37, 2321-2328 (2010).
- Schormann, T., Zilles, K. Three-Dimensional linear and nonlinear transformations: An integration of light microscopical and MRI data. Hum Brain Mapp. 6, 339-347 (1998).
- Jiang, L., et al. Combined MR, fluorescence and histology imaging strategy in a human breast tumor xenograft model. NMR Biomed. 26 (3), 285-298 (2013).
- Absinta, M., et al. Postmortem magnetic resonance imaging to guide the pathologic cut: individualized, 3-dimensionally printed cutting boxes for fixed brains. J Neuropathol Exp Neurol. 73 (8), 780-788 (2014).
- Gaitán, M. I., et al. Perivenular brain lesions in a primate multiple sclerosis model at 7-tesla magnetic resonance imaging. Mult Scler. 20 (1), 64-71 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon