Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Dinamik için objektif-ücretsiz Video mikroskobu ve kantitatif analiz yapisan hücre kültürü
Bu Makalede
Özet
Objektif-ücretsiz video mikroskobu hücre kültürleri doğrudan kuluçka makinesi içinde izlemek sağlar. Burada biz almak ve kültürlü HeLa hücreleri 2,7 gün uzun edinimi çözümlemek için kullanılan tam iletişim kuralı tanımlamak, 2.2 x 10 bir veri kümesi için önde gelen6 ölçümleri tek hücre morfolojisi ve 10584 hücre döngüsü izler.
Özet
Burada, biz o objektif-ücretsiz video göstermek mikroskobu hücreleri doğrudan kuluçka makinesi içinde binlerce Kinetik aynı anda yakalamak için bize sağlar ve birkaç hücre döngüsü boyunca tek hücreleri ölçmek ve izlemek mümkündür. Biz 2,7 gün bir HeLa hücre kültürü ölçmek ve izlemek için kullanılan tam iletişim kuralı tanımlamak. İlk olarak, hücre kültürü edinme objektif-ücretsiz video mikroskopla gerçekleştirilir ve sonra verileri bir dört adımlı süreç aşağıdaki analiz edilir: Çoklu dalga boyu holografik yeniden yapılanma, hücre-izleme, hücre segmentasyon ve hücre bölünmesi algılama algoritmalar. Sonuç olarak, bir veri kümesi 10.000 hücre döngüsü parça ve 2 x 10'dan fazla6 hücre morfolojik ölçümler daha fazla featuring toplamak mümkün olduğunu gösteriyor.
Giriş
Boyut ve hücre hücre birkaç hücre döngüsü boyunca kültürlü memeli hücreleri izleme ve doğru ölçme kuru kütlesi olduğunu zor bir görev. Birkaç etiket içermeyen optik teknikleri bu görev1,2gerçekleştirmek edebiliyoruz: faz kayması Interferometry3, dijital holografik mikroskobu (DHM)4,5,6, 7, quadriwave yanal kesme Interferometry8,9 ve nicel faz tomografi10,11. Bu yöntemler memeli hücrelerinin hücre döngüsü anlayış içine birçok yeni anlayışlar açmıştır. Ancak nadiren algoritmaları izleme otomatik hücre ile birleştiğinde ve onların üretilen iş ne zaman ölçme sınırlı kalır kitle yörüngeleri1 hücre (N < 20 sırasıyla3,4,5 , 6). dolayısıyla bir roman optik yöntemi hücre kitle yörüngeleri büyük istatistikleri ile ölçmek için gereklidir (N > 1000).
Bu yazıda, biz aynı anda hücreleri doğrudan kuluçka makinesi içinde binlerce resim ve tek hücre ölçümleri tek hücre döngüsü parça binlerce boyunca ölçmek için objektif-ücretsiz video mikroskobu yeteneğini göstermek. Objektif-Alerjik mikroskobu mi nicel bir aşama aşama görüntü yoğun paketlenmiş hücre edinimi üzerinde görüş çok büyük bir alan sağlayan teknik görüntüleme (genellikle birkaç on mm2, burada 29.4 mm2)12,13 ,14,15. Tek hücre düzeyinde çeşitli ölçümler belirlenir, örneğin, hücre alanı, cep kuru kitle, hücre kalınlığı, hücre Binbaşı eksen uzunluğu ve en boy oranı12,15, her görüntü hücre. Sonra bir hücre izleme algoritma uygulayarak, bu özellikler tek her hücre için deneme süresi14,15bir fonksiyonu olarak çizilebilir. Ayrıca, hücre bölünmeler oluşumunu hücre parça olarak algılayarak, ilk hücre kuru kitle (hemen sonra hücre bölünmesi), son hücre kuru kitle (hemen önce hücre bölünmesi) ve hücre gibi diğer önemli bilgileri ayıklamak mümkün olduğunu döngüsü süresi, Yani, iki ardışık tümen15arasındaki süre. Bu ölçümler ile çok iyi istatistikler hesaplanabilir (N > 1000) geniş görüş alanı genellikle 200-10.000 hücreleri tek bir objektif-Alerjik kazanım analizi sağlayacak bu yana.
Objektif-ücretsiz video mikroskobu dayalı bu yöntemi açıklamak için protokolü için 2,7 gün bir HeLa hücre kültürü ölçmek ve izlemek için açıklar. Veri analizi çok dalga boyu holografik yeniden yapılanma, hücre izleme, hücre segmentasyon ve hücre bölünmesi algoritmaları dayalı dört adımlı bir işlemdir. Burada Standart hücre izleme algoritmaları ile uyumlu Uzaysal çözünürlük ve bu objektif-ücretsiz video mikroskobu Kur'a elde nispeten hızlı kare hızı (bir edinme her 10 dakikada bir) gösterilir. Bu veri kümesinin tam analiz tam hücre döngüsü 10,584 hücre parça ölçüm sonuçları.
Özet olarak, objektif-ücretsiz video mikroskobu otomatik olarak etiketlenmemiş, eşitlenmemiş binlerce ve deney başına değiştirilmemiş hücre izlemek için güçlü bir araçtır; birkaç hücre döngü üzerinde izlenen her hücre. Bizim ölçümleri böylece birkaç hücre parametreleri, ama daha da önemlisi, arası hücre değişkenlik hücrelerinin büyük bir nüfus üzerinden ortalama değerini sağlar.
Protokol
1. hücre kültürü edinme izleme
- DMEM + (örneğin, GlutaMAX) glutamin HeLa hücreleri büyümek orta % 10 (v/v) fetal buzağı ısı inaktive serum ve % 1 penisilin ve streptomisin ile desteklenmiştir.
- 6-iyi cam alt kültür pilakalar ve fibronektin (25 µg/mL) 1 h için kat. O zaman iyi başına 2 x 104 hücre tohum.
- Satın alma sırasında orta 3 günde değiştirin.
- Hızlandırılmış edinmesinin video mikroskop (ticari olarak mevcut) objektif ücretsiz kullanın.
Not: Bu objektif-Alerjik Hesaplamalı görüntüleme tekniği üzerinde Özcan vd tarafından açıklandığı gibi temel alır 16 bir kuluçka 37 ° C12,15kontrollü bir sıcaklık sürekli izleme gerçekleştirmek için güncellenmiştir. 1,67 µm bir piksel aralığı ve görüntüleme 6.4 x 4.6 mm2lik bir tamamlayıcı metal oksit yarı iletkeni (CMOS) görüntü algılayıcı bulunuyor. Birden çok dalga boyu aydınlatma kırmızı, yeşil ve mavi aydınlatma sağlayan bir multichip ışık yayan diyot (LED) aygıtı tarafından sağlanır. 636, 521 ve 452 dalga boylarında ortalanır nm sırasıyla, spektral bant genişliği 25, 45 ve 25 ile nm anılan sıraya göre. Kırmızı-yeşil-mavi (RGB) LED hücreleri yaklaşık 5 cm uzaklıkta bir 150 µm iğne deliği yukarıda yer alır. Ölçülen yakın LED ışık güç gibi düşük 10 µW at her dalga boyu ve aydınlatma zaman edinme başına yalnızca bir saniye. Bu nedenle, hücre kültürlerinde objektif-ücretsiz video mikroskop altında gözlendiğinde fotoğraf-toksisite sorun bekleniyor. - CMOS sensör (şekil 1) ile temas koymak hücre kültür kap koymak. Objektif-Alerjik edinme kalitesi için önemlidir alt cam coverslip ile bir kapsayıcı kullanın. Plastik kaplar-ebilmek da var kullanılmış ama objektif-Alerjik edinme görme duyusuyla ilgili kalitesiz bu kapları sayesinde düşer.
- Hızlandırılmış edinme ve holografik imar yapan video objektif-Alerjik mikroskop edinme yazılım (ticari olarak mevcut) ile kontrol. Yazılım arayüzü kullanıcı tarafından girilmesi gerekir kare hızı, deneme ve hücre kültürü, yani yapışık hücreleri veya yüzen hücreleri türünü süresi parametrelerdir.
- Satın alma yazılım giriş parametrelerini ayarlamak. Her 10 dakikada bir edinme küme ve hücre kültür tipi 'yapışkan' kare hızı ayarlayın.
Not: güvenilir bir hücre çözümlenmesi için elde edilen veri kümesi boyutunu hala makul olmakla birlikte izleme sağlar bir alım her 10 dakikada bir kare hızı iyi bir uzlaşma gibidir. En hızlı kare hızı bu objektif-Alerjik mikroskobu kurulum ile ulaşılabilir bir 5 dakikada değil. Daha fazla kare hızını artırarak aşırı ısınma kültür hücrelerdeki canlılık etkileyebilecek CMOS sensörünün sonuçlanır. - Hızlandırılmış edinme başlatmak ve holografik imar algoritması (ticari olarak mevcut) otomatik olarak hücre kültürü faz görüntüsünü elde etmek için objektif ücretsiz satın alma etkin olur. Holografik imar algoritması bir çoklu dalga boyu faz alma algoritması17 tarihinde dayanmaktadır ve RGB yeniden oluşturulan faz görüntüyü aralığında sağlar [-π, + π] 29.4 mm2görüş büyük bir alan üzerinde tek her hücre için. Bir objektif içermeyen satır içi Holografi ince bir örnek aydınlatmak için ilkesidir (z = 0) ile bir düzlem dalga (Toplam genlik 1 normalleştirme sonra) ve bir CMOS sensör üzerinde sonraki kırınım yoğunluğu görüntü kısa mesafe z algılamak için Z, sonra genellikle 1 mm = örnek. Bizim kurulum, aydınlatma sırayla 3 boyları için açık olduğundan (λ10,450 µm, λ2= 0.540 µm, λ3= 0.647 µm =) üç kırınım desen aynı örnek ölçmek için.
2. hücre Kültür veri analizi
- Hücre-izleme için Trackmate algoritması, tek parçacıklar18otomatik izleme için bir açık kaynak Fiji eklenti kullanın. İlk olarak, yük tam hızlandırılmış edinme Fiji (yük görüntü sırası komutu). Genellikle 400 RGB çerçeveler 29,7 MB özellikleri, veri kümeleri, büyüklüğü nedeniyle onları 8-bit biçimde yük daha hızlı olur. Sonraki Trackmate Fiji eklenti birkaç aşamada hücre izleme algoritması, yani bir hücre algılama sahne, bir hücre izci sahne ve hücre tespitlerde ve hesaplanan parça için uygulanan çeşitli filtreler aracılığıyla kullanıcıya gösterir. Her aşamada algoritmalar yapılandırmak ve sonuçları görüntülemek böylece hemen gerekirse, bir kolayca ileri geri ayarları yeniden düzenlemek için gidebilirsiniz. Trackmate arabiriminin çeşitli menüler Şekil 2 ' HeLa hücreleri deneme için kullanılan gerçek ayarları ile gösterilir.
- (Bkz: Şekil 2) takip olarak satın alma yazılım giriş parametrelerini ayarlamak. Tahmini blob çapı 15 piksel, 0,25 dedektörü eşik, bağlantı maksimum mesafe 15 piksel, gap-kapanış en fazla uzaklık 15 piksel ve 3.5 parçalardaki noktaların sayısını ayarlayın.
Not: Bu ayarlar belli ki bir deneyden başka bir '(burada 1,67 µm piksel cinsinden verilen) hücre boyutu karşılık gelen özellikle tahmini blob çapı' farklı olacaktır. Aynı remark '(burada 1,67 µm piksel cinsinden verilen) iki ardışık çerçeveler içinde bir hücre tarafından hangi hesap için maksimum mesafe yolculuk bağlantı maksimum mesafe' geçerlidir. En uygun değerini hücre hareketliliği aynı zamanda hücre yoğunluğuna bağlı olacaktır. - Hücre izleme işleminin sonunda sonuçları üç metin dosyası şeklinde oluşturma ('Analiz' düğme, bkz: Şekil 2). 'Noktalar parça istatistikleri' adlı en yararlı dosya (x, y) ilgili konumlarını satın alma, onların çerçeve numarası ve onların parça numarası ile algılanan tüm hücreleri listelendiği bir tablo oluşur. Bu bilgiler temelinde hücre segmentasyon gerçekleştirmek ve hücre adanmış algoritmaları (bkz: ek kod dosyaları) kullanarak bölümler algılamak. Diğer iki dosya 'Parça istatistikleri bağlantılar' adlı ve 'İzlemek istatistikleri' ve ilgili parça, örneğin parça sürelerini, algılanan boşluklar sayısı ile tüm sonuçlar içerir, izlemek ilk çerçeve, vb.
- Hücre segmentasyon algoritma kullanın (bkz: ek kod dosyasını otomatik olarak yeniden oluşturulan faz görüntüden hücre morfolojisi açıklayan çeşitli ölçümler ayıklamak için). Bu ölçümler hücre yüzey alanı (S), hücre Binbaşı eksen uzunluğu (M), hücre küçük eksen uzunluğu (m) ve hücre en boy oranı (L/m) dir. Objektif-Alerjik mikroskobu kurtarılan yoğunluğu ve15daha önce tartııldıı gibi numune katman kalınlığı orantılı aşamasıdır.
- Hücre morfolojik özelliklere ek olarak, nicel hücre kuru kitle (CDM) ölçümleri yeniden oluşturulan faz13,19,20 ayıklayın.
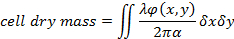 EQ (1)
EQ (1)
yeniden oluşturulan faz kayması19, λ dalga boyu ve α nerede φ(x,y) = 1.8 x 10-4 m3/kg kitle1, Kuru için Kırılma indisi varyasyonu ilgili belirli Kırılma indisi 19. - Hücre Kırılma indisi ile bu kültür ortamının arasındaki fark bir tahmini kullanarak hücre kalınlığı değerlendirin. Hücre kalınlığı h(x,y) ve ölçülen faz kayması ilişkisi20tarafından verilir:
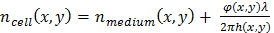 EQ (2,1)
EQ (2,1) EQ (2,2)
EQ (2,2)
Δn(x,y) = nhücre (x,y) - nOrta (x,y), hücre ve kültür medya arasındaki Kırılma indisi fark. Aşağıda, Δ sabit bir değer kabuln 0,025 =, hangi HeLa hücre çekirdeği içinde ölçülen Kırılma indisi üzerinden tahmin ediliyor (n = 1.35511) ve fosfat tamponlu tuz çözeltisi (PBS) kültür ortamının (n 1.33 =). Her ne kadar hücre Kalınlık değeri yalnızca bir varsayıma dayalı olarak göstergesidir, göreli varyasyonları anlamlı ve sayesinde bunun bölünen hücreler algılamak için kullandı. - Özel algoritması kullanın (hücre bölünmeler oluşumunu algılayan ve hücre bölünmesi algılamak için tespit edilen hücre bölümler için ilişkili hücre parçaları ayıklamak için bkz: ek kod dosyası) hücreleri ile ölçülen kalınlık 8 µm büyük kontrol yeni bir hücre yakından olarak görünüp görünmeyeceğini belirtir uzay ve zaman o zaman ilk, tanımlanır. Bu şekilde, hücre bölünmeler algılanması iki sağlam kriterlere dayanır. Alternatif ve hücre bölünmesi algılama için daha ayrıntılı yöntemleri için lensfree hızlandırılmış edinme21,22,23uygulanabilir.
Sonuçlar
Holografik yeniden yapılanma süreci için ışık alan bir skaler bir alan tarafından gösterilmiştir (nerede 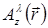 a karmaşık değerdir mesafe z örnek ve lateral pozisyonda uçakta
a karmaşık değerdir mesafe z örnek ve lateral pozisyonda uçakta 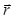 ve dalga boyu λ). Işık yayma yayıcısı çekirdek sağlayan Huygens-Fresnel teorisi tarafından örnek alınarak
ve dalga boyu λ). Işık yayma yayıcısı çekirdek sağlayan Huygens-Fresnel teorisi tarafından örnek alınarak
Tartışmalar
Bu yazıda, bu objektif-ücretsiz video mikroskobu içinde bir kuluçka hücreleri binlerce Kinetik yakalamak için kullanılabileceğini göstermektedir. Genel yöntembilim tanımlamak için HeLa hücreleri kültür 2,7 gün hızlandırılmış edinimi Standart hücre izleme algoritmalarıyla nasıl çözümlenebilir açıkladı. 2.2 x 106 hücre ölçümleri ve 10,584 hücre döngüsü parça içeren bir veri kümesi sonucudur. Satın almalar Hela hücreleri nispeten büyük bir hücre hücre mesafe ile bir ...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar kabul etmek bir şey yok.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cytonote lens-free video microscope | Iprasense | ||
| Horus acquisition software | Iprasense | ||
| 6-well glass bottom culture plates | MatTek corporation | Part No: P06G-0-14-F | |
| DMEM + GlutaMAX medium | Gibco | ||
| heat-inactivated fetal calf serum | Eurobio | ||
| penicillin and streptomycin | Gibco | ||
| Fibronectin | Sigma Aldrich | ||
| Matlab, image processing toolbox | Mathworks |
Referanslar
- Zangle, T. A., Teitell, M. A. Live-cell mass profiling: an emerging approach in quantitative biophysics. Nat Methods. 11 (12), 1221-1228 (2014).
- Popescu, G., Park, K., Mir, M., Bashir, R. New technologies for measuring single cell mass. Lab Chip. 14 (4), 646-652 (2014).
- Reed, J., et al. Rapid, massively parallel single-cell drug response measurements via live cell interferometry. Biophys J. 101 (5), 1025-1031 (2011).
- Mir, M., et al. Optical measurement of cycle-dependent cell growth. Proc Natl Acad Sci. USA. 108 (32), 13124-13129 (2011).
- Girshovitz, P., Shaked, N. T. Generalized cell morphological parameters based on interferometric phase microscopy and their application to cell life cycle characterization. Biomed Opt Express. 3 (8), 1757-1773 (2012).
- Kemper, B., Bauwens, A., Vollmer, A., Ketelhut, S., Langehanenberg, P. Label-free quantitative cell division monitoring of endothelial cells by digital holographic microscopy. J Biomed Opt. 15 (3), (2010).
- Mir, M., Bergamaschi, A., Katzenellenbogen, B. S., Popescu, G. Highly sensitive quantitative imaging for monitoring single cancer cell growth kinetics and drug response. PLoS One. 9 (2), 1-8 (2014).
- Bon, P., Savatier, J., Merlin, M., Wattellier, B., Monneret, S. Optical detection and measurement of living cell morphometric features with single-shot quantitative phase microscopy. J Biomed Opt. 17 (7), (2012).
- Aknoun, S., et al. Living cell dry mass measurement usinq quantitative phase imaging with quadriwave lateral shearing interferometry: an accuracy and sensitivity discussion. J Biomed Opt. 20 (1), 1-4 (2015).
- Cotte, Y., et al. Marker-free phase nanoscopy. Nature Photonics. 7 (2), 113-117 (2013).
- Choi, W., et al. Tomographic phase microscopy. Nat Methods. 4 (9), 717-719 (2007).
- Kesavan, S. V., et al. High-throughput monitoring of major cell functions by means of lensfree video microscopy. Sci Rep. 4, 1-11 (2014).
- Zheng, G., Lee, S. A., Antebi, Y., Elowitz, M. B., Yang, C. The ePetri dish, an on-chip cell imaging platform based on subpixel perspective sweeping microscopy (SPSM). Proc Natl Acad Sci USA. 108 (41), 16889-16894 (2011).
- Pushkarsky, I., et al. Automated single-cell motility analysis on a chip using lensfree microscopy. Sci Rep. 4, 4717 (2014).
- Allier, C., et al. Imaging of dense cell cultures by multiwavelength lens-free video microscopy. Cytom Part A. 91 (5), 1-10 (2017).
- Su, T. -. W., Seo, S., Erlinger, A., Ozcan, A. High-throughput lensfree imaging and characterization of a heterogeneous cell solution on a chip. Biotechnol Bioeng. 102 (3), 856-868 (2009).
- Delacroix, R., et al. Cerebrospinal fluid lens-free microscopy: a new tool for the laboratory diagnosis of meningitis. Sci Rep. 7, 39893 (2017).
- Tinevez, J. -. Y., et al. TrackMate: an open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2016).
- Popescu, G. Optical imaging of cell mass and growth dynamics. Am J Physiol Physiol. 295 (2), 538-544 (2008).
- Liu, P. Y., et al. Cell refractive index for cell biology and disease diagnosis: past, present and future. Lab Chip. 16, 634-644 (2016).
- Rapoport, D. H., Becker, T., Mamlouk, A. M., Schicktanz, S., Kruse, C. A novel validation algorithm allows for automated cell tracking and the extraction of biologically meaningful parameters. PLoS One. 6 (11), e27315 (2011).
- Al-Kofahi, O., et al. Automated cell lineage construction: A rapid method to analyze clonal development established with murine neural progenitor cells. Cell Cycle. 5 (3), 327-335 (2006).
- Meijering, E., Dzyubachyk, O., Smal, I., van Cappellen, W. A. Tracking in cell and developmental biology. Semin Cell Dev Biol. 20 (8), 894-902 (2009).
- Posakony, J. W., England, J. M., Attardi, G. Mitochondrial growth and division during the cell cycle in HeLa cells. J Cell Biol. 74 (2), 468-491 (1977).
- Zocchi, E., et al. Expression of CD38 Increases Intracellular Calcium Concentration and Reduces Doubling Time in HeLa and 3T3 Cells. J Biol Chem. 273 (14), 8017-8024 (1979).
- Reitzer, L. J., Wice, B. M., Kennell, D. Evidence that glutamine, not sugar, is the major energy source for cultured HeLa cells. J Biol Chem. 254 (8), 2669-2676 (1979).
- Benedetti, A. D. E., Joshi-barve, S., Rinker-Schaeffer, C., Rhoads, R. E. Expression of Antisense RNA against Initiation Factor eIF-4E mRNA in HeLa Cells Results in Lengthened Cell Division Times, Diminished Translation Rates, and Reduced Levels of Both eIF-4E and the p220 Component of eIF-4F. Mol Cell Biol. 11 (11), 5435-5445 (1991).
- Kumei, Y., Nakajima, T., Sato, A., Kamata, N., Enomoto, S. Reduction of G1 phase duration and enhancement of c-myc gene expression in HeLa cells at hypergravity. J Cell Sci. 93 (2), 221-226 (1989).
- Ginzberg, M. B., Kafri, R., Kirschner, M. On being the right (cell) size. Science. 348 (6236), 1245075 (2015).
- Mathieu, E., et al. Time-lapse lens-free imaging of cell migration in diverse physical microenvironments. Lab Chip. 16 (17), 3304-3316 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır