Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kültür ve zebra balığı primer hücre Transfection
Bu Makalede
Özet
Biz birincil hücre kültürleri zebra balığı embriyo transfection ve canlı hücre görüntüleme gibi primer hücre--dan yetişkin zebra balığı beyin hazırlamak için bir protokol için hazırlanması için etkili ve kullanımı kolay bir protokol mevcut.
Özet
Zebra balığı embriyo şeffaf ve hızla böylece bir sağlam ve gelişmekte olan omurgalılar dinamik biyolojik süreçlerin mükemmel vivo içinde görüntüleme için izin Anne, dışarıda geliştirmek. Ancak, farklı hücre tipleri ve hücre altı yapıları türleri morfoloji ayrıntılı görüntüleme tüm bağlar sınırlıdır. Bu nedenle, etkili ve kullanımı kolay bir iletişim kuralı kültür canlı primer hücre için zebra balığı embriyo ve yetişkin doku kurduk.
Kısaca, dechorionated, deyolked, steril ve collagenase sahip tek kişilik hücrelerin ayrışmış 2 dpf zebra balığı embriyo vardır. Filtrasyon adımdan sonra primer hücre cam alt yemekleri kaplama ve birkaç gün için ekili. Taze kültürler, olduğu kadar uzun vadeli differenciated olanlar, yüksek çözünürlüklü confocal görüntüleme çalışmaları için kullanılabilir. Kültür çizgili miyositler ve poli-L-lizin kaplama üzerinde önemli varlık nöronlar ile farklı hücre türleri içerir. Özellikle etiket hücre altı yapıları için floresan marker proteinler tarafından plazmid DNA nöronlar da dahil olmak üzere farklı hücre tipleri, içine transfection sağlayan bir adım iletişim kuralı da kurduk. Böylece, operatör huzurunda tanımlanmış uyaranlara, karmaşık hücre davranış ve hücre içi birincil zebra balığı hücre dinamiği yüksek uzamsal ve zamansal çözünürlük ile değerlendirilebilir. Buna ek olarak, Yetişkin zebra balığı beyin kullanarak, açıklanan ayrılma tekniği gibi temel kodlamayla koşulları da yetişkin zebra balığı doku için iş göstermektedir.
Giriş
Zebra balığı (Danio rerio, D. rerio) temel ve Biyomedikal araştırma1çok sayıda alanlar için omurgalı popüler bir modeldir. Zebra balığı embriyolar rahimhızla geliştirmek, şeffaf ve böylece canlı bir organizma olarak omurgalı geliştirme eğitim mükemmel önkoşulları sağlayan bir mikroskop altında Sığdır. Zebra balığı2genetik tractability nedeniyle, birçok istikrarlı transgenik muhabir satırları hücre türüne özgü ifade çeşitli floresan işaretleri ile belirli hücre popülasyonlarının gözlem için izin kurulmuştur. Zebra balığı topluluk sentetik Kal4TA4 (veya KalTA3-eşdeğer GalFF) ifade bir transgene taşımaya sözde Gal4-sürücü satırları geniş sunar gen Gal4 DNA'ya bağlanıcı etki alanı Maya ile erimiş viral transkripsiyon harekete geçirmek hücre türüne özgü arttırıcılar kontrolü altındaki etki alanları. Bu sürücü satırları transgenes bir muhabir gen erimiş bir tanımlanmış ters yönde harekete geçirmek sırasında (UAS) oluşan taşımak efektör satırlar için üzerinden geçilen. Kal4TA4 protein böylece hücre türü Seçici ifade muhabir gen3,4aktive UAS öğesine bağlar. Hemen hemen tüm kullanılabilir artırıcı ve muhabir'ndaki öğelerin çift transjenik hayvanlar çok çeşitli Kombinatorik çalışmaları için bu yaklaşım sağlar.
Ancak, tek tek hücreler veya hücre altı içeriklerini odaklanmak ile derinlemesine canlı görüntüleme bir bütün ve sürekli değişen embriyo sınırlıdır. Belirli hücre biyolojik soruları ile en yüksek çözünürlük için hücre kültürlerinde kullanımı genellikle tercih edilir. Zebra balığı, bazı hücre satır yok, ama ağırlıklı olarak seçilen5,6,7 olarak kabul edilir ve onların yayılma kez zaman alır. Ayrıca, tüm kullanılabilir hücre satırlarını türetilmiş, fibroblast hücreleri bir tür hücre kültürü kullanarak deneyler sınırlama vardır. Bu nedenle, biz doğrudan doğruya--dan zebra balığı embriyo ve yaklaşımlar ve uzun ömürlü kültür artırmak ekili çeşitliliği genişletmek için birlikte yetişkin zebra balığı beyin primer hücre hazırlamak için hem bir etkili ve kullanımı kolay iletişim kuralı kurulan hücre tipleri. Buna ek olarak, biz embriyonik primer hücre ifade yapıları floresan organel işaretleri ile transfect için bir yordam mevcut. Böylece, hücresel türleri Morfoloji ve hücre altı yapıları korumak onların temel özellikleri farklı hücre tipleri yüksek zamansal ve mekansal çözünürlükte ile çözümlenebilir.
Protokol
Burada açıklanan tüm hayvan yasal düzenlemelere (EU-yönergesi 2010/63) uygun şekilde bir iştir. Bakım ve balık işleme yerel yetkililer tarafından ve hayvan refahı Braunschweig Teknik Üniversitesi ve tüketicinin korunması, alt Saksonya eyalet Office ve gıda güvenliği (LAVES, Oldenburg, Almanya; temsilcisi tarafından onaylandı Az. §4 (02.05) TSchB TU BS).
1. Primer Hücre zebra balığı embriyo üzerinden hazırlanması
- Hazırlık 2 gün sonrası döllenme (dpf) zebra balığı embriyolar
- 1. gün: zebra balığı baskı seçtiği ve senin zebra balığı Tesis Yöneticisi8belirtimlerine göre çeşitli geçiş noktaları ayarlayın.
- 2. gün: balık dostum ve doğrudan bir 10 cm Petri kabına (plastik) yumurtlama sonra yumurta8 toplamak. Ölü ya da kirli yumurta ile Pasteur pipet (plastik) kaldırın. Yıkama 1 x Danieau %30 (5.8 mM sodyum klorür, 0,07 mM potasyum klorür, aldı 0.04 mM magnezyum sülfat, 0,06 mM Kalsiyum nitrat, 5 mM 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic asit, pH 7.2)8 %0,0001 (w/v) metilen mavisi ile ile yumurta. Orta Danieau olarak döviz metilen mavisi, metilen mavisi autofluorescence neden olabilir ve gece 28 ° C'de yumurtaları kuluçkaya beri olmadan % 30
Not: en az 100 yumurta balık satırda hücreler yeterli miktarda elde etmek için başlayın. 150'den fazla embriyo yerleştirilmesi bir Petri kabına yükseltmeyin. - 3. gün: ölü ya da kontamine embriyo kaldırmak ve orta Danieau olarak % 30 değişimi. Embriyo sayısını sayarak belirler. Gece 28 ° C'de embriyo kuluçkaya
Not: floresan muhabir ifade bir transgenik satırı kullanırken, tarama 1 dpf veya 2 dpf gerekli olabilir.
Not: embriyolar daha büyük miktarlarda için ilgili Petri kabına (Şekil 1A) siyah-beyaz bir görüntüsünü almak ve bir görüntüleme yazılımlarıyla embriyo sayısını ölçmek için önerilir. - 4. gün: Embriyo 2 dpf oldular. Chorions kaldırmak, 1 mL pronase konsantrasyonu 1 mg/mL ile Danieau %308 10 mL için eklemek ve tüm chorions kadar embriyo bir shaker oda sıcaklığında üzerinde kuluçkaya (20-40 dk ortam sıcaklığına bağlı olarak) ilişkisi kesildi. Danieau ile yıkama pronase ve chorions kaldırmak ve embriyo oda sıcaklığında kadar daha fazla kullanılmasını korumak için % 30.
- Yeniden kullanılabilir poli-L-lizin kaplamalı cam alt yemeklerin hazırlanması
Not: Piyasada bulunan cam alt yemekleri sadece tek-kullanılmak üzere tasarlanmış ve pahalıdır. Aşağıdaki yordam, yeniden kullanılabilir kendi kendine yapılan cam alt yemekleri Standart laboratuvar malzemeleri hazırlamak açıklar.- Standart hücre kültür yemekleri (çapı 6 cm, plastik) (Şekil 1B) altına 10 mm çapında bir delik. Çanak dipleri delme toz kaldırmak için musluk suyu ile iyice yıkayın.
- Silikon gres çanak dipleri alt Hole'da etrafında yayılmış ve bir coverslip yağ tutkal kullanarak ekleyebilirsiniz. Yağ çanak alt ve coverslip arasındaki boşluğu mühürler emin olun.
Not: kullanılan coverslips kalınlığı daha sonra görüntüleme uygulama için uygun olduğundan emin olun. - Kendi kendine yapılan cam alt yemekleri iyice, ama dikkatli bir şekilde, soğuk musluk su ve sabun ile yıkayın. Cam alt Bulaşık Sabun kaldırmak için üç kez deiyonize suyla durulayın. Tabak kapakları kurumasına ve çanak dipleri ve onları daha fazla kullanmak kadar temiz bir kutu içinde saklamak.
- Kültür hazırlama gün (gün 4, bkz: 1.1.4): her ikisi de iç nemlendirin çanağı kapakları ve çanak dipleri % 70 (v/v) etanol ile. Tabak kapakları yerleştirin ve yukarı bakacak şekilde iç tarafında steril bir tezgah laminar akış ve UV ışığı içinde dipleri çanağı. Etanol buharlaşan kadar kuruması sonra UV ışığı 20 min için uygulayın. Bu tedaviden sonra yemekler toplandı ve kadar steril olarak kabul.
- Kaplama, poli-L-lizin (0.1 mg/mL) her cam alt yemeğin ortasında 200 µL pipet ve sıvı coverslip üzerinde yüzey gerilimi bir pipet ucu ile kırarak yayıldı. İçin 60 dk kurumaya bırakın, sonra steril 1 fosfat tamponlu tuz çözeltisi (PBS) x 1 x yıkayın. Sıvı kaldırın. Yemekleri tezgah altında daha fazla kullanılmasını kadar tutun.
Not: Diğer kaplamalar deneme amaç bağlı olarak test edilebilir. Poli-L-lizin nöronların büyümesini desteklemek için yeterli bulduk, plastik olmadan tedavi ise ek herhangi bir kaplama fibroblast benzeri hücreler (Şekil 1E, F) büyüme için elverişli olduğu ortaya çıktı.
Not: Kendi kendine yapılan cam alt yemekleri birçok kez kullanılabilir. Coverslip değişimi için sıcak musluk suyu ile yıkayın, dikkatle coverslip ayırmak ve % 70 (v/v) etanol ve sabun ile kalan yağ çıkarmak.
- Hazırlık ve primer hücre kaplama
- Kültür hazırlama gün (gün 4, bkz: 1.1.4): Transfer embriyoların bir steril hücre kültür tabak içine (çapı 6 cm) taze bir plastik Pasteur pipet kullanarak. Tüm embriyoların çapı yaklaşık 2 cm veya daha az olan büyük bir düşüş toplanmış bulunuyoruz kadar sıvı step-wise kaldırın.
- Steril Vork Benç embriyo ile çanak yerleştirin ve CO2ekleyin-bağımsız Orta (% 10 ile desteklenmiştir (v/v) Sığır serum, 1 x glutamin ve % 1,2 (v/v) 10.000 filtrated U penisilin-streptomisin; tüm destekleri ile orta olduğunu aşağıda, "hücre kültür ortamı" olarak anılacaktır) kadar yarım dolu yemektir.
Not: Seçimli-e doğru CO2-bağımsız orta test edilebilir deneme, amaç bağlı olarak örneğin neurobasal orta DMEM orta veya iyi'nın L-15 orta. CO2-bağımsız orta ve iyi'nın L-15 orta var CO2 kuluçka gerektirmeyen avantajı. - Sarısı kaldırmak için yukarı ve aşağı 200 µL-pipet ucu kullanarak embriyo pipet. Başarılı deyolking orta clouding tarafından kabul edilebilir.
- % 70 (v/v) etanol ile bir hücre kültür yemek ve başka bir hücre kültür tabak taze hücre kültür orta ile doldurun. Bir kesme 1.000 µL-pipet ucu steril hücre süzgeç (40 µm; saplı içine embriyo transfer için kullanın Şekil 1 c). Süzgeç tarafından ele almak ve böylece tüm embriyoların 5 için batık etanol ile çanak içine daldırma hemen s. daha sonra taze hücre kültür orta ile çanak embriyo ile süzgeç daldırın.
Not: Hücre süzgeçler birkaç kez yeniden kullanılmış olabilir. Musluk suyu, mağaza onları % 70 etanol ve kuru ve UV tedavi çalışan altında temiz yumuşak bir fırça ile onları steril iş altında doğrudan kullanmadan önce tezgah (Ayrıca bkz: 1.2.4). - Steril 1,5 mL tepki tüpler (yaklaşık 100 embriyo bir tüp yerleştirilmesi) içine embriyo transfer. Hücre kültür orta ve 4 mg/mL 1 ml toplam birimindeki son bir konsantrasyon içinde seyreltilmiş collagenase (tip 2) ekleyin. Embriyo üzerinde dikey tüp rotator için oda sıcaklığında 45 dk dk başına 30 devrimler ile tüplerini kuluçkaya.
- Kalan hücre kümeleri embriyo-collagenase karışımı tarafından yukarı ve aşağı 1.000 µL-pipet ucu ile pipetting ayırmak. Daha sonra hücre süspansiyon ile havalandırma yarık (40 µm; bir steril hücre süzgeç aracılığıyla filtre uygulayın Şekil 1 d) 50 mL konik tüp içine. Süzgeç yaklaşık 10 mL taze hücre kültür orta ile yıkayın.
- 180 x g, 3 dk aralıklarla tarafından hücreleri cips. Pelet neredeyse görünmez olabilir. Dikkatle süpernatant kaldırmak ve 200 µL taze hücre kültür orta başına 30 başlangıçta kullanılan embriyo hücrelerinde resuspend.
Not: görünür Pelet elde etmek için en az 100 embriyo ile başlatmak için önerilir. - Adım 1.3.7 self-made poli-L-lizin-kaplı cam alt çanak cam alan üzerinde doğrudan elde hücre süspansiyon 200 µL pipet (1.2 bakın). Steril tezgah altında oda sıcaklığında 60 dk için kuluçkaya. 6 mL taze hücre kültür ortamının ekleyin ve primer hücre 28 ° C'de kuluçkaya
- 28 ° C'de ters bir mikroskop kullanarak istediğiniz görüntüleme uygulamayı gerçekleştirmek Hücre kültür orta günlük döviz. Kültürler (dap) kaplama sonra birkaç gün görüntüleme için kullanılabilir.
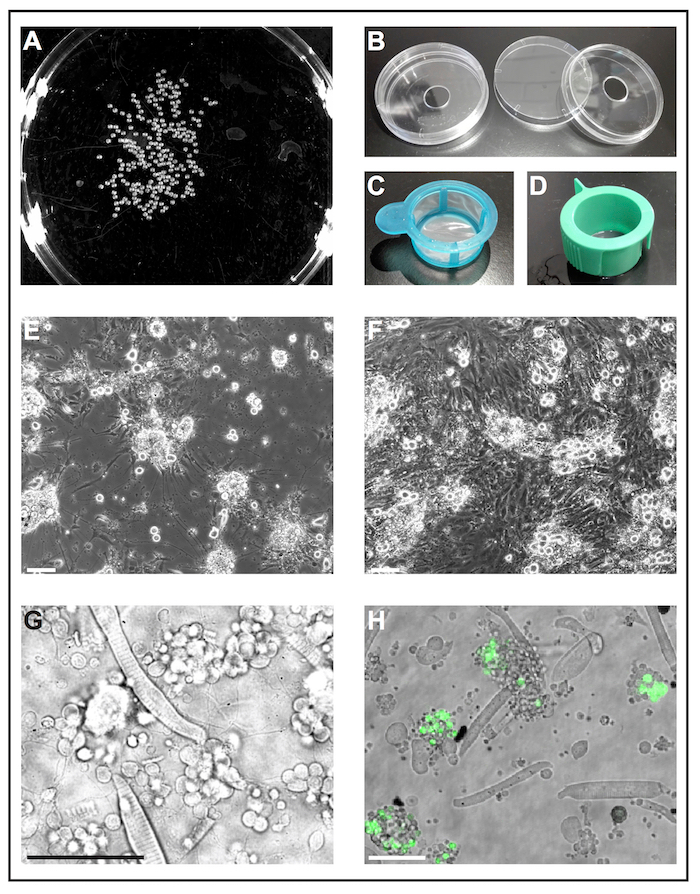
Şekil 1: birincil hücre kültürü zebra balığı embriyolar. (A)1 siyah-beyaz görüntü dap embriyolar, embriyo sayısı analiz için bir yazılım aracı tarafından işlenebilir. (B) hücre kültür yemekleri (çapı 6 cm) ile açılmış bir delik (çapı 10 mm) yeniden kullanılabilir kendi kendine yapılan cam alt yemekleri hazırlamak için kullanılır. (C) hücre süzgeçler (40 µm) basit bir kolu ile "açılış ağlar" deyolked embriyo etanol daldırma ve onları hızlı bir şekilde taze hücre kültür ortamına aktarmak için kullanılır. (D) hücre yuvaları havalandırma ile süzgeçler (40 µm) hücreleri collagenase-aracılı ayrılma sonra filtre uygulamak için kullanılır. (5 dap sonraE), primer hücre numaralı seribaşı öncelikle poli-L-lizin ile kaplı cam üzerinde formu nöronlar belirgin uzantılı. Ölçek çubuğu = 100 µm. (F) kaplama, fibroblast benzeri hücreler kültür sarmak olmadan 5 üzerinde işlem görmüş plastik dap sonra. Ölçek çubuğu = 100 µm. (E) ve (F) bir epifluorescent mikroskobu tarafından satın alınan. (G) bulaşan hafif görüntü İlköğretim 1'de vahşi türü zebra balığı türetilmiş hücre dap. Çizgili miyositler ve ince süreçleri uzanan nöron kümeleri kolayca görülebilir. Ölçek çubuğu 50 µm. (H) kültürlü transgenik satırının Tg = hücre (ptf1a: eGFP) jh1, eGFP arka beyin çoğunlukla GABAergic nöronlarda nöronal ataları ve Retina hücre popülasyonları29, bir alt kümesini ifade eder 30 , 31. ölçek çubuğu = 50 µm. (G) ve (H) (B) gösterildiği gibi yapılan cam alt yemekler kullanarak mikroskobu tarama confocal bir lazer satın alınan. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
2. İlköğretim transfection plazmid DNA ile hücreleri
- Resuspend filtrated ve pelleted hücreleri elde 1.3.7 1 x PBS hücre kültür orta yerine içinde adım. Bir aliquot Trypan bir sayım odası9cep numarasını belirlemek için mavi hücre süspansiyon leke.
- 0.5 milyon hücre 10 µg ultra-saf plazmid DNA 1,5 mL tepki tüp içinde karıştırın ve 1 x PBS ile 100 µL için toplam ses seviyesini.
Not: bizim deneyler için Biz esas olarak plazmid pCS2 +10tabanlı ifade yapıları kullanılır. İfade açık okuma çerçevesi pCS2 + klonlama birden çok siteye klonlanmış insan sitomegalovirüs (CMV organizatörü) her yerde düzenleyici tarafından tahrik edilmektedir. Diğer ifade yapıları ve rehberleri (Ayrıca bkz: temsilcisi sonuçları ve Şekil 2 ve Şekil 3) test edilebilir. - Transfer hücre DNA karışıma bir Elektroporasyon küvet (0.4 cm), hemen bir adım aygıt ve electroporate aşağıdaki ayarlarla küvet koyun: tek seferlik darbe, üstel çürüme, 280 V, 950 µF.
- Doğrudan Elektroporasyon sonra hücre DNA mix taze hücre kültür ortamının 300 µL ile 1,5 mL tepki tüp içine aktarın.
- 1.3.8 içinde açıklandığı gibi hücre süspansiyon 200 µL plaka ve devam 1.3.9 bağlı olarak kullanılan ifade yapısı açıklandığı gibi ifade floresan proteinlerin bir kaç saat sonra ya da ertesi gün itibariyle tespit olabilir.
3. sabit primer hücre boyama
Not: Hücre altı yapıları da çift immunostaining floresan füzyon protein gazetecilere kullanmak yerine tarafından görüntülenmeyecektir. Zebra balığı primer hücre için aşağıdaki standart protokol örnek leke çekirdeği, F-aktin ve acetylated tübülin floresan işaretleri ile kullanın.
- Poli-L-lizin kaplamalı kapak paket fişi hücrelerdeyse plaka (bkz. yukarıda 1.3.8) açıklandığı gibi bir hücre kültür çanak veya multiwell tabak içinde yerleştirilir.
- Giderme, orta kaldırmak ve 1 x PBS %4 paraformaldehyde hücrelerle kapsar. Bir shaker üzerinde 4 ° C'de 10 dakika için hücreleri kuluçkaya. Yıkama 3 x 1 x PBS oda sıcaklığında ile her 5 min için hücreleri. 1 x PBS hücreleri tamamen kapsar emin olun ve bir shaker çamaşır adımları gerçekleştirin.
- Engellemek ve sabit hücreleri, permeabilize için % 5 yağsız süt ve %0,3 içeren 1 x PBS ile hücreleri kapak için Triton X-100. Bir shaker üzerinde oda sıcaklığında 10 dakika için hücreleri yerleştirin. Hücreleri 3.2 açıklandığı gibi yıkayın.
- Acetylated tübülin, akson11, avans etiketlemek için 1 x PBS % 1 yağsız süt içeren birincil antikor 1:2,000 oranında seyreltin. Bu çözüm hücrelerle kapak ve onları gece bir shaker üzerinde 4 ° C'de kuluçkaya. Ertesi gün, hücreleri 3.2 açıklandığı gibi yıkayın.
- Yeşil fluorochrom floresein isothiocyanate (FITC) 1: %100 1 yağsız süt içeren 1 x PBS içinde ile Birleşik ikincil antikor sulandırmak ve karanlık oda sıcaklığında 1 h için bu çözüm hücrelerle kuluçkaya (çanak Örneğin bir kutu ile kapak veya Alüminyum folyo) bir shaker üzerinde. Hücreleri 3.2 açıklandığı gibi yıkayın.
- 1 x PBS ile kırmızı fluorochrome (1:50) ve 4', 6-diamidino-2-phenylindole (DAPI)13 (100 ng/mL) Oda, 10 min için Birleşik Phalloidin12 ile takıma hücrelerde aynı anda aktin sitoiskeleti ve çekirdekleri leke için kuluçkaya bir shaker karanlık sıcaklığında. Hücreleri 3.2 açıklandığı gibi yıkayın.
- Hücreleri görüntüleme için hazırlamak için bir cam nesne taşıyıcı (mikroskop kaymak) temiz bir yüzey üzerinde koymak ve montaj medyada damla üzerinde yer. Bir kapak notu sabit ve lekeli hücrelerle Cımbız kullanarak bir tabak dışarı alın ve nesne taşıyıcı karşı karşıya bulunduğu hücreleri teslimi yerleştirin. O montaj orta kapak fişinin tüm alana yayılır emin olun. Let karanlık kuru.
- Mağaza sabit ve istediğiniz görüntüleme uygulamayı gerçekleştirilene kadar 4 ° C'de karanlık hücrelerde monte.
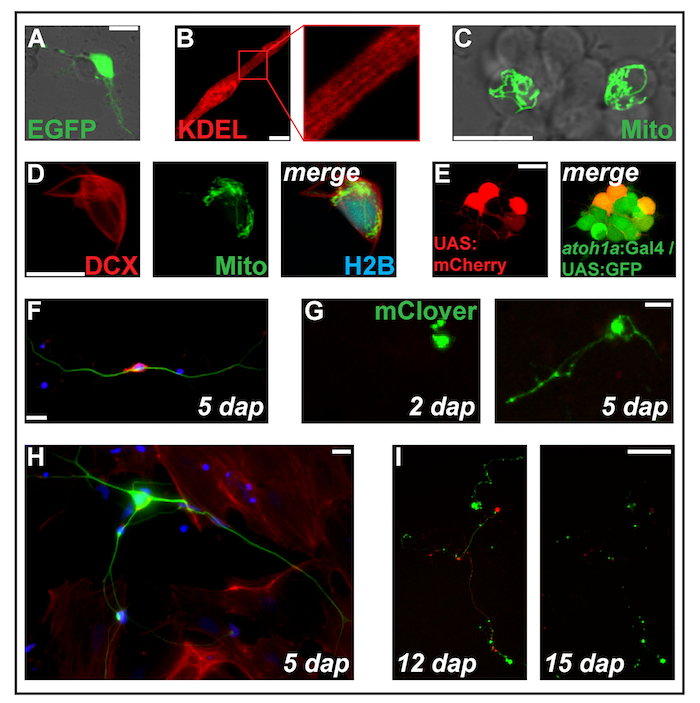
Resim 2: Transfection ifade oluşturur tarafından Elektroporasyon. (A)1 adet-eGFP ile transfected Putative nöron dap. (B) çizgili myocyte (2 dap) protein endoplazmik retikulum hedefli ss-RFP-KDEL ifade. (C) 2 adet-MitoTag-YFP ile transfected nöronal küme içindeki iki neurons dap. (D) hücre (2 dap) üç kez transfected ile pCS-DCX-tdTomato, PC'ler-MitoTag-YFP ve PC'ler-H2B-mseCFP. (E) pSK-Primer (1 dap) hücre içine UAS:mCherry electroporated elde edilen transgenes Tg taşıyan çift transgenik embriyo (atoh1a: Gal4TA4) hzm222 ve GFP ifadede sonuçlanan Tg (4xUAS:KGFPGI) hzm332 arka beyin nöronal ataları. Ölçek çubukları = 10 elde confocal bir lazer cam alt yemekleri Şekil 1Badımında gösterildiği gibi yapılan kullanarak mikroskobu tarama µm. (AE). (F) Floresan sabit zebra balığı birincil nöronlar saat 5'te boyama dap. Mavi: DAPI (çekirdek); Kırmızı: Phalloidin (F-aktin); Yeşil: tübülin (nöron) Acetylated. Ölçek çubuğu pCS-Kes ile transfected 10 µm. (G) nöron benzeri hücre =. 2 dap, uzantısı görünür. Saat 5'te dap, neurite benzeri yapıda oluşturmuştur. Ölçek çubuğu 25 µm. (H) = (F), hücre olarak aynı hazırlık üzerinden nöron fibroblast benzeri hücreleri tarafından çevrili. Ölçek çubuğu 10 µm transgene Tg taşıyan bir transgenik embriyo türetilmiş. (ı) nöron = (XITubb: DsRed) zf14828 adet-Kes ile transfected. 12 ve 15 arasında dap, neurites büyük dejenerasyon tabi. Ölçek çubuğu = 100 (F-ben) gösterilen µm. hücreleri poli-L-lizin kaplamalı cam (F, H) üzerinde seribaşı veya plastik (G, ben), % 10 huzurunda L-15 ortamda ekili filtrated Sığır serum ve nöronal ek B-27 (seyreltilmiş 1:50) ve bir epifluorescent mikroskopla görüntüsü. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
4. Primer hücre--dan yetişkin zebra balığı beyin hazırlanması
-
Beyin çıkarma
- En az 90 gün yaş yetişkin bir balık seçin. Belirli hücre tipi ile çalışma gerekiyorsa, hücre özgü floresan muhabir ifade istediğiniz hücreleri görselleştirmek için izin verir bir transgenik satırı seçin.
- Anestezik Tricaine8 (% 0,2) 200 mL ile dolu bir ölçek balık Danieau içinde % 30 koyun. Balık hareket etmeyi durdurana kadar bekleyin. 200 mL buzlu su bu ötenazi 15 dakika ile dolu bir ölçek imzalat balık bırakın.
- Petri kabına doldurun (çapı 6 cm) % 70 (v/v) etanol ile. Balık kuyruğundan cımbız ile per ve etanol daldırma. Balık tamamen 5 için etanol içinde sular altında sağlamak s.
- Gupta Mullins ve14 ile aşağıdaki adaptasyonlar protokolüne göre beyin özü: yalnızca autoclaved veya steril Paketli araçlarını kullanın ve steril 1 x PBS kafasından incelemek.
- Doğrudan çıkarma sonra beyin bir Petri kabına yerleştirin (çapı 3 cm) steril 1 x PBS ile dolu ve çanak hücre kültürü için steril bir tezgah altında taşıyın.
-
Beyin ayrılma ve primer hücre kaplama
- Yer iki ayarlar steril cımbız (autoclaved) steril Petri kabına (çapı 6 cm) ile % 70 (v/v) etanol, steril Petri kabına dolu (çapı 10 cm) iyi'nın L-15 orta % 10 ile desteklenmiş dolu (v/v) Sığır serum, B-27 (1:50) ve % 1.2 filtrated (v / v) 10.000 U penisilin-streptomisin ve bir steril hücre süzgeç saplı (40 µm; Şekil 1 c) temiz tezgah altında.
- Yer Petri çanak içine hücre süzgeç etanol ile dolu ve sıvı düzeyi en az 5 mm süzgeç alt yüksek olduğundan emin olun.
- Cımbız ilk kümesi kullanarak, beyin zaten etanol içinde yerleştirilir süzgeç içine transfer ve tamamen sıvı tarafından kaplıdır emin olun. 1 sonra s, transfer süzgeç ile belgili tanımlık yukarıda ile iyi'nın L-15 orta içeren Petri kabına beynine açıklanan takviyeleri.
- Cımbız ikinci kümesi kullanarak, 500 µL iyi'nın L-15 orta yukarıda ile steril 1,5 mL tepki tüp beynine dolu transfer takviyeleri nitelendirdi. Collagenase (tip 2) 4 mg/mL 1 ml toplam birimindeki son bir konsantrasyon ekleyin.
- Dikey tüp rotator için oda sıcaklığında 35 dk dk başına 30 devrimler ile tüp kuluçkaya. Mekanik olarak kalan doku kümeleri ayrılma işlemi yardım için 1.000 µL pipet ucu kullanarak yukarı ve aşağı pipetting tarafından ayırmak.
- Hiçbir görünür parçacıklar çözümde kalır ayrılma durdurur. Hücre süspansiyon ile havalandırma yarık (40 µm; bir steril hücre süzgeç aracılığıyla filtre Şekil 1 d) 50 mL konik tüp içine. Süzgeç yaklaşık 10 mL taze hücre kültür orta ile yıkayın.
Not: ne zaman tek hücre süspansiyon elde filtrasyon adım embriyo ayrılma durumunda olduğu gibi gerekli değildir. Beyin yumuşak bir dokudur ve bu nedenle daha homojen tek hücre süspansiyon ayrışmış eğilimli. - Santrifüjü 180 x g , 5 min için tarafından hücreleri cips ve hücre Pelet taze iyi'nın L-15 orta yukarıda açıklanan takviyeleri ile 1 mL içine resuspend.
- 500 µL hücre süspansiyon (elde edilen hücrelerin % 50), bir kendi kendine yapılan poli-L-lizin kaplamalı cam alt çanak üzerinde pipet (1.2 bakın) veya 24-şey plaka bir kuyu. Daha küçük yüzeyler (Yani, 125 µL çözüm için iyi bir 96-şey plaka) durumunda downscale. Steril tezgah altında oda sıcaklığında 60 dk için kuluçkaya. Sonra taze orta belirli kapsayıcıyı doldurmak ve primer hücre 28 ° C'de kuluçkaya için gerekli hacmi ekleyin
- 28 ° C'de ters bir mikroskop kullanarak istediğiniz görüntüleme uygulamayı gerçekleştirmek Kültürleri kaplama sonra birkaç gün için görüntüleme için kullanılabilir. Günlük olarak orta % 50'si yerine.
Sonuçlar
Şekil 1G çizgili miyositler ve en bol olan nöron benzeri hücre kümeleri ile vahşi türü embriyo elde tipik bir kültürün iletilen bir ışık görüntü gösterir. Bazı hücre tipleri daha kolay tanımlamak için hücre türüne özgü ifade floresan bir protein ile transgenik bir çizgi olabilir (Şekil 1 H) kullanılır.
PCS2 + transfection-floresan protein ...
Tartışmalar
Burada, iki farklı protokol 2 dpf zebra balığı embriyo veya yetişkin zebra balığı beyin Kültür primer hücre için mevcut.
2 dpf zebra balığı birincil hücre kültürleri hazırlanması temel hücre kültürü teknikleri deneyimi olan herkes için gerçekleştirmek nispeten kolaydır. Ancak, iyi ve tekrarlanabilir sonuçlar elde etmek için yeterli sayıda embriyo malzeme başlangıç olarak çok önemlidir (100 olduğunu en azından). Embriyo yükseltme sırasında tüm olası ka...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
T. Fritsch, A. kurt-Asseburg, ı. Linde ve S.-M teşekkür ederiz. Tokarski mükemmel hayvan bakım ve teknik destek için. Yoğun ve yararlı tartışmalar için Köster laboratuvar Tüm üyeler için minnettarız. Deutsche Forschungsgemeinschaft (KO 1949/5-1) ve Federal Devlet Aşağı Saksonya, Niedersächsisches Vorab (VWZN2889) tarafından finansman minnetle anıyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments | |||
| Fish lines | ||||||
| AB (wild-type) | established by Streisinger and colleagues, available from the Zebrafish International Resource Center (ZIRC) | |||||
| Tg(ptf1a:eGFP)jh1 | stable transgenic line in which the enhancer of the zebrafish gene ptf1a drives expression of the fluorescent protein EGFP (Parsons et al., 2007) | |||||
| Tg(XITubb:DsRed)zf148 | stable transgenic line in which the Xenopus neural-specific beta tubulin promoter drives expression of the fluorescent protein DsRed (Peri and Nüsslein-Volhard, 2008) | |||||
| Name | Company | Catalog Number | Comments | |||
| Equipment | ||||||
| centrifuge | Eppendorf | model 5804 R | ||||
| ChemiDoc MP imaging system | BioRad | model XRS+, used to acquire black-and-white images of Petri dishes containing 1 da embryos | ||||
| confocal laser scanning microscope | Leica microsystems | model SP8, equipped with 28 °C temperature box and a 63 x objective | ||||
| epifluorescent microscope | Leica microsystems | model DM5500B, equipped with 28 °C temperature box and a 40 x objective | ||||
| Gene Pulser Xcell with capacitance extender | BioRad | 1652661 | electroporation device | |||
| Horizontal shaker | GFL | model 3011 | ||||
| incubator for cell culture (28 °C) | Memmert | model incubator I | ||||
| incubator for embryos (28 °C) | Heraeus | type B6120 | ||||
| light microscope | Zeiss | model TELAVAL 31 | ||||
| micro pipettes | Gilson | |||||
| sterile work bench | Bio Base | with laminar flow and UV light | ||||
| tweezers | Dumont | Style 5, Inox | ||||
| vertical tube rotator | Labinco B.V. | model LD-79 | ||||
| Name | Company | Catalog Number | Comments | |||
| Software | ||||||
| Image Lab Software | BioRad | for the ChemiDoc MP imaging system from BioRad | ||||
| ImageJ | National Institutes of Health | used for counting 1 dpf embryos by applying the Count particles-tool to the respective black-and-white images; Rasband, W.S., ImageJ, U. S. National Institutes of Health, Bethesda, Maryland, USA, https://imagej.nih.gov/ij/. (1997-2016). | ||||
| LAS X | Leica Microsystems | for both confocal and epifluorescent microscopes from Leica Microsystems | ||||
| Name | Company | Catalog Number | Comments | |||
| Plasmids | ||||||
| pCS-DCX-tdTomato | Köster Lab | # 1599 | based on the backbone pCS2+ (Rupp et al., 1994) | |||
| pCS-eGFP | Köster Lab | # 7 | based on the backbone pCS2+ (Rupp et al., 1994) | |||
| pCS-H2B-mseCFP | Köster Lab | # 2379 | based on the backbone pCS2+ (Rupp et al., 1994) | |||
| pCS-mClover | Köster Lab | # 3865 | based on the backbone pCS2+ (Rupp et al., 1994) | |||
| pCS-MitoTag-YFP | Köster Lab | # 2199 | based on the backbone pCS2+ (Rupp et al., 1994) | |||
| pCS-ss-RFP-KDEL | Köster Lab | # 4330 | based on the backbone pCS2+ (Rupp et al., 1994) | |||
| pCS-VAMP1-mCitrine | Köster Lab | # 2291 | based on the backbone pCS2+ (Rupp et al., 1994) | |||
| pSK-UAS:mCherry | Köster Lab | # 1062 | based on the pBluescript-backbone of Stratagene | |||
| Plasmid numbers refer to the database entries of the Köster lab. Plasmids are available upon request. | ||||||
| Name | Company | Catalog Number | Comments | |||
| Plastic and glass ware | ||||||
| BD Falcon Cell Strainer (40 µm) | FALCON | REF 352340 | distributed by BD Bioscience, used as “landing net” to dip deyolked embryos into ethanol and to transfer them quickly to fresh cell culture medium | |||
| 1.5 mL reaction tubes | Sarstedt | 72690550 | ||||
| 24-well plate | Sarstedt | 83.3922 | ||||
| 50 mL falconic tube | Sarstedt | 62.547.004 | ||||
| 96-well plate | Sarstedt | 83.3924.005 | ||||
| EasyStrainer (40 µm) | Greiner Bio-One | 542 040 | with venting slots; used to filter cells after collagenase-mediated dissociation | |||
| electroporation cuvette (0.4 cm) | Kisker | 4905022 | ||||
| glass coverslips | Heinz Herenz Medizinalbedarf GmbH | 1051201 | ||||
| Microscope slides | Thermo Fisher Scientific (Menzel Gläser) | 631-0845 | ||||
| Neubauer chamber | Henneberg-Sander GmbH | 9020-01 | ||||
| Pasteur pipettes (plastic; 3 mL) | A. Hartenstein | PP05 | ||||
| Petri dishes (plastic; diameter 10 cm) | Sarstedt | 821473 | for zebrafish embryos | |||
| pipette tips | Sarstedt | Blue (1000 µl): 70762; Yellow (200 µl): 70760002; White (10 µL): 701116 | ||||
| sterile cell culture dishes (plastic; diameter 3 cm) | TPP Techno Plastic Products AG | 93040 | ||||
| sterile cell culture dishes (plastic; diameter 6 cm) | Sarstedt | 72690550 | ||||
| sterile Petri dishes (plastic; diameter 10 cm) | Sarstedt | 83.3902 | for brain dissection | |||
| Name | Company | Catalog Number | Comments | |||
| Chemicals and Reagents | ||||||
| sodium chloride | Roth | 0601.1 | ||||
| 4 % paraformaldehyde in 1 x PBS | Sigma-Aldrich | 16005 | ||||
| 4',6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | ||||
| calcium nitrate tetrahydrate | Sigma-Aldrich | C1396 | ||||
| ethanol p.a. 100% | Sigma-Aldrich | 46139 | ||||
| goat α-mouse IgG (Fc specific) FITC conjugated | Thermo Fisher Scientific | 31547 | ||||
| HEPES | Roth | 9105.4 | ||||
| high vacuum grease | DOW CORNING | 3826-50 | silicon grease used for self-made glass bottom dishes | |||
| magnesium sulfate heptahydrate | Merck | 105886 | ||||
| methylene blue | Serva | 29198.01 | ||||
| Monoclonal Anti-Tubulin, Acetylated antibody | Sigma-Aldrich | T6793 | ||||
| Aqua-Poly/Mount (mounting medium) | Polyscience | 18606 | ||||
| poly-L-lysine | Biochrom | L 7240 | ||||
| potasssion chloride | Merck | 104938 | ||||
| Skim milk | Roth | 68514-61-4 | ||||
| Texas Red-X Phalloidin | Thermo Fisher Scientific | T7471 | ||||
| Tricaine | Sigma-Aldrich | E10521 | Synonym: Ethyl 3-aminobenzoate methanesulfonate | |||
| Triton X-100 | BioRad | 1610407 | ||||
| Trypan Blue | Gibco by Life Technologies | 15250061 | ||||
| Name | Company | Catalog Number | Comments | |||
| Enzymes | ||||||
| collagenase (Type 2) | Thermo Fisher Scientific | 17101015 | dissolve powder in cell culture medium (8 mg/mL) and sterile-filter the solution, store aliquots at -20 °C | |||
| pronase (from Streptomyces griseus) | Roche | 11459643001 | distributed by Sigma-Aldrich, dissolve in 30% Danieau (10 mg/mL) and store aliquots at -20 °C | |||
| Name | Company | Catalog Number | Comments | |||
| Medium and solutions for cell culture | ||||||
| 1 x PBS (Dulbecco's Phosphate Buffered Saline) | Gibco by Life Technologies | 14190-169 | distributed by Thermo Fisher Scientific | |||
| CO2-independent medium | Gibco by Life Technologies | 18045054 | distributed by Thermo Fisher Scientific | |||
| filtrated bovine serum (FBS) | PAN-Biotech | individual batch | ||||
| glutamine 100 x | Gibco by Life Technologies | 25030081 | distributed by Thermo Fisher Scientific | |||
| Leibovitz's L-15 medium | Gibco by Life Technologies | 11415049 | distributed by Thermo Fisher Scientific | |||
| PenStrep (10,000 units/mL) | Gibco by Life Technologies | 15140148 | distributed by Thermo Fisher Scientific |
Referanslar
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends in Cell Biology. 23, 584-586 (2013).
- Sassen, W. A., Köster, R. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. , 151 (2015).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80, 153-158 (1999).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233, 329-346 (2001).
- Driever, W., Rangini, Z. Characterization of a cell line derived from zebrafish (Brachydanio rerio) embryos. In Vitro Cellular & Developmental Biology - Animal. 29A, 749-754 (1993).
- Badakov, R., Jaźwińska, A. Efficient transfection of primary zebrafish fibroblasts by nucleofection. Cytotechnology. 51, 105-110 (2006).
- Senghaas, N., Köster, R. W. Culturing and transfecting zebrafish PAC2 fibroblast cells. Cold Spring Harbor Protocols. , (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. Journal of Visualized Experiments Available from: https://www.jove.com/science-education/5048/using-a-hemacytometer-to-count-cells (2017)
- Rupp, R. A., Snider, L., Weintraub, H. Xenopus embryos regulate the nuclear localization of XMyoD. Genes & Development. 8, 1311-1323 (1994).
- Piperno, G., Fuller, M. T. Monoclonal antibodies specific for an acetylated form of alpha-tubulin recognize the antigen in cilia and flagella from a variety of organisms. Journal of Cell Biology. 101 (6), 2085-2094 (1985).
- Barden, J. A., Miki, M., Hambly, B. D., Dos Remedios, C. G. Localization of the phalloidin and nucleotide-binding sites on actin. European Journal of Biochemistry. 162 (3), 583-588 (1987).
- Kapuscinski, J. DAPI: a DNA-specific fluorescent probe. Biotechnic & Histochemistry. 70 (5), 220-233 (1995).
- Gupta, T., Mullins, M. C. Dissection of organs from the adult zebrafish. Journal of Visualized Experiments. 37, E1717 (2010).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Stornaiuolo, M. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Molecular Biology of the Cell. 14, 889-902 (2003).
- Lithgow, T. Targeting of proteins to mitochondria. FEBS Letters. 476, 22-26 (2000).
- Nagai, T., Ibata, K., Park, E. S., Kubota, M., Mikoshiba, K., Miyawaki, A. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nature Biotechnology. 20, 87-90 (2002).
- Sassen, W. A., Lehne, F., Russo, G., Wargenau, S., Dübel, S., Köster, R. W. Embryonic zebrafish primary cell culture for transfection and live cellular and subcellular imaging. Developmental Biology. 430, 18-31 (2017).
- Horesh, D., et al. Doublecortin, a stabilizer of microtubules. Human Molecular Genetics. 8, 1599-1610 (1999).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N. G., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22, 1567-1572 (2004).
- Distel, M., Hocking, J. C., Volkmann, K., Köster, R. W. The centrosome neither persistently leads migration nor determines the site of axonogenesis in migrating neurons in vivo. Journal of Cell Biology. 191, 875-890 (2010).
- Matsuda, T., Miyawaki, A., Nagai, T. Direct measurement of protein dynamics inside cells using a rationally designed photoconvertible protein. Nature Methods. 5, 339-345 (2008).
- Archer, B. T., Ozçelik, T., Jahn, R., Francke, U., Südhof, T. C. Structures and chromosomal localizations of two human genes encoding synaptobrevins 1 and 2. Journal of Biological Chemistry. 265, 17267-17273 (1990).
- Griesbeck, O., Baird, G. S., Campbell, R. E., Zacharias, D. A., Tsien, R. Y. Reducing the environmental sensitivity of yellow fluorescent protein. Mechanism and applications. Journal of Biological Chemistry. 276, 29188-29194 (2001).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10, 407-409 (2013).
- Campbell, R. E., et al. A monomeric red fluorescent protein. Procedings of the National Academy of Sciences of the United States of America. 99, 7877-7882 (2002).
- Peri, F., Nüsslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133, 916-927 (2008).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132, 5069-5079 (2005).
- Jusuf, P. R., Harris, W. A. Ptf1a is expressed transiently in all types of amacrine cells in the embryonic zebrafish retina. Neural Development. 4, 34 (2009).
- Kani, S., et al. Proneural gene-linked neurogenesis in zebrafish cerebellum. Developmental Biology. 343, 1-17 (2010).
- Distel, M., Wullimann, M. F., Köster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Procedings of the National Academy of Sciences of the United States of America. 106, 13365-13370 (2009).
- Choorapoikayil, S., Overvoorde, J., den Hertog, J. Deriving cell lines from zebrafish embryos and tumors. Zebrafish. 10, 316-332 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır