Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fonksiyonel ve Polarize Safra Epitel Kistlerinin Oluşumu ve Kantitatif Karakterizasyonu
Bu Makalede
Özet
Üç boyutlu (3D) hücresel sistemler organogenezin araştırılması için uygun modellerdir. Safra kist üretimi ve karakterizasyonu için hidrojel bazlı bir yöntem önerilmektedir. Bu protokol, kist oluşumu verimliliğini, boyutlarını değerlendirmek ve işlevselliklerini test etmek için basit ve güvenilir bir yöntemle 3B karakterizasyonunun engellerini ortadan kaldırmaktadır.
Özet
Kolanjiyositler, karaciğerdeki safra kanallarını oluşturan epitel hücreleri, safra oluşumunu ve modifikasyonu denetler. Son yirmi yılda, karaciğer hastalıkları bağlamında, kolanjiyositlere dayalı 3 boyutlu (3D) modeller, organogenez, hastalık modellemesi ve ilaç tarama çalışmaları için doku topolojisini taklit etmek için kistler, küreseloidler veya tüp benzeri yapılar gibi ortaya çıkmıştır. Bu yapılar esas olarak bir hidrojel kolanjiyositkitler katıştırma ile elde edilmiştir. Temel amaç epitelyal polarite, fonksiyonel ve morfolojik özellikleri ele alarak kendi kendini örgütleme çalışması oldu. Ancak, çok az çalışma kist oluşumu verimliliği üzerinde duruluyor. Bu durumda, verimlilik genellikle tek bir düzlemin görüntülerinden ölçülür. Hidrojel polimerizasyon heterojenitelerinden ve yan etkilerinden kaynaklanan kist dağılımının potansiyel heterojenliğini temsil etmeden fonksiyonel tahliller ve yapısal analizler yapılmaktadır. Bu nedenle, nicel çözümleme yapıldığında, bir makaleden diğerine karşılaştırma için kullanılamaz. Ayrıca, bu metodoloji farklı matrisler ve hücre türlerinin 3D büyüme potansiyelinin karşılaştırmalarına izin vermez. Ayrıca, immünboyama kistler için deneysel sorun giderme söz yoktur. Bu makalede, ilk hücre dağılımının kist oluşumunun heterojen dikey dağılımı ile ilişkili olduğunu göstermek için güvenilir ve evrensel bir yöntem sayılmiyoruz. Hidrojel gömülü kolanjiyosit hücreleri 10 gün boyunca hidrojel derinliği boyunca Z-yığınları analizi ile takip edilir. Bu yöntemle kist oluşumunda verimlilik ve büyüme sağlam bir kinetik elde edilir. Ayrıca kist polaritesini ve salgı fonksiyonunu değerlendirmek için yöntemler saklıyız. Son olarak, görüntüleme için kist çöküşünü sınırlamak için immünboyama protokollerini optimize etmek için ek ipuçları sağlanmıştır. Bu yaklaşım diğer 3D hücre kültürü çalışmalarına uygulanabilir, böylece bir sistemi diğer sistemle karşılaştırma olanakları açılabilir.
Giriş
Son otuz yılda, in vitro araştırma alanı 3D kültür sistemlerine doğru ilerlemiştir. Bir iskele/matrisin varlığında veya yokluğunda, bir damla, ajitasyonda, mikroakışkan cihazlarda veya yüzen 1'de, 3Boyutlu olarak hücreleri küresel olarak veyaagrega olarak bir dizi şekilde kültüre alma için bir dizi protokol ortaya çıkmıştır. 3D kültür yöntemlerinin kullanımı, özellikle kistler veya acini adı verilen 3Boyutlu yapılarda kendi kendini organize ettiği gösterilen epitel hücreleri başta olmak üzere 2 boyutlu (2D) kültürlere göre avantajlarını kanıtlamıştır. Bu durumda, hücreler bir lümen çevreleyen bir monolayer oluşturur, hücrelerin geliştirilmiş fizyolojik özel fonksiyonları ile tam epitel fenotip eldenerede 2.
Doğal matrislerde bu epitel organoidlerin oluşturulması için yöntemlerin geliştirilmesine çok sayıda çalışma katkıda bulunmuştur. Bu vivo hücre-hücre ve hücre-mikroçevre etkileşimleri recapitulate izin verdi, kurulması ve epitel fenotip istikrar elde etmekiçin 3,4,5,6,7. Son zamanlarda, ve özellikle nakledilebilir organoidler geliştirmek ve epitel programı düzenlemek için mikroortamın gereksinimini deşifre amacı ile, sentetik hidrojeller epitel acini oluşumunu artırmak için geliştirilmiştir8,9,10. Ne yazık ki, bu çalışmalar nitel veri raporu, ya da 2D düzlemde olmayan kistler üzerinde kistlerin oranı gibi iç referanslar kullanarak mevcut hesaplama yöntemleri8,9,10. Bu, epitel organoidlerinin verimlilik, stabilite veya morfolojik ve fizyolojik karakterizasyonu açısından farklı çalışmalar arasında herhangi bir karşılaştırma yıkmaktadır.
Mikroakışkan cihazlar kullanarak boncuklarda epitel hücrelerinin mikrokapsülasyonu daha gerçekçi nicel ve karşılaştırmalı sonuçlar almıştır. Bu teknoloji kullanılarak, çeşitli hücre tiplerinden organoidler oluşmuş ve farklı 3D hücresel yapılar arasında morfolojiye dayalı farklılaşmış11,12. Ancak, bu teknoloji ile çalışmak kolay değildir ve mikroakışkan cihazlar üretmek için temiz oda kullanımını gerektirir. Bu teknoloji hidrojeller birkaç tür için kurulmuştur ama teknik adaptasyon diğer hidrojeller için uygulanacak gerektirir, onun çok yönlülük kısıtlayan. Bu nedenle, epitel organoidler geliştirmek için amaçlanan çoğu çalışma bir hidrojel toplu epitel hücrelerinin katıştırma güveniyor. Bu yöntemlerde, tüm 3D kültür içinde jel strüktürasyonu ve hücre dağılımı yüksek heterojenlik genellikle ihmal edilir. Bu nedenle, analizlerin çoğu tek 2B görüntülerle ilgilidir, bu da yalnızca kabaca tüm 3B hacimdeki çeşitli hücresel nesnelerin dağılımını temsil eder.
Kolanjiokarsinom, safra atrezisi, primer sklerozan kolanjit gibi safra kanallarını etkileyen hastalıklar mortalite ve morbiditenin başlıca nedenidir. Karaciğer nakli dışında bu durumlar için etkili bir tedavi yoktur13. Safra yolu oluşumunu, hastalık nedenlerini ve ilerlemesini araştırma çabaları yeni tedavilerin geliştirilmesine olanak sağlayacaktır14.
Normal veya hasta kaynaklı, diferansiye veya ata türevi kolanjiyosit hücre hatları kullanan kist, küresel oidler veya tüp benzeri yapıların biliyer organotipik modelleri geliştirilmiştir15,16,17,18,19,20. Çeşitli çalışmalar da kolanjiyofit polaritere, kolanjisit belirteçlerinin ekspresyonu, silya varlığı, kolanjiyosit salgıve reabsorptif yetenek, ve lümen oluşumu ve obstrüksiyonu; bunların hepsi kolanjiyosit fenotip, morfoloji ve fonksiyon15,17,19önemli özelliklerini temsil eder. Diğerleri uzun süre hasta kaynaklı safra organoidleri bakım bildirdin20. Son zamanlarda, biz biliyer kistler organogenez biyokimyasal ve biyofiziksel ipuçları rolünüaraştırdı21. Daha da önemlisi, biliyer atrezisi patogenezi safra spheroidleri ve tüpler7,22çalışıldı. Ayrıca, kolanjiyosit senescence, pro-inflamatuar sitokinlerin salgılanması gibi birincil sklerozan kolanjitin temel özellikleri, yanı sıra makrofaj işe başarıyla safra spheroids kullanılarak çalışılmıştır15,20. Ancak, bu soruların ele alınabileceği kolanjiyosit fenotip, fizyoloji ve mikroçevreyi fizyolojik olarak modüle eden in vitro 3D kantitatif modellere hala ihtiyaç duyulmaktadır. Ayrıca, sadece birkaç yayın kist oluşumu verimliliği21,23 bildirdin. Bu, özellikle organogenez, hastalık nedeni ve kolanjiyosit fonksiyonu ve polarizasyon ile ilaç yanıtlarının korelasyonunu araştırırken, saptanması gereken önemli bir noktadır. Buna ek olarak, protokolden protokole kadar kullanılan iskele/matris farklılıkları ile sistemler arasında karşılaştırmak zordur. Bu sorunları çözmek için lümen oluşumunu, kolanjisit polarizasyonunu ve kolanjiyit salgı işlevini taklit eden biliyer kistler oluşturmak için nicel, güvenilir ve evrensel bir yöntem öneriyoruz. Daha da önemlisi, zaman içinde değerlendirilirken 3D jel boyunca Z-ekseni boyunca yapılan sistematik bir analiz, kist oluşumu verimliliği, boyut, canlılık, polarizasyon ve işlevsellik sayılmaktadır. Ayrıca, doğal bir hidrojel ve normal sıçan kolanjiyositler (NRC) s, protokol için bir örnek olarak kullanılan, ancak diğer doğal veya sentetik hidrojeller, yanı sıra epitel hücreleri 3D kistik yapıların oluşumu için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Kistlerin üretimi
NOT: Jelleşme hücrelerin katıştırılmasına izin veriyorsa, bu protokol her türlü hidrojel ile yapılabilir.
- Hidrojel kaplama
NOT: Hazne saklıdoğru hidrojel kaplama kuyunun alt kısmında 2D hücre tabakaları oluşumunu önlemek için kritik bir adımdır, sonraki kist görüntüleme müdahale ve kist oluşumu verimliliği hesaplama sını bozabilir.- Jel çözeltisinin homojenliğini sağlamak için hidrojeli bir gecede 4 °C'de (O/N) eritin.
- -20 °C'de buz veya O/N üzerinde precool pipet uçları ve -20 °C O/N'de 8 kuyulu bir hazne kaydırağı.
- Buz dolu bir buz kovası üzerine hidrojel ve 8-iyi oda slayt yerleştirin.
- 15 mL konik bir tüpte, soğuk NRC komple ortamda %40 hidrojel (V/V) içeren bir çözelti hazırlayın (bkz. Malzeme Tablosu)ve tüpü buzüzerine yerleştirin.
- Soğuk pipet uçları kullanarak bir hazne slaytKaplamak için, her kuyunun ortasına 50 μL hidrojel çözeltisi ekleyin ve hazne ucunu buz üzerinde tutarken bir pipet ucu kullanarak tüm yüzeye yayıldı(Şekil 1A).
NOT: Hidrojel çözeltisini mümkün olduğunca eşit olarak kabarcıklardan kaçınarak yayın. - Hidrojeli polimerize etmek için, 37 °C,% 5 CO2en az 15 dakika için oda slayt kuluçka .
- Hücre hazırlama
- Isınma NRC komple orta, fosfat tamponlu salin (PBS), ve tripsin-etilendiamin tetraasetik asit (tripsin-EDTA) önceden ısıtılmış bir su banyosunda 37 °C.
- Hidrojel polimerize iken, NRCs bir T-25 cm2 kollajen kaplı şişe21%birleşimi için yetiştirilen emin olun. Önceden ısıtılmış 1x PBS ile hücreleri bir kez yıkayın.
- NRC'leri 5 mL önceden ısıtılmış 1x PBS (T-25 cm2 şişe için) 37 °C'de 20 dk, %5 CO2ile inkübedin.
NOT: Tripsin-EDTA ile kuluçka süresini kısaltan bu adım, hücrelerin kendi kendini organize eden özelliklerini korumada etkilidir. - PBS atın, trypsin-EDTA 1 mL ekleyin ve 37 °C, % 5 CO25-10 dakika kuluçka.
- Önceden ısıtılmış tam NRC ortamının 4 mL'si ile nötralize edin. Hücre süspansiyonuna 15 mL konik bir tüp toplayın ve aktarın ve 4 dk boyunca 150 x g'da döndürün.
- Orta atın ve önceden ısıtılmış orta 5 mL hücre pelet resuspend.
- 40 μm hücreli süzgeç kullanarak hücre çözeltisini 50 mL konik bir tüpe filtreleyin ve hücreleri sayın.
NOT: Hücreleri bir süzgeçten geçirmek, kantitatif sonuçların tekrarlanabilir olması, yani gömülü hücre agregalarının neredeyse benzer boyutunu elde etmesi için kritik bir adımdır.
- Hidrojel çözeltisindeki hücre süspansiyonunun gömülmesi
- 1.600 μL%80 hidrojel (V/V) çözeltisi hazırlayın. buzda tutun. Seyreltin 5 x 105 hücreleri / mL 1,600 ° L soğuk tam NRC orta (tüp 2) ve buz içinde tutun.
NOT: Bu adım, hidrojelin hücre süspansiyonu ile karıştırılması ve hücre canlılığının korunması için hızlı bir şekilde yapılmalıdır. - %40 hidrojel (V/V) içinde2,5 x 10 5 hücre/mL'lik bir hücre tohumlama çözeltisi hazırlamak için tüp 1 ve tüp 2'yi karıştırın. Hidrojel kaplı oda kaydırağının kabarcıklardan kaçınarak her kuyuya hücre çözeltisinin 400 μL'sini ekleyin (Şekil 1B).
- Ortam değişene kadar oda kaydırasını 37 °C'de %5 CO2 ile bir kuvözde tutun.
- Kültürde 2 gün sonra, her kuyunun bir köşesinden 250 μL orta çıkarın, hidrojel pipet değil dikkatli olun. Daha sonra, yavaş yavaş kültür ortamı250 μL ekleyin. Orta yı 2 günde bir değiştirin.
NOT: Özellikle kist inisiyasyonu sırasında oda kaydırağının hareketini en aza indirin.
- 1.600 μL%80 hidrojel (V/V) çözeltisi hazırlayın. buzda tutun. Seyreltin 5 x 105 hücreleri / mL 1,600 ° L soğuk tam NRC orta (tüp 2) ve buz içinde tutun.
2. Kist nicelemesi
- Kist görüntüleme
NOT: Mikroskop CO2 ve sıcaklığı kontrol etmek için bir ısıtma odası ile donatılmış değilse bu bölüm hızlı bir şekilde hücre canlılığı ödün vermek için yapılmalıdır. Tam hidrojel hacminde kist dağılımının tutarlı bir şekilde ölçülmesini sağlamak için, kistler faz-kontrast mikroskobu ve seri görüntüleme (Z-yığınları) ile farklı zaman dilimleri boyunca önceden tanımlanmış parametrelerle görüntülenir.- Her zaman noktası için hidrojel derinliği boyunca bir Z-yığını alın(Şekil 1C, D). Bu örnekte, Z yığınları 1, 2, 4, 7 ve 10 günlerinde alınır.
NOT: Bu yöntemin uygulanabilirliğini sağlamak için ilk hücre dağılımının hidrojelde tek düze olup olmadığını kontrol edin.- Görüntü edinme yazılımı ile donatılmış faz kontrastlı mikroskopla, manuel burun parçası ped penceresindeki 10x nesnel büyütmeyi seçin(Şekil 2B(1)).
- Beyaz lambayı açın ve brightfield görüntüleme seçeneğini seçin.
- Alt menüdeki "Play" düğmesini seçerek kamerayı açın. Kistlerin bir alana odaklanmak ve maruz kalma süresini ayarlamak(Şekil 2B(2)). Görüntülerin otomatik olarak kaydedilmesi için Otomatik Yakalama Klasörü penceresini açın(Şekil 2B(3)).
- Yakalama Z serisi pencereyi açın ve Z-yığınının üst ve alt düzlemlerini (aynı XY koordinatları ancak farklı Z ekranlı) Z vidaile tanımlayın. Hedefe, çözünürlük düzeyine bağlı olarak Z adımını ayarlayın ve satın almayı başlatmak için "Şimdi çalıştırın" düğmesine basın (Şekil 2B(4)).
NOT: Bu örnekte, kistler 520 μm. hidrojel kalınlığı üzerine yayılır 26 görüntü 20 μm Z-adım aralığı ile hidrojel derinliği boyunca elde edilir. Amaca bağlı olarak, Z-adımı herhangi bir kist kaçırmamak ve tek hücre ve agregaların tespitini sağlamak için ayarlanmalıdır. - Kuyu başına en az 3 örtüşmeyen Z-yığınları alın.
NOT: Bu örnekte olduğu gibi, kistler hidrojel polimerizasyonundaki heterojenlikler nedeniyle kenarlardan daha fazla jel derinliğinde olduğunda bu örnekleme gereklidir. - Temsili bir veri kümesinin 2.1.1.5 adımLarını yinelemesi için. toplam 3 kuyu için.
NOT: Kistlerin heterojen dağılımı hidrojelin tipine, polimerizasyonuna ve hücre hattına bağlıdır. Kuyu başına üç Z-destes ve deney başına üç kuyu göz önüne alındığında, her zaman noktada kist oluşumu ve kist büyümesini karakterize etmek için dokuz Z-yığınları üzerinde en az 200 kistler görüntülenir.
- Her zaman noktası için hidrojel derinliği boyunca bir Z-yığını alın(Şekil 1C, D). Bu örnekte, Z yığınları 1, 2, 4, 7 ve 10 günlerinde alınır.
- Görüntü işleme
NOT: Bir hidrojelde, NCB'ler tek hücre, kistler veya agrega lar olarak bulunabilir. Kistler bir lümen çevreleyen yuvarlak ve ince kontrasthücre kabuğu varlığı ile tanımlanır, hücre agregaları düzensiz bir şekil mevcut ve bir lümen yok iken. Agregalar ve tek hücreler yoğun ve zıt bir görünüme sahiptir(Şekil 3B(4)).- Fiji yazılımını açın, Z-yığınını açın ve Fiji menüsüne gidin ve Dosya | Aç 'ı (EkŞekil 1)tıklatın. Çözümlemek için Z yığınını seçin. Gerekirse "Sanal Yığın" seçeneğini seçin ve açmak için "Evet" seçeneğini tıklayın (Şekil 3A(1)).
- Görüntüyü kopyala | Yinelenen. "Yinelenen yığın" kutusuna tıklayın ve "Ok" ( EkŞekil 2) düğmesinetıklayın.
NOT: Bu örnekte, Z-yığınları .nd2 dosya biçiminde 16 bit kodlanır. - Yinelenen yığından minimum yoğunluklu projeksiyon oluşturun. Resim menüsüne git | Yığınlar | Z Projesi. Projeksiyon türünü "Min Intensity" seçin ve "Ok"(Şekil 3A(2))(Ek Şekil 3)'yi tıklatın.
- Arka planı projeksiyondan çıkarın. İşlem menüsüne git | Arka Planı çıkarın. Yuvarlanan top yarıçapının 500.0 pikselini yazın ve kistleri arka plandan daha zıt hale getirmek için "ışık arka planı" düğmesine tıklayın ( Şekil3A(3)) (Ek Şekil 4).
NOT: Yuvarlanan top yarıçapı, arka plan çıkarmanın çalıştırıldığı bölgenin boyutunu tanımlar. Bu parametre tanımlamak için en büyük nesnenin boyutuna ayarlanmalıdır. - Kontrast geliştirme gerekiyorsa, Resim menüsüne gidin | Ayarla | Parlaklık /Kontrast | Otomatik | Uygula. Fiji parlaklık ve kontrastı otomatik olarak optimize eder. (Şekil3A(3)olarak, alt ve üst gri değerleri sırasıyla 49702 ve 65452 olarak belirlenmiştir (Ek Şekil 5).
NOT: Projeksiyon kalibre edilmemişse, Analiz menüsüne gidin | Ölçeği ayarlayın ve ilgili kalibrasyon μm/piksel oranını yazın(Ek Şekil 6).
- Kist sayma ve kist boyutu ölçümleri
- Yaklaşık kist çapını ölçmek için, Fiji menüsündeki Düz çizgi aracını seçin ve son projeksiyonda her kistin çapı boyunca bir çizgi çizin(Şekil 3B(4)). Her kist için oluşturulan yeni ilgi bölgesini (RoI) Yatırım Getirisi yöneticisine ekleyin: YG yöneticisinin daha hızlı sayılması ve açılması için klavyedeki "t" kısayoluna basın. Sayılan kistleri görmek için " TümünüGöster " seçeneğini tıklayın ( EkŞekil 7)
- Z-yığınındaki projeksiyondan set ROI'ları üst üste koyarak saymadan hiçbir kistin bırakılmadığını kontrol edin. Bunu yapmak için, seçmek için Z-yığın penceresine tıklayın. YG Yöneticisi'nde "Tümünü Göster" seçeneğini tıklayın ve görüntü başına bu görüntüyü kontrol etmek için imleci Z-yığını boyunca hareket ettirin, tüm kistler sayılmıştır(Ek Şekil 8).
- Yeni kistler sayıldıktan ve 2.3.1.adıma ROI'lar eklendikten sonra, YG kümesini seçin ve Daha Fazla ' ya tıklayarak YG Yöneticisi penceresi üzerinden kaydedin | Kaydet (Ek Şekil 9).
- Yatırım Getirisi Yöneticisi'ndeki tüm ROI'ları seçin ve her kistin boyutunu almak için YG Yöneticisi'ndeki "Ölçü"seçeneğini tıklayın. Bu, her kistve tahmini boyutunu numaralandırarak "Sonuçlar" adlı yeni bir ölçüm penceresi açacaktır. Daha sonra "Sonuçlar" penceresine tıklayarak ve menü üzerinden .csv formatında kaydedin: Dosya | Gibi Kaydet (Ek Şekil 10).
NOT: Yığınları yarı otomatik olarak işlemek, projeksiyonlardan kist sayısını/boyutlarını tahmin etmek ve verileri daha hızlı sayma işlemi için depolamak için bir makro oluşturulabilir. Bunu yapmak için, Eklentiler ' i tıklatarak çubuk menüsündeki "Kaydet" aracını seçin | Makrolar | Kaydet.
- Kist oluşumu etkinliğinin nicelleştirilmesi
- Y gündeki kistlerin sayısını
 bir projeksiyonda (Y=1, 2, 4, 7 veya 10) sayın.
bir projeksiyonda (Y=1, 2, 4, 7 veya 10) sayın. - Y gününde 1000 hücre için kist oluşum verimliliğini hesaplamak için, o zaman noktasında sayılan kistlerin sayısını hidrojel hacminden 0 gün içinde tohumlanan hücre sayısına bölün ve 1000 ile çarpın(Şekil 3C, Şekil 4).
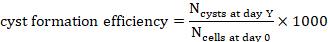
- Y gündeki kistlerin sayısını
3. Hücre canlılığı
- 1 mL aseton da 5 mg FDA eriterek 5 mg/mL'de floresan diasetat (FDA) bir stok çözeltisi hazırlayın ve -20 °C'de saklayın.
- Deiyonize suda (dH2O) 2 mg/mL konsantrasyonda propidium iyodür (PI) bir stok çözeltisi hazırlayın ve 4 °C'de saklayın.
- Fetal baldır serumu (FCS) olmadan NRC ortamını hazırlayın.
- FDA/PI boyama çözeltisini hazırlamak için, 4 μL FDA stok çözeltisi (8 μg/mL son konsantrasyon) ve 25 μL PI stok çözeltisi (20 μg/mL son konsantrasyon) fcs olmadan 2,5 mL NRC ortamına ekleyin.
- Haznedeki slayttan ortayı çıkarın, her kuyuya 250 μL boyama çözeltisi ekleyin ve 37 °C, %5 CO2karanlıkta 4-5 dk kuluçkaya yatırın. Pipet lezne çözeltisini dikkatlice dışarı atın ve 250 μL 1x PBS ile bir kez yıkayın.
- Her kuyuya 250°L tam NRC ortamı ekleyin ve Texas kırmızısı ve floresan isotiyoyanat (FITC) filtreleriyle ters floresan mikroskobu kullanarak fotoğraf çekin. Canlı hücreler yeşil, ölü hücreler kırmızı olacaktır (Şekil 5A).
NOT: Canlı/ölü hücreleri ölçmek için, 2.
4. Salgı etkinliği
NOT: Kolanjiyositlerin apikal membran ı salgılanır lümen floresan salgıları ile değerlendirilir. Özgüllüğü Verapamil ile aynı testi yaparak değerlendirilebilir, bir çok ilaca dirençli (MDR) taşıyıcı inhibitörü24.
- 5 μg/mL'de Hoechst 33258'in boyama çözeltisini hazırlamak için, FCS olmadan 2,5 mL NRC ortamına 0,83 μL Hoechst stok çözeltisi (dH2O'da 15 mg/mL stok konsantrasyonu) ekleyin.
- Her kuyuya 250 μL Hoechst çözeltisi ekleyin ve 37 °C'de %5 CO2 ila 15 dakika kuluçkaya yatırın.
- Hoechst çözeltisini çıkarın ve her kuyuya 250 μL FDA çözeltisi (8 g/mL son konsantrasyon) ekleyin. Kuluçka 4-5 dk 37 °C, 5% CO2.
NOT: Hücreler FDA boyama solüsyonuna maruz kalır bırakmaz, floresan salgılayan kinetiklerin takibi kistlerin salgılanması için gereken zamanı ayarlamak için yararlı olabilir. Bunu yapmak için, zaman atlamalı görüntüleme ile 1 saat boyunca her dakika fotoğraf çekmek. Bu örnekte, hidrojel de NRC salgılayan kistler gözlemlemek için gerekli zaman yaklaşık 15-20 dk. - FCS olmadan orta ile durulama sonra ters floresan mikroskop 5 dakika kullanarak görüntü alın. Lümen de çekirdek etiketleme ve floresan birikimi ortaya çıkarmak için 4′, 6-diamidino-2-fenilindole (DAPI) ve FITC filtrelerkullanın (Şekil 6A). Salgılayan kistlerin sayısını ölçmek için, adım 2'deki gibi Z-yığınlarını alın ve görüntü işleme adımlarını floresan görüntülere uyarlayın.
NOT: Verapamil testi için, önceki süreçten önce (4.3. ila 4.4.) Verapamil ile bir kuluçka ile aşağıdaki koşullara göre: - Dimetil sülfoksitte (DMSO) 10 mM Verapamil stok çözeltisi hazırlayın. 10 μM çalışma çözeltisi hazırlamak için 2,5 μL'lik Verapamil stok çözeltisini FCS'siz 2,5 mL kültür ortamıyla karıştırın.
- Lümendeki floresan'ın MDR salgısından elde edilen sonuçları değerlendirmek için, başka bir slayt alın ve her kuyuya 250 μL Verapamil çalışma solüsyonu ekleyin ve 37°C'de 20 dk, %5 CO2
- Çözeltiyi çıkarın ve her kuyuya 250 μL FDA çözeltisi (8 μg/mL son konsantrasyon) ekleyin. Kuluçka 4-5 dk karanlıkta 37 °C, 5% CO2. Daha sonra, görüntülemeden önce 250 μL 1x PBS(Şekil 6B, C)ile yıkayın.
5. İmmünfluoresans ile epitelyal polarite değerlendirmesi
- Sabitleme çözeltisini hazırlamak için % 4 formaldehit ile %5 sakaroz, 1x PBS, pH 7.4 ve önceden 37 °C'de ısıtılmış bir su banyosunda kuluçkaya yatırın.
- Hücreleri düzeltmek için, yavaşça matris zarar vermeden kuyudan kültür ortamı dışarı pipet. Sabitleme çözeltisinin 400 μL'sini yavaşça kuyuların yan tarafına ekleyin. Oda sıcaklığında 20 dakika (RT) kuluçka.
NOT: Zarar görmesini önlemek için sıvının 25°L'ini her zaman matrisin üzerinde bırakın. - Sabitleme çözeltisini yavaşça çıkarın ve 3x 400 μL 1x PBS (RT) ile yıkayın.
- Pipet PBS dışarı, permeabilization çözeltisi 400 μL ekleyin (0.5% Triton X-100 1x PBS) ve RT 10 dakika kuluçka.
- Permeabilizasyon çözeltisini hafifçe çıkarın, ardından 400 μL 1x PBS ile 3 hızlı yıkama ve RT'de 30 dk'lık uzun bir yıkama adımı.
NOT: Bu adımda, slayt 2 gün boyunca 4 °C'de saklanabilir. Bu durumda, buharlaşmave matris kurumasını önlemek için slaytı bir parafin filmle kapatın. - PBS'yi çıkarın, 1x PBS'de %0.1 büyükbaş hayvan serum albumini (BSA) ve %10 keçi serumu içeren 400 μL blokaj solüsyonu ekleyin ve RT'de 60 dakika kuluçkaya yatırın.
DİkKAT: %0.1'den yüksek BSA konsantrasyonları lümen retraksiyonuna ve daha fazla kist çökmesine neden olur (Bkz. Temsili Sonuçlar bölümü)(Şekil 7A). - Pipet blokaj çözeltisini çıkarın ve %400 PBS/0.05 Tween 20 ile bir kez yıkayın ve atın.
- 1x PBS'de 1x PBS'de 150 μL antikor solüsyonu, örneğin E-kadherin antikor seyreltilmiş 1:400 ve Phalloidin 568 (16,2 nM son konsantrasyon) ekleyin ve RT'de 90 dakika kuluçkaya yatırın.
NOT: E-kadherinin bu seyreltmesi standart 2D immünoreskence protokolünde kullanılan la aynıdır. - Numuneyi %400 PBS/0.05%20, 3x ile yıkayın; rt de 10 dakika için örnek kuluçka her zaman.
- Sekonder antikor (keçi anti-tavşan IgG Alexa Fluor Plus 647), 1x PBS 1:500 seyreltilmiş ve RT 60 dakika kuluçka 150 μL ekleyin.
- 3x'i 400 μL PBS/0.05% Tween 20 ile yıkayın, numuneyi rt'de 10 dakika kuluçkaya yatırın.
- 3x'i 400 μL 1x PBS ile yıkayın, numuneyi her kuluçkaya yatırın ve 10 dakika RT'de.
- Son yıkamanın PBS'sini atın ve aşağıdaki iki seçenekten birini takiben konfokal mikroskopi ile oda slaytını görselleştirmeye hazırlayın.
- Kuyu başına 400 μL 1x PBS ve 50°L DAPI ekleyin. Örnekler, kapak kaymaları ile montaja gerek kalmadan kuyunun alt kısmından incelenebilir (Şekil 7B).
- DAPI içeren antifade reaktifinin kuyu başına 100 μL'sini ekleyin ve sakaya o/n'yi RT'de kurutun.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Kistlerin oluşumu ve karakterizasyonu
3D hücre kültür sistemleri organogenez ve hastalık modelleme25çalışma için önemli bir araçtır. Ne yazık ki, bu yöntemlerin çoğu nitel veya çeşitli çalışmalar arasında kist oluşumu verimliliği açısından herhangi bir karşılaştırma önleme, değişken ve genellikle belirtilmemiş hacimlerde, kistler ve non-kistler karşı kistlerin sayısı karşılaştırarak tek bir düzlemde yapılan iç nicelleştirme kullan?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Organogenez ve 3D hücresel yapıların bakım çalışması için, çeşitli dokular modellenmiştir, farklı hücresel kökenleri kullanarak ama aynı zamanda sentetik hidrojeller de dahil olmak üzere ekstra-hücresel matrisfarklı türleri8,9,10,21. Ancak, organoidoluşumu veya işlevselliği açısından yöntemler arasında karşılaştırmalar sağlar 3D kantitatif analiz eksikliği nede...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Biz Dr Nicholas LaRusso (Mayo Clinic, Rochester, Minnesota, Amerika Birleşik Devletleri), kim nazilikle NRC hücre hattı sağlanan teşekkür ederiz.
Bu çalışma hem iLite RHU programı (grant ANR-16-RHUS-0005) hem de DHU Hepatinov'un mali desteğini almıştır.
Isabelle Garcin ve Réseau d'Imagerie Cellulaire Paris Saclay'e görüntüleme konusundaki desteklerinden dolayı teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 µl- Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000020 | |
| 100 µl - Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000046 | |
| 1000 µl - Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000062 | |
| 1X PBS | Thermo Fisher Scientific | 14190-094 | |
| 200 µl - Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000054 | |
| 3,3′,5-Triiodo-L-thyronine sodium salt | Sigma-Aldrich | T5516 | NRC complete medium final concentration = 3.4 µg/mL |
| Acetic acid | VWR | 20104-298 | 0.02N final |
| Aerosol barrier pipettes tips 10 µl (Fisherbrand) | Thermo Fisher Scientific | 2707439 | |
| Aerosol barrier pipettes tips 1000 µl (Fisherbrand) | Thermo Fisher Scientific | 2707404 | |
| Aerosol barrier pipettes tips 200 µl (Fisherbrand) | Thermo Fisher Scientific | 2707430 | |
| Antibiotic Antimicotic Solution (100X) | Sigma-Aldrich | A5955 | NRC complete medium final concentration = 1:100 dilution |
| Bovine pituitary extract | Thermo Fisher Scientific | 13028-014 | NRC complete medium final concentration = 30 µg/mL |
| Bovine serum albumin | Sigma-Aldrich | A2153 | 1:1000 dilution |
| Chemically Defined Lipid Concentrate (100X) | Thermo Fisher Scientific | 11905-031 | NRC complete medium final concentration = 1:100 dilution |
| Collagen high concentration, rat tail | Thermo Fisher Scientific | 354249 | 50 µg/mL final concentration |
| Dexamethasone | Sigma-Aldrich | D4902 | NRC complete medium final concentration = 0.393 µg/mL |
| DMEM F12 | Thermo Fisher Scientific | 21331-020 | NRC complete medium final concentration = 1X |
| E-cadherin Rabbit anti-Human, Rat, Polyclonal | Thermo Fisher Scientific | PA5-32178 | 1:400 dilution |
| Eclipse TE300 inverted microscope | Nikon | imaging | |
| Ethanolamine | Sigma-Aldrich | E9508 | NRC complete medium final concentration = 0.32 mM |
| Fetal calf serum | Thermo Fisher Scientific | 10270-106 | NRC complete medium final concentration = 5:100 dilution |
| Fluoroshield with DAPI (Mounting medium) | Sigma-Aldrich | F6057 | |
| Formaldehyde 16% (W/V) | Thermo Fisher Scientific | 28906 | 4% (W/V) |
| Goat serum | Thermo Fisher Scientific | 16210-064 | 1:10 dilution |
| Hamamatsu camera (Digital camera C11440 ORCA - flash 4.OLT) | Hamamatsu | imaging | |
| Hoechst 33258 | Sigma-Aldrich | B1155 | 5 µg/mL final concentration |
| IgG (H+L) Highly Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor Plus 647 | Thermo Fisher Scientific | A32733 | 1:500 dilution |
| ImageJ version 2.0.0-rc-69/1.52n | Open source image processing software | ||
| Insulin-Transferrin-Selenium (100X) | Thermo Fisher Scientific | 51300-044 | NRC complete medium final concentration = 1:100 dilution |
| L-Glutamine (100X) | Thermo Fisher Scientific | 25030-024 | NRC complete medium final concentration = 1:100 dilution |
| Matrigel GFR (stock concentration 9.7 mg/mL) | Thermo Fisher Scientific | 356231 | 4:10 dilution |
| NIS Elements software version 4.50.00 | Nikon | image acquisition and display | |
| Non-Essential-Amino-Acids-Solution (100X) | Thermo Fisher Scientific | 11140-035 | NRC complete medium final concentration = 1:100 dilution |
| Objective Plan Fluor 10X/0.30 Ph1 DL (∞/1.2 WD 15.2) | Nikon | ||
| Prolong Gold Antifade Reagent | Thermo Fisher Scientific | P36931 | |
| Propidium Iodide (PI) | Sigma-Aldrich | P4170 | 20 µg/mL final concentration |
| Rhodamine Phalloidin | Thermo Fisher Scientific | R415 | 16.2 nM final concentration |
| Sir-Actin / Verapamil kit | Spirochrome | SC001 | 10 µM final concentration |
| Soybean trypsin inhibitor | Thermo Fisher Scientific | 17075-029 | NRC complete medium final concentration = 50 µg/mL |
| Sterile cell strainer 40 µm (Fisherbrand) | Thermo Fisher Scientific | 22363547 | |
| Sterile pipettes 10 mL (Fisherbrand) | Thermo Fisher Scientific | 1367811E | |
| Sterile pipettes 5 mL (Fisherbrand) | Thermo Fisher Scientific | 1367811D | |
| Sterile tubes 1.5 mL (Fisherbrand) | Thermo Fisher Scientific | 11926955 | |
| Sterile tubes 15 mL (Fisherbrand) | Thermo Fisher Scientific | 7200886 | |
| Sterile tubes 50 mL (Fisherbrand) | Thermo Fisher Scientific | 553913 | |
| Sucrose | Sigma-Aldrich | S0389 | 5:100 dilution |
| Tissue culture treated flask 25cm2 (Falcon) | Thermo Fisher Scientific | 353108 | |
| Triton X-100 | Sigma-Aldrich | T8787 | 5:1000 dilution |
| Trypsin-EDTA (0.05%) phenol red | Thermo Fisher Scientific | 25300-054 | 1X |
| Tween-20 | Sigma-Aldrich | P1379 | 5:10000 dilution |
| Vitamin (100X) | Thermo Fisher Scientific | 11120-037 | NRC complete medium final concentration = 1:100 dilution |
| μ-Slide 8 Well ibiTreat, Ibidi | Clinisciences | 80826 |
Referanslar
- Edmondson, R., Broglie, J. J., Adcock, F., Yang, L. Three-Dimensional Cell Culture Systems and Their Applications in Drug Discovery and Cell-Based Biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Martín-Belmonte, F., et al. Cell-polarity dynamics controls the mechanism of lumen formation in epithelial morphogenesis. Current Biology. 18, 507-513 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Artym, V. V., Matsumoto, K. Imaging Cells in Three-Dimensional Collagen Matrix. Current Procotols in Cell Biology. , Chapter 10 (Unit 10) (2010).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bisell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 89, 9064-9068 (1992).
- Kim, S. P., Lee, D. H., Park, J. K. Development of hepatocyte spheroids immobilization technique using alternative encapsulation method. Biotechnology and Bioprocess Engineering. 3, 96-102 (1998).
- Lorent, K., et al. Identification of a plant isoflavonoid that causes biliary atresia. Science Translational Medicine. 7 (286), 67(2015).
- Nowak, M., Freudenberga, U., Tsurkana, M. V., Wernera, C., Levental, K. R. Modular GAG-matrices to promote mammary epithelial morphogenesis in vitro. Biomaterials. 112, 20-30 (2017).
- Miroshnikova, Y. A., et al. Engineering Strategies to Recapitulate Epithelial Morphogenesis Within Synthetic Three-Dimensional Extracellular Matrix With Tunable Mechanical Properties. Physical Biology. 8 (2), 026013(2011).
- Ozdemir, T., et al. Tuning Hydrogel Properties to Promote the Assembly of Salivary Gland Spheroids in 3D. ACS Biomaterials Science & Engineering. 2 (12), 2217-2230 (2016).
- Dolega, M. E., Abeille, F., Picollet-D'hahan, N., Gidrol, X. Controlled 3D culture in Matrigel microbeads to analyze clonal acinar development. Biomaterials. 52, 347-357 (2015).
- Laperrousaz, B., et al. Direct transfection of clonal organoids in Matrigel microbeads: a promising approach toward organoid-based genetic screens. Nucleic Acids Research. 46 (12), 70(2018).
- Lazaridis, K. N., LaRusso, N. F. The Cholangiopathies. Mayo Clinic Proceedings. 90 (6), 791-800 (2015).
- Tam, P. K., Yiua, R. S., Lendahl, U., Andersson, E. R. Cholangiopathies - Towards a molecular understanding. EBioMedicine. 35, 381-393 (2018).
- Loarca, L., et al. Development and characterization of cholangioids from normal and diseased human cholangiocytes as an in vitro model to study primary sclerosing cholangitis. Laboratory Investigation. 97, 1385-1396 (2017).
- De Assuncao, T. M., Jalan-Sakrikar, N., Huebert, R. C. Regenerative medicine and the biliary tree. Seminars in Liver Disease. 37, 17-27 (2017).
- Dianat, N. H., et al. Generation of functional cholangiocyte-like cells from human pluripotent stem cells and HepaRG cells. Hepatology. 60, 700-714 (2014).
- Masyuk, A. I., et al. Cholangiocyte autophagy contributes to hepatic cystogenesis in polycystic liver disease and represents a potential therapeutic target. Hepatology. 67 (3), 1088-1108 (2018).
- Sampaziotis, F., Cardoso, M., Madrigal, P., Bertero, A., Saeb-Parsy, K., et al. Cholangiocytes derived from human induced pluripotent stem cells for disease modeling and drug validation. Nature Biotechnology. 33 (8), 845-852 (2015).
- Soroka, J. C., et al. Bile-Derived Organoids From Patients With Primary Sclerosing Cholangitis Recapitulate Their Inflammatory Immune Profile. Hepatology. 70 (3), 871-882 (2019).
- Funfak, F., et al. Biophysical Control of Bile Duct Epithelial Morphogenesis in Natural and Synthetic Scaffolds. Frontiers in Bioengineering and Biotechnology. 7 (417), 417(2019).
- Du, Y., et al. Bile Duct-on-a-Chip With Organ-Level Functions. Hepatology. 0 (0), (2019).
- Shiota, J. M., Mohamad Zaki, N. H., Merchant, J. L., Samuelson, L. C., Razumilava, N. Generation of Organoids from Mouse Extrahepatic Bile Ducts. Journal of Visualized Experiments. (146), e59544(2019).
- Bircsak, K. M., Richardson, J. R., Aleksunes, L. M. Inhibition of Human MDR1 and BCRP Transporter ATPase Activity by Organochlorine and Pyrethroid Insecticides. Journal of Biochemical and Molecular Toxicology. 27 (2), 157-164 (2013).
- Fennema, E., Rivron, N., Rouwkema, J., Blitterswijk, C., Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Kanade, S., Nataraj, G., Ubale, M., Mehta, P. Fluorescein Diacetate Vital Staining for Detecting Viability of Acid-Fast Bacilli in Patients on Antituberculosis Treatment. International Journal of Mycobacteriology. 5 (3), 294-298 (2016).
- Rieger, A. M., Nelson, K. L., Konowalchuk, J. D., Barreda, D. R. Modified Annexin V/Propidium Iodide Apoptosis Assay For Accurate Assessment of Cell Death. Journal of Visualized Experiments. (50), e2597(2011).
- Tabibian, J. H., Masyuk, A., Masyuk, T. V., O'Hara, S. P., LaRusso, N. F. Physiology of Cholangiocytes. Comprehensive Physiology. 3 (1), (2013).
- Spirlì, C., et al. Functional polarity of Na+/H+ and Cl-/HCO3- exchangers in a rat cholangiocyte cell line. American Journal Physiology. 275, 1236-1245 (1998).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır