JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
기능성 및 편광 담즙 상피 낭종의 생성 및 정량적 특성화
요약
3차원(3D) 셀룰러 시스템은 유기발생을 조사하기 위한 관련 모델이다. 담즙 낭종 생산 및 특성화를 위한 하이드로겔 기반 방법이 제안됩니다. 이 프로토콜은 낭종 형성 효율, 크기를 평가하고 기능을 테스트하는 간단하고 신뢰할 수 있는 방법으로 3D 특성화의 장벽을 해명합니다.
초록
간에서 담관을 정렬하는 상피 세포인 Cholangiocytes는 담즙 형성 및 수정을 감독합니다. 지난 20년 동안 간 질환의 맥락에서, 통기성, 스페로이드 또는 튜브와 같은 구조에 기초한 3차원(3D) 모델이 조직발생, 질병 모델링 및 약물 선별 연구를 위한 조직 토폴로지를 모방하였다. 이러한 구조는 주로 하이드로겔에 담고치오시테를 포함시킴으로써 얻어졌다. 주요 목적은 상피 극성, 기능 및 형태학적 특성을 해결하여 자기 조직을 연구하는 것이었습니다. 그러나, 아주 몇몇 연구 결과는 낭종 형성 효율성에 집중합니다. 이 경우 효율성은 종종 단일 평면의 이미지에서 정량화됩니다. 기능적 분석 및 구조적 분석은 하이드로겔 중합이질 및 부작용으로 인해 발생하는 낭종 분포의 잠재적 이질성을 나타내지 않고 수행된다. 따라서 정량적 분석이 완료되면 한 문서에서 다른 아티클으로 비교하는 데 사용할 수 없습니다. 더욱이, 이 방법론은 다른 행렬 및 세포 모형의 3D 성장 잠재력의 비교를 허용하지 않습니다. 추가적으로, 면역 염색 낭종에 대한 실험 적인 문제 해결의 아무 언급도 없습니다. 본 문서에서는, 우리는 초기 세포 분포가 낭종 형성의 이기종 수직 분포와 관련이 있음을 보여주기 위해 신뢰할 수 있고 보편적인 방법을 제공한다. 하이드로겔에 내장된 Cholangiocyte 세포는 10일 의 시간 과정을 통해 하이드로겔 깊이를 따라 Z 스택 분석을 따릅니다. 이 방법을 통해 낭종 형성 효율및 성장의 견고한 운동학이 얻어진다. 우리는 또한 낭종 극성 및 분비 기능을 평가하는 방법을 제시합니다. 마지막으로 이미징용 낭종 붕괴를 제한하기 위해 면역 염색 프로토콜을 최적화하기 위한 추가 팁이 제공됩니다. 이 접근법은 다른 3D 세포 배양 연구에 적용될 수 있으므로 한 시스템을 다른 시스템과 비교할 수 있는 가능성을 열어줍니다.
서문
지난 3년 동안 체외 연구 분야는 3D 문화 시스템으로 발전했습니다. 스캐폴드/매트릭스의 존재 또는 부재에서 스페로이드 또는 응집체로서, 낙하, 동요, 미세유체 장치 또는 부동1으로3D로 세포를 배양하기 위한 다수의 프로토콜이 등장하였다. 3D 배양 방법의 사용은 2차원 (2D) 배양, 특히 낭종 또는 아시니에게 불린 3D 구조물에서 자기 조직하는 것을 보여주었다 상피 세포에 대한 그것의 이점을 입증했습니다. 이 경우, 세포는 루멘을 둘러싸고 있는 단층층을 형성하며, 여기서 세포는 생리학적 특이적 기능2를개선하여 완전한 상피 표현형을 획득한다.
수많은 연구는 자연 행렬에서 이러한 상피 오르가노이드를 형성하기위한 방법의 개발에 기여했다. 이는 생체 내 세포 세포 및 세포-미세 환경 상호 작용에서 회수할 수 있게 하여 상피 표현형3,4,5,6,7의확립 및 안정성을 얻을 수 있다. 최근에는 이식 가능한 오르가노이드를 개발하고 상피 프로그램을 조율하기 위한 미세 환경의 요구 사항을 해독하는 것을 목표로, 합성 하이드로겔은 상피 아시니8,9,10의형성을 향상시키기 위해 개발되었다. 안타깝게도, 이러한 연구는 질적 데이터를 보고하거나, 2D 평면8,9,10에서비낭종에 대한 낭종의 비율과 같은 내부 참조를 사용하여 계산 방법을 제시한다. 이것은 상피 오르가노이드의 효율성, 안정성, 또는 형태학적 및 생리적 특성의 관점에서 다른 연구 사이의 비교를 배제합니다.
미세 유체 장치를 사용하여 구슬에 있는 상피 세포의 미크로캡슐화는 보다 현실적인 정량적 및 비교 결과를 허용했습니다. 이 기술을 이용하여, 다양한 세포 유형으로부터의 오르가노이드가 형성되고 상이한 3D 세포구조(11,12)의형태에 기초하여 분화되었다. 그러나 이 기술은 작업하기 쉽지 않으며 미세 유체 장치를 생산하기 위해 클린 룸을 사용해야 합니다. 이 기술은 몇 가지 유형의 하이드로겔에 대해 확립되었지만 다른 하이드로겔에 기술적 적응을 적용하여 다재다능함을 제한해야 합니다. 따라서 상피 오르가노이드를 개발하기위한 대부분의 연구는 하이드로 겔 벌크에 상피 세포의 포함에 의존합니다. 이러한 방법에서, 겔 구조화 및 세포 분포의 높은 이질성은 전체 3D 배양 내부의 종종 소홀히 한다. 따라서 대부분의 분석은 전체 3D 볼륨에서 다양한 셀룰러 개체의 분포만 극히 대략적인 단일 2D 이미지와 관련이 있습니다.
담관에 영향을 미치는 질병, 이러한 담관 아크라키종 등, 담즙 atresia, 1 차 경화 담관염, 다른 사람의 사이에서, 사망률과 이환율의 주요 원인입니다. 간 이식을 제외하고, 이러한 조건에 대한 효과적인 치료법은없다(13). 담관 형성, 질병 원인 및 진행을 조사하는 노력은 새로운 치료법14의개발을 허용할 것입니다.
낭종, 스페로이드 또는 튜브와 같은 구조의 담즙 조직 모델-일반 또는 환자 유래, 분화, 또는 선조 유래 담랑고이오시테 세포주15,16,17,18,19,20이개발되었다. 다양한 연구는 cholangiocyte 극성을 recapitud, cholangiocyte 마커의 표현, 섬모의 존재, cholangiocyte 분비 및 재봉 능력, 루멘 형성 및 방해; 이 모든 것은 cholangiocyte 표현형, 형태학 및기능(15,17,19)의중요한특성을나타낸다. 그 외는시간 20의장기간 동안 환자 유래 담즙 유기체의 유지 보수를 보고했습니다. 최근에는 담즙 낭종 유기발생에 대한 생화학적 및 생물리학적 단서의 역할을조사했다. 중요하게도, 담즙 아레시아의 병기 발생은 담즙 스페로이드 및 튜브7,22에서공부되었다. 또한, 담랑고이테 노화, 프로 염증성 사이토카인의 분비, 대식세포 모집 등 1차 경화질담염의 주요 특징은 담즙 구형 구형15,20을사용하여 성공적으로 연구되었다. 그러나, 이러한 질문을 해결할 수 있는 생리학적으로 콜린고이트 표현형, 생리학 및 미세 환경을 조절하는 체외 3D 정량적 모델에서 재현가능한 것은 여전히 필요하다. 더욱이, 낭종 형성효율(21,23)을보고한 간행물은 극소수에 불과하다. 이것은 특히 조직발생, 질병 원인 및 cholangiocyte 기능 및 편광을 가진 약물 반응의 상관 관계를 조사할 때 확립하는 중요한 포인트입니다. 또한 프로토콜에서 프로토콜로 사용되는 스캐폴드/매트릭스의 차이로 시스템 간에 비교하기가 어렵습니다. 이러한 문제를 해결하기 위해 루멘 형성, 담랑고이트 편광 및 cholangiocyte 분비 기능을 모방한 담즙 낭종을 생성하는 정량적이고 신뢰할 수 있으며 보편적인 방법을 제안합니다. 중요한 것은 시간이 지남에 따라 평가할 때 3D 젤을 통해 Z축을 따라 수행되는 체계적인 분석, 낭종 형성 효율, 크기, 생존가능성, 편광 및 기능을 제시합니다. 더욱이, 우리는 자연 하이드로겔 및 일반 쥐 cholangiocytes (NRC)s를 프로토콜에 대한 예로 사용하지만, 다른 천연 또는 합성 하이드로겔뿐만 아니라 상피 세포는 3D 낭포성 구조의 형성에 사용될 수 있었다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 낭종의 세대
참고: 젤레이션이 셀을 포함할 수 있는 경우 이 프로토콜은 모든 유형의 하이드로겔로 수행할 수 있습니다.
- 하이드로겔 코팅
참고: 챔버 슬라이드의 적절한 하이드로겔 코팅은 웰 의 바닥에 2D 세포 층의 형성을 피하기 위한 중요한 단계이며, 이는 후속 낭종 이미징을 방해하고 낭종 형성 효율의 계산을 손상시킬 수 있습니다.- 젤 용액의 균질성을 보장하기 위해 하이드로겔을 하룻밤 사이에 4°C(O/N)에서 해동하십시오.
- -20°C의 얼음 또는 O/N에 대한 프리쿨 파이펫 팁과 -20°C O/N의 8웰 챔버 슬라이드.
- 하이드로겔과 8웰 챔버 슬라이드를 얼음으로 가득 찬 얼음 양동이에 놓습니다.
- 15mL 원추형 튜브에서, 차가운 NRC 완전 매체(재료표참조)에 40% 하이드로겔(V/V)을 함유한 용액을 준비하고 튜브를 얼음 위에 놓습니다.
- 챔버 슬라이드를 코팅하려면, 차가운 파이펫 팁을 사용하여, 각 우물의 중앙에 하이드로겔 용액의 50 μL을 추가하고, 파이펫 팁을 사용하여 전체 표면에 확산, 얼음에 챔버 슬라이드를 유지하면서(도 1A).
참고: 거품을 피하기 위해 가능한 한 균일하게 하이드로겔 용액을 확산시다. - 하이드로겔을 중합하려면 챔버 슬라이드를 37°C, 5% CO2에서최소 15분 동안 배양한다.
- 세포 준비
- 37°C로 예열된 수조에서 NRC 완충식식염(PBS) 및 트립신-에틸렌디아민 테트라아세산(trypsin-EDTA)을 가열한다.
- 하이드로겔이 중합화되는 동안, NrC가 T-25cm2 콜라겐 코팅플라스크(21)에서70%의 합류로 성장하도록 한다. 예열된 1x PBS로 한 번 씻어내다.
- NrC는 37°C, 5%CO2에서 20분 동안 사전 가열된 1x PBS(T-25cm2 플라스크용)로 NrC를 배양한다.
참고: 트립신-EDTA로 잠복식 시간을 단축하는 이 단계는 세포의 자체 조직 특성을 유지하는 데 중요한 역할을 합니다. - PBS를 버리고, 트립신-EDTA 1mL을 추가하고, 37°C, 5% CO2에서5-10분 동안 배양한다.
- 4mL의 사전 가열 된 완전한 NRC 매체로 중화하십시오. 세포 현탁액을 15mL 원판 튜브로 수집하고 전송하고 150 x g에서 4 분 동안 회전하십시오.
- 배지를 버리고 전가열 된 배지의 5mL에서 세포 펠릿을 다시 중단하십시오.
- 40 μm 세포 스트레이너를 사용하여 셀 용액을 50mL 원문 튜브로 필터링하고 셀을 계산합니다.
참고: 스트레이너를 통해 세포를 전달하는 것은 정량적 결과가 재현가능한, 거의 유사한 크기의 셀 응집체를 포함하기 위한 중요한 단계입니다.
- 하이드로겔 용액에 세포 현탁액 포함
- 차가운 완전 NRC 배지(튜브 1)에서 80% 하이드로겔(V/V)의 1,600 μL의 용액을 준비; 얼음에 보관하십시오. 5 x 105 셀/mL을 1,600 μL에 희석하여 완전한 NRC 배지(튜브 2)를 희석하고 얼음에 보관하십시오.
참고: 이 단계는 하이드로겔의 중합화를 피하고 세포 현탁액과 혼합하고 세포 생존가능성을 유지하기 위해 신속하게 수행해야 합니다. - 40% 하이드로겔(V/V), 혼합 튜브 1 및 튜브 2에서 2.5 x 105 셀/mL의 세포 파종 용액을 준비한다. 기포(도1B)를피하는 하이드로겔 코팅 챔버 슬라이드의 각 웰에 셀 용액의 400 μL을 추가합니다.
- 챔버 슬라이드를 미디어가 변경될 때까지 5% CO2로 인큐베이터에 37°C로 유지합니다.
- 배양 2일 후, 각 웰의 구석에서 배지의 250 μL을 제거하고 하이드로겔을 피펫하지 않도록 주의하십시오. 그런 다음 배양 배지의 250 μL을 천천히 추가합니다. 매 2일마다 배지를 변경합니다.
참고: 챔버 슬라이드의 움직임을 최소화, 특히 낭종 개시 하는 동안.
- 차가운 완전 NRC 배지(튜브 1)에서 80% 하이드로겔(V/V)의 1,600 μL의 용액을 준비; 얼음에 보관하십시오. 5 x 105 셀/mL을 1,600 μL에 희석하여 완전한 NRC 배지(튜브 2)를 희석하고 얼음에 보관하십시오.
2. 낭종 정량화
- 낭종 이미징
참고: 현미경이 CO2 및 온도를 제어하는 가열 챔버가 장착되어 있지 않은 경우 이 섹션은 세포 생존 가능성을 손상시키지 않도록 신속하게 수행해야 합니다. 전체 하이드로겔 부피에서 낭종 분포를 대표하는 일관된 정량화를 보장하기 위해 낭종은 상대비 현미경 검사법과 직렬 이미징(Z-stacks)을 통해 서로 다른 시간 점에 걸쳐 미리 정의된 파라미터를 통해 이미지화됩니다.- 각 시간 지점에 대한 하이드로겔의 깊이를 따라 Z 스택을 가져가라(도 1C, D). 이 예제에서는 Z 스택을 1일, 2, 4, 7 및 10일 동안 촬영합니다.
참고: 하이드로겔에서 초기 세포 분포가 균일하여 이 방법의 적용 가능성을 확인합니다.- 이미지 수집 소프트웨어가 장착된 위상 대비 현미경으로 수동 코 조각 패드창(그림 2B(1)에서10배 이상의 객관적배율을 선택합니다.
- 흰색 램프를 켜고 밝은 필드 이미징 옵션을 선택합니다.
- 바 하위 메뉴에서"재생"버튼을 선택하여 카메라를 켭분. 낭종 필드에 초점을 맞추고 노출 시간을 설정합니다(그림 2B (2)). 자동 캡처 폴더 창을 열어 이미지를 자동으로 저장합니다(그림2B(3)).
- 캡처 Z 시리즈 창을 열고 Z 스택의 상단 및 하단 평면을 나사로 정의합니다(동일한 XY 좌표하지만 다른 Z 스크린). 목표에 따라 Z-스텝을 조정하고, 해상도의 수준과 버튼을누르기 "지금 실행"인수를 시작합니다(그림 2B(4)).
참고: 이 예에서 낭종은 520 μm의 하이드로겔 두께에 걸쳐 확산됩니다. 26 이미지는 20 μm Z 단계 간격으로 하이드로겔 깊이를 따라 획득된다. 목표에 따라 Z 단계는 낭종을 놓치지 않고 단일 세포 및 골재의 검출을 보장하기 위해 조정되어야 합니다. - 잘 겹치지 않는 Z 스택을 3개 이상 섭취하십시오.
참고: 이 예제와 마찬가지로 이 예제와 같이 수압 중합의 이질성으로 인해 가장자리보다 방광이 젤 깊이에 더 많이 있을 때 이 샘플링이 필요합니다. - 대표적인 데이터 집합을 갖기 위해 2.1.1.5 단계를 반복합니다. 총 3 개의 우물.
참고: 낭종의 이질분포는 하이드로겔의 종류, 중합화 및 세포주에 따라 달라집니다. 우물당 3개의 Z-스택과 실험당 3개의 우물을 고려할 때, 최소 200개의 낭종이 9개의 Z 스택을 통해 이미지되어 매시점에서 낭종 형성과 낭종 성장을 특성화합니다.
- 각 시간 지점에 대한 하이드로겔의 깊이를 따라 Z 스택을 가져가라(도 1C, D). 이 예제에서는 Z 스택을 1일, 2, 4, 7 및 10일 동안 촬영합니다.
- 이미지 처리
참고: 하이드로겔에서 NrC는 단일 세포, 낭종 또는 골재로 찾을 수 있습니다. 낭종은 루멘을 둘러싸고 있는 둥글고 얇은 대조세포 껍질의 존재에 의해 확인되며, 세포 응집체는 불규칙한 모양을 제시하고 루멘이 없는 동안. 골재 및 단일 세포는 조밀하고 대조되는 외관을갖는다(그림 3B(4)).- 피지 소프트웨어를 열고 Z 스택을 열고 피지 메뉴로 이동하여 파일 | 열기 (보충그림 1)를클릭합니다. 분석할 Z 스택을 선택합니다. 필요한 경우 "가상 스택" 옵션을 선택하고 열기위해"예"를클릭합니다(그림 3A(1)).
- 이미지를 통해 스택을 복제 | 중복. 상자를 클릭 "중복 스택" 그리고 클릭 "OK"(보충 그림 2).
참고: 이 예제에서는 Z 스택이 16비트로 인코딩된 .nd2 파일 형식입니다. - 중복된 스택에서 최소 강도 투영을 만듭니다. 이미지 메뉴로 이동 | 스택 | Z 프로젝트. 투영 유형"최소 강도"를선택하고 클릭 "OK"(그림 3A (2)(보충 도 3).
- 투영에서 배경을 뺍니다. 프로세스 메뉴로 이동 | 배경을 뺍니다. 롤링 볼 반경 500.0 픽셀을 입력하고"라이트 배경"을클릭하여 낭종을 배경(그림 3A(3))(보충도4)보다더 대조적으로 렌더링합니다.
참고: 롤링 볼 반지름은 배경 빼기가 작동하는 영역의 크기를 정의합니다. 이 매개 변수는 식별하려면 가장 큰 개체의 크기로 설정해야 합니다. - 대비 향상이 필요한 경우 이미지 메뉴로 이동 | 조정 | 밝기/대비 | 자동 | 적용합니다. 피지는 자동으로 밝기와 대비를 최적화합니다. (도 3A(3)에서하부 및 상회색 값은 각각 49702 및 65452로 설정되었다(보충도5).
참고: 프로젝션이 보정되지 않은 경우 분석 메뉴로 이동 | 스케일을 설정하고 해당 교정 μm/픽셀비율(보충 도 6)을입력합니다.
- 낭종 계수 및 낭종 크기 측정
- 대략적인 낭종 직경을 측정하려면 피지 메뉴에서 직선 도구를 선택하고 최종 투영(그림3B(4)에서각 낭종의 직경에 걸쳐 선을 그립니다. ROI 관리자에 각 낭종에 대해 생성된 새로운 관심 영역(ROI)을추가합니다. "모든표시" 를 클릭하여 계산된 낭종을 확인합니다(추가그림 7)
- Z 스택의 투영에서 세트 ROI를 겹쳐 서 계산하지 않고 낭종이 남아 있지 않은지 확인합니다. 이렇게 하려면 Z 스택 창을 클릭하여 선택합니다. ROI 관리자에서"모든 표시"를클릭하고 Z 스택을 따라 커서를 이동하여 이미지당 해당 이미지를 확인하면 모든 낭종이 계산되었습니다(보충도 8).
- 새로운 낭종이 계산되고 ROI가 2.3.1 단계에 추가되면 ROI 세트를 선택하고 더 많은 것을 클릭하여 ROI 관리자 창을 통해 저장 | 저장 (보충 도9).
- ROI 관리자의 모든 ROI를 선택하고 ROI 관리자에서"측정"을클릭하여 각 낭종의 크기를 가져옵니다. 이렇게 하면 각 낭종과 예상 크기에"결과"라는이름의 새 측정 창이 열립니다. 그런 다음"결과"창을 클릭하고 메뉴를 통해 .csv 형식으로 저장 : 파일 | 저장 (보충 도 10).
참고: 매크로를 만들어 스택을 반 자동 처리하고, 프로젝션에서 낭종 수/크기를 추정하고, 데이터를 저장하여 더 빠른 계산 절차를 수행할 수 있습니다. 이렇게하려면 플러그인을 클릭하여 막대 메뉴에서"기록"도구를선택 | 매크로 | 기록.
- 낭종 형성 효율의 정량화
 투영(Y=1, 2, 4, 7 또는 10)에서 Y일의 낭종 수를 계산합니다.
투영(Y=1, 2, 4, 7 또는 10)에서 Y일의 낭종 수를 계산합니다.- Y일세포1000세포에 대한 낭종 형성 효율을 계산하기 위해, 하이드로겔 부피로부터 유추된 0일째에 시드된 세포의 수로 그 시점에서 계산된 낭종의 수를 1000(도3C, 도 4)으로나눈다.
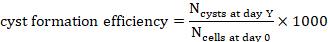
3. 셀 생존 가능성
- 1mL 아세톤에 5 mg의 FDA를 용해시켜 5 mg/mL에서 형광제(FDA)의 스톡 용액을 준비하고 -20°C에 저장한다.
- 증분(dH2O)에서2 mg/mL의 농도로 프로피듐 요오드(PI)의 스톡 용액을 준비하고 4°C에 보관한다.
- 태아 종아리 혈청(FCS)없이 NRC 배지를 준비한다.
- FDA/PI 염색 용액을 준비하려면 FCS 없이 NRC 배지의 2.5mL에 FDA 주식 용액 4μL(8 μg/mL 최종 농도) 및 PI 스톡 용액 25μL(20 μg/mL 최종 농도)을 추가합니다.
- 챔버 슬라이드에서 배지를 제거하고, 각 우물에 염색 용액의 250 μL을 추가하고 37 °C, 5 % CO2에서어둠 속에서 4-5 분 인큐베이션하십시오. 스테핑 용액을 조심스럽게 피펫하고 1x PBS의 250 μL로 한 번 세척하십시오.
- 각 우물에 완전한 NRC 배지 250 μL을 조심스럽게 추가하고 텍사스 적색 및 형광이소야네이트 (FITC) 필터와 반전 형광 현미경을 사용하여 사진을 찍습니다. 살아있는 세포는 녹색이고 죽은 세포는 적색이 될 것이다(그림 5A).
참고: 라이브/데드 셀을 정량화하기 위해 2단계 다음 하이드로겔 부피 에서 Z 스택을 가져 와서 형광을 위한 이미지 처리 방법을 조정합니다.
4. 분비 활동
참고: 담랑고이티테스의 정압막을 통한 분비 활동은 루멘내의 형광세포의 분비에 의해 평가된다. 그 특이성은 Verapamil, 다중 약물 내성 (MDR) 수송 억제제(24)와동일한 테스트를 수행하여 평가 될 수있다.
- 5 μg/mL에서 Hoechst 33258의 염색 용액을 준비하려면 FCS없이 NRC 배지의 2.5 mL에 Hoechst 주식 용액 (dH2O의 15 mg / mL 재고 농도)의 0.83 μL을 추가하십시오.
- 각 우물에 Hoechst 용액 250 μL을 추가하고 37 °C에서 배양하고 15 분 동안 5 % CO2를 배양하십시오.
- Hoechst 용액을 제거하고 각 우물에 250 μg/mL 최종 농도(8μg/mL 최종 농도)를 추가합니다. 37 °C에서 4-5 분, 5 % CO2에서배양하십시오.
참고: 세포가 FDA 염색 용액에 노출되는 즉시, 형광 분비 운동학의 후속은 낭종이 분비하는 데 필요한 시간을 보정하는 데 유용 할 수 있습니다. 이렇게하려면 시간 경과 이미징을 통해 1 시간 마다 사진을 찍습니다. 이 예에서, 하이드로겔에서 NRC 분비낭을 관찰하는 데 필요한 시간은 약 15-20 분이다. - FCS 없이 배지로 헹구고 5분 후에 반전된 형광 현미경을 사용하여 이미지를 찍습니다. 4′,6-diamidino-2-페닐린돌 (DAPI) 및 FITC 필터를 사용하여 루멘에서 핵 라벨링 및 형광 축적을 드러냅니다(도 6A). 분비 낭종의 수를 정량화하려면 2단계에서와 같이 Z 스택을 취하고 이미지 처리 단계를 형광 이미지에 적용합니다.
참고: Verapamil 테스트의 경우, 다음 조건에 따라 베라파밀의 인큐베이션에 의해 이전 프로세스(4.3. ~ 4.4.) 선행: - 디메틸 설프리산화물(DMSO)에서 10m 베라파밀의 스톡 솔루션을 준비한다. 10 μM 작업 용액을 준비하려면 VErapamil 스톡 용액2.5 μL과 FCS 없이 2.5mL 배양 배지를 혼합하십시오.
- 루멘의 형광이 MDR 분비에서 발생한다는 것을 평가하기 위해 다른 슬라이드를 가지고 베라파밀 작업 용액 250μL을 각 우물에 넣고 37° C에서 20분, 5% CO2를 배양합니다.
- 용액을 제거하고 FDA 용액의 250 μL(8 μg/mL 최종 농도)을 각 우물에 추가합니다. 37 °C, 5 % CO2에서어둠 속에서 4-5 분 인큐베이션. 그런 다음, 이미징(그림 6B, C)전에1 x PBS의 250 μL로 세척하십시오.
5. 면역형광에 의한 상피 극성 평가
- 고정 용액을 준비하려면 4% 포름알데히드를 5% 자당으로 섞고, 1x PBS, pH 7.4로 혼합하고 37°C에서 예열된 수조에 배양한다.
- 세포를 고치려면 매트릭스를 손상시키지 않고 우물에서 배양 배지를 부드럽게 피펫합니다. 고정 용액의 400 μL을 우물 측면에 천천히 추가합니다. 실온(RT)에서 20분 동안 배양합니다.
참고: 손상이 발생하지 않도록 항상 액체의 25 μL을 매트릭스 위에 둡니다. - 고정 용액을 부드럽게 제거하고 RT(RT)에서 1x PBS400 μL로 3배 세척합니다.
- PBS를 피펫아웃하고, 400 μL의 투과성 용액(1x PBS에서 0.5% 트리톤 X-100)을 추가하고 RT에서 10분 동안 배양합니다.
- 투과성 용액을 부드럽게 제거하고, 1x PBS의 400 μL과 RT에서 30분의 긴 세척 단계로 3개의 빠른 세척을 합니다.
참고: 이 단계에서 슬라이드는 2 일 동안 4 °C로 저장할 수 있습니다. 이 경우 증발 및 매트릭스 건조를 방지하기 위해 파라핀 필름으로 슬라이드를 밀봉하십시오. - PBS를 제거하고, 0.1% 소 세럼 알부민(BSA)을 포함하는 블로킹 용액400 μL을 추가하고 1x PBS에 염소 세럼 10% 및 RT에서 60분 동안 배양합니다.
주의: BSA농도가 0.1% 이상 높으면 루멘 후퇴와 낭종 붕괴가 발생할 수 있습니다(대표 결과 섹션 참조)(그림7A참조). - 블로킹 용액을 피펫아웃하고 PBS/0.05% 트웬 20의 400 μL로 한 번 세척하고 폐기하십시오.
- 항체 용액의 150 μL을 추가, 예를 들어, E-cadherin 항체 희석 1:400 및 Phalloidin 568 (16.2 nM 최종 농도) 1 x PBS에 및 RT에서 90 분 동안 인큐베이션.
참고: E-cadherin의 이러한 희석은 표준 2D 면역 형광 프로토콜과 동일하게 사용됩니다. - PBS/0.05% 트위엔 20, 3x의 400 μL로 시료를 세척; RT에서 10 분 동안 샘플을 배양 할 때마다.
- 이차 항체의 150 μL (염소 안티 토끼 IgG 알렉사 플루어 플러스 647)를 추가하고, 1x PBS에 1:500을 희석하고 RT에서 60 분 인큐베이션하십시오.
- PBS/0.05% Tween 20의 400 μL로 3배, RT에서 10분 동안 시료를 배양할 때마다 세척합니다.
- 1x PBS의 400 μL로 3배, RT에서 10분 동안 시료를 배양할 때마다 세척합니다.
- 마지막 세척의 PBS를 버리고 아래두 가지 옵션 중 하나에 따라 공초점 현미경 검사를 통해 시각화를위한 챔버 슬라이드를 준비하십시오.
- 1x PBS의 400 μL과 잘 당 50 μL을 추가합니다. 샘플은 커버슬립(도7B)을장착할 필요 없이 우물 바닥을 통해 검사할 수 있다.
- DAPI가 포함된 안티페이드 시약의 웰당 100 μL을 추가하고 RT에서 슬라이드건조 O/N을 허용합니다.
Access restricted. Please log in or start a trial to view this content.
결과
낭종의 형성 과 특성화
3D 세포 배양 시스템은 유기 발생 및 질병모델링(25)을연구하는 중요한 도구이다. 불행하게도, 이들 방법의 대부분은 다양한연구7,8,9,10,15,18,23사이의 낭종 형성 효율?...
Access restricted. Please log in or start a trial to view this content.
토론
3D 세포 구조의 유기 발생 및 유지를 연구하기 위해 다양한 조직을 모델링하여 서로 다른 세포 기원뿐만 아니라 합성 하이드로겔8,9,10,21을포함한 다른 유형의 세포 행렬을 사용하여 모델링되었습니다. 그러나, 3D 정량분석의 부족으로 인해 오르가노이드 형성또는 기능성7,
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
NRC 세포주를 친절하게 제공한 니콜라스 라루소 박사(미국 미네소타 주 로체스터 클리닉)에게 감사드립니다.
이 작품은 iLite RHU 프로그램 (ANR-16-RHUS-0005 부여)과 DHU 간염노프 모두의 재정 지원을 받았습니다.
이사벨 가르신과 레소 디오 디스토리 셀룰레르 파리 사클레이가 이미징에 대한 지원을 해준 것에 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 10 µl- Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000020 | |
| 100 µl - Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000046 | |
| 1000 µl - Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000062 | |
| 1X PBS | Thermo Fisher Scientific | 14190-094 | |
| 200 µl - Pipette Eppendorf Research Plus | Thermo Fisher Scientific | 3120000054 | |
| 3,3′,5-Triiodo-L-thyronine sodium salt | Sigma-Aldrich | T5516 | NRC complete medium final concentration = 3.4 µg/mL |
| Acetic acid | VWR | 20104-298 | 0.02N final |
| Aerosol barrier pipettes tips 10 µl (Fisherbrand) | Thermo Fisher Scientific | 2707439 | |
| Aerosol barrier pipettes tips 1000 µl (Fisherbrand) | Thermo Fisher Scientific | 2707404 | |
| Aerosol barrier pipettes tips 200 µl (Fisherbrand) | Thermo Fisher Scientific | 2707430 | |
| Antibiotic Antimicotic Solution (100X) | Sigma-Aldrich | A5955 | NRC complete medium final concentration = 1:100 dilution |
| Bovine pituitary extract | Thermo Fisher Scientific | 13028-014 | NRC complete medium final concentration = 30 µg/mL |
| Bovine serum albumin | Sigma-Aldrich | A2153 | 1:1000 dilution |
| Chemically Defined Lipid Concentrate (100X) | Thermo Fisher Scientific | 11905-031 | NRC complete medium final concentration = 1:100 dilution |
| Collagen high concentration, rat tail | Thermo Fisher Scientific | 354249 | 50 µg/mL final concentration |
| Dexamethasone | Sigma-Aldrich | D4902 | NRC complete medium final concentration = 0.393 µg/mL |
| DMEM F12 | Thermo Fisher Scientific | 21331-020 | NRC complete medium final concentration = 1X |
| E-cadherin Rabbit anti-Human, Rat, Polyclonal | Thermo Fisher Scientific | PA5-32178 | 1:400 dilution |
| Eclipse TE300 inverted microscope | Nikon | imaging | |
| Ethanolamine | Sigma-Aldrich | E9508 | NRC complete medium final concentration = 0.32 mM |
| Fetal calf serum | Thermo Fisher Scientific | 10270-106 | NRC complete medium final concentration = 5:100 dilution |
| Fluoroshield with DAPI (Mounting medium) | Sigma-Aldrich | F6057 | |
| Formaldehyde 16% (W/V) | Thermo Fisher Scientific | 28906 | 4% (W/V) |
| Goat serum | Thermo Fisher Scientific | 16210-064 | 1:10 dilution |
| Hamamatsu camera (Digital camera C11440 ORCA - flash 4.OLT) | Hamamatsu | imaging | |
| Hoechst 33258 | Sigma-Aldrich | B1155 | 5 µg/mL final concentration |
| IgG (H+L) Highly Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor Plus 647 | Thermo Fisher Scientific | A32733 | 1:500 dilution |
| ImageJ version 2.0.0-rc-69/1.52n | Open source image processing software | ||
| Insulin-Transferrin-Selenium (100X) | Thermo Fisher Scientific | 51300-044 | NRC complete medium final concentration = 1:100 dilution |
| L-Glutamine (100X) | Thermo Fisher Scientific | 25030-024 | NRC complete medium final concentration = 1:100 dilution |
| Matrigel GFR (stock concentration 9.7 mg/mL) | Thermo Fisher Scientific | 356231 | 4:10 dilution |
| NIS Elements software version 4.50.00 | Nikon | image acquisition and display | |
| Non-Essential-Amino-Acids-Solution (100X) | Thermo Fisher Scientific | 11140-035 | NRC complete medium final concentration = 1:100 dilution |
| Objective Plan Fluor 10X/0.30 Ph1 DL (∞/1.2 WD 15.2) | Nikon | ||
| Prolong Gold Antifade Reagent | Thermo Fisher Scientific | P36931 | |
| Propidium Iodide (PI) | Sigma-Aldrich | P4170 | 20 µg/mL final concentration |
| Rhodamine Phalloidin | Thermo Fisher Scientific | R415 | 16.2 nM final concentration |
| Sir-Actin / Verapamil kit | Spirochrome | SC001 | 10 µM final concentration |
| Soybean trypsin inhibitor | Thermo Fisher Scientific | 17075-029 | NRC complete medium final concentration = 50 µg/mL |
| Sterile cell strainer 40 µm (Fisherbrand) | Thermo Fisher Scientific | 22363547 | |
| Sterile pipettes 10 mL (Fisherbrand) | Thermo Fisher Scientific | 1367811E | |
| Sterile pipettes 5 mL (Fisherbrand) | Thermo Fisher Scientific | 1367811D | |
| Sterile tubes 1.5 mL (Fisherbrand) | Thermo Fisher Scientific | 11926955 | |
| Sterile tubes 15 mL (Fisherbrand) | Thermo Fisher Scientific | 7200886 | |
| Sterile tubes 50 mL (Fisherbrand) | Thermo Fisher Scientific | 553913 | |
| Sucrose | Sigma-Aldrich | S0389 | 5:100 dilution |
| Tissue culture treated flask 25cm2 (Falcon) | Thermo Fisher Scientific | 353108 | |
| Triton X-100 | Sigma-Aldrich | T8787 | 5:1000 dilution |
| Trypsin-EDTA (0.05%) phenol red | Thermo Fisher Scientific | 25300-054 | 1X |
| Tween-20 | Sigma-Aldrich | P1379 | 5:10000 dilution |
| Vitamin (100X) | Thermo Fisher Scientific | 11120-037 | NRC complete medium final concentration = 1:100 dilution |
| μ-Slide 8 Well ibiTreat, Ibidi | Clinisciences | 80826 |
참고문헌
- Edmondson, R., Broglie, J. J., Adcock, F., Yang, L. Three-Dimensional Cell Culture Systems and Their Applications in Drug Discovery and Cell-Based Biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Martín-Belmonte, F., et al. Cell-polarity dynamics controls the mechanism of lumen formation in epithelial morphogenesis. Current Biology. 18, 507-513 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Artym, V. V., Matsumoto, K. Imaging Cells in Three-Dimensional Collagen Matrix. Current Procotols in Cell Biology. , Chapter 10 (Unit 10) (2010).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bisell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 89, 9064-9068 (1992).
- Kim, S. P., Lee, D. H., Park, J. K. Development of hepatocyte spheroids immobilization technique using alternative encapsulation method. Biotechnology and Bioprocess Engineering. 3, 96-102 (1998).
- Lorent, K., et al. Identification of a plant isoflavonoid that causes biliary atresia. Science Translational Medicine. 7 (286), 67(2015).
- Nowak, M., Freudenberga, U., Tsurkana, M. V., Wernera, C., Levental, K. R. Modular GAG-matrices to promote mammary epithelial morphogenesis in vitro. Biomaterials. 112, 20-30 (2017).
- Miroshnikova, Y. A., et al. Engineering Strategies to Recapitulate Epithelial Morphogenesis Within Synthetic Three-Dimensional Extracellular Matrix With Tunable Mechanical Properties. Physical Biology. 8 (2), 026013(2011).
- Ozdemir, T., et al. Tuning Hydrogel Properties to Promote the Assembly of Salivary Gland Spheroids in 3D. ACS Biomaterials Science & Engineering. 2 (12), 2217-2230 (2016).
- Dolega, M. E., Abeille, F., Picollet-D'hahan, N., Gidrol, X. Controlled 3D culture in Matrigel microbeads to analyze clonal acinar development. Biomaterials. 52, 347-357 (2015).
- Laperrousaz, B., et al. Direct transfection of clonal organoids in Matrigel microbeads: a promising approach toward organoid-based genetic screens. Nucleic Acids Research. 46 (12), 70(2018).
- Lazaridis, K. N., LaRusso, N. F. The Cholangiopathies. Mayo Clinic Proceedings. 90 (6), 791-800 (2015).
- Tam, P. K., Yiua, R. S., Lendahl, U., Andersson, E. R. Cholangiopathies - Towards a molecular understanding. EBioMedicine. 35, 381-393 (2018).
- Loarca, L., et al. Development and characterization of cholangioids from normal and diseased human cholangiocytes as an in vitro model to study primary sclerosing cholangitis. Laboratory Investigation. 97, 1385-1396 (2017).
- De Assuncao, T. M., Jalan-Sakrikar, N., Huebert, R. C. Regenerative medicine and the biliary tree. Seminars in Liver Disease. 37, 17-27 (2017).
- Dianat, N. H., et al. Generation of functional cholangiocyte-like cells from human pluripotent stem cells and HepaRG cells. Hepatology. 60, 700-714 (2014).
- Masyuk, A. I., et al. Cholangiocyte autophagy contributes to hepatic cystogenesis in polycystic liver disease and represents a potential therapeutic target. Hepatology. 67 (3), 1088-1108 (2018).
- Sampaziotis, F., Cardoso, M., Madrigal, P., Bertero, A., Saeb-Parsy, K., et al. Cholangiocytes derived from human induced pluripotent stem cells for disease modeling and drug validation. Nature Biotechnology. 33 (8), 845-852 (2015).
- Soroka, J. C., et al. Bile-Derived Organoids From Patients With Primary Sclerosing Cholangitis Recapitulate Their Inflammatory Immune Profile. Hepatology. 70 (3), 871-882 (2019).
- Funfak, F., et al. Biophysical Control of Bile Duct Epithelial Morphogenesis in Natural and Synthetic Scaffolds. Frontiers in Bioengineering and Biotechnology. 7 (417), 417(2019).
- Du, Y., et al. Bile Duct-on-a-Chip With Organ-Level Functions. Hepatology. 0 (0), (2019).
- Shiota, J. M., Mohamad Zaki, N. H., Merchant, J. L., Samuelson, L. C., Razumilava, N. Generation of Organoids from Mouse Extrahepatic Bile Ducts. Journal of Visualized Experiments. (146), e59544(2019).
- Bircsak, K. M., Richardson, J. R., Aleksunes, L. M. Inhibition of Human MDR1 and BCRP Transporter ATPase Activity by Organochlorine and Pyrethroid Insecticides. Journal of Biochemical and Molecular Toxicology. 27 (2), 157-164 (2013).
- Fennema, E., Rivron, N., Rouwkema, J., Blitterswijk, C., Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Kanade, S., Nataraj, G., Ubale, M., Mehta, P. Fluorescein Diacetate Vital Staining for Detecting Viability of Acid-Fast Bacilli in Patients on Antituberculosis Treatment. International Journal of Mycobacteriology. 5 (3), 294-298 (2016).
- Rieger, A. M., Nelson, K. L., Konowalchuk, J. D., Barreda, D. R. Modified Annexin V/Propidium Iodide Apoptosis Assay For Accurate Assessment of Cell Death. Journal of Visualized Experiments. (50), e2597(2011).
- Tabibian, J. H., Masyuk, A., Masyuk, T. V., O'Hara, S. P., LaRusso, N. F. Physiology of Cholangiocytes. Comprehensive Physiology. 3 (1), (2013).
- Spirlì, C., et al. Functional polarity of Na+/H+ and Cl-/HCO3- exchangers in a rat cholangiocyte cell line. American Journal Physiology. 275, 1236-1245 (1998).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유