Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nötron Spin Yankı Spektroskopisi ile Protein Dinamiğinin İncelenmesi
Bu Makalede
Özet
Bu protokol, insan sağlığında önemli bir role sahip olan iki model proteinin yapısını ve dinamiklerini araştırmak için kullanılan yöntemleri açıklamaktadır. Bu teknik, protein etki alanları arası hareketlerle ilgili zaman ve uzunluk ölçeklerindeki dinamiklere erişmek için tezgah üstü biyofiziksel karakterizasyonu nötron spin eko spektroskopisi ile birleştirir.
Özet
Çoğu insan vücudu proteininin aktivitesi ve işlevselliği, protein kristal yapısı içindeki tüm alt alanların konfigürasyonel değişiklikleri ile ilgilidir. Kristal yapılar, çoğu zaman güçlü geometrik kısıtlamalarla bir proteinin yapısını veya dinamiklerini tanımlayan herhangi bir hesaplamanın temelini oluşturur. Bununla birlikte, kristal yapıdan gelen bu kısıtlamalar çözeltide mevcut değildir. Çözeltideki proteinlerin yapısı, piko-nanosaniye zaman ölçeğindeki döngülerin veya alt alanların yeniden düzenlenmesi nedeniyle kristalden farklı olabilir (yani, iç protein dinamiği zaman rejimi). Bu çalışma, onlarca nanosaniyelik zaman ölçeklerindeki yavaş hareketlere nötron saçılması kullanılarak nasıl erişilebileceğini açıklamaktadır. Özellikle, iki ana insan proteininin, iyi tanımlanmış bir ikincil yapıya ve klasik bir antikor proteinine sahip olmayan, özünde düzensiz bir proteinin dinamik karakterizasyonu, çok çeşitli laboratuvar karakterizasyon yöntemleriyle birlikte nötron spin eko spektroskopisi (NSE) ile ele alınmaktadır. Deneysel nötron verilerini tanımlamak ve kombine difüzyon ve iç protein hareketleri arasındaki geçişi belirlemek için matematiksel modelleme kullanılarak protein etki alanı dinamikleri hakkında daha fazla bilgi elde edildi. Çeşitli hareketlerin zaman çizelgesi de dahil olmak üzere NSE'den elde edilen ara saçılma fonksiyonuna iç dinamik katkının ekstraksiyonu, tek proteinlerin mekanik özelliklerine ve kalabalık protein çözeltisindeki neredeyse doğal ortamlarında proteinlerin yumuşaklığına daha fazla görüş sağlar.
Giriş
Yumuşak maddenin nötronlarla sondalama dinamikleri
Proteinlerin ve peptitlerin dinamik özelliklerini araştırmak, biyofiziksel araştırmanın önemli bir parçasıdır ve günümüzde çok çeşitli enerji manzaralarına erişmek için birçok iyi geliştirilmiş yöntembulunmaktadır 1. Proteinlerin deneysel olarak ortaya çıkan dinamiklerini biyolojik işlevleriyle ilişkilendirmek, karmaşık matematiksel modeller ve bilgisayar destekli dinamik simülasyonları gerektiren çok daha zor bir iştir. Protein hareketlerinin analizi için nötron spektroskopisinin önemi, iyi karşılanan ve yaygın olarak tanınan birkaç çalışmada vurgulanmıştır 1,2,3,4,5. İç protein dinamiklerinin çeşitli enerji manzarasını keşfetmeden önce, yumuşak maddedeki dinamik süreçlere ve nötronların bunlara nasıl erişebileceğine dair kısa bir genel bakış gereklidir.
Nötronların izotopik konfigürasyona duyarlılığı ve yumuşak madde ile gösterdikleri etkileşimlerin türü, nötron saçılımını en çok yönlü araştırma tekniklerinden biri haline getirir6. Nötronların erişebileceği geniş bir korelasyon uzunluğu ölçekleri ve korelasyon süreleri spektrumu vardır, nükleer uyarımlardan ve atomik titreşimlerden kolektif hareketlere ve izotropik rotasyonlar ve difüzif hareketler gibi yavaş gevşeme süreçlerine kadar. Dağınık nötronları enerji transferleri için araştırırken, üç ana etkileşim ayırt edilebilir: numunede gelen nötron ve parçacık arasında enerji alışverişinin olmadığı elastik saçılma; nötron ve parçacık arasında büyük, ölçülebilir bir enerji değişimi ile elastik olmayan saçılma; ve olay nötron enerjisine kıyasla çok küçük bir enerji transferini gösteren tuhaf yarı-elastik saçılma durumu 1,7. Bu etkileşimler, araştırılan malzeme hakkında kesin bilgi verir ve çok çeşitli nötron saçılma tekniklerinin teorik temelini oluşturur.
Elastik saçılmada, dedektör nötronların yönlerini, örnek atomların birbirlerine göre konumunu gösteren bir kırınım paterni olarak kaydeder. Atomik konumların korelasyonları hakkında bilgi edinilir (yani, yalnızca yapısal bilgiyle ilgili olan momentum transferi Q ile ilgili entegre yoğunluk S ( Q). Bu ilke nötron kırınımının temelini oluşturur8.
Karmaşıklık, numune malzemesindeki uyarılmalar ve iç dalgalanmalar nedeniyle enerji transferi artık sıfır olmadığında ortaya çıkar. Bu, dağınık nötronların hem enerji transferi E hem de momentum transferi Q'nun bir fonksiyonu olarak araştırıldığı nötron spektroskopisinin temelini oluşturur. Dinamik ve yapısal bilgiler elde edilir. Nötron spektroskopisi, enerji transferi için aynı entegre yoğunluk S(Q)'yu ölçer (yani, numune saçılması nedeniyle nötronların hız değişimi, S(Q,ω) = S(Q, E), dinamik yapı faktörü olarak da adlandırılır)9.
Bir malzemeden saçılımı hesaplamak için, 7,10 çift korelasyon fonksiyonunu kullanmak daha yeterlidir. Kırınım durumunda, statik çift korelasyon fonksiyonu G(r), bir parçacığın merkezini başka bir parçacığın merkezinden belirli bir mesafe r'de bulma olasılığını verir. Spektroskopi, statik çift korelasyon fonksiyonunu genelleştirir ve saçılma denklemine enerji / frekans / zaman içerir. Çift korelasyon fonksiyonu G(r), ayrı bir atom çifti korelasyon fonksiyonu G D(r, t) ve bir öz-korelasyon fonksiyonu G S(r, t) olarak ayrıştırılabilen G(r, t) zamanının bir fonksiyonu haline gelir. Bunlar iki tür korelasyonu tanımlar: tutarlı saçılımı yöneten atomların çift korelasyonlu hareketleri ve tutarsız saçılımı yöneten kendi kendine korelasyon10.
Tutarlı saçılma, "ortalama" dan saçılmadır ve dağınık dalgaların göreceli fazına bağlıdır. Küçük açılı saçılma rejiminde, farklı saçılma merkezlerinden (farklı atomlar) gelen saçılan nötron dalgaları yapıcı bir şekilde müdahale eder (benzer fazlara sahiptir) ve atomların kolektif hareketi güçlü yoğunluk artışı ile gözlenir. Tutarlı saçılma esas olarak örnek10'daki tüm çekirdeklerden tek bir nötronun saçılmasını tanımlar.
Farklı merkezlerden gelen dağınık nötron dalgaları arasında yapıcı bir girişim meydana gelmediğinde, zaman içinde tek bir atom takip edilir ve atomun t = 0 zamanındaki konumu ile t zamanındaki aynı atom arasındaki öz korelasyon gözlenir. Böylece, atomların göreceli konumları hakkındaki bilgiler kaybolur ve odak noktası sadece yerel dalgalanmalardır. Yerel dalgalanmalardan kaynaklanan saçılma, tutarsız saçılımı yönetir. Tutarsız saçılma izotropiktir, arka plan sinyaline katkıda bulunur ve sinyalden gürültüye 10,11'i bozar.
Yukarıdakilerin hepsini birleştirerek, dört ana nötron saçılma işlemini ayırt ediyoruz10: (1) elastik tutarlı (atomik konumların korelasyonlarını ölçer), (2) elastik olmayan tutarlı (atomların kolektif hareketlerini ölçer), (3) elastik tutarsız (arka plana katkıda bulunur, Debye-Waller faktörü (DWF) ile saçılma yoğunluğunu azaltır ve sınırlı geometrideki difüzyon hareketlerinin geometrisini tanımlayan elastik tutarsız yapı faktörünü (EISF) ölçer, ve (4) elastik tutarsız (tek atom dinamiklerini ve kendi kendine korelasyonu ölçer).
Nötronların biyolojide erişebileceği dinamik süreçler, düşük frekanslı atomik ve moleküler titreşimlerin sönümlenmesinden, çözücü moleküllerinin biyo-yüzeylerle etkileşiminden ve makromoleküllerin hidrasyon tabakasındaki difüzyon işlemlerinden ve sınırlı geometriden, kısa menzilli translasyonel, rotasyonel ve yuvarlanan difüzyon hareketlerine ve protein alanlarına ve allosterik hareketlere kadaruzanır1 . Protein dinamiklerini ölçmek için nötron yöntemlerinin ve araçlarının geniş çeşitliliği, olayın veya giden nötron ışınının akromatizasyonunun nasıl elde edildiğine ve dağınık nötronların enerji analizinin nasıl yapıldığına dayanmaktadır. Üç eksenden uçuş zamanına, geri saçılmaya ve spin-echo spektrometrelerine kadar, 1 x 10-14 s ile 1 x 10-6 s (femtosaniyelerden mikrosaniyelere)12 arasındaki karakteristik sürelere sahip dinamik süreçler keşfedilebilir.
Oak Ridge Ulusal Laboratuvarı, iki ünlü nötron kaynağı olan Spallation Neutron Source - SNS13 ve High Isotop Flux Reactor - HFIR14 ile, biyo-malzemelerdeki dinamikleri araştırmak için en iyi spektrometre paketlerinden birine sahiptir. En anlamlı örneklerden bazıları, SNS15'teki soğuk nötron kıyıcı spektrometresinin (CNCS), çözelti16'daki yeşil floresan proteini etrafındaki hidrasyon suyunun dinamik pertürbasyonunu veya birkaç proteinin pikosaniye altı kolektif titreşimlerini araştırmak için kullanılmasıdır17. Elastik olmayan nötron saçılma araştırmalarının tekrarlayan bir problemi, bazı biyolojik süreçlerin gözlemlenemeyecek kadar yavaş olmasıdır. Büyük bir nötron yoğunluğu kaybına yol açan aşırı kurulumlar olmadan, uçuş süresi spektrometreleri, ~ 200 ps 10,11'lik maksimum zaman ölçeğine karşılık gelen10 μeV enerji çözünürlüğü ile sınırlıdır. Bu, proteinlerdeki büyük ölçekli hareketleri gözlemlemek için yeterli değildir. Bu nedenle, geri saçılma spektrometreleri gibi daha yüksek enerji çözünürlüğüne sahip cihazlara sıklıkla ihtiyaç duyulur. Uçuş süresi ve geri saçılma tekniklerini birleştirmek, hidroksilasyon kafuru18'i katalize eden bir enzim olan Sitokrom P450cam'ın (CYP101) iç dinamiklerindeki değişimi araştırmak için güçlü olduğunu kanıtlamıştır.
SNS-BASIS19'daki geri saçılma spektrometresi tarafından ölçülen mikroskobik difüzyon şaşırtıcı derecede iyi tanımlanmıştır ve suyun difüzyonuna (hidrasyon, sitoplazmik ve toplu benzeri su) ve nötron saçılması ile incelenen ilk canlı hayvan olan planarian yassı solucanlardaki hücre bileşenlerinin difüzyonuna ayrılabilir20 . Geri saçılma yüksek çözünürlüklü spektroskopik bir tekniktir, ancak aynı zamanda birkaç μeV = birkaç nanosaniye ile sınırlıdır, biyomalzemelerdeki yavaş dinamikler aynı zamanda atomik konum veya spin oryantasyonları arasındaki korelasyonun hayatta kalma süresi olarak da kendini gösterir (örneğin, on ila yüzlerce nanosaniye zaman aralığında düzenli olarak gerçekleşen gevşeme süreçleri).
Nötron spin eko spektroskopisi (NSE), bu kadar yüksek çözünürlüğe ulaşan tek nötron saçılma tekniğidir. Diğer nötron tekniklerinin aksine, NSE, nötronların manyetik momentleri olan kuantum mekanik fazını kullandığı için ışının akromatizasyonunu gerektirmez. Manyetik momentlerin manipülasyonu, geniş bir nötron ışını dalga boyu dağılımının kullanılmasına izin verirken, teknik 1 x 10-4 sırasına göre çok küçük nötron hızı değişikliklerine duyarlıdır. NSE, birçok protein için çözeltideki proteinlerin yavaş dinamiklerini araştırmak için başarıyla kullanılmıştır. Bu birçok öncü çalışma arasında, domuz immünoglobulin21'in segmental esnekliğinin incelenmesini kabul ediyoruz; Taq polimeraz22'deki birleştirilmiş alan hareketleri; maya alkol dehidrogenaz23'ün tetramerindeki etki alanı hareketleri; substrat bağlanması üzerine fosfogliserat kinazdaki konformasyonun değişmesi3; alan hareketlerinin aktivasyonu ve Na+/H+ değişim düzenleyici kofaktör 1 (NHERF1) proteini4,24,25'teki allosterik sinyallerin dinamik yayılımı; merkürik iyon redüktaz26'nın kompakt bir durumunun dinamiği; ve hemoglobinin kırmızı kan hücrelerinde difüzyonu27. Protein dinamiği üzerine yapılan iki yeni çalışma, insan antikoru İmmünoglobulin G'nin (IgG) entropik bir yay28 olarak esnekliğini ve çözücünün içsel olarak bozulmuş miyelin bazik proteininin (MBP) dinamiklerine katkısının özelliklerini ortaya koymuştur5.
Bu makalede, NSE'nin temel ilkeleri, kapsamlı bir protein dinamiği araştırması için önerilen çoklu hazırlık yöntemleri ve ayrıca SNS, SNS-NSE'deki NSE spektrometresinde NSE veri toplama metodolojisi ve deneysel protokolü açıklanmaktadır. Protokol iki proteini karakterize eder: IgG, normal bir insan antikor proteini ve özünde düzensiz protein MBP. Biyofiziksel etkileri, örneklerin araştırma ile ilgisi ve tekniğin sınırlamaları kısaca tartışılmıştır.
NSE spektroskopisi, yavaş dinamik ölçümleri için yöntem
NSE, bir numunedeki nötronlar ve atomlar arasındaki yarı-elastik etkileşim nedeniyle enerji değişimini (polarizasyon kaybı) ölçmek için nötron uçuş süresini kullanan polarize bir tekniktir. NSE spektroskopisinin özünde iki temel ilke yatmaktadır: (1) nötron spininin manyetik alanda manyetik kuvvetle 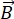 orantılı bir frekansla presese kabiliyeti, yani Larmor frekansı29 ve (b) bir dizi radyofrekans darbesi uygulanırken polarizasyon sinyalinin manipülasyonunu ve yeniden odaklanmasını temsil eden spin-echo veya Hann echo30.
orantılı bir frekansla presese kabiliyeti, yani Larmor frekansı29 ve (b) bir dizi radyofrekans darbesi uygulanırken polarizasyon sinyalinin manipülasyonunu ve yeniden odaklanmasını temsil eden spin-echo veya Hann echo30.
NSE sürecinin temelleri, Şekil 1 kullanılarak birkaç basit adımda 6,11 olarak özetlenebilir. (1) Kaynak tarafından üretilen nötron ışını (konum 1) polarize edilir (konum 2), yönlendirilir ve taşınır (konum 3) ve NSE spektrometresinin girişine ulaşır, burada ilk pi-yarı palet (konum 4) tarafından 90 ° döndürülür. (2) Polarize ışın (örneğin, nötron manyetik momentleri) ilk mıknatısın manyetik alan çizgilerine (ilk presesyon bölgesi, pozisyon 5) dik hale gelir ve presese başlar. (3) Mıknatısın sonunda, nötron dönüşleri, manyetik alan kuvveti ve içeride harcanan uçuş süresi ile orantılı olarak belirli bir presesyon açısı biriktirir (temel olarak nötron hızıyla ters orantılıdır). Bireysel nötron hızları, ilk presesyon bölgesinin sonundaki presesyon açıları içinde kodlanır. (4) Numune konumuna yakın olan pi-palet (konum 6), presesyon açısının işaretini değiştirerek spinin yönünü 180 ° tersine çevirir. (5) Nötronlar numunenin molekülleriyle etkileşime girer (konum 7) ve dağılır. (6) Dağınık nötronlar ikinci presesyon bölgesine (pozisyon 8) girer ve presese girer, ancak ters yönelimli hale gelir. (7) Spin yönünü dikten yatay yöne döndürmek için başka bir pi-yarım palet (konum 9) kullanılır. Bu, presesyon açısını φ cos(φ) ile orantılı polarizasyona çevirerek presesyonu durduracaktır. (8) Analizör (konum 10) nötronları bir yöne göre seçer. Numune ile etkileşim elastik ise, nötronun hızı değişmeyecektir. Nötronlar, birinci ve ikinci presesyon bölgelerinde uçmak için aynı miktarda zaman harcayacak ve biriken presesyon açıları tamamen geri kazanılacaktır. Tam polarizasyon, dedektörde (pozisyon 11) orijinal polarizasyonun (yani spin-echo) bir yankısı olarak geri yüklenir. (9) Bununla birlikte, NSE'de saçılma yarı-elastiktir, bu nedenle nötronlar ve numune molekülleri arasındaki küçük bir enerji değişimi, numune tarafından saçıldıktan sonra farklı nötron hızlarına yol açar. Farklı hızlar nedeniyle, nötronlar ikinci presesyon bölgesinden uçmak için ek bir zaman harcayacak ve presesyon açılarını düzgün bir şekilde geri kazanamayacaktır. Dedektör üzerinde kısmi bir polarizasyon alınır ve spin gevşemesine bağlı polarizasyon kaybı, spektral fonksiyon S(Q, ω), ara saçılma fonksiyonu F(Q, t)'nin cos-Fourier dönüşümü ile orantılıdır. (10) F(Q, t) fonksiyonunun zaman parametresi, presesyon manyetik alan kuvveti ile orantılıdır. Polarizasyon kaybının manyetik alan kuvvetinin bir fonksiyonu olarak taranması, bu nedenle, numune içindeki dinamik süreçlere bağlı bir gevşeme fonksiyonu verir.

Resim 1: SNS'DE (SNS-NSE) NSE SPEKTROMETRESININ VE EN ÖNEMLI FONKSIYONEL BILEŞENLERLE NÖTRON SINEK YOLU ŞEMASıNıN FOTOĞRAFı. Sağdan sola: 1 = nötron kaynağı; 2 = doğrayıcılar-bükücü-polarizör-ikincil deklanşör sistemi; 3 = kiriş taşıma kılavuzları; İlk 90° spin-turn için 4 = pi/2 palet; 5 = ilk presesyon bölgesi; 6 = 180 ° spin-turn için pi flipper; 7 = numune alanı ve numune ortamı (burada, kriyo-fırın gösterilmiştir); 8 = ikinci presesyon bölgesi; İkinci 90° spin-turn için 9 = pi/2 palet; 10 = analizör; 11 = dedektör. (3'ün yanı sıra 2 ve 1'in bölümlerinin ekranlamanın içindeki mavi duvarın arkasında yer aldığını unutmayın; Kıyıcılar, reaktör tabanlı NSE için bir hız seçici ile değiştirilir). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Bu çalışma iki proteini karakterize ediyor: düzenli bir insan antikor proteini IgG ve özünde düzensiz MBP. Proteinlerin liyofilize formu ticari kaynaklardan elde edilmiştir (bakınız Malzeme Tablosu).
1. Protein numunesi hazırlama
- İlgili katı reaktifleri ağır suda (D2O) tartarak ve çözerek 50 mM sodyum fosfat + 0,1 M NaCl tamponu hazırlayın (bkz. Bu, IgG için deuterated tampon çözücüsüdür.
- Tampon çözeltisinin pH'ını 6,6'ya ayarlayın.
- İlgili katı bileşenleri tartarak ve ağır suda(D 2O) çözerek 20 mM sodyum fosfat + 6 M üre tamponu hazırlayın. Bu, MBP için deuterated tampon çözücüsüdür.
- Tampon çözeltisinin pH'ını 4,7'ye ayarlayın.
- Tampon çözücüleri 0,2 μm gözenek boyutunda filtreler kullanarak filtreleyin (bkz.
- Saflaştırılmış protein liyofilize tozlarını, ilgili proteinler için deuterated çözücülerde tartın ve çözün (Adım 1.1.-1.2.) yüksek protein konsantrasyonunda (~ 50 mg / mL).
- Protein çözeltisini 3,5 K MWCO'luk diyaliz membranlarına sahip diyaliz sepetlerine yükleyin ve bir difüzyon gradyanı oluşturmak için tüpleri hafifçe sallayarak MBP için 10 °C'de ve IgG için 25 °C'de filtrelenmiş tampona karşı 24 saat boyunca diyaliz yapın ( bkz.
- Diyaliz tamponunu kullanarak protein çözeltisini bir dizi konsantrasyonda seyreltin: 1, 2, 5, 10 ve 50 mg / mL.
- Bir Nanodrop spektrofotometresi kullanarak kesin konsantrasyonları belirleyin (bkz.
2. Dinamik ışık saçılması (DLS) ile ön numune karakterizasyonu
- Yukarıda hazırlanan konsantrasyon serisinden (Adım 1.6.) her bir protein çözeltisinin 80 μL'sini DLS tek kullanımlık hücresine yükleyin (bakınız Malzeme Tablosu) ve ortalama 10'dan fazla kazanım elde ederek difüzyon katsayılarını belirleyin.
- Translasyonel difüzyon katsayılarını protein konsantrasyonunun bir fonksiyonu olarak çizin ve sıfır konsantrasyona ekstrapolat yapın.
- Her protein çözeltisini konsantrasyon serisinden bir viskozitörün kılcal tüplerine yükleyin ( bakınız Malzeme Tablosu) ve dinamik viskoziteyi ölçün.
- Protein konsantrasyonunun bir fonksiyonu olarak ölçülen dinamik viskoziteleri çizin ve sıfır konsantrasyona ekstrapolat yapın.
NOT: DLS difüzyonunun sıfır konsantrasyona ekstrapolasyonu, tek bir protein için translasyonel difüzyon değerini verir. Dinamik viskozitenin sıfır konsantrasyona ekstrapolasyonu, tampon çözeltisi için deneysel olarak ölçülen dinamik viskozite değerini vermelidir.
3. Küçük açılı saçılmanın toplanması (nötron veya x-ışını)
- Küçük açılı nötron saçılımını (SANS) ve / veya küçük açılı x-ışını saçılımını (SAXS) ( Malzeme Tablosuna bakınız) dört protein konsantrasyonunda, tercihen 2 mg / mL, 5 mg / mL, 10 mg / mL ve 50 mg / mL'de ölçün.
- SANS ve SAXS spektrumlarını protein konsantrasyonu ile normalleştirin.
- Topluluk optimizasyonu31 ve/veya SasView32 yazılımını kullanarak protein form faktörü P(Q)'yu SANS ve SAXS spektrumlarına takın.
- SANS ve SAXS sinyalini her konsantrasyon için P(Q) ile bölerek S(Q, c) yapı faktörünü hesaplayın.
NOT: NSE ölçümleri için destek olarak küçük açılı saçılma verilerinin nasıl ölçüleceği ve yorumlanacağı ile ilgilenen okuyucuların, 23,28,31,32,33 referanslarına iyice başvurmaları önerilir.
4. NSE ölçümü
- Deneme için kurulum yapın ve aşağıdaki adımları izleyerek örneği bağlayın.
- Protein çözeltisinin konsantrasyonuna, ölçüm için gereken sıcaklığa ve mevcut çözelti miktarına bağlı olarak numune yükleme için hücrenin kalınlığını seçin.
NOT: Bu çalışmada 40 mm x 30 mm x 4 mm'lik üstten yükleyici şeffaf kuvars kaplar kullanılmıştır. - Hücreyi, fosfatsız bulaşık deterjanı ( bakınız Malzeme Tablosu), deiyonize su ve% 70 etanol arasında geçiş yaparak tekrar tekrar temizleyin.
- Hücreyi konveksiyon fırınında kurutun; kuvars hücreleri için 80 °C'yi geçmemelidir.
- Hücreye 4 mL protein çözeltisi yükleyin ve kapaklarla kapatın. Numune hücrelerini kapatmak için balmumu filmi veya herhangi bir sızdırmazlık maddesi kullanın (bkz.
NOT: Bu çalışmada, yeterli saçılma yoğunluğunu elde etmek için ~ 50 mg / mL'de 4.8 mL çözelti kullanılmıştır. - 4 mL diyaliz tamponunu protein numunesi ve conta ile aynı kaba yükleyin.
- Örnekleri ışın çizgisine taşıyın, deklanşörü kapatın ve spektrometre muhafaza mağara alanına girin34.
- Numune hücresini, vidaları ve tutma plakalarını sıkarak alüminyum numune tutucu üzerine monte edin (Şekil 2, sol panel).
NOT: Tüm numuneler için aynı ölçüm protokolünün gerekli olması koşuluyla, aynı anda iki numune hücresi monte edilebilir. - Grafit numunesini ve/veya Al2O3 toz numunesini, protein numunesi ile aynı kaba yüklenmiş olarak monte edin. Bunlar SNS-NSE ışın hattı desteği tarafından sağlanan standartlardır.
- Numune tutucuyu yavaşça sıcaklık zorlama sisteminin kutusuna kaydırarak yerleştirin (TFS, bkz.
NOT: TFS, SNS-NSE'de en çok kullanılan numune ortamıdır ve istenen sıcaklığı elde etmek için numune kabına kuru hava pompalar (Şekil 2, orta ve sağ paneller). - TFS kapağını kapatın ve TFS'nin etkileşimli ekranına erişerek sıcaklığı istenen değere ayarlayın.
- Örneklerin ışına hizalanması için nötron kamerayı takın (bkz.
- Cihaz muhafazasını süpürün, boşaltın, kapıları kapatın ve kiriş deklanşörünü açın.
NOT: Örnek hücreler SNS-NSE ışın hattı desteği ile sağlanır. Mevcut örnek hücreler ve örnek ortam kitaplığı için lütfen SNS-NSE beamline web sayfası 7,35'e bakın.
- Protein çözeltisinin konsantrasyonuna, ölçüm için gereken sıcaklığa ve mevcut çözelti miktarına bağlı olarak numune yükleme için hücrenin kalınlığını seçin.
- Aşağıdaki adımları izleyerek NSE verilerini toplayın.
- Nötron kamerasını ve dört bağımsız örnek açıklığını kullanarak numuneyi nötron ışınında hizalayın.
- SNS-NSE veri toplama yazılımı36'yı açın ve istenen saçılma açıları ve dalga boyu için kırınım taramaları çalıştırarak örnek istatistikler toplayın.
- Yardımcı Alet Bilimcisi tarafından sağlanan ölçüm makrolarını düzenleyerek her numune için toplanan istatistiklere dayanarak ölçüm parametrelerini ayarlayın.
- Komut istemine protokol adını yazarak taramaya başlayın ve örnek için yankılar alın.
- Taramaya başlayın ve elastik referans ve tamponlanmış çözücü için de yankılar elde edin. Numune değişimi için aralıklı ışın deklanşör işlemi gerçekleştirin.

Şekil 2: NSE ölçüm sistemi. Sol panel: alüminyum (Al) numune tutucu üzerine vida ve plakalarla monte edilmiş kuvars kapta protein çözeltisi numuneleri. Al numune tutucu, numune ortamına aynı anda iki numune monte etme imkanı sunar. Orta panel: Sıcaklık zorlama sistemi (TFS) örneği, nötron ışını penceresinin sağda olduğu örnekleme aşamasına monte edilebilirken, hizalama için kullanılan nötron kamerası sol tarafta görülebilir. Sağ panel: Numune tutucuyu iki numune ile numuneye yerleştirmek, silikon (Si) pencerelerle çalışabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. NSE veri azaltma
NOT: SNS-NSE, ORNL Neutron Sciences Uzaktan Analiz Kümesi'nde bulunan DrSpine (spin-echo için veri azaltma)37,38 adlı özel bir yazılım, Hızlı Kullanım Kılavuzu ve yerleşik yardım desteği ile donatılmıştır.
- Neutron Sciences Remote Analysis Cluster'da (bkz. Malzeme Tablosu) ORNL kullanıcı kimlik bilgileriyle oturum açın ve Oturumu Başlat düğmesine basın.
- Aşağıdaki adımları izleyerek veri azaltma yazılımını kurun.
- Kullanıcı dizininde bir terminal penceresi açın ve şunu yazın: source/SNS/software/nse/etc/setup_nse.sh.
- Ardından, şunu yazın: drspine_create_env.sh.
- Giriş dizininde veri azaltma için bir klasör oluşturun ve sağlanan komut dosyalarını ve makroları paylaşılan dizinden kopyalayın.
- Uygun şekilde sağlanan azaltma makrosunu düzenleyin, yeniden adlandırın ve kaydedin.
- Komut istemine drspine yazın ve yazılım azaltma ortamını başlatmak için enter tuşuna basın.
- Adım 5.4'te düzenlenen "azaltma makrosunun adı" yazın. yazılım ortamındaki komut istemine gidin ve Enter tuşuna basın.
6. NSE veri uydurma
- Yardımcı Instrument Scientist tarafından sağlanan "stapler-drspine.py" python betiğini, azaltılmış dosya verilerinin adlarıyla düzenleyin.
NOT: Python betiği, cihazın kullanıcıları tarafından ücretsiz olarak kullanılabilir. - İşlevi, sağlanan kitaplıktan sığacak şekilde düzenleyin.
- Komut istemine "stapler-drspine.py" adlı düzenlenmiş komut dosyasının adını yazın ve azaltılmış NSE verilerini okumak, sığdırmak ve çizmek için Enter tuşuna basın.
NOT: Instrument Scientist, NSE azaltılmış verilerini okuyabilen ve sığdırabilen indirgeme makrosu ve "stapler-drspine.py" python komut dosyası için bir şablon sağlayacaktır. Son azaltılmış NSE verileri ASCII formatındadır ve tercih edilen çeşitli yazılımlar tarafından okunabilir.
Sonuçlar
İnsan serumu ve sığır MBP proteinlerinden elde edilen IgG proteini,D2O-baz tamponlarında yüksek konsantrasyonlarda (~ 50 mg / mL) yeniden oluşturuldu. Proteinler yüksek konsantrasyonlarda çözündüğü için, elde edilen çözeltiler kalabalık protein çözeltileriydi. NSE kullanılarak araştırılan dinamikler, proteinlerin içinde bulunduğu kalabalık ortamdan muzdariptir (yapı faktörü etkileşimleri ve hidrodinamik etkiler)5,28,39.
Tartışmalar
NSE spektroskopisi, diğer spektroskopik tekniklerin üretemediği proteinlerin dinamiklerinin benzersiz ve ayrıntılı bir görünümünü sunar. Uzun bir zaman ölçeğindeki ölçümler, burada sunulduğu gibi, hem proteinlerin translasyonel hem de rotasyonel difüzyonunun gözlemlerini sağlar. Segmental dinamikler ve diğer iç salınımlar kendilerini kısa bir zaman ölçeğinde tutarlı saçılma fonksiyonu S(Q, t)'nin güçlü bir bozunumu olarak ortaya çıkarır ve genel difüzyonel gevşeme süreçl...
Açıklamalar
Yazar, rakip finansal çıkarlar ve çıkar çatışması olmadığını beyan eder. Makalenin içeriği, yazarın 2019-2021 yılları arasında HANDS-Neutron Scattering Applications in Structural Biology School'da sunduğu derse dayanmaktadır.
Teşekkürler
Bu araştırma, Oak Ridge Ulusal Laboratuvarı tarafından işletilen Bilim Kullanıcı Tesisi'nin bir DOE Ofisi olan Spallation Neutron Source'taki (BL-15, BL-6, Biyoloji ve Kimya laboratuvarları) kaynakları kullandı. Bu araştırma aynı zamanda MLZ-FRM2 reaktörü Garching (KWS-2, Phoenix-J-NSE) ve Forschungszentrum Jülich GmbH, Almanya'daki JCNS1'deki kaynakları da kullandı. Yazar, modelleme konusundaki yardımları ve hem IgG hem de MBP protein araştırmalarına katkıları için Dr. Ralf Biehl ve Dr. Andreas Stadler'a, NSE veri azaltma desteği için Dr. Piotr A. Żołnierczuk'a, SANS ölçümlerine destek için Dr. Changwoo Do'ya ve SNS biyokimya laboratuvarı desteği için Rhonda Moody ve Dr. Kevin Weiss'a teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bovine MBP protein solution | Sigma-Aldrich | M1891 | lyophilized powder reconstituted in D2O |
| D2O - heavy water | Sigma-Aldrich | Product No. 151882 | liquid |
| Dionized water | in house | - | for washing / cleanning cells |
| DLS instrument | Zetasizer Nano ZS, FZ-Jülich | - | dynamic light scattering instrument |
| Elastic scattering standards | SNS-NSE, ORNL | - | Al2O3 and Graphite powders |
| Ethanol | Sigma-Aldrich | 65350-M | 70% ethanol for cleaning cells |
| IgG protein solution | Sigma-Aldrich | I4506 | lyophilized powder reconstituted in D2O |
| KWS-2 instrument | JCNS outstation at the MLZ, Garching, Germany | - | small angle neutron instrument |
| Liquinox dish detergent | Alconox | - | Phosphate-free liquid lab glassware cleaner |
| Na2HPO4·7H2O | Sigma-Aldrich | Product No.S9390 | disodium phosphate heptahydrate salt |
| NaCl | Sigma-Aldrich | Product No.S9888 | sodium chloride salt |
| NaH2PO4·H2O | Sigma-Aldrich | Product No. S9638 | monosodium phosphate monohydrate salt |
| Nanodrop spectrophotometer | Thermo Scientific | Catalog number: ND-2000 | NanoDrop 2000/2000c Spectrophotometer |
| Neutron alignment camera | NeutronOptics, Grenoble | NOG210222 | 100 x 100 mm camera with Sony IMX249 CMOS sensor |
| Parafilm M - wax parafilm | Bemis | Parafilm M - 5259-04LC PM996 | all-purpose laboratory film in cardboard dispenser |
| Phoenix-J-NSE Spectrometer | JCNS outstation at the MLZ, Garching, Germany | - | neutron spectrometer |
| SasView | https://www.sasview.org/ | ||
| SAXSpace, Anton Paar instrument | FZ-Jülich | - | small angle x-ray instrument |
| Slide-A-Lyzer dialysis membranes | Thermo Scientific | 88400-88405 | Slide-A-Lyzer mini dialysis devices tubes of 3.5 K MWCO |
| SNS Remote Analysis Cluster | Neutron Science Remote Analysis (sns.gov) | https://analysis.sns.gov | |
| SNS-NSE spectrometer | ORNL, Oak Ridge, TN, USA | - | neutron spectrometer |
| Sterile syringe filters | VWR | N.A. PN:28145-501 | 0.2 µm pore size filters |
| Temperature Forcing System (TFS) | SP Scientific | Part Number 100004055 | sample environment equipment |
| Urea -d4 | Sigma-Aldrich | Product No. 176087 | deuterated Urea salt |
| Viscometer | FZ-Jülich | - | falling ball viscometer |
Referanslar
- Fitter, J., Gutberlet, T., Katsaras, J. . Neutron Scattering in Biology: Techniques and Applications. , (2006).
- Stadler, A., Monkenbusch, M., Biehl, R., Richter, D., Ollivier, J. Neutron spin-echo and TOF reveals protein dynamics in solution. Journal of the Physical Society of Japan. 82, (2013).
- Inoue, R. Large domain fluctuations on 50-ns timescale enable catalytic activity in phosphoglycerate kinase. Biophysical Journal. 99 (7), 2309-2317 (2010).
- Callaway, D. J. E., et al. Controllable activation of nanoscale dynamics in a disordered protein alters binding kinetics. Journal of Molecular Biology. 429 (7), 987-998 (2017).
- Stingaciu, L. R., Biehl, R., Changwoo, D., Richter, D., Stadler, A. M. Reduced internal friction by osmolyte interaction in intrinsically disordered myelin basic protein. Journal of Physical Chemistry Letters. 11 (1), 292-296 (2020).
- Monkenbusch, M., Richter, D. High resolution neutron spectroscopy-a tool for the investigation of dynamics of polymers and soft matter. Comptes Rendus Physique. , (2007).
- Richter, D., Monkenbusch, M., Schwahn, D. Neutron Scattering. Polymer Science: A Comprehensive Reference, 10 Volume Set. , (2012).
- Wilson, C. C. . Single Crystal Neutron Diffraction From Molecular Materials. , (2000).
- Marshall, W. . Theory of thermal neutron scattering. , (1971).
- . Roger Pynn Introduction & Neutron Scattering "Theory" Available from: https://neutrons.ornl.gov/sites/default/files/intro_to_neutron_scattering.pdf (2004)
- Richter, D. Neutron scattering in polymer physics. Physica B: Condensed Matter. 276-278, 22-29 (2000).
- Harroun, T. A., Wignall, G. D., Katsaras, J. Neutron scattering for biology. Neutron Scattering in Biology. , (2006).
- . SNS Available from: https://neutrons.ornl.gov/sna (2020)
- . HFIR Available from: https://neutrons.ornl.gov/hfir (2020)
- . CNCS Available from: https://neutrons.ornl.gov/cncs (2020)
- Perticaroli, S., et al. Description of hydration water in protein (green fluorescent protein) solution. Journal of the American Chemical Society. 139 (3), 1098-1105 (2017).
- Perticaroli, S., Nickels, J. D., Ehlers, G., Sokolov, A. P. Rigidity, secondary structure, and the universality of the boson peak in proteins. Biophysical Journal. 106 (12), 2667-2674 (2014).
- Miao, Y., et al. Coupled flexibility change in cytochrome p450cam substrate binding determined by neutron scattering, NMR, and molecular dynamics simulation. Biophysical Journal. 103 (10), 2167-2176 (2012).
- Mamontov, E., Zamponi, M., Hammons, S., Keener, W. S., Hagen, M., Herwig, K. W. BASIS: A new backscattering spectrometer at the SNS. Neutron News. 19 (3), 22-24 (2008).
- Mamontov, E. Microscopic diffusion processes measured in living planarians. Scientific Reports. 9, 8708 (2018).
- Alpert, Y., Cser, L., Faragó, B., Franěk, F., Mezei, F., Ostanevich, Y. M. Segmental flexibility in pig immunoglobulin G studied by neutron spin-echo technique. Biopolymers. 24 (9), 1769-1784 (1985).
- Bu, Z., Biehl, R., Monkenbusch, M., Richter, D., Callaway, D. J. E. Coupled protein domain motion in Taq polymerase revealed by neutron spin-echo spectroscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (49), 17646-17651 (2005).
- Biehl, R., et al. Direct observation of correlated interdomain motion in alcohol dehydrogenase. Physical Review Letters. 101, 138102 (2008).
- Farago, B., Li, J., Cornilescu, G., Callaway, D. J. E., Bu, Z. Activation of nanoscale allosteric protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 99 (10), 3473-3482 (2010).
- Bu, Z., Callaway, D. J. E. Dynamic propagation of long-range allosteric signals by nanoscale protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 100 (3), 223 (2011).
- Hong, L., et al. Structure and dynamics of a compact state of a multidomain protein, the mercuric ion reductase. Biophysical Journal. 107 (2), 393-400 (2014).
- Longeville, S., Stingaciu, L. -. R. Hemoglobin diffusion and the dynamics of oxygen capture by red blood cells. Scientific Reports. 7, 10448 (2017).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Hahn, E. L. Nuclear induction due to free larmor precession. Physical Review. 77, 297 (1950).
- Hahn, E. L. Spin echoes. Physical Review. 80, 580 (1950).
- Svergun, D. I., Koch, M. H. J. Small-angle scattering studies of biological macromolecules in solution. Reports on Progress in Physics. 66 (10), 1735-1782 (2003).
- . Sasview Available from: https://www.sasview.org (2020)
- Zhao, J. K., Gao, C. Y., Liu, D. The extended Q-range small-angle neutron scattering diffractometer at the SNS. Journal of Applied Crystallography. 43, 1068-1077 (2010).
- Ohl, M., et al. The high-resolution neutron spin-echo spectrometer for the SNS with τ ≥ 1 µs. Physica B: Condensed Matter. 350, 147-150 (2004).
- . SNS-NSE web page Available from: https://neutrons.ornl.gov/nse (2022)
- Ohl, M., et al. The spin-echo spectrometer at the Spallation Neutron Source (SNS). Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 696, 85-99 (2012).
- Zolnierczuk, P. A., Holderer, O., Pasini, S., Kozielewski, T., Stingaciu, L. R., Monkenbusch, M. Efficient data extraction from neutron time-of-flight spin-echo raw data. Journal of Applied Crystallography. 52 (5), 1022-1034 (2019).
- . Dr Spine hub Available from: https://jugit.fz-juelich.de/nse/drspine (2022)
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), (2014).
- . FZJ Available from: https://www.fz-juelich.de/portal/EN/AboutUs (2022)
- . KWS2 Available from: https://miz-garching.de/kws-2 (2022)
- Moorhouse, M., Barry, P. The protein databank. Bioinformatics Biocomputing and Perl. , (2005).
- Tria, G., Mertens, H. D. T., Kachala, M., Svergun, D. I. Advanced ensemble modelling of flexible macromolecules using X-ray solution scattering. IUCrJ. 2 (2), 207-217 (2015).
- Holderer, O., Monkenbusch, M., Schätzler, R., Kleines, H., Westerhausen, W., Richter, D. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 90 (4), 043107 (2008).
- Biehl, R., Monkenbusch, M., Richter, D. Exploring internal protein dynamics by neutron spin echo spectroscopy. Soft Matter. 7 (4), 1299-1307 (2011).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), 6987-6994 (2014).
- Biehl, R., Richter, D. Slow internal protein dynamics in solution. Journal of Physics: Condensed Matter. 26 (50), 503103 (2014).
- Hinsen, K. The molecular modeling toolkit: A new approach to molecular simulations. Journal of Computational Chemistry. 21 (2), 79-85 (2000).
- Uhlenbeck, G. E., Ornstein, L. S. On the theory of the Brownian motion. Physical Review. 36 (5), 823 (1930).
- Wang, M. C., Uhlenbeck, G. E. On the theory of the Brownian motion II. Reviews of Modern Physics. 17, 323 (1945).
- Callaway, D. J. E., Bu, Z. Nanoscale protein domain motion and long-range allostery in signaling proteins-a view from neutron spin echo spectroscopy. Biophysical Reviews. 7 (2), 165-174 (2015).
- Liu, Y. Intermediate scattering function for macromolecules in solution probed by neutron spin echo. Physical Review E. 95, 020501 (2017).
- Liu, Y. Short-time dynamics of proteins in solutions studied by neutron spin echo. Current Opinion in Colloid & Interface Science. 42, 147-156 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır