Method Article
İPSC-Makrofajlar tarafından Ölü Nöroblastom Hücrelerinin Fagositozu için İn vitro Nicel Görüntüleme Tahlili
Bu Makalede
Özet
Nörodejeneratif hastalıklar düzensiz mikroglia fonksiyonları ile ilişkilidir. Bu makalede, iPSC-makrofajlar tarafından nöroblastom hücrelerinin fagositozunun in vitro bir tahlili özetlenen bir makale verilmiştir. Nicel mikroskopi okumaları hem canlı hücre zaman atlamalı görüntüleme hem de sabit hücreli yüksek içerikli görüntüleme için açıklanmıştır.
Özet
Microglia, Parkinson hastalığı ve Alzheimer hastalığı da dahil olmak üzere çeşitli nörodejeneratif hastalıklarda nöroimmün yanıtları düzenler. Microglia, fagositozun özel bir formu olan efferositoz süreciyle ölü ve ölmekte olan nöronları temizler. Fagositoz fonksiyonu mikrogliayı etkileyen çevresel veya genetik risk faktörleri ile bozulabilir. Bu makale, fagositik kargo için pH'a duyarlı bir boya ile etiketlenmiş bir insan nöroblastom hücre hattı (SH-SY5Y) kullanarak, mikroglianın indüklenmiş pluripotent kök hücre (iPSC) modelinde mikroglial efferositozu incelemek için hızlı ve basit bir in vitro mikroskopi protokolü sunmaktadır. Prosedür, fagositler tarafından "beni ye" sinyali olarak kabul edilen yüzey fosfatidiylserine gösteren ölü nöroblastom hücrelerinin yüksek verimine neden olur. 96 kuyulu plaka tahlili canlı hücre zaman atlamalı görüntüleme için uygundur veya plaka daha fazla işlemden önce başarıyla sabitlenebilir ve yüksek içerikli mikroskopi ile ölçülebilir. Sabit hücreli yüksek içerikli mikroskopi, tahlillerin küçük molekül inhibitörlerinin taranması veya genetik varyant iPSC hatlarının fagositik işlevinin değerlendirilmesi için ölçeklendirilmesini sağlar. Bu test, tüm ölü nöroblastom hücrelerinin fagositozunu iPSC-makrofajlar tarafından incelemek için geliştirilmiş olsa da, test sinaptozomlar ve miyelin gibi nörodejeneratif hastalıklarla ilgili diğer kargolar ve diğer fagositik hücre tipleri için kolayca uyarlanabilir.
Giriş
Mikroglia beyin dokusu yerleşik makrofajlardır ve işlevleri bağışıklık gözetimi, yaralanma / enfeksiyona enflamatuar yanıtları koordine etme, sinaptik yeniden şekillendirme ve ölü hücrelerin, miyelin, protein agregaları ve patojenlerin fagositozunu içerir. Fagositoz, mikroglia'nın yüzey reseptörleri ile kargoyu tanıdığı ve sitoskeletonlarını nesneyi bir fagogoz içine sarmak için yeniden düzenlediği ve daha sonra kargonun bozulması için lizozomlarla kaynaştığı süreçtir. Sağlıklı mikroglia fagositoz apoptotik beyin hücrelerini nekrotik olmadan önce çıkarmakiçin 1. Apoptotik hücrelerin fagositozu efferositoz olarak da bilinir ve ölmekte olan hücre tarafından fosfatidiylserine "eat-me" sinyalinin gösterilmesini gerektirir2. TIM-4, BAI1, Stabilin-2 ve TREM2 dahil olmak üzere çok sayıda mikroglia reseptörü doğrudan fosfatidiylserine bağlanır. Mikroglial TAM reseptörleri (örneğin, MERTK) ve integrinler sırasıyla GAS6 veya MFG-E8 aksesuar proteinlerini kullanarak dolaylı olarak fosfatidiylserine bağlanır. Diğer "beni ye" sinyalleri ölmekte olan hücrelerin tanınması için gerekli olabilir, bunlar glikosilasyon değişiklikleri veya yüzey proteinlerinin şarjını içerir; hücre içi proteinlerin ekspresyözü ICAM3, kalretikülin, hücre yüzeyinde annexin-I; oksitlenmiş LDL; veya apoptotik hücrenin mikroglia tarafından üretilen tamamlayıcı C1q1,2ile kaplanması.
Parkinson hastalığı, Alzheimer hastalığı, frontotemporal demans ve amyotrofik lateral skleroz da dahil olmak üzere nörodejeneratif hastalıklar, ölü hücreler, miyelin parçaları ve protein agregaları gibi beyin atık ürünlerinin birikmesi ve bu uyaranlara abartılı enflamatuar yanıtlar da dahil olmak üzere mikroglia fonksiyonuna bozulma ile ilişkilendirilmiştir3. Fagositoz nörodejeneratif hastalıklarda bozulabilir ve yaşlanma, inflamasyon veya spesifik genetik risk varyantlarının bir kombinasyonu nedeniyle patolojiye katkıda bulunabilir4,5. Öte yandan, mikroglia'nın uygun nöronları veya sinapsları uygunsuz bir şekilde fagositoz haline sokabileceğine dair nörodejeneratif hastalıkların hayvan modellerinden de kanıtlarvardır 6,7,8. Mekanizmanın hasarlı nötralizörlerin fosfatidiylserine gösterimi ile tetiklenmesi muhtemeldir, mikroglial fagositoz reseptörleri TREM2 veya GPR56 tarafından doğrudan algılanan veya dolaylı olarak çözünür kompleman C1q ile fosfatidiliserin zenginleştirilmiş membranla algılanan CR3 aracılı fagositoz9,10,11.
Fagositoz fonksiyonunun in vitro tahlilleri, örneğin, mikroglia'daki bir genetik risk varyantının fenotipik etkisini değerlendirmek için, lateks boncuklar4gibi fizyolojik olmayan kargolar kullanılarak sıklıkla gerçekleştirilir. Floresan etiketli bakteriler ve zymosan da fizyolojik olan ancak nörodejeneratif hastalıklarla ilgili olmayan bakteriler kullanılır. Fizyolojik olmayan fagositik kargolar, fagositik yutmanın temel makinelerindeki kusurları tespit etmek için kullanılabilir, ancak apoptotik nöronların fagositozunda ilk "tanıma" adımını doğru bir şekilde modelleyememiştir. Kargonun boyutu, şekli, sertliği ve türü, etkinleştirilen hücre içi sinyal yollarını da dikte eder ve mikroglia aktivasyon durumunun farklı sonuçlarına yol açar. Örneğin, E.coli bakterileri insan hücrelerinin aksine küçük ve serttir ve yüzeylerindeki lipopolisakkaritler fagositoz ve pro-enflamatuar sinyal yollarını aktive eden Toll benzeri reseptör 4 (TLR4) tarafından tanınır2,12.
Nörodejeneratif hastalık çalışmaları bağlamında, daha alakalı bir fagositik kargo, memeli plazma membranlarında fosfatidilinerine ekrana sahip olacak ve mikroglia'nın karşılaşması muhtemel sinyalleri içerecek şekilde ideal olarak insan ve nöronal olacaktır. Bu fagositoz protokolü için insan nöroblastom hücre hattı SH-SY5Y, kültürü kolay bir nöron modeli olarak seçildi. Kalıcı yüzey fosfatidilizerin ekranı, daha öncetrombositlerinfosfatidilizin görüntülenmesine neden olduğu gösterilen paraformaldehit tarafından yapay olarak indüklenmiştir 13 . Mikroglia hücre modeli için, insan mikrogliasının ontogeny ve transkripsiyonel profilini taklit eden ve fagostik olarak yetkin14 , 15 , 16,17olan insan iPSC-makrofajları kullanılmıştır. iPSC-makrofajlar mevcut en otantik mikroglia modeli değildir, örneğin mikroglia morfolojisini taklit etmezler; ancak, istenirse, Haenseler ve ark.15gibi daha otantik bir monokültür iPSC mikroglia modeli ile ikame edilebilir. İnsan iPSC modelleri, insan ve fare nörodejeneratif hastalık dokularında gözlenen mikroglia transkripsiyonel modüllerinin sınırlı çakışması ile ilgili endişeler nedeniyle nörodejenerasyonu incelemek için birincil kemirgen mikroglia tercih edilir18. Ölü SH-SY5Y'ler, nötr pH'da zayıf ve fagositozdan sonra iPSC makrofajlarının fagolyozomlarının içinde zayıf bir şekilde floresan aside duyarlı bir boya ile lekelenir. Aside duyarlı bir boya kullanmak, fagositik olayları tespit etme doğruluğunu artırır, canlı ve sabit makrofajların farklı okumaları için çok yönlülük19. Bu protokol, hem fagositozun canlı hücre zaman atlamalı görüntülemesini hem de fagositoz için sabit bir yüksek içerikli görüntüleme testini, okumadan önce aynı hücre hazırlama adımlarıyla özetlemektedir (Şekil 1).
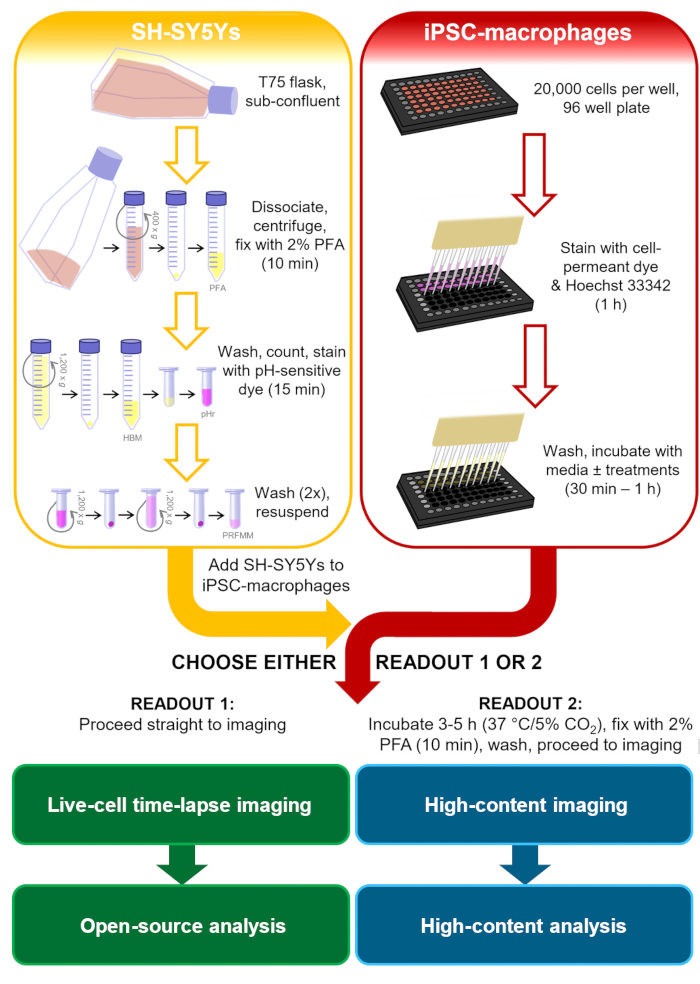
Şekil 1: Metodolojinin şematik diyagramı. SH-SY5Y'lerin hazırlanması ve iPSC-makrofajların boyanmasına paralel olarak gerçekleştirilen ve daha sonra SH-SY5Y'lerin iPSC-makrofajlara pipetlendiği fagositoz tahlilinin ana hatları. Canlı hücreli zaman atlamalı görüntüleme hemen yapılır veya hücreler gerekli süre boyunca %37 °C/5 CO2'de inkübe edilir ve yüksek içerikli mikroskopi yapılmadan önce sabitlenir. PFA: paraformaldehit, HBM: fenol kırmızı içermeyen HEPES tamponlu ortam, pHr: pH'a duyarlı kırmızı floresan boya STP Ester çözeltisi, PRFMM: fenol kırmızı içermeyen makrofaj ortamı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Protokol, Oxford Üniversitesi, Oxford Parkinson Hastalığı Merkezi'nde (Etik Komitesi: Ulusal Sağlık Hizmeti, Sağlık Araştırma Otoritesi, NRES Komitesi South Central, Berkshire, İngiltere(REC 10/H0505/71)) türetilen insan iPS hücre hatlarının kullanımına ilişkin yönergeleri izler. İnsan iPSC'leri, işçiyi olası maceracı ajanlardan korumak için sınıf II güvenlik kabini içinde ele alınacaktır. Yerel, ulusal ve AB sağlık ve güvenlik düzenlemelerine uyulmalıdır. Hücre kültürü medya kompozisyonları Tablo 1'deayrıntılı olarak açıklanmıştır ve tüm malzemeler ek Malzeme Tablosu'ndalistelenmiştir.
1. Deneyden önce hücre kültürü
- iPSC ortamlarında kültür iPSC'leri (Tablo 1) hESC nitelikli bodrum membran matrisi, alt birleştiği ve düşük geçiş numarası ile önceden kaplanmış 6 kuyulu plakalarda.
- İnsan iPSC'lerini iPSC-makrofaj öncüllerine ayırın: embriyoid vücut oluşumunu teşvik etmek ve 5-6 gün boyunca günlük% 75 medya değişikliği gerçekleştirmek için dört milyon iPSC'yi 2 mL embriyoid vücut ortamına sahip bir mikrowell düşük yapışmış 24 kuyu plakasına tohumleyin (Tablo 1). Embriyoid cisimleri T175 şişelerine, şişe başına yaklaşık 150 embriyoid gövdesine aktarın, 20 mL fabrika ortamı içerir (Tablo 1). 10-20 mL fabrika ortamı ilavesi ile haftalık besleyin.
NOT: iPSC-makrofaj öncülleri yaklaşık 2-3 hafta sonra süpernatanta ortaya çıkar ve birkaç ay boyunca sürekli olarak üretilir. Bu deney için, farklılaşma fabrikaları kurulduktan yaklaşık 6 hafta sonrasına ait hücrelerin kullanılması tercih edilir. Daha önce hasat edilen iPSC-makrofajlar bazı proliferatif kapasiteyi koruyabilir ve daha az yapışarak düşük hücre yoğunluğunda tohumlamayı bile önler. Fagositoz yeteneği için bir üst yaş sınırı belirlenmemiştir. - iPSC makrofaj öncüllerini iPSC makrofajlarına ayırt edin: gerekli süpernatant hacmini kaldırarak hasat öncülleri; kümeleri çıkarmak için 40 μm hücre süzgecinden geçirin; pelet hücrelerine 5 dakika boyunca 400 x g'da santrifüj ve makrofaj ortamlarında yeniden biriktirin (Tablo 1). 96 kuyulu doku kültüründe (TC) iyi günde 20.000-30.000 hücrede tohum iPSC-makrofajları siyah kuyu duvarları ve optik olarak net bir taban ile iyi günde 100 μL makrofaj ortamı ile tedavi edilir. Kenar kuyularından kaçının ve bunları PBS ile doldurun; bu, buharlaşmanın test üzerindeki etkisini azaltmak için önemlidir. 37 °C/5% CO2'deinkübasyon ile 6-10 gün ayırt edin.
NOT: Bu tahlil için BIONi010-C (ECACC ID: 66540023) iPSC hattı kullanılmıştır; ancak, başka bir iPSC hattı değiştirilebilir. - SH-SY5Y'leri 20 mL SH-SY5Y ortam (Tablo 1)ile T75 şişelerinde alt izne çıkarın, her 3-4 günde bir geçer.
| Ad | Temel ortam | Katkı maddesi, son konsantrasyon |
| iPSC ortamı | mTeSR1 | - |
| Embriyoid Vücut ortamı | mTeSR1 | BMP4, 50 ng/mL |
| VEGF, 50 ng/mL | ||
| SCF, 20 ng/mL | ||
| Fabrika ortamı | XVIVO15 | GlutaMAX, 2 mM |
| Penisilin, 100 adet/mL | ||
| Streptomisicin, 100 μg/mL | ||
| 2-Mercaptoethanol, 50 μM | ||
| IL-3, 25 ng/mL | ||
| M-CSF, 100 ng/mL | ||
| Makrofaj ortamı | XVIVO15 | GlutaMAX, 2 mM |
| Penisilin, 100 adet/mL | ||
| Streptomisicin, 100 μg/mL | ||
| M-CSF, 100 ng/mL | ||
| SH-SY5Y medya | DMEM/F12 | Fetal sığır serumu, %10 |
| Penisilin, 100 adet/mL | ||
| Streptomisicin, 100 μg/mL |
Tablo 1: Medya tarifleri.
İletişim kuralında kullanılan hücre kültürü ortamlarının bileşenleri. Ortam bileşenlerinin daha fazla ayrıntısını Malzeme Tablosu 'ndabulabilirsiniz.
2. Ölü SH-SY5Y'lerin hazırlanması
- Sınıf II biyolojik güvenlik kabininde, SH-SY5Y'leri, rekombinant tripsin benzeri enzimler içeren bir hücre ayrıştırma tamponunun 4 mL'si ve 1,1 mM EDTA (bkz. Malzeme Tablosu) eklenerek,hücreleri kaplayan ince bir film olarak 1 mL'den daha az kalacak şekilde derhal çıkarılması gerekir. 37 °C/ %5 CO 2'de 2-3 dakika kuluçkayayatır.
- Durulamak için T75 şişesine 10 mL HBSS ekleyin ve SH-SY5Y'leri 15 mL konik santrifüj tüpüne pipetleyin. 5 dakika boyunca 400 x g'da santrifüj. Süpernatantı aspire edin ve hücreleri 2 mL fenol kırmızı içermeyen HEPES tamponlu ortamda yeniden askıya alın (bkz. Malzeme Tablosu). Peletin sabitlenmeden önce kümeleri parçalamak için 100-1.000 μL pipetle pipetle dikkatlice yeniden itmeye devam ettiğinden emin olun.
- Tüpe %4 paraformaldehit (son konsantrasyon %2) 2 mL ekleyerek hücreleri düzeltin. Tüpün ara sıra hafif ajitasyonu ile oda sıcaklığında 10 dakika kuluçkaya yatırın.
- Tüpe 10 mL HBSS ekleyin. 7 dakika boyunca 1.200 x g'da santrifüj ve 2 mL fenol kırmızı içermeyen HEPES tamponlu ortamda yeniden askıya alın.
NOT: Adım 2.4'den sonra, sabit SH-SY5Y preparatı, akış sitometrisi okuma ile hücre geçirgenliğini ölçmek için erişilebilir fosfatidiylserine ve propidium iyodür göstermek için eksel V-FITC ile boyanarak kalite kontrol edilebilir. Sabit hazırlığı, adım 2.2'den elde edilen canlı SH-SY5Y'lerle karşılaştırın. Bkz. bölüm 7 ve Tamamlayıcı Şekil S1. 2.4. adımdan sonra sabit SH-SY5Y'lerin depolanmasının değerlendirilmesi önerilmez.
3. Ölü SH-SY5Y'lerin pH'a duyarlı kırmızı floresan boya ile etiketlenmesi
- 2.4. adımdan sonra, hücreleri sayın ve 2 mL düşük protein bağlayıcı bir tüpe gereken toplam hücre sayısını çıkarın. Her 1 milyon SH-SY5Y için, fenol kırmızısız HEPES tamponlu ortamla 2 mL tüpteki toplam hacmi 300-500 μL'ye kadar tamamlar. Tüpü 37 °C'lik bir su banyosunda kısa bir süre ısıtın.
- pH'a duyarlı kırmızı floresan boya STP esterini yeniden inşa edin (bkz. Malzeme Tablosu)ve sıcak 2 mL hücre tüpüne milyon SH-SY5Y başına 12,5 μg boya ekleyin. Pipetleme ile hafifçe karıştırın. Tüpü oda sıcaklığında 30 dakika boyunca inkübte edin, ışıktan kornun.
NOT: pH'a duyarlı boyanın STP ester türleri birincil aminlerle reaksiyona sokulur ve bu nedenle etiketleme tamponu serbest amin içermemelidir. Sulu tamponlarda potansiyel olarak sınırlı çözünürlük nedeniyle, DMSO çözünmüş boyayı sadece sulu tamponu ısıtmak, hemen karıştırmak ve çökelti belirtilerini (hafif mikroskop altındaki koyu parçacıklar) incelemek için ekleyin. - 4 °C'de 7 dakika boyunca 1200 x g'da 1 mL HBSS ve santrifüj ekleyin. Süpernatant atın ve 2 mL HBSS ile yıkayın. Santrifüjü tekrarlama.
- Süpernatant atın ve fenol kırmızı içermeyen makrofaj medyasındaki hücreleri yenidenaskıya alın (bkz. Malzeme Tablosu), 200.000-1.2 milyon hücre/mL konsantrasyonuna, böylece 50 μL 10.000-60.000 hücre (yani, iPSC makrofajlarından 0,5x-3 kat daha fazla SH-SY5Ys).
NOT: Medyada fenol kırmızısı arka plan floresanını arttırır ve bu nedenle canlı hücre görüntüleme yapılacaksa fenol kırmızısız bir ortam kullanılmalıdır. Lekeli SH-SY5Y'lerin birkaç saatten fazla saklanması önerilmez, çünkü bu değerlendirilmemiştir. Lekeli SH-SY5Y'leri buzda tutun ve ışıktan koruyun.
4. iPSC makrofajlarının boyanma
- Biyolojik bir güvenlik kabininde, derin kırmızı floresan, hücre geçirgen, süksinidil ester-reaktif boyanın makrofaj ortamlarında bir çözelti hazırlayın (bkz. Malzeme Tablosu). Hoechst 33342 ekleyin (bkz. Malzeme Tablosu). Çalışma sosu bir su banyosunda 37 °C'ye ısıtın.
- Hücre üstnatantını çok kanallı bir pipetle steril bir rezervuara pipetleterek iPSC makrofaj ortamını nazikçe epire edin. 4.1. adımda hazırlanan boya çözeltisinin 70 μL/kuyusunu çok kanallı pipet kullanarak iPSC makrofajlarına ekleyin. 37 °C/%5 CO 2'de 1 saat kuluçkayayaslanın.
- Fenol kırmızı içermeyen makrofaj ortamlarında deneysel tedaviler hazırlayın. Negatif kontrol tedavisi olarak 10 μM sitochalasin D'ye dahil edin. İnkübasyon sonrası iPSC-makrofaj ortamını çok kanallı bir pipetle çok nazikçe epire edin ve yıkamak için Hank'in tamponlu tuzlu su çözeltisinin (HBSS) 100 μL / kuyusunu ekleyin. HBSS'yi hemen nazik pipetleme ile çıkarın, ardından 100 μL ortam ± bileşikleri ekleyin. 37 °C/ %5 CO 2'de 10 dk-1 saat kuluçkayayaslanın.
NOT: Sitochalasin D güçlü bir aktin inhibitörüdür ve fagositozu bloke eder. Daha uzun inkübasyon gerektiren deneysel tedaviler için, örneğin 24-72 saat, tam makrofaj ortamlarında 100 μL / kuyu tedavisi kullanarak 4.1 adımından önce deneysel tedaviyi gerçekleştirin. Protokole göre 4.1-4.3 adımlarını izleyin, böylece hücre boyama işlemi yapılır ve daha sonra tedavi fagositoz testinin geri kalanı için fenol kırmızı içermeyen makrofaj medyasında yeniden uygulanır.
5. Görüntüleme fagositozu
Aşağıda iki farklı fagositoz okuma yöntemi vardır, alt bölüm 5.1 veya 5.2'yi seçin.
- Canlı hücre zaman atlamalı görüntüleme
- Fagositozdan önce, canlı hücreli zaman atlamalı görüntüleme mikroskobu (bkz. Malzeme Tablosu),bilgisayar, çevre odası ve CO2 gazını açın. Görüntü yakalama yazılımını açın. DAPI, RFP ve CY5 ışık küplerinin mikroskopta takılı olup olmadığını kontrol edin. Time Lapse | tıklayın Kuluçka | Çevre Odasını etkinleştirin ve CO2 gazı ile 37 °C'ye kadar ısınmayı seçin, ayrıca nemin seçildiğini sağlayın. Mikroskobun 37 °C'ye ısınması için 30 dakika izin verin.
- 4.3. adımdaki bileşik inkübasyon sırasında, iPSC makrofaj plakasını mikroskopa yükleyin.
- Resim | tıklayın | yakalayın Gemi Uzmanı. Kuyu Plakası'nı seçin ve 96 kuyulu bir plaka tipi seçin.
- Görüntü sekmesinde, faz kanalını açın ve hücrelerin odakta olması için dikey kaydırıcıları kullanarak kaba ve ince odaklamayı ayarlayın. Yatay kaydırıcı ile aydınlatma seviyelerini ayarlayın. DAPI, RFP ve CY5 kanallarına tıklayın ve her kanal için aydınlatma seviyelerini ayarlayın.
- Sistem sekmesinde, Gemi Hizalamasını Kalibre Et'e tıklayın ve ekran talimatlarını izleyin.
- Time Lapse | tıklayın Rutinler | Yeni Yordam Oluştur. Zaman Atlama Sihirbazı'nınilk ekranında yordamı adlandırın. İleri 'yitıklatın. İkinci ekranda, 20x hedefini seçin, Tek Renkli yakalama'yı seçin ve DAPI, RFP, CY5 ve Faz kanallarını seçin. Aşağıdaki seçenekleri seçmeyin: Otomatik Örnek Bul, Otomatik ince odak, Z-Stack, Otomatik aydınlatma. İleri 'yitıklatın.
- Bir sonraki ekranda, her kuyunun ortasına bir işaret ayarlayın, bu da mikroskobun her zaman noktası için aynı aydınlatma ayarlarıyla aynı koordinatlara dönmesini sağlar. Her işaret için odaklama ve aydınlatma ayarları bağımsızdır. Bir işaretçi ayarlamak için: mavi daireyi plaka haritasındaki konuma sürükleyin, kaba ve ince odak dikey kaydırıcısını kullanın ve memnun olduğunuzda İşaret Ekle 'yitıklayın. İşaret ayarları daha sonra Seçileni Güncelleştir düğmesi kullanılarak güncellenebilir.
- Fagositoz testini başlatmaya hazır olduğunuzda, tahlil plakasını çıkarın ve biyolojik bir güvenlik kabinine yerleştirin. Sıvının kenarındaki her kuyunun kenarına ekleyerek kuyu başına 50 μL SH-SY5Y eklemek için çok kanallı bir pipet kullanın.
- Plakayı mikroskopa yükleyin ve termal kaymanın dengeye geçmesi için yaklaşık 30 dakika bekleyin.
NOT: Plakanın mikroskopta olduğu ilk 30 dakika boyunca, test plakasının değişen sıcaklığı odağın kaymasına neden olacaktır. Plakanın dengelemesine izin verilmezse, yakalanan görüntüler zaman atlamalı sırasında odaktan çıkar. - Her işaretçiye tıklayın ve odak ayarını güncelleyin. İleri 'yitıklatın. Zaman Atlama Sihirbazı'nınbir sonraki ekranında, dosya biçimi TIFF'i seçin, Tek Tek Kanalları Kaydetseçeneğini etkinleştirin ve Her İşaretçi için Video Oluşturmaseçeneğini etkinleştirin ve aşağıdaki seçeneklerin aşağıdaki bilgileri filigran olarak eklemesineizin verin. İleri 'yitıklatın.
- Sahne Sayısını 1 olarak ayarlayın. İleri 'yitıklatın. Zaman atlamalı süreyi ve aralıkları ayarlayın, örneğin, 3 saat ve görüntüleme her 5 dakikada bir. Yalnızca bir kare yakala 'yı seçmeyin. İleri 'yitıklatın.
- 37 °C ve CO2 sıcaklıkla çevre odasını etkinleştirin (nem kısa deneyler için isteğe bağlıdır). İleri'ye iki kez tıklayın. Verileri kaydetmek için bir yol seçin. İleri 'yitıklatın. Zaman atlamalı başlatmak için Başlat'ı tıklatın.
- Sabit hücreli yüksek içerikli görüntüleme
- Etiketli SH-SY5Y'lerin kuyu başına 50 μL'lik kısmını eklemek için çok kanallı bir pipet kullanın ve her kuyunun kenarına sıvının kenarına ekleyin. 3-5 saat boyunca 37 °C/%5 CO 2'de kuluçkaya yatırın.
- Fagositoz inkübasyonundan sonra, çok kanallı pipet ile pipetleme yaparak hücre süpernatantlarını hafifçe aspire edin ve atın. 100 μL PBS ile bir kez yıkayın.
- Plakayı% 2 paraformaldehitin 100 μL'si ilave larak sabitlayın, oda sıcaklığında 15 dakika kuluçkaya yatırın.
- Kuyuları aspire edin ve 100 μL PBS ekleyin. Plaka sızdırmazlık ve folyo ile örtün; gerekli olana kadar 4 °C'de saklayın.
NOT: Test plakası, önemli bir sinyal bozulması olmadan en az bir hafta boyunca bu şekilde saklanabilir; daha uzun depolama alanı sınanmamıştır. - Yüksek içerikli görüntüleme mikroskobu açın (bkz. Malzeme Tablosu)ve görüntü yakalama yazılımını açın. Ekranın üst kısmındaki Yükle simgesine tıklayarak test plakasını mikroskopa yükleyin.
- Kurulum sekmesini seçin. Sol üst kutunun açılır menülerinde: uygun plaka türünü seçin, otomatik netleme seçeneği İki Tepe (Varsayılan)seçeneğini seçin, hedef 40x Su, NA1.1'iseçin, Konfokal modu seçin ve 1binning 'i seçin.
- Kullanmadan önce Ayarlar menüsünden 40x su hedefini yıkayın.
- Kanal Seçimi kutusunda, DAPI, Alexa 647 ve Alexa 568 kanallarını eklemek için + simgesini kullanın. Bunları 1 μm'lik tek bir düzlemde ölçecek şekilde ayarlayın. Test plakasının boyama verimliliği için Zaman ve Güç ayarlarını optimize edin.
NOT: Kılavuz olarak, DAPI'yı 200 ms pozlama ve %100 güç, Alexa 647'yi 1500 ms pozlama ve %100 güç ve Alexa 568'i 100 ms pozlama ve %40 güç olarak ayarlayın. - Kanalları ayırmak için Kanal Sırası'na tıklayarak kanalların aynı anda ölçülmediğine emin olun.
- Gezinti | Altında Düzen Tanımla, ölçüm kuyularını seçin ve kuyu başına 9-12 alan seçin.
- Kurulum sırasında, plaka haritasındaki temsili bir alana tıklayın ve kanal uzaklığını ayarlayarak boyamanın mevcut olduğundan ve görüntülerin odaklandığından emin olmak için her ölçüm kanalını sırayla kontrol edin.
- Verilerin uzaktan çözümleme için bir sunucuya yüklenmesi için Çevrimiçi İşler kutusunu ve ilgili ekran adını tıklatın; bu, görüntülemeden sonra verilerin bir sunucuya otomatik olarak yüklenmesini sağlar.
- Kaydet düğmesine tıklayarak test protokolünü kaydedin.
- Üstteki Denemeyi Çalıştır sekmesine tıklayın ve deneme plakasını adlandırın, sonra Başlat'a tıklayın.
6. Veri analizi
Aşağıda iki farklı veri analizi yöntemi vardır, alt bölüm 5.1 takip edildiyse alt bölüm 6.1'i veya alt bölüm 5.2 takip edildiyse alt bölüm 6.2'yi seçin.
- Canlı hücreli zaman atlamalı mikroskopla elde edilen fagositoz görüntülerinin analizi
- Önerilen açık kaynaklı yazılımı indirip yükleyin (bkz. Malzeme Tablosu). Yazılımı açın.
- Giriş modülleri kutusunda Görüntüler'i seçin.
- Windows Gezgini'nden Beacon-1, Beacon-2 vb. Tüm Beacon klasörlerini seçip Dosya listesi kutusuna sürükleyin.
- Giriş modülleri kutusunda Meta Veriler'i seçin. Meta Verileri Ayıkla? Meta Veri Ayıklama Yöntemi'nin yanındaki açılır menüde Dosya/Klasör Adlarından Ayıkla 'yıseçin. Meta Veri Kaynağıiçin Klasör Adı'nı seçin. Normal ifadenin sağındaki büyütece tıklayın ve ".*[\.*](? P.*)$" regex metin kutusuna (tırnak işaretleri hariç). Gönder 'etıklayın. Meta Verileri Ayıklamakiçin , Tüm Görüntüler'i seçin. Ekranın altındaki Güncelle'ye tıklayın. Görüntüler artık işaretle gruplanacak.
- Giriş Modülleri kutusunda NamesAndTypes'ı seçin. Aşağıdaki işlem, her zaman noktası için görüntülerin doğru floresan kanalına atanmasına izin verecektir. Görüntüler Eşleştirme Kuralları'na (açılır menü) bir ad atayın. Aşağıdaki kuralların Tümü (açılır menü) ile eşleşen kural ölçütlerini seçin. Dosya (açılan menü), Yapar (açılır menü), İçerdiği (açılır menü), DAPI (metin kutusu). Bu görüntülere atanacak ad DAPI (metin kutusu). Görüntü türü Greyscale Image'yi (açılır menü) seçin. Görüntü Meta Verileri'nden (açılır menü) yoğunluk aralığını ayarlayın.
- Ekranın en altında, Başka Bir Resim Ekle 'yetıklayın ve 6.1.5 adımını yineleyin. DAPI'yı RFPile değiştirin, böylece RFP görüntüleri gruplandırilir.
- CY5 kanal görüntüleri için 6.1.6 adımını yineleyin.
- Ekranın altındaki Güncelleştir'e tıklayın, görüntü dosyaları artık DAPI, RFP ve CY5 etiketli üç sütunda listelenecektir.
- Giriş Modülleri kutusunda Gruplar'ı seçin. Resimlerinizi gruplamak istiyor musunuz? Meta Veri Kategorisiaçılır menüsünde İşaretçi'yi seçin.
- Analiz Modülleri kutusunda, tüm modüllerin listesini çağırmak için beyaz alana sağ tıklayın.
- | Ekle'ye tıklayın Görüntü İşleme | EnhanceOrSuppressFeatures. Giriş görüntüsü olarak ilk açılan kutudan DAPI'yı seçin. Çıktı görüntüsünü "DAPIspeckles" olarak adlandırın. 20 piksellik bir özellik boyutuna sahip Geliştirme ve özellik türü Beneklerişlem türünü seçin. Hızlı/Altıgenseçeneğini belirleyin.
- Yeni bir modül oluşturun. | Ekle Nesne işleme | IdentifyPrimaryObjects. Giriş görüntüsü olarak ilk açılan kutudan DAPIspeckles'ı seçin. Birincil nesneleri "Çekirdek" olarak adlandırın. Nesnelerin tipik çapını 10 ila 35 piksel birimi olarak girin; bu parametre en iyi duruma getirilebilir. Eşik stratejisi Global, eşik yöntemi RidlerCalvard, yumuşatma yöntemi Otomatik'i seçin ve eşik düzeltme faktörünü alt ve üst sınırlar 0-1 ile 12 olarak verin. Kümelenmiş nesneleri Shape olarak ayırt etmek için yöntemi değiştirin, ancak diğer parametreleri varsayılan ayarlarında bırakın.
NOT: iPSC-makrofaj çekirdekleri, çapı azaltan ve çekirdeğin kontrastını artıran bir görüntü işleme adımının ardından 6.1.12 adımında kabaca bölümlere ayrılmıştır. SH-SY5Y'lerin daha zayıf çekirdekler olarak ortaya çıkacakları ve aksi takdirde iPSC makrofajları olarak yanılacakları için sadece en parlak çekirdeklerin seçilmesi önemlidir. Seçilen çekirdek oranını ayarlamak için eşik düzeltme faktörünü artırın veya azaltın. Test aşamasında, elde eden çekirdek seçimini, hücre morfolojisini kullanarak iPSC-makrofaj ve SH-SY5Y arasında ayrım yapmanın kolay olduğu bir faz görüntüsüyle karşılaştırın. - Yeni bir modül oluşturun. | Ekle Görüntü işleme | CorrectIlluminationCalculate. Giriş görüntüsü olarak ilk açılan kutudan CY5'i seçin. Çıktı görüntüsünü "IllumCY5" olarak adlandırın. Aydınlatmanın Nasıl Olduğunu Seçiniçin, açılan menüden Arka Plan'ı seçin. Diğer parametreleri varsayılan ayarlarında bırakın.
- Yeni bir modül oluşturun. | Ekle'ye tıklayın Görüntü işleme | CorrectIlluminationApply. Giriş görüntüsü olarak ilk açılan kutudan CY5'i seçin. Çıktı görüntüsünü "CorrCY5" olarak adlandırın. Aydınlatmayı Seçiniçin, açılır menüden IllumCY5'i seçin. Aydınlatmanın Nasıl Olduğunu Seçiniçin, açılan menüden Böl'ü seçin.
NOT: 6.1.13-6.1.14 adımlarının amacı, CY5 görüntülerinin arka plan aydınlatmasındaki varyasyonu düzeltmektir, aksi takdirde doğru hücre segmentasyonuna engel olur. - Yeni bir modül oluşturun. | Ekle'ye tıklayın Nesne işleme | IdentifySecondaryObjects. Giriş görüntüsü olarak ilk açılan kutudan CorrCY5'i seçin. Giriş nesneleri olarak Çekirdek'i seçin. İkincil nesneleri "Mac" olarak adlandırın. Mesafe - Bolarak tanımlama yöntemini seçin. Eşik stratejisi Genel, eşik yöntemi RidlerCalvard, yumuşatma yöntemi Yumuşatma yok 'useçin ve eşik düzeltme faktörünü alt ve üst sınırlar 0-1 ile 1 olarak verin. Diğer parametreleri varsayılan ayarlarında bırakın.
NOT: Bu hücre segmentasyon adımı, hücre sınırlarını büyütmek veya küçültmek için eşik düzeltme faktörünü ayarlayarak iyileştirme gerektirebilir. Segmentasyon verimliliği, iPSC-makrofaj boyamanın mukavemetini veya görüntüleme sırasında CY5 ışık küpünün aydınlatılmasını artırarak da geliştirilebilir. - Yeni bir modül oluşturun. | Ekle'ye tıklayın Görüntü işleme | EnhanceOrSuppressFeatures. Giriş görüntüsü olarak ilk açılan kutudan RFP'yi seçin. Çıktı görüntüsünü "FilteredRFP" olarak adlandırın. 15 piksellik bir özellik boyutuyla Geliştirme ve özellik türü Beneklerişlem türünü seçin. Özellik boyutu optimize edilebilir. Hızlı/Altıgenseçeneğini belirleyin.
- Yeni bir modül oluşturun. | Ekle'ye tıklayın Nesne işleme | IdentifyPrimaryObjects. Giriş görüntüsü olarak ilk açılan kutudan FilteredRFP'yi seçin. Birincil nesneleri "pHr" olarak adlandır. Nesnelerin tipik çapını 5-20 piksel birimi olarak girin. Eşik stratejisi El kitabı'nı seçin ve el ile bir eşik yazın, örneğin, 0,005. Kümelenmiş nesneleri Shape olarak ayırt etmek için yöntemi değiştirin, ancak diğer parametreleri varsayılan ayarlarında bırakın.
NOT: SH-SY5Y'ler, çapı azaltan ve noktalama işaretlerinin kontrastını artıran bir görüntü işleme adımının ardından 6.1.17 adımında bölümlere ayrılmıştır. PH'a duyarlı boyanın yoğunluğu fagositozlu parçacıklarda zamanla arttığından ve diğer eşik stratejileri erken zaman noktalarında pH'a duyarlı boya puncta sayısını yapay olarak şişireceğinden, manuel eşiklendirme yapmak önemlidir. Test modu kullanılarak sonraki her deneysel yineleme için manuel eşik ayarlanmalıdır. - Yeni bir modül oluşturun. | Ekle'ye tıklayın Nesne işleme | RelateObjects. Açılan menüden pHr giriş alt nesnelerini seçin. Açılan menüden Mac'in giriş üst nesnelerini seçin. Tüm Alt Ölçümler için Ebeveyn Başına Araçları Hesapla? Alt-üst mesafeleri hesaplama (Yok).
NOT: Adım 6.1.18, pH'a duyarlı boya sinyalini iPSC makrofajlarıyla ilişkilendirir ve iPSC makrofaj başına ortalama fagositozlu nesne sayısının ölçülmesine izin verir. - Yeni bir modül oluşturun. | Ekle'ye tıklayın Dosya işleme | ExportToSpreadsheet. Sütun sınırlayıcısını Sekme olarak seçin ve işaret numarasını belirtmek için dosya adları için bir önek ekleyin. Aşağıda belirtildiği gibi ihracat için belirli ölçümleri seçin (adım 6.1.19.1 - 6.1.19.4); diğer parametreleri varsayılan ayarlarında bırakır.
- Resim | Sayım | pHr ve Mac'i seçme
- Resim | Dosyaadı
- Resim | Grup
- Mac | Çocuk | Phr
- Çıktı kutusunda, Çıktı Ayarlarını Görüntüle 'yitıklatın. Bu deneme için masaüstünde yeni bir klasör oluşturun ve bunu varsayılan çıktı klasörü olarak ayarlayın.
- ardışık düzen Dosyasını kaydet | SaveProject Farklı....
- Sol alt köşedeki Test Modunu Başlat'a tıklayarak işlem hattını temsili bir görüntü üzerinde test edin ve optimize edin. Program test için ilk görüntüyü otomatik olarak seçer ve işlem hattının her adımı, çıktıyı görünür kılan göz sembollerine tıklayarak ve ardından Çalıştır'ı tıklatarak görüntülenebilir. Test için kullanılan işaretçiyi değiştirmek için, üst menü çubuğunda Test | Görüntü Grubu 'nu seçin. İşaretçi içindeki görüntüyü (zaman noktası) değiştirmek için, üst menü çubuğunda Test | Görüntü Kümesi 'ni seçin. En iyi duruma getirilmesi gereken parametreler önceki adımlarda belirtilmiştir.
- İşlem hattından memnun kaldığınızda, Test Modundan Çık'a tıklayın ve bunları kapatmak için açık göz sembollerine tıklayın. İşlem hattını kaydedin. Tam görüntü analizine başlamak için Görüntüleri Analiz Et'e tıklayın.
- Oluşturulan metin dosyaları uygun elektronik tablo yazılımıyla elektronik tablo olarak açılabilir ve "Resim" etiketli dosya, parametreleri temsil eden sütunlarla birlikte her görüntü zaman noktası için bir satır içerir.
NOT: Count_Mac ve Count_pHr, görüntüdeki iPSC makrofajlarının sayısını ve tanımlanan pH duyarlı nesnelerin sayısını temsil eder. Sayım, fagositozdan olmayan loş floresan SH-SY5Y'leri içerdiği için Count_pHr verilerini kullanmayın. Sütun Mean_Mac_Children_pHr_Count, tek bir görüntü için Mac başına ortalama fagositozlu pHr nesnesi sayısını (adım 6.1.18 RelateObjects) alır, yani bir işaretin tek tek zaman noktası. - Verileri, her işaretçinin elektronik tabloda ayrı bir sütun olacak şekilde düzenleyin, görüntüler kronolojik sıra satırları olarak düzenlenmiştir ve elektronik tablo çalışma kitabının farklı sayfalarını kaplayan farklı parametrelerle.
- Görüntü başına nokta sayısı parametresini oluşturmak için Mean_Mac_Children_pHr_Count ölçümleri Count_Mac ile çarpın. Her beacon için ortalama Count_Mac hesaplayın. Görüntü başına nokta sayısını bu işaretçinin ortalama Count_Mac bölerek hücre başına nokta sayısı parametresini oluşturur.
NOT: Adım 6.1.26, verileri bir beacon'ın tüm zaman noktalarındaki ortalama iPSC makrofaj sayısına normalleştirerek iPSC makrofaj sayımında (Count_Mac) oluşabilecek hatalı dalgalanmaları düzelter. - Fagositozun başlamasından bu yana geçen süreyi (en az) her görüntü satırına atayın.
- Çoğaltma kuyuları/işaretçileri için araçlar ve standart sapma oluşturun. Fagositoz oranını görselleştirmek için hücre başına nokta sayısını (y ekseni) zamana (x ekseni) göre grafikleştirin.
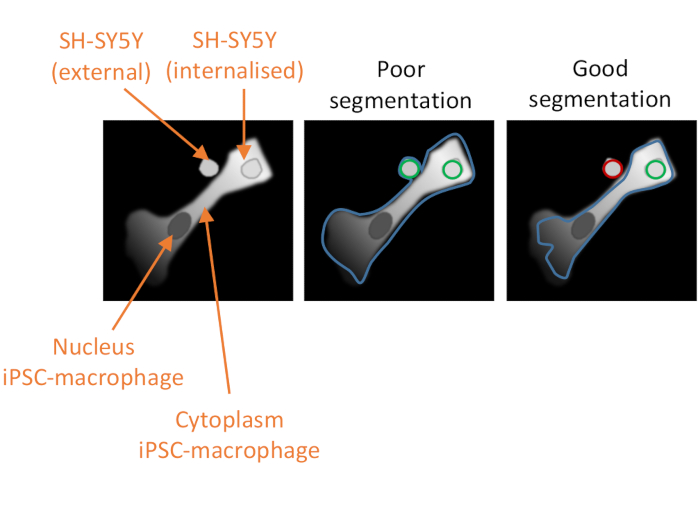
Şekil 2: Yüksek içerikli fagositoz analizinde hücre segmentasyonu. bir iPSC makrofajının iyi ve zayıf segmentasyonunu, fagositozlu olmayan bir SH-SY5Y'ye yakın, ikinci bir SH-SY5Y tamamen fagositozlu olarak göstermek için illüstrasyon. Her iki hücre tipi de gri renkte gösterildiğinde, bilgisayar analizi tarafından belirtilen iPSC-makrofaj hücresi kenarlığı (mavi) özetlenmiştir. Fagositoz olayı olarak sayılan SH-SY5Y'ler, analizden hariç tutulursa yeşil veya kırmızı olarak özetlenir. Ortadaki görüntü zayıf segmentasyon gösterir; iPSC-makrofaj, bir fagositoz olayı olarak sayılacak hücre sınırı içindeki fagositozlu olmayan SH-SY5Y'yi içeren alt optimal tanımlamaya sahiptir. Sağdaki görüntü, iPSC-makrofaj hücre kenarlığını tanımlayan daha katı parametreler nedeniyle iyi segmentasyon gösterir ve bu da fagositozlanmamış SH-SY5Y'nin analizden doğru bir şekilde dışlanmasına neden olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Yüksek içerikli mikroskopla elde edilen fagositoz görüntülerinin analizi
- Önerilen görüntü işleme yazılımına giriş yapın (bkz. Malzeme Tablosu).
- Ekran adı klasörünü seçin ve görüntüleme sol menüden alt klasörü çalıştırın. Görüntü Analizi simgesine (büyüteçli bir ekran) tıklayın. Analiz boru hattını ayarlamak için plaka düzeninde bir temsilci seçin.
- İlk analiz yapı taşı giriş görüntüsüdür. Yığın işleme (Bireysel Düzlemler) ve düz alan düzeltmesi (Yok) için varsayılan ayarları bırakın. Bir sonraki yapı taşını eklemek için bloğun sağ üst köşesindeki + işaretine tıklayın ve Çekirdek Bul 'useçin.
- Çekirdek Bul'da kanalı DAPI, yatırım getirisi popülasyonunu Yok, segmentasyon yöntemini Colarak ayarlayın. Yöntem kutusu, ortak eşik (örneğin, 0,40) ve alan (örneğin, >30 μm2)ayarlarıyla parametrenin en iyi duruma getirilmesini sağlayan bir açılır menü içerir. Çıktı popülasyonu "Çekirdek" olarak adlandırın. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Sitoplazma Bul 'useçin.
- Sitoplazmayı Bul'da kanalı Alexa 647 ve yöntemi Bolarak ayarlayın. Yöntem kutusu, ortak eşik (örneğin, 0,45) ve tek tek eşik (örneğin, 0,20) ayarlarıyla parametrenin en iyi duruma getirilmesine izin veren bir açılır menü içerir. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Popülasyon Seç 'iseçin.
NOT: Sitoplazma segmentasyonunu, fagositozlanmamış ancak fagositozlu kargoları dışlamayan bitişik SH-SY5Y'leri dışlayacak şekilde uygun şekilde optimize etmek önemlidir (bkz. Şekil 2). - Popülasyon Seç'te, popülasyon Çekirdek , yöntem Ortak Filtreler , Kenarlık Nesnelerini Kaldıriçin bir onay işareti ve "Çekirdek Seçildi" adlı çıktı popülasyonu olacak varsayılan ayarları koruyun. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Morfoloji Özelliklerini Hesapla 'yıseçin.
- Morfoloji Özelliklerini Hesaplaalanında, popülasyonu Çekirdek Seçildi, bölge Hücre, yöntem standartolarak ayarlayın. Açılır menüde, alan ve yuvarlaklığın seçildiğini (μm2)emin olun. Çıktı popülasyonu "Morfoloji Hücresi" olarak adlandırın. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Popülasyon Seç 'iseçin.
- Popülasyon Seç (2)alanında, Seçilen Çekirdek popülasyonuve Özelliklere Göre Filtre Uygulayöntemini seçin. F1 Filtresialtındaki açılan kutuda Morfoloji Hücre Alanı [μm2]'yi seçin. Sağdaki açılan kutudan > seçin ve bunun sağındaki kutuya 160 yazın. Çıktı popülasyonu "Çekirdek Seçildi 2" olarak adlandırın. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Leke bul 'useçin.
NOT: Bu adım, yanlış bölümlenmiş hücreleri ve ölü hücreleri daha fazla analizden hariç tutar. Kesme boyutunu artırarak veya azaltarak optimize etmek gerekebilir. - Noktaları Bul'da Alexa 568kanalını seçin, yatırım getirisi popülasyonu Çekirdek Seçildi 2, yatırım getirisi bölgesi Hücresi, yöntem Bve çıktı popülasyonu "Noktalar" olarak adlandırın. Yöntem, gerekirse, algılama duyarlılığı (örneğin, 0,20) ve bölme hassasiyeti (örneğin, 0,400) ayarlarıyla açılır menü kullanılarak optimize edilebilir. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Morfoloji Özelliklerini Hesapla 'yıseçin.
- Morfoloji Özelliklerini Hesapla 'da (2)nüfus Lekeleri, bölge Spotuve Standart yöntemi seçin. Açılır menüde, alan ve yuvarlaklığın seçildiğini (μm2)emin olun. Çıktı özelliklerini "Morfoloji Noktası" olarak adlandırın. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Popülasyon Seç 'iseçin.
- Popülasyon Seç (3)alanında, nüfus Lekeleri'ni ve Özelliklere Göre Filtre Uygulayöntemini seçin. F1 Filtresialtındaki açılan kutularda, Spot Alan [px2], >, 20'yi seçin. F2 Filtresialtındaki açılan kutularda, Spot Alan [px2], <, 2500'ü seçin. F3 Filtresialtındaki açılan kutularda, Morfoloji Nokta Yuvarlaklığı, >, 0,6'yı seçin. F4 Filtresialtındaki açılan kutularda, Bölge yoğunluğuna göre fark edin, >, 2,5'i seçin. Çıktı popülasyonu "Seçili Noktalar" olarak adlandırın. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Popülasyon Seç 'iseçin.
NOT: Otomatik nokta seçimi, iPSC makrofajları içindeki otofluoresan gövdelerden kaynaklanan birçok küçük floresan lekeyi segmentlere ayırmış olacaktır. Bu adım, noktalara, yuvarlaklığa ve yoğunluğa sıkı kesmeler uygulayarak otolüoresan gövdeleri filtrelemeyi amaçlamaktadır ve bazı optimizasyon gerektirebilir. - Nüfus Seç (4)alanında, Seçilen Çekirdek 2 popülasyonu ve Özelliklere Göre Filtre Uygulayöntemini seçin. F1 Filtresialtındaki açılan kutularda, Nokta Sayısı, >, 0,5'i seçin. Çıktı popülasyonu "Spot Pozitif Hücreler" olarak adlandırın. + simgesine tıklayarak bir sonraki yapı taşı ekleyin ve Sonuçları Tanımla 'yıseçin.
- Sonuçları Tanımlaalanında, ilk yöntemi Çıktı Listesiolarak seçin. Varsayılan ayar, her popülasyon için hesaplanacak nesne sayısıdır. Nüfus: Çekirdek Seçilen 2 için açılan menüye tıklayın ve Nesne Sayısının işaretli olduğundan emin olun ve Tümüne Uygula açılır menüsünde TÜMÜ'nü seçin. Popülasyon için Spot Pozitif Hücre, Nesne Sayısının işaretli olduğundan emin olun. Diğer popülasyonlar için herhangi bir parametre bildirmek gerekli değildir. formül çıktısıolarak ikinci yöntemi seçin ve formülü (a/b)*100yazın. Değişken A Spot Pozitif Hücre- Nesne Sayısıolarak seçin ve B değişkeni olarak Çekirdek Seçilen 2- Nesne Sayısı 'nıseçin. Çıktıyı "Spot Pozitif Hücreler (%)" olarak adlandırın.
- İşlem hattını kaydedin: Analizi Diske Kaydet simgesine (aşağı oklu bir disket) tıklayın.
- Toplu İşlem Analizi simgesine tıklayın (ekranın üst kısmında bir huni ve dişli sembolü). Soldaki deneysel klasörlerden, seçilen ölçüm sayısını 1olarak güncellemesi gereken ham veri dosyasını seçin. Çözümleme seçenekleri bölgesinde, Yöntemiçin açılan menüyü tıklatın ve Varolan Analiz 'iseçin. Tıklayınız ... simgesini tıklatın ve kaydedilen çözümleme dosyasına (sonekli .aas) göz atın. Ardından, Analizi Başlat'ın yanındaki yeşil oka tıklayın. Analiz ilerlemesi, İş Durumu'na tıklayarak (ekranın sağ üst köşesinde) izlenebilir.
- Analiz tamamlandıktan sonra, Dışarı Aktarsekmesine tıklayın, deneme klasörünü seçin ve bir hedef klasör seçin. Verileri dışa aktaran ancak TIFF görüntülerini vermeyen varsayılan ayarları bırakın ve dışa aktarmayı başlatın.
- İndirilen dosyayı uygun bir elektronik tablo yazılımında elektronik tablo olarak açın. Kuyular satırlar halinde ve parametreler sütunlar halinde düzenlenir. Spot Pozitif Hücreler (%), Seçilen Çekirdek 2 - Nokta Sayısı - Kuyu Başına Ortalama ve Çekirdek Seçilen 2 - Toplam Nokta Alanı - Kuyu Başına Ortalama etiketli sütunlardaki verileri seçin ve bunları her parametre için yeni elektronik tablolara kopyalayın. Her koşulun çoğaltma kuyuları için parametre ortalamasını hesaplayın ve grafiği uygun şekilde hesaplayın.
7. Sabit SH-SY5Y'lerin homojenliği için kalite kontrol tahlilleri
- Adım 2.2'den canlı SH-SY5Y'lerden oluşan bir aliquot toplayın ve ek V-FITC boyama kiti için bir kitten ek bağlantı tamponuna yeniden depolayın (bkz. Malzeme Tablosu)mL başına yaklaşık 200.000 hücre konsantrasyonunda.
- Adım 2.4'ten sabit SH-SY5Y'lerden oluşan bir aliquot toplayın ve ekine bağlama arabelleğine mL başına yaklaşık 200.000 hücre konsantrasyonunda yeniden depolayın.
- 5 μL ek v-FITC ve 5 μL propidium iyodür ile iki test tüpü hazırlayın (bkz. Malzeme Tablosu). Bir tüpe 500 μL canlı SH-SY5Y, diğerine 500 μL sabit SH-SY5Y ekleyin.
- Üç kontrol tüpü hazırlayın: biri 5 μL ek v-FITC, biri 5 μL propidium iyodür ve bir tüp boş. 1:1'lik canlı ve sabit SH-SY5Y oranını karıştırın ve her kontrol tüpüne 500 μL ekleyin.
- Boruları pipetleme ile hafifçe karıştırın. Işıktan korunarak oda sıcaklığında 10 dakika kuluçkaya yatın.
- Bir akış sitometresi üzerinde hemen ölçüm (Örn = 488 nm; Em = 530 nm) ek V-FITC için FITC sinyal dedektörü (genellikle FL1) ve propidium iyodür için fiterythrin emisyon sinyal dedektörü (genellikle FL2) kullanarak.
- FITC vs PI sinyalinin nokta çizimlerini görüntülemek için herhangi bir akış sitometrisi analiz yazılımını kullanın ve çift negatif popülasyonu seçmek için dikdörtgen bir gating aracı kullanın. Çift negatif popülasyon içinde, FSC vs SSC'yi görüntüleyin ve enkaz olarak sınıflandırılan ve bu nedenle daha fazla analizden dışlanan çok düşük FSC ve SSC'ye sahip popülasyonun etrafında bir dışlama kapısı oluşturmak için çokgen bir gating aracı kullanın. Kalan olayları FITC vs PI sinyali olarak görüntüleyin ve FITC/PI-, FITC+/PI-, FITC -/PI+ ve FITC+/PI+ olayları için bir dörtgen kapı ayarlamak üzere tek lekeli ve lekesiz denetimleri kullanın.
NOT: Fosfatidiylserine ekrana yapay olarak neden olabilecek canlı SH-SY5Y'lerle kaba kullanımdan, girdaplamadan veya uzun inkübasyonlardan kaçının. Gecikmeden akış sitometrisine devam edin. İstenilen bir sonuç, sabit SH-SY5Y'lerde FITC/PI- olaylarının oranının %<5 olmasıdır. Temsili sonuçlar Ek Şekil S1'de gösterilmiştir.
Sonuçlar
Canlı hücre zaman atlamalı görüntüleme, daha önce özetlenen protokol kullanılarak gerçekleştirildi ve vahşi tip iPSC makrofajları kuyu başına 20.000 hücrede tohumlandı. Farklı miktarlarda SH-SY5Y uygulandı (adım 3.1'deki hücre sayımından tahmin edildiği gibi 10.000-30.000) ve fagositoz inhibitörü sitochalasin D, her sh-SY5Y miktarı için fagositozu inhibe etmek için bir kontrol görevi görenerek bazı kuyularla önceden inkübe edildi (1 saat). Görüntüleme, SH-SY5Y'lerin eklenmesinden 40 dakika sonra başladı ve görüntüler sonraki 3 saat boyunca 5 dakika aralıklarla çekildi (veriler ilk 40 dakikalık gecikmeyi içerir). Ek Veriler'de temsili bir zaman atlamalı video bulunur ve Şekil 3'tegösterilen nicel veriler analiz edilir. Kuyu başına 10.000 SH-SY5Y miktarı ile, hücre başına fagositozlu parçacıkların (lekeler) sayısı zamanla doğrusal olarak artmıştır ve sitochalasin D tarafından yaklaşık% 50 oranında inhibe edildi. Sitochalasin D'nin inhibisyonu beklenenden daha zayıftı, büyük olasılıkla yetersiz teknik veya biyolojik çoğalmalardan kaynaklandı, çünkü durum başına sadece bir kuyu üç görüntü alanıyla görüntülendi. Kuyu başına daha yüksek miktarda SH-SY5Y (20.000 ve 30.000) ile fagositoz, muhtemelen daha kalabalık bir görüş alanında iPSC-makrofajların ve SH-SY5Y'lerin zayıf segmentasyonu nedeniyle zayıf doğrusallık gösterdi.
Sabit hücreli yüksek içerikli görüntüleme, daha önce özetlenen protokol kullanılarak, kuyu başına 20.000 hücrede vahşi tip iPSC makrofajları, birkaç farklı miktarda SH-SY5Y (kuyu başına 10.000-80.000) ile gerçekleştirildi ve test plakası 5 saat sonra sabitlendi ve görüntülendi. Şekil 4A'da ve Şekil 4B17'degösterilen analiz edilmiş verilerde fagositozun temsili bir görüntüsü sunulmuştur. SH-SY5Y miktarının artırılması, hücre başına daha fazla sayıda fagositozlu parçacık (leke) ile sonuçlandı; bununla birlikte, SH-SY5Y miktarının iki katına çıkması, hücre başına nokta sayısında sadece 1,5 kat artışa yol açar. Bu, test edilen miktarların fagositoz ile oran sınırlayıcı olmadığını gösterir. Daha sonra yüksek içerikli görüntüleme fagositozu tahlilleri, fagositozun çeşitli inhibitörleri kullanılarak doğrulanmıştır (Şekil 4C)17. Aktin polimerizasyon inhibitörleri sitochalasin D ve jasplakinolid, fagositozdan önce 1 saat ön kuluçkaya yattıklarında sırasıyla% 91 ve% 90 oranında fagositozu önemli ölçüde inhibe etti. Sitochalasin D veya jasplakinolid negatif kontroller olarak kullanıldığında tahlillerin sağlam Z'si sırasıyla 0.7 ve 0.8 olarak hesaplanır,20. Lizozom asitleşme inhibitörü bafilomycin A1, fagositozdan önce 1 saat kuluçkalandığında fagositozu önemli ölçüde% 31 azalttı. Lizozom asitleşme inhibitörünün akin inhibitörlerine karşı daha zayıf etkisi, içselleştirilmiş kargonun tespit edilmesinin fagozomun tam asitlenmesini gerektirmeyebileceğini göstermektedir. Rekombinant ek v, SH-SY5Y'lerin yüzeyinde maruz kalan fosfatidiylserine'i özellikle bloke etmek için bir kontrol olarak kullanıldı ve fagositik reseptörlerin önemli bir "beni ye" sinyali olan ligand'a erişmesini engelledi. Rekombinant ekine V ilavesi, SH-SY5Y ilavesinden hemen önce kuyulara eklendiğinde fagositozu% 30 oranında önemli ölçüde azalttı. Sabit SH-SY5Y'lerin floresan ek v probu kullanılarak fosfatidiylserine maruz kaldığı doğrulanmıştır, oysa canlı SH-SY5Y'ler ek V boyama için negatifti(Şekil 4D).
Mikroglial fagositoz reseptörü TREM2'nin daha önce apoptotik nöronların fagositozu için önemli olduğu gösterilmiştir21. TREM2'nin R47H mutasyonu Alzheimer hastalığının geç başlaması için bir risk genidir ve TREM223'ünligand bağlanmasını azaltmak için hipotez edilir. R47H TREM2 ve TREM2 KO'nun fagositik fonksiyonlarının değerlendirilmesi amacıyla WT/R47H/KO TREM217ile izojenik iPSC-makrofaj hatları kullanılarak sabit hücreli yüksek içerikli fagositoz tahlil işlemi gerçekleştirilmesi gerçekleştirilmesi amaçla gerçeklenmiştir. Fagositik yükün (40.000 SH-SY5Y) kademeli bir ilavesi kullanılarak 1 ila 5 saat arasında çeşitli fagositoz süresi test edildi. Elde eden sinyal doğrusal olarak 4 h'ye çıkar ve 5 h'de hafifçe seviye atlar (Şekil 5)17. Trem2 KO'da WT'ye kıyasla düşük fagositoz oranı ve kapasitesi (% nokta pozitif hücreler) belirginken, R47H TREM2 mutantında değiştirilmiş fagositoz yoktu. TREM2 KO hücrelerindeki fagositik defekt, R47H TREM2 mutasyonu tarafından fenoskopi değildir, çünkü TREM2 işlevi normal fagositozu desteklemek için yeterlidir.
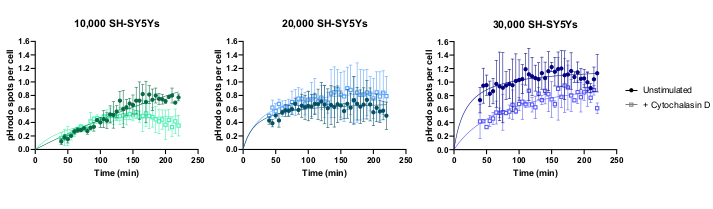
Şekil 3: Canlı hücreli zaman atlamalı fagositoz tahlil için örnek veriler. Ölü SH-SY5Y'lerin vahşi tip iPSC-makrofajlar bioni010-C (ECACC ID: 66540023) tarafından alınması 3 saat boyunca 5 dakika aralıklarla görüntülenmiştir. Grafikte görüntülenen süreler, ölçümsüz ilk 40 dakika da dahil olmak üzere fagositozun başlatılmasındandır. Üç çoğaltma kuyusundan hücre başına ortalama nokta sayısı çizilir. 10.000 SH-SY5Y'nin fagositozu 1 saat ön tedavi ile 10 μM sitochalasin D ile inhibe edilirken, daha yüksek miktarda SH-SY5Y (20.000 ve 30.000) fagositozun yetersiz nicel nicemine sahiptir. Ortalama ± standart sapma (SD), N = 1 deneme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
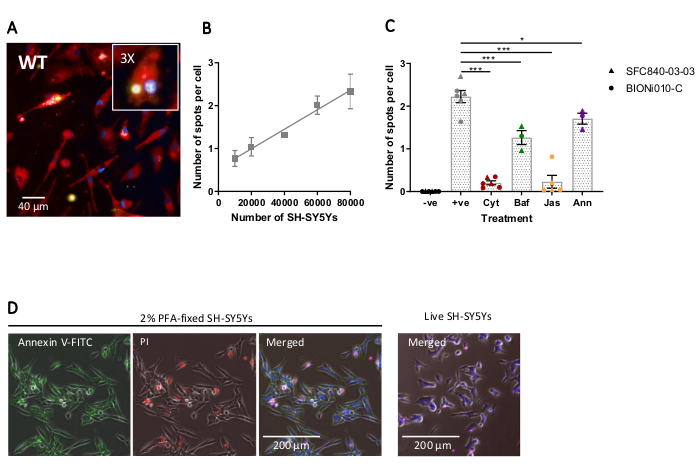
Şekil 4: Sabit hücreli yüksek içerikli fagositoz tahlilinin optimizasyonu ve doğrulanması. (A) Vahşi tip iPSC-makrofajlar BIONi010-C (ECACC ID: 66540023) tarafından fagositozlanmış SH-SY5Ys'nin temsili yüksek içerikli mikroskopi görüntüsü. 40.000 SH-SY5Ys ile 3 saat zaman noktası gösterilir. Floresan kanalları birleştirilir, iPSC-makrofaj lekesi kırmızı, çekirdek mavi ve SH-SY5Ys sarı olarak gösterilir. İç panel, görüntünün 3x büyütülmüş bir bölümüdür. (B) Vahşi tip iPSC makrofajlarına farklı miktarlarda kargo ilavesi kullanılarak, 5 saat sonra fagositozlu ölü SH-SY5Y'lerin hücre başına nokta sayısı. Ortalama ± standart hata (SEM), N = 3 hasat için. (C) Fagositoz (3 h) 10 μM sitochalasin D (Cyt), 1 μM bafilomycin A1 (Baf), 1 μM jasplakinolid (1 saat ön tedavi ile); Jas) ve 13 μg/mL rekombinant annexin V (ölü SH-SY5Y'lere aynı anda eklenir; Ann). SH-SY5Ys eklenmemiş iPSC makrofajları negatif kontrol (-ve) olarak kullanıldı ve pozitif (+ve) kontrol SH-SY5Ys eklenmiş iPSC-makrofajlar tedavi edilmemiştir. Veriler, deneme tekrarı ortalamasına göre normalleştirildi. SEM ± anlamına gelir, N = 3-6 hasatlar için ve iki vahşi tip hücre hattıyla (SFC840-03-03, Bu satırın karakterizasyonu (Fernandes ve ark.21 ve BIONi010-C). Dunnett'in post-hoc testi ile 1 yönlü ANOVA, işlenmemiş hücrelerle karşılaştırmalar. *p < 0.05, ***p < 0.001. (D) Taze sabitlenmiş SH-SY5Ys leke fosfatidiylserine ekran (eksel V-FITC) için eşit olarak leke ve sınırlı hücre geçirgenliği (propidium iyodür) vardır. Canlı SH-SY5Y'ler, kültürdeki birkaç ölü hücrede bulunan odak lekesi dışında ek V-FITC veya propidium iyodür için lekelenmez. Rakamlar Alzheimer Araştırma ve Tedavi17'denizin alınarak çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
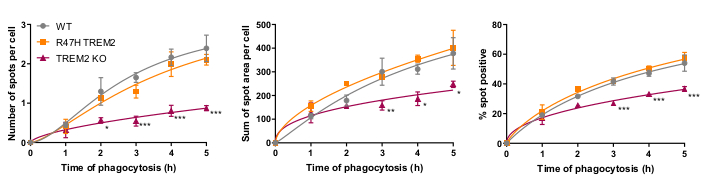
Şekil 5: Fagositoz TREM2 KO'da azalır, ancak R47H TREM2 iPSC makrofajlarında azalmaz. Yüksek içerikli fagositoz tahlilleri, şaşırtıcı eklemelerle kuyu başına 40.000 SH-SY5Ys ile gerçekleştirildi. Parametreler için araçlar ölçülmektedir: hücre başına nokta sayısı, hücre başına nokta alanlarının toplamı(μm 2)ve alan başına fagositozlu parçacıklar içeren hücrelerin yüzdesi. Veriler, deney başına her genotip için anlam ifade etmek üzere normalleştirildi. Ortalama ± SEM, N = 3 hasat için. Dunnett'in geçici sonrası testi olan 2 yönlü ANOVA'yı her seferinde WT ile çift yönlü olarak ölçer: *p < 0.05, **p < 0.01, ***p < 0.001. Rakamlar Alzheimer Araştırma ve Tedavi17'denizin alınarak çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: SH-SY5Ys hazırlama için örnek QC. Ayrışmış SH-SY5Y'ler % 0 (canlı hücreler), % 1 ve paraformaldehitin (PFA) % 2'si ile 10 dakika sabitlendi, daha sonra yıkandı. Hücreler ekselin V-FITC ve propidium iyodür (PI) ile boyandı ve hemen akış sitometrisi ile ölçüldü. Renk yoğunluğu nokta çizimleri, akış sitometri analiz yazılımında, bir çeyrek kapısı yerleştirmek için tek lekeli ve lekesiz kontroller kullanılarak oluşturulmuştur. Kadranlar, bu çeyrekteki olayların yüzdesiyle açıklamalı. Canlı hücreler esas olarak Q4'tedir ve sabit hücreler çoğunlukla Q2'dedir. Q1 = ek V-/PI-, Q2 = ek V+/PI+, Q3 = ek V+/PI-, Q4 = ek V-/PI- (canlı hücreler). Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Video: Canlı hücreli zaman atlamalı fagositoz. Vahşi tip iPSC makrofajları BIONi010-C (ECACC ID: 66540023) tarafından fagositozlanmış SH-SY5Ys'nin temsili zaman atlamalı videosu. Görüntüler her 5 dakikada bir 3 saat boyunca çekildi. Video kırpılır ve saniyede 3 karede çalışır ve tahlilin son 1,5 saatini gösterir. Aside duyarlı boya lekeli SH-SY5Y'ler kırmızı renkte gösterilir, fagozom asitleşme ile sinyal yoğunluğu artar. Hoechst 33342 ile boyanmış hücre çekirdekleri mavi renkte gösterilmiştir. Bu Videoyu indirmek için lütfen tıklayınız.
Tartışmalar
Mikroglia, apoptotik nöronların fagositozu da dahil olmak üzere nörodejeneratif hastalıkların başlatılmasını ve ilerlemesini etkileyen önemli işlevlere sahiptir. Bozulmuş mikroglial fagositoz ve sinapsların uygunsuz fagositozu, alttaki mekanizmalar ve nedensellik iyi anlaşılmasa da nörodejeneratif hastalıklarla ilişkilendirilmiştir4,23. Bu makalede, apoptotik hücrelerin fagositozunu iPSC-makrofajlarla ölçmek için bir fagositoz tahlilini özetlemektedir, canlı hücreli zaman atlamalı görüntüleme okuması veya sabit hücreli yüksek içerikli mikroskopi veya her ikisinin bir kombinasyonu tek bir testte. Bu çok yönlülük, tahlillerin zaman içinde birkaç kuyuda bireysel fagositik olayları incelemek için kullanılabileceği veya birden fazla koşul veya tedavi ile yüksek içerikli tarama için kullanılabileceği anlamına gelir. Yüksek içerikli tahlil tek bir zaman noktasında sabit olduğundan, aynı anda birden fazla tahlil plakası hazırlanabilir. Yüksek içerikli test, makrofajları / mikrogliayı hastalıkla ilişkili genetik varyantlarla karakterize etmek veya fagositoz değişiklikleri için küçük molekül inhibitörlerini taramak için potansiyel bir yardımcılığa sahiptir. Test ayrıca diğer mikroglia modellerinin fagositozunu veya potansiyel olarak astrositleri incelemek için kolayca uyarlanabilir. Fagositoz tahlili potansiyel olarak canlı hücre görüntüleme lekeleri ile çoklayıcı olabilir, örneğin mitokondri, kalsiyum veya ROS göstergeleri ve ilgi çekici proteinler için fiksasyon sonrası immünofluoresan boyama yapılabilir. Apoptotik nöronal hücreleri kullanan mevcut fagositoz testleriyle karşılaştırıldığında, bu protokolün sağladığı temel avantajlar, fagositik yükün hazırlanmasının nispeten basit ve hızlı olması ve tek tip bir ürünle sonuçlanmasıdır. Diğer tahliller nöronların veya SH-SY5Y'lerin 2 h 25 için S-nitroso-L-sistein, 3 h22için okadaikasit,stauro 4-16 h26,27 ,28,29veya24 h30için UV ışınlama içinsporin ve apoptozun farklı aşamalarında hücrelere neden olabilir. Ayrıca, canlı hücre görüntüleme ve yüksek içerikli görüntüleme okumaları, yazarların bildiği kadarıyla daha önce açıklanmamıştır. Fagositik kargoyu hazırlamak için paraformaldehit fiksasyonunu kullanmanın ana sınırlaması, apoptoz sürecini tam olarak repapitoz haline vermemesidir, çünkü fiksasyon hücrelerin daha küçük boyutları nedeniyle daha hızlı bir şekilde fagositoz yapılması muhtemel apoptotik cisimlere bölünmesini önler. Fiksasyonun, fagositleri çeken hedef hücreden nükleotid "beni bul" sinyallerinin (örneğin, ATP, UDP) salgılanması üzerinde nasıl bir etkisi olduğu bilinmemektedir. Apoptotik hücrelere benzer şekilde, sabit SH-SY5Y'ler propidium iyodüre bazı membran geçirgenliği sergiler. Membran geçirgenliği "beni bul" sinyallerinin serbest bırakılmasıyla ilişkilidir; ancak, bu sabit SH-SY5Y'lerde çalışılmamıştır ve nükleotid çok hızlı bir şekilde serbest bırakılırsa, SH-SY5Y'ler iPSC-makrofajlara eklenmeden önce yıkanırlar.
Protokoldeki ilk kritik adım, ölü SH-SY5Y'lerin pH'a duyarlı kırmızı floresan boyanın STP esteriyle boyanmasıdır. Bu boya, ölü SH-SY5Y'lerin yüzeyinde serbest birincil aminlerle hızlı ve yaygın bir şekilde reaksiyona sokulur. Boyama süresinin optimize edilmesi gerekmez; ancak etiketlemeden önce boyanın işlenmesine dikkat edilmelidir. Etiketleme reaksiyonu serbest amin içeren tamponlarda yapılmamalıdır. Ayrıca, DMSO stoğu soğuk sulu tamponda veya yüksek son konsantrasyonda seyreltilirse yağış riski vardır. Çökelticiler mikroskop altında yoğun koyu nesneler olarak görünecektir. Ek olarak, pH'a duyarlı boya çözeltisi normal plastik santrifüj tüplerine yapışır ve yavaşça yıkanır; bu nedenle, etiketleme adımı için düşük bağlayıcı tüpler önerilir. Kalıcı olarak floresan boya yerine pH'a duyarlı bir boyanın kullanılması, plazma zarını komşu olan parçacıklara karşı, yutulan parçacıkların tanımlanmasına yardımcı olur. Nötr pH'da bir miktar floresan olduğundan, fagositik kargo ve iPSC makrofajlarının yoğunluğunun doğru segmentasyon için yeterince düşük tutulması gerekir, ancak çok sayıda fagositik olay yakalanacak kadar yüksektir. Yüksek içerikli mikroskopi, kuyuda orta yoğunlukta kargo (iPSC-makrofaj başına 2 SH-SY5Y'den fazla) ile fagositozu doğru bir şekilde tanımlayabiliyordu. Tersine, derin kırmızı spektrumdaki mikroskobun daha zayıf hassasiyeti nedeniyle, canlı hücre zaman atlamalı görüntüleme verilerindeki iPSC-makrofajların segmentasyonu daha az özgüvenliydi ve yanlış pozitif olasılığını azaltmak için çok düşük bir kargo yoğunluğu kullanmak gerekiyordu (her iki iPSC makrofajı için 1 SH-SY5Y). Uygun segmentasyon ve kargo yoğunluğunun doğrulanması, tedavi edilmemiş ve sitochalasin D-tedavi edilen kuyular arasındaki karşılaştırmalarla yapılmalıdır. İyi optimize edilmiş bir testte, sitochalasin D, tedavi edilmemiş örneklere göre hücre başına ortalama nokta sayısını% 90 azaltmalıdır.
Protokoldeki bir diğer kritik adım, hücrenin görüntü analizinde tanımlanmasını ve segmentlere ayrıştırılmasını sağlayan iPSC-makrofaj boyamadır, böylece herhangi bir harici SH-SY5Y'ler sayım dışı bırakılmıştır. Önerilen boya hücre geçirgendir, sitoplazma içinde çözünmeyen bir floresan ürüne dönüştürülür, sabitlenebilir ve toksik değildir (bkz. Malzeme Tablosu). Boyama adımı, yüksek içerikli görüntüleme fagositozu testine sahip iPSC-makrofajların kullanımı için optimize edilmiştir ve diğer hücre tipleri kullanılırsa yeniden optimize edilmesini öneririz. Çözünmeyen floresan ürünün hücreler içindeki birikimini iyileştirmek için hücre boyama süresi arttırılabilir. Boya konsantrasyonu optimize edilmişse, organik çözücü aracın toksik seviyelerinden kaçınmaya özen edilmelidir.
Tahlilin başarısında üçüncü kritik faktör veri analizidir. Sağlanan analiz işlem hatları, boyama yoğunluğuna veya hücre morfolojisine olan farklılıklar, yazıldığı gibi işlem hatlarının segmentasyon etkinliğini azaltabileceğinden, kuralcı değil, rehberlik amaçlıdır. Bu nedenle, işlem hattının uygun pozitif ve negatif denetimler üzerinde test edilmesiyle bazı iyileştirmeler gerekecektir ve en iyi duruma getirilmesi gereken parametreler protokol metninde belirtilir. Negatif kontroller, SH-SY5Y'ler eklenmeden önce iPSC-makrofajların sitalazisin D gibi güçlü bir fagositoz inhibitörü ile önceden tedavi edildiği bir durumu içermelidir. Başka bir olası olumsuz kontrol, Ş-SY5Y'lerin daha önce tedavi edilmemiş iPSC-makrofaj kuyularına eklenmesidir, tahlilden 10 dakika önce, bu da kargonun bir miktar yerleşmesine izin verir, ancak kayda değer miktarda fagositozun gerçekleşmesi için çok kısadır. Fagositoz olayı, derin kırmızı floresan kanalını kullanan yazılım algoritması tarafından tanımlanan bir iPSC makrofajının sınırları içinde kırmızı floresan bir nesne olarak tanımlanır. Hücrelerin segmentasyonu zayıfsa (Şekil 2), iPSC-makrofajlara yakın birçok fagositozlu olmayan SH-SY5Y analize hatalı olarak dahil edilebilir, yani yanlış pozitifler. İyi segmentasyon elde etmedeki en önemli faktör, iPSC makrofajlarının sıkı bir şekilde tanımlamasıdır. Her iki analiz için segmentasyon otomatiktir, bu nedenle her hücre için mükemmel segmentasyon elde etmek mümkün değildir; ancak, referans olarak birkaç test görüntüsü kullanılarak segmentasyonu daha uygun hale getirmek için birkaç parametre ayarlanabilir. Sitachalasin D kontrolü optimal segmentasyonu değerlendirmek için önemlidir, çünkü bu durumda tespit edilen yüksek sayıda fagositik olay segmentasyonun en uygunun altında olduğunu gösterir. Veri analizi boru hattının optimizasyonu ideal olarak, sitochalasin D durumunda hücre başına fagositik olay sayısı% 80-% 90 daha düşük olana kadar tekrarlanmalıdır.
Fagositoz tahlilinde meydana gelme olasılığı en yüksek olan problemler şunlardır: (1) pozitif kontrollerde zayıf pH'a duyarlı floresan, (2) tahlil sonundaki makrofajların seyrek veya düzensiz dağılımı veya (3) fagositozlu olmayan SH-SY5Y'lerden yapılan analizlerde yüksek sayıda yanlış pozitif. Zayıf pH'a duyarlı floresan sorunlarının giderilmesi öncelikle SH-SY5Y'lerin lekelenmelerinin güçlü bir macenta rengine sahip bir hücre peletiyle sonuçlanıp sonuçlanmadığını kontrol etmelidir. Renk zayıfsa, taze bir boya stoğu kullanıldığından emin olun, etiketleme tamponunun aminsiz olduğundan emin olun, boyamadan önce SH-SY5Y'lere ekstra bir yıkama ekleyin, doğru sh-SY5Y sayısının lekeli olup olmadığını kontrol edin, hiçbir boya çökeltisinin kanıtta olmadığından emin olun ve boyanın etiketleme konsantrasyonunu optimize edin. SH-SY5Y'ler güçlü bir şekilde lekelenmişse, test plakasına eklenen konsantrasyonun doğru olup olmadığını kontrol edin ve iPSC makrofajlarının sağlıklı ve çok eski olmadığından emin olun. İkinci tür sorun, düzensiz makrofaj dağılımı, pipetleme sırasında hücre kaybından neden olabilir ve hücrelerin yaşadığı pipetleme kuvvetlerini azaltmak için adımlar atılmalı, dar delikli uçlardan kaçınılmalıdır. Sorun devam ederse, iPSC makrofajlarını hücre geçirgen boyası ile yüklemenin kuluçka süresini azaltın. Üçüncü sorun, fagositozsuz parçacıkların analize hatalı bir şekilde dahil edilmesiyle ilgili olarak, analiz işlem hattının daha fazla optimizasyonunun gerekli olduğunu gösterir. Sorun giderme, öncelikle hücre segmentasyonuna ve yazılımın bitişik nesneleri içerip dahil etmediğine odaklanmalıdır. Ayarlanabilen belirli parametreler ilgili adımların altındaki notlarda önerilmektedir (canlı hücre zaman atlamalı analizi için adım 6.1.11-6.1.15 ve yüksek içerik analizi için 6.2.4-6.2.8 adımları). Hücre segmentasyonu daha da geliştirilemezse, yüksek içerik analizinin yanlış bölümlenmiş iPSC makrofajlarını dışlayan ek bir adımı (adım 6.2.8) vardır. Ayrıca, iPSC makrofajlarında pH'a duyarlı floresanların kabul edilen noktalarını filtreleyen modül optimize edilebilir, bu da kabul edilen nesnelerin eşik yoğunluğunu artırarak, fagositozlu olmayan SH-SY5Y'leri (canlı hücre zaman atlamalı analizi için adım 6.1.17 ve yüksek içerik analizi için adım 6.2.11) dışlamaya yardımcı olmalıdır.
Fagositoz tahlilleri için her birinin avantajları ve sınırlamaları olan iki tip mikroskopi okuması geliştirdik. Canlı hücreli zaman atlamalı görüntüleme, fagositoz kinetiği hakkında ekstra bilgi sağlamanın yararlarına sahiptir ve yüksek içerikli görüntüleme platformlarından daha yaygın olarak kullanılabilir. Önerilen açık kaynaklı yazılım mikroskop kaynağına göre agnostiktir ve canlı hücre zaman atlamalı veya canlı hücreli zaman atlamalı olsun veya olmasın, herhangi bir kaliteli floresan mikroskopla kullanılabilir. Canlı hücre görüntülemenin ana sınırlaması sınırlı hassasiyet ve optiktir, bu da iPSC makrofajlarının iyi segmentasyonunu tespit etmeyi ve gerçekleştirmeyi daha zor hale getirir. Bu sınırlama, iPSC-makrofaj boyama süresini artırarak veya varsa daha hassas bir mikroskopa geçerek azaltılabilir. Yüksek içerikli görüntüleme fagositozu tahlili, yüksek içerikli bir görüntüleme sistemi varsa önerilen okumadır. Yüksek içerikli görüntüleme sistemleri, daha yüksek aktarım hızı ve daha güvenilir veriler sağlar ve bu tahlilin tarama için kullanılmasını sağlar, bu da "hücre başına nokta sayısı" çıkışı20için ≥7'lik sağlam bir Z' beklenir. Canlı hücre zaman atlamalı yöntemi ile karşılaştırıldığında, yüksek içerikli mikroskopi okuma daha yüksek hassasiyete, daha yüksek otomasyon ve hız derecesına sahiptir, daha fazla kuyu ve görüntüleme alanı işlenebilir ve yüksek çözünürlüklü konfokal görüntüler üretilir. Hücre segmentasyonu iyi görüntülerle daha etkilidir ve segmentasyon ayrıca son derece düzensiz şekilli hücreler için uygun daha fazla hücre segmentasyon yöntemi sağlayan yüksek içerikli görüntüleme analiz yazılımı ile desteklenmiştir. Yüksek içerikli görüntüleme analizi yazılımı ayrıca, fagositik hücrelerin yüzdesi gibi açık kaynaklı yazılımla karşılaştırıldığında daha fazla fagositoz parametresi hesapladı. Yüksek içerikli fagositoz testinin ana sınırlaması, görüntüleme sisteminin ve analiz yazılımının maliyet ve erişilebilirliklerinden biridir.
Sonuç olarak, bu makalede sunulan nicel fagositoz tahlilleri, ölü nöronların in vitro mikroglia fagositozunu modellemek için yararlı bir araçtır. Mikroglia iPSC-makrofajlar tarafından modellenir ve ölü nöronlar paraformaldehit sabit SH-SY5Y'ler tarafından modellenir. Yayınlanan en otantik mikroglia ve ölü/ apoptotik nöron modelleri olmasa da, bunlar hazırlanması kolaydır ve ölçeklenebilir. Testin kendisi çok yönlüdür, iki tür görüntüleme okuması ayrıntılıdır ve farklı mikroglia / makrofaj monokültür modelleri veya fagositik kargo olarak hareket etmek için farklı bir hücre tipi ile kullanılmak üzere uyarlanabilir. Yüksek içerikli görüntüleme okuması nicel veri elde etmek için avantajlıdır ve fagositozun küçük molekül modülatörlerini veya iPSC makrofajlarındaki ekran genetik varyantlarını test etmek için ölçeklendirilebilir. Bununla birlikte, yüksek içerikli görüntüleme sistemleri pahalı ve veri ağırlıklı olduğundan, gerekirse herhangi bir kaliteli geleneksel floresan mikroskobun yerine ikame edilebilecek canlı hücreli bir zaman atlamalı mikroskop kullanılarak protokole alternatif bir görüntüleme okuması dahil edilmiştir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, yüksek içerikli mikroskopiye yardımlarından dolayı Dr. Val Millar ve Dr. Sohaib Nizami'ye ve yüksek içerikli mikroskoplara erişim için Dr. Daniel Ebner'e teşekkür ediyor. Ayrıca, yazarlar dr. Emma Mead'e test geliştirme tavsiyeleri için ve Bayan Cathy Browne'a iPSC desteği için teşekkür eder. Bu çalışma, Oxford Martin School LC0910-004'ten James Martin Kök Hücre Tesisi Oxford'a (S.A.C.) ek destekle Alzheimer Research UK Oxford Drug Discovery Institute (ARUK ODDI, grant reference ARUK-2020DDI-OX) tarafından desteklendi; Parkinson İngiltere'den Monument Trust Discovery Ödülü (J-1403); MRC Demans Platformu İngiltere Kök Hücre Ağı Sermaye Ekipmanları MC_EX_MR/N50192X/1, Ortaklık MR/N013255/1 ve Momentum MC_PC_16034 Ödülleri.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
Referanslar
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer's disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer's variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer's Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z' factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson's iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır